题型:解答题-结构与性质
难度:0.65
引用次数:150
题号:21142358
I.纳米氧化亚铜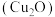 粒径在
粒径在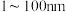 之间,是一种重要的无机化工原料,在涂料、有色玻璃和催化剂领域有着广泛的应用。
之间,是一种重要的无机化工原料,在涂料、有色玻璃和催化剂领域有着广泛的应用。
(1)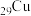 在元素周期表中的位置是第四周期
在元素周期表中的位置是第四周期___________ 族;
(2)基态铜原子的价电子排布式为___________。
(3)在普通玻璃中加入纳米 可制成红色玻璃。用光束照射该玻璃,在垂直方向上可以观察到
可制成红色玻璃。用光束照射该玻璃,在垂直方向上可以观察到___________ 。
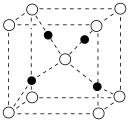
(4) 属于离子晶体,晶体结构如图所,图中●表示的微粒是___________。
属于离子晶体,晶体结构如图所,图中●表示的微粒是___________。
II. 溶于浓氨水中形成无色的
溶于浓氨水中形成无色的 ,该无色溶液接触空气会很快变成深蓝色。
,该无色溶液接触空气会很快变成深蓝色。
(5) 中
中 的N原子提供
的N原子提供___________ ,与中心离子形成___________ 。
A.空轨道、离子键 B.孤电子对、离子键
C.空轨道、配位键 D.孤电子对、配位键
(6)已知 分子中
分子中 键角为107°,则
键角为107°,则 中
中 键角___________。
键角___________。
(7)无色溶液在空气中变色的原因可表示如下,完成并配平该离子方程式________ (化学计量数若为1可不写)。
III.纳米 的制备方法有多种,常见的有还原法、电解法等。
的制备方法有多种,常见的有还原法、电解法等。
(8)还原法以葡萄糖作为主要原料。能用葡萄糖制备 是因为其分子中含有
是因为其分子中含有___________ (填官能团名称),制备时除了葡萄糖溶液与硫酸铜溶液外,还需要___________ (填试剂名称)。
(9)电解法制备 的装置如图所示,电解过程中阳极依次发生反应:
的装置如图所示,电解过程中阳极依次发生反应:
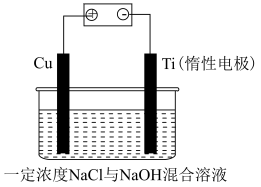
①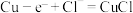
②
③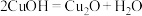
阴极的电极反应式为___________ ;该法制备 的总反应可以表示为:
的总反应可以表示为:___________ 。
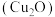 粒径在
粒径在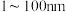 之间,是一种重要的无机化工原料,在涂料、有色玻璃和催化剂领域有着广泛的应用。
之间,是一种重要的无机化工原料,在涂料、有色玻璃和催化剂领域有着广泛的应用。(1)
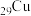 在元素周期表中的位置是第四周期
在元素周期表中的位置是第四周期(2)基态铜原子的价电子排布式为___________。
A. | B.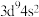 | C.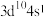 | D. |
(3)在普通玻璃中加入纳米
 可制成红色玻璃。用光束照射该玻璃,在垂直方向上可以观察到
可制成红色玻璃。用光束照射该玻璃,在垂直方向上可以观察到(4)
 属于离子晶体,晶体结构如图所,图中●表示的微粒是___________。
属于离子晶体,晶体结构如图所,图中●表示的微粒是___________。
A. | B. | C. | D. |
II.
 溶于浓氨水中形成无色的
溶于浓氨水中形成无色的 ,该无色溶液接触空气会很快变成深蓝色。
,该无色溶液接触空气会很快变成深蓝色。(5)
 中
中 的N原子提供
的N原子提供A.空轨道、离子键 B.孤电子对、离子键
C.空轨道、配位键 D.孤电子对、配位键
(6)已知
 分子中
分子中 键角为107°,则
键角为107°,则 中
中 键角___________。
键角___________。| A.大于107° | B.小于107° | C.等于107° | D.等于107° |
(7)无色溶液在空气中变色的原因可表示如下,完成并配平该离子方程式

III.纳米
 的制备方法有多种,常见的有还原法、电解法等。
的制备方法有多种,常见的有还原法、电解法等。(8)还原法以葡萄糖作为主要原料。能用葡萄糖制备
 是因为其分子中含有
是因为其分子中含有(9)电解法制备
 的装置如图所示,电解过程中阳极依次发生反应:
的装置如图所示,电解过程中阳极依次发生反应:
①
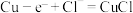
②

③
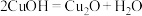
阴极的电极反应式为
 的总反应可以表示为:
的总反应可以表示为:
更新时间:2023/12/15 08:31:37
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂,已知K2FeO4在Fe3+催化下会分解,在强碱性条件下稳定。高铁酸钾(K2FeO4)生产流程如图:
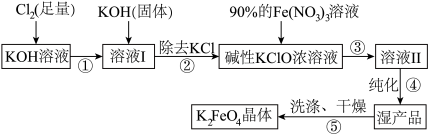
(1)在溶液Ⅰ中加入KOH固体的目的是 。
(2)写出③反应的离子方程式_______ 。
(3)制备K2FeO4时,将90%的Fe(NO3)3溶液缓缓滴加到碱性的KClO浓溶液中,并且不断搅拌,采用这种混合方式的原因是_______ 。
(4)K2FeO4在酸性或弱碱性条件下能与水反应生成一种胶体和一种氧化性气体单质,该气体单质为_______ (写出化学式)。
(5)K2FeO4净水时能吸附悬浮物的原因是_______ 。

(1)在溶液Ⅰ中加入KOH固体的目的是 。
| A.与溶液Ⅰ中过量的Cl2继续反应,生成更多的KClO |
| B.KOH固体溶解时会放出较多的热量,有利于提高KClO产率 |
| C.为下一步反应提供碱性的环境 |
| D.使KClO3转化为KClO |
(2)写出③反应的离子方程式
(3)制备K2FeO4时,将90%的Fe(NO3)3溶液缓缓滴加到碱性的KClO浓溶液中,并且不断搅拌,采用这种混合方式的原因是
(4)K2FeO4在酸性或弱碱性条件下能与水反应生成一种胶体和一种氧化性气体单质,该气体单质为
(5)K2FeO4净水时能吸附悬浮物的原因是
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】下表标出的是元素周期表前四周期的部分元素。

强调:必须用相应的化学符号回答下列问题
(1)表中用字母标出的14种元素中,化学性质最不活泼的元素是____________ ,属于过渡元素的是_____________ (该空用字母表示)。
(2)G元素原子结构示意图为___________ 。K元素简单离子结构示意图为__________ 。
(3)D、G、I、L简单离子半径大小顺序是________________ 。(用离子符号表示)
(4)C、D、H的气态氢化物的稳定性大小顺序是_______________ 。(用分子式表示)
(5)表中所给元素的最高价氧化物水化物中碱性最强的是_________ 。(填化学式)
(6)E、F、G简单离子的氧化性大小顺序是________________ 。(用离子符号表示)
(7)写出元素G的氧化物与E的氢氧化物反应的离子方程式________________ 。
(8)I的某种氧化物和J单质的水溶液发生反应的方程式________________ 。

强调:必须用相应的化学符号回答下列问题
(1)表中用字母标出的14种元素中,化学性质最不活泼的元素是
(2)G元素原子结构示意图为
(3)D、G、I、L简单离子半径大小顺序是
(4)C、D、H的气态氢化物的稳定性大小顺序是
(5)表中所给元素的最高价氧化物水化物中碱性最强的是
(6)E、F、G简单离子的氧化性大小顺序是
(7)写出元素G的氧化物与E的氢氧化物反应的离子方程式
(8)I的某种氧化物和J单质的水溶液发生反应的方程式
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】三氯化六氨合钴 是合成其它一些Co(Ⅲ)配合物的原料,其在水中的溶解度随着温度的升高而增大。实验室用
是合成其它一些Co(Ⅲ)配合物的原料,其在水中的溶解度随着温度的升高而增大。实验室用 晶体制备
晶体制备 的实验步骤如下:
的实验步骤如下:
i.在锥形瓶中,将 溶于水中,加热至沸,加入研细的
溶于水中,加热至沸,加入研细的 晶体,溶解得到混合溶液;
晶体,溶解得到混合溶液;
ii.将上述混合液倒入三颈烧瓶中,加入活性炭。冷却,利用如图装置先加入浓氨水,再逐滴加入5% 溶液,水浴加热至50~60℃,保持20min;
溶液,水浴加热至50~60℃,保持20min;
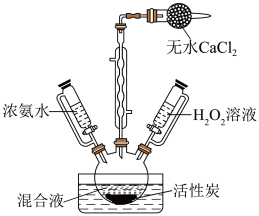
iii.然后用冰浴冷却至0℃左右,吸滤,把沉淀溶于50mL沸水中,经操作X后,慢慢加入浓盐酸于滤液中,即有大量橙黄色晶体( ,
,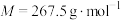 )析出;
)析出;
iv.用冰浴冷却后吸滤,晶体以冷的盐酸洗涤,再用少许乙醇洗涤,吸干。回答下列问题:
(1)步骤i中,研细晶体所用的仪器名称为________ ,无水 的作用是
的作用是________ 。
(2)写出制备三氯化六氨合钴的化学方程式___________ 。
(3)步骤i中操作X为___________ 。
(4)取0.2000g 样品,配成100mL溶液,取50mL样品溶液于锥形瓶中,加入3滴
样品,配成100mL溶液,取50mL样品溶液于锥形瓶中,加入3滴 溶液做指示剂,用0.0600
溶液做指示剂,用0.0600 的
的 溶液滴定至终点时,消耗
溶液滴定至终点时,消耗 溶液的体积为10.00mL,样品的纯度为
溶液的体积为10.00mL,样品的纯度为___________ 。
(5)某兴趣小组为探究 的还原性,设计如下实验:
的还原性,设计如下实验:
实验I:粉红色的 溶液在空气中久置,无明显变化。
溶液在空气中久置,无明显变化。
实验II:向0.1
 溶液中滴入2滴酸性
溶液中滴入2滴酸性 溶液,无明显变化。
溶液,无明显变化。
实验III:按下图装置进行实验,观察到电压表指针偏转。

根据实验III得出结论: 可以被酸性
可以被酸性 溶液氧化。
溶液氧化。
另一名同学设计了实验IV,否定了该结论,请说明实验IV的操作和现象___________ 。
 是合成其它一些Co(Ⅲ)配合物的原料,其在水中的溶解度随着温度的升高而增大。实验室用
是合成其它一些Co(Ⅲ)配合物的原料,其在水中的溶解度随着温度的升高而增大。实验室用 晶体制备
晶体制备 的实验步骤如下:
的实验步骤如下:i.在锥形瓶中,将
 溶于水中,加热至沸,加入研细的
溶于水中,加热至沸,加入研细的 晶体,溶解得到混合溶液;
晶体,溶解得到混合溶液;ii.将上述混合液倒入三颈烧瓶中,加入活性炭。冷却,利用如图装置先加入浓氨水,再逐滴加入5%
 溶液,水浴加热至50~60℃,保持20min;
溶液,水浴加热至50~60℃,保持20min;
iii.然后用冰浴冷却至0℃左右,吸滤,把沉淀溶于50mL沸水中,经操作X后,慢慢加入浓盐酸于滤液中,即有大量橙黄色晶体(
 ,
,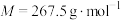 )析出;
)析出;iv.用冰浴冷却后吸滤,晶体以冷的盐酸洗涤,再用少许乙醇洗涤,吸干。回答下列问题:
(1)步骤i中,研细晶体所用的仪器名称为
 的作用是
的作用是(2)写出制备三氯化六氨合钴的化学方程式
(3)步骤i中操作X为
(4)取0.2000g
 样品,配成100mL溶液,取50mL样品溶液于锥形瓶中,加入3滴
样品,配成100mL溶液,取50mL样品溶液于锥形瓶中,加入3滴 溶液做指示剂,用0.0600
溶液做指示剂,用0.0600 的
的 溶液滴定至终点时,消耗
溶液滴定至终点时,消耗 溶液的体积为10.00mL,样品的纯度为
溶液的体积为10.00mL,样品的纯度为(5)某兴趣小组为探究
 的还原性,设计如下实验:
的还原性,设计如下实验:实验I:粉红色的
 溶液在空气中久置,无明显变化。
溶液在空气中久置,无明显变化。实验II:向0.1

 溶液中滴入2滴酸性
溶液中滴入2滴酸性 溶液,无明显变化。
溶液,无明显变化。实验III:按下图装置进行实验,观察到电压表指针偏转。

根据实验III得出结论:
 可以被酸性
可以被酸性 溶液氧化。
溶液氧化。另一名同学设计了实验IV,否定了该结论,请说明实验IV的操作和现象
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
解题方法
【推荐1】(1)C、N、O三种元素电负性从大到小的顺序是___________。
(2)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物.NH3分子的空间构型是___________;与N2H4分子属于等电子体的是___________(写出一种即可)。
(3)金属镍及其化合物在合金材料以及催化剂等方面应用广泛.请回答下列问题:
①Ni原子的核外电子排布式为___________;
②NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO___________FeO(填“<”或“>”);
③NiO晶胞中Ni和O的配位数分别为___________、___________。
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,其价电子排布与Cu相似,Au原子的价电子排布式为___________;一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为___________;该晶体中,原子之间的强相互作用是___________;上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2(如图)的结构相似,该晶体储氢后的化学式应为___________。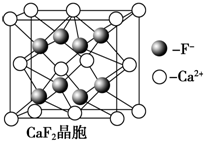
(2)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物.NH3分子的空间构型是___________;与N2H4分子属于等电子体的是___________(写出一种即可)。
(3)金属镍及其化合物在合金材料以及催化剂等方面应用广泛.请回答下列问题:
①Ni原子的核外电子排布式为___________;
②NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO___________FeO(填“<”或“>”);
③NiO晶胞中Ni和O的配位数分别为___________、___________。
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,其价电子排布与Cu相似,Au原子的价电子排布式为___________;一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为___________;该晶体中,原子之间的强相互作用是___________;上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中.若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2(如图)的结构相似,该晶体储氢后的化学式应为___________。

您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
【推荐2】H、N、O、S、Fe、Cu是日常生活中常见的元素。
(1)基态Fe2+的核外电子排布式为_______ ,Fe3+有_______ 种能量不同的电子。
(2)[Cu (NH3)4]SO4·H2O中,Cu2+的配位数为_______ , 的空间构型是
的空间构型是_______ 。
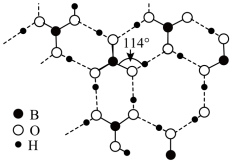
(3)硼酸晶体是片层结构如图所示,其中键角∠B-O-H(114° ),则硼酸晶体中氧原子的杂化方式是_______ 。键角∠B-O-H不同于键角 ∠O-B-O的原因是_______ 。
(4)GaN (相对分子质量为M)是新型半导体材料,该晶体的一种晶胞结构与金刚石晶胞(如图所示)相似,其晶胞可看作金刚石晶胞内部的碳原子被N原子替代,顶点和面心的碳原子被Ga原子替代,晶胞参数为acm。沿Z轴从上往下俯视的晶胞投影图如下图所示。
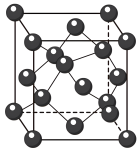
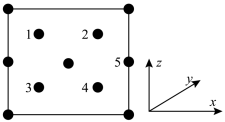
①若图中原子1的分数坐标是( ,
, ,
, )则原子5的分数坐标是
)则原子5的分数坐标是_______ 。
②晶胞结构中原子1、5之间的距离为_______ cm。
③设阿伏加德罗常数的值为NA,则GaN晶体的密度为_______ g·cm-3。
(1)基态Fe2+的核外电子排布式为
(2)[Cu (NH3)4]SO4·H2O中,Cu2+的配位数为
 的空间构型是
的空间构型是(3)硼酸晶体是片层结构如图所示,其中键角∠B-O-H(114° ),则硼酸晶体中氧原子的杂化方式是

(4)GaN (相对分子质量为M)是新型半导体材料,该晶体的一种晶胞结构与金刚石晶胞(如图所示)相似,其晶胞可看作金刚石晶胞内部的碳原子被N原子替代,顶点和面心的碳原子被Ga原子替代,晶胞参数为acm。沿Z轴从上往下俯视的晶胞投影图如下图所示。


①若图中原子1的分数坐标是(
 ,
, ,
, )则原子5的分数坐标是
)则原子5的分数坐标是②晶胞结构中原子1、5之间的距离为
③设阿伏加德罗常数的值为NA,则GaN晶体的密度为
您最近一年使用:0次
解答题-结构与性质
|
适中
(0.65)
名校
【推荐3】钴镍及其化合物在工业、医药等领域有着重要的应用,回答下列问题。
(1)Co2+的价电子的电子排布图为____ 。
(2)Na3[Co(NO2)6]常用于检验钾离子,NO 的空间构型为
的空间构型为____ ,任写一个与NO 互为等电子体的分子:
互为等电子体的分子:____ (填化学式),Na3[Co(NO2)6]中存在的化学键类型有___ 。
(3)NH3可与Co2+形成[Co(NH3)6]2+,与游离的氨分子相比,其键角∠H—N—H变大,原因是____ 。
(4)砷化镍可用于制造发光器件,第一电离能:As____ Se(填“>”或“<"),原因是___ 。
(5)镍钛记忆合金用于飞机外壳。已知一种镍钛合金的晶胞结构如图所示,其中Ti原子采用面心立方最密堆积方式,该合金中与Ti原子距离最近且相等的Ni原子个数为____ ;若合金的密度为ρg·cm-3,设NA是阿伏加德罗常数的值,则晶胞中两个钛原子间的最近距离是___ pm(用含ρ和NA的计算式表示,不必化简)。

(1)Co2+的价电子的电子排布图为
(2)Na3[Co(NO2)6]常用于检验钾离子,NO
 的空间构型为
的空间构型为 互为等电子体的分子:
互为等电子体的分子:(3)NH3可与Co2+形成[Co(NH3)6]2+,与游离的氨分子相比,其键角∠H—N—H变大,原因是
(4)砷化镍可用于制造发光器件,第一电离能:As
(5)镍钛记忆合金用于飞机外壳。已知一种镍钛合金的晶胞结构如图所示,其中Ti原子采用面心立方最密堆积方式,该合金中与Ti原子距离最近且相等的Ni原子个数为

您最近一年使用:0次



