1 . 近来,《饮用天然矿泉水》新标准引起热议,其中备受争议的溴酸盐是一种致癌物,新标准中溴酸盐极值为0.01mg/L。已知在酸性条件下有以下反应:
①2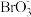 +I2===2
+I2===2 +Br2
+Br2
②2 +10Br-+12H+===I2+5Br2+6H2O
+10Br-+12H+===I2+5Br2+6H2O
③5Br-+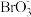 +6H+===3Br2+3H2O
+6H+===3Br2+3H2O
请回答下列问题:
(1)有同学根据反应①得出氧化性:I2>Br2的结论,请说明该结论错误的理由是:_________ 。
(2)反应②中: →l2发生的是
→l2发生的是__________ 反应(氧化、还原)。
现向含6mol的KI的硫酸溶液中逐滴滴加KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量有如图的关系:
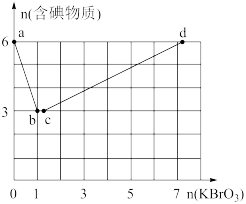
(3)完成a→b阶段的反应方程式,并标出电子转移的方向和数目:I-+BrO3-+H+→ ,________ 。
(4)b→c阶段只有一种元素化合价发生了改变,反应中氧化产物和还原产物的物质的量之比为______ 。
(5)a→b、b→c、c→d阶段的还原剂分别是______ 、_______ 、______ ,依次发生的这些反应,说明有关物质(l2、Br2、I-、Br-)还原性由强到弱的顺序是________ 。
①2
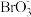 +I2===2
+I2===2 +Br2
+Br2②2
 +10Br-+12H+===I2+5Br2+6H2O
+10Br-+12H+===I2+5Br2+6H2O③5Br-+
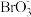 +6H+===3Br2+3H2O
+6H+===3Br2+3H2O请回答下列问题:
(1)有同学根据反应①得出氧化性:I2>Br2的结论,请说明该结论错误的理由是:
(2)反应②中:
 →l2发生的是
→l2发生的是现向含6mol的KI的硫酸溶液中逐滴滴加KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量有如图的关系:

(3)完成a→b阶段的反应方程式,并标出电子转移的方向和数目:I-+BrO3-+H+→ ,
(4)b→c阶段只有一种元素化合价发生了改变,反应中氧化产物和还原产物的物质的量之比为
(5)a→b、b→c、c→d阶段的还原剂分别是
您最近一年使用:0次
名校
2 . 氯化铁和摩尔盐是铁的两种重要盐类,在净水和定量分析等方面具有重要作用。
(1) 用FeCl3溶液腐蚀印刷电路板上的铜,向所得溶液中加入铁粉,对加入铁粉充分反应后的溶液分析合理的是____________ 。
a. 若无固体剩余,则溶液中一定有Fe3+ b. 若有固体存在,则溶液中一定有Fe2+
c. 若溶液中有Cu2+,则一定没有固体析出 d. 若溶液中有Fe2+,则一定有Cu析出
(2)工业上通过氧化酸性FeCl2废液得到含FeCl3的溶液。若酸性FeCl2废液中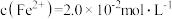 ,
,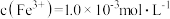 ,
,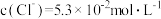 ,则该溶液的
,则该溶液的 约为
约为______ (不考虑水的电离和离子的水解)。
(3)摩尔盐 [(NH4)2Fe(SO4)2•6H2O]在定量分析中常作为基准物质,用来标定重铬酸钾、高锰酸钾等溶液的浓度,在 的该盐的溶液中,离子浓度由大到小的顺序是
的该盐的溶液中,离子浓度由大到小的顺序是____________ 。
(4)摩尔盐与酸性高锰酸钾发生反应: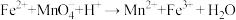
a.配平上述离子方程式:( ) Fe2++( ) MnO4-+( ) H+→( ) Mn2++( ) Fe3++( ) H2O
b.已知摩尔盐相对分子质量为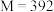 ,取摩尔盐产品
,取摩尔盐产品 (杂质不与高锰酸钾反应),配成
(杂质不与高锰酸钾反应),配成 溶液,取出
溶液,取出 用
用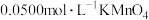 溶液滴定,消耗
溶液滴定,消耗 溶液
溶液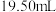 ,则产品中摩尔盐的质量分数为
,则产品中摩尔盐的质量分数为____________ (用小数表示,保留四位小数)。
(1) 用FeCl3溶液腐蚀印刷电路板上的铜,向所得溶液中加入铁粉,对加入铁粉充分反应后的溶液分析合理的是
a. 若无固体剩余,则溶液中一定有Fe3+ b. 若有固体存在,则溶液中一定有Fe2+
c. 若溶液中有Cu2+,则一定没有固体析出 d. 若溶液中有Fe2+,则一定有Cu析出
(2)工业上通过氧化酸性FeCl2废液得到含FeCl3的溶液。若酸性FeCl2废液中
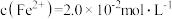 ,
,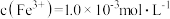 ,
,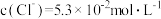 ,则该溶液的
,则该溶液的 约为
约为(3)摩尔盐 [(NH4)2Fe(SO4)2•6H2O]在定量分析中常作为基准物质,用来标定重铬酸钾、高锰酸钾等溶液的浓度,在
 的该盐的溶液中,离子浓度由大到小的顺序是
的该盐的溶液中,离子浓度由大到小的顺序是(4)摩尔盐与酸性高锰酸钾发生反应:
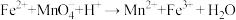
a.配平上述离子方程式:
b.已知摩尔盐相对分子质量为
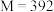 ,取摩尔盐产品
,取摩尔盐产品 (杂质不与高锰酸钾反应),配成
(杂质不与高锰酸钾反应),配成 溶液,取出
溶液,取出 用
用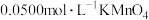 溶液滴定,消耗
溶液滴定,消耗 溶液
溶液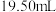 ,则产品中摩尔盐的质量分数为
,则产品中摩尔盐的质量分数为
您最近一年使用:0次
名校
3 . (1)在标准状况下,体积为11.2L 的SO2所含O原子数为__________ 。
(2)9g水与_________ g硫酸所含的分子数相等,它们所含氧原子数之比是__________ 。
(3)在2H2S+SO2===2H2O+3S反应中氧化产物与还原产物的物质的量之比为__________ 。
(4)氯气有毒,实验室常用NaOH溶液吸收多余的氯气,反应的离子方程式为
______________________________ ;将少量 的CO2通入次氯酸钙溶液中发生反应的离子方程式为__________________________________________________________________________ ;
(5) 配平下列化学方程式___ NH3 + ___ O2 === ___ NO + ___ H2O
(6) 请在下列化学方程式上用双线桥法标出电子转移的方向和数目 8NH3 + 3Cl2 === 6NH4Cl + N2__________________________________ 。
(2)9g水与
(3)在2H2S+SO2===2H2O+3S反应中氧化产物与还原产物的物质的量之比为
(4)氯气有毒,实验室常用NaOH溶液吸收多余的氯气,反应的离子方程式为
(5) 配平下列化学方程式
(6) 请在下列化学方程式上用双线桥法标出电子转移的方向和数目 8NH3 + 3Cl2 === 6NH4Cl + N2
您最近一年使用:0次
2018-12-07更新
|
260次组卷
|
2卷引用:沪科版高中化学拓展课程第4章《离子互换反应和氧化还原反应》检测题1
11-12高二上·上海·期中
4 . 将10g铁粉置于40mL较浓的硝酸中,微热完全反应时,收集到NO2和NO混合气体1792mL(标准状况下),还残留4.4g固体。求:
(1)该反应中被还原的硝酸和未被还原的硝酸的物质的量之比_______ ;
(2)原硝酸的物质的量浓度_______ ;
(3)NO和NO2的体积比_______ ;
(4)写出总的化学方程式_______ 。
(1)该反应中被还原的硝酸和未被还原的硝酸的物质的量之比
(2)原硝酸的物质的量浓度
(3)NO和NO2的体积比
(4)写出总的化学方程式
您最近一年使用:0次
真题
名校
5 . 氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3-+4H++3e→NO+2H2O ;KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的方程式:_______________________________
(2)反应中硝酸体现了_________ 、_________ 性质。
(3)反应中若产生0.2mol气体,则转移电子的物质的量是________ mol。
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:___________________________________ 。
(1)写出并配平该氧化还原反应的方程式:
(2)反应中硝酸体现了
(3)反应中若产生0.2mol气体,则转移电子的物质的量是
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是:
您最近一年使用:0次
2009-11-16更新
|
1896次组卷
|
10卷引用:沪科版化学拓展性课程4《离子互换反应和氧化还原反应》测试题
沪科版化学拓展性课程4《离子互换反应和氧化还原反应》测试题2007年普通高等学校招生全国统一考试(上海卷)化学试题(已下线)2012-2013学年辽宁省丹东市宽甸二中高二4月月考(一)化学试卷(已下线)2012届北京四中高三上学期期中测试化学试卷(已下线)2014高考化学二轮专题突破 专题四氧化还原反应练习卷(已下线)2014届高考化学三轮复习排查 专题3离子反应 氧化还原反应练习卷(已下线)2015届四川省成都市高新区高三9月月考化学试卷(已下线)2015届浙江省江山实验中学高三9月月考化学试卷2015届福建省武平县第一中学高三上学期12月月考化学试卷四川省南充高级中学2017-2018学年高一12月月考化学试题



