名校
1 . 化学工业中会产生大量含铬废水。需进行无害化处理检测达标后才能排放。
(1)工业常用NaHSO3还原法处理,方法:向酸性废水中加入NaHSO3使Cr2O 还原成为Cr3+,然后加入熟石灰调节废水的pH,使Cr3+完全沉淀。
还原成为Cr3+,然后加入熟石灰调节废水的pH,使Cr3+完全沉淀。
①写出NaHSO3与Cr2O 反应的离子方程式:
反应的离子方程式:___________ 。
②已知25℃时Ksp[Cr(OH)3]=6.4×10-31,若除去废水中Cr3+,使其浓度小于1×10-5mol·L-1,此时溶液中的c(H+)<___________ mol·L-1
(2)废水中铬元素总浓度的测定方法:向一定量含Cr2O 和Cr3+的酸性废水样中加入足量(NH4)2S2O8,溶液将Cr3+氧化成Cr2O
和Cr3+的酸性废水样中加入足量(NH4)2S2O8,溶液将Cr3+氧化成Cr2O ,煮沸除去过量的(NH4)2S2O8;再加入过量的KI溶液,Cr2O
,煮沸除去过量的(NH4)2S2O8;再加入过量的KI溶液,Cr2O 与I-完全反应生成Cr3+和I2后,以淀粉为指示剂,用Na2S2O3标准溶液滴定至终点。测定过程中物质的转化关系为Cr3+
与I-完全反应生成Cr3+和I2后,以淀粉为指示剂,用Na2S2O3标准溶液滴定至终点。测定过程中物质的转化关系为Cr3+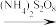 Cr2O
Cr2O
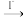 I2
I2 S4O
S4O 。
。
①上述操作过程中,若无煮沸操作,则测定的铬元素总浓度会___________ (填“偏大”、“偏小”或“不变”)。
②准确移取含Cr2O 和Cr3+的酸性废水样100.00mL,按上述方法测定废水样中铬元素总浓度,消耗0.01000mol·L-1Na2S2O3标准溶液13.50mL。计算该废水中铬元素总浓度(以mg·L-1表示)(写出计算过程)。
和Cr3+的酸性废水样100.00mL,按上述方法测定废水样中铬元素总浓度,消耗0.01000mol·L-1Na2S2O3标准溶液13.50mL。计算该废水中铬元素总浓度(以mg·L-1表示)(写出计算过程)。___________
(1)工业常用NaHSO3还原法处理,方法:向酸性废水中加入NaHSO3使Cr2O
 还原成为Cr3+,然后加入熟石灰调节废水的pH,使Cr3+完全沉淀。
还原成为Cr3+,然后加入熟石灰调节废水的pH,使Cr3+完全沉淀。①写出NaHSO3与Cr2O
 反应的离子方程式:
反应的离子方程式:②已知25℃时Ksp[Cr(OH)3]=6.4×10-31,若除去废水中Cr3+,使其浓度小于1×10-5mol·L-1,此时溶液中的c(H+)<
(2)废水中铬元素总浓度的测定方法:向一定量含Cr2O
 和Cr3+的酸性废水样中加入足量(NH4)2S2O8,溶液将Cr3+氧化成Cr2O
和Cr3+的酸性废水样中加入足量(NH4)2S2O8,溶液将Cr3+氧化成Cr2O ,煮沸除去过量的(NH4)2S2O8;再加入过量的KI溶液,Cr2O
,煮沸除去过量的(NH4)2S2O8;再加入过量的KI溶液,Cr2O 与I-完全反应生成Cr3+和I2后,以淀粉为指示剂,用Na2S2O3标准溶液滴定至终点。测定过程中物质的转化关系为Cr3+
与I-完全反应生成Cr3+和I2后,以淀粉为指示剂,用Na2S2O3标准溶液滴定至终点。测定过程中物质的转化关系为Cr3+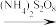 Cr2O
Cr2O
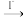 I2
I2 S4O
S4O 。
。①上述操作过程中,若无煮沸操作,则测定的铬元素总浓度会
②准确移取含Cr2O
 和Cr3+的酸性废水样100.00mL,按上述方法测定废水样中铬元素总浓度,消耗0.01000mol·L-1Na2S2O3标准溶液13.50mL。计算该废水中铬元素总浓度(以mg·L-1表示)(写出计算过程)。
和Cr3+的酸性废水样100.00mL,按上述方法测定废水样中铬元素总浓度,消耗0.01000mol·L-1Na2S2O3标准溶液13.50mL。计算该废水中铬元素总浓度(以mg·L-1表示)(写出计算过程)。
您最近半年使用:0次
名校
2 . 氧化还原反应是一类重要的反应,请按要求完成下列题目。
(1)实验室可用该反应制取氯气: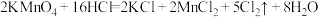 ,若有
,若有 参加反应,转移的电子数目是
参加反应,转移的电子数目是___ ,被氧化的 的物质的量是
的物质的量是__ ,请用双线桥法标出该反应电子转移的方向和数目: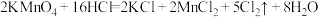 ,
,___ 。
(2)酸性 溶液可与
溶液可与 发生反应,已知
发生反应,已知 被还原为
被还原为 ,则氧化剂与还原剂的物质的量之比为
,则氧化剂与还原剂的物质的量之比为__ 。
(3)已知: ,
, 。
。
①向含有 和
和 的溶液中通入
的溶液中通入 ,此时被氧化的离子是
,此时被氧化的离子是__ 。
②某溶液中含有大量的 、
、 、
、 ,若向
,若向 该混合溶液中通入一定量的
该混合溶液中通入一定量的 ,溶液中
,溶液中 、
、 、
、 的物质的量与通入
的物质的量与通入 的体积(标准状况)的关系如下表所示,分析后回答下列问题:
的体积(标准状况)的关系如下表所示,分析后回答下列问题:
原溶液中 、
、 、
、 的物质的量浓度之比为
的物质的量浓度之比为_______ 。
(1)实验室可用该反应制取氯气:
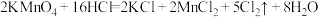 ,若有
,若有 参加反应,转移的电子数目是
参加反应,转移的电子数目是 的物质的量是
的物质的量是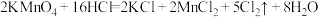 ,
,(2)酸性
 溶液可与
溶液可与 发生反应,已知
发生反应,已知 被还原为
被还原为 ,则氧化剂与还原剂的物质的量之比为
,则氧化剂与还原剂的物质的量之比为(3)已知:
 ,
, 。
。①向含有
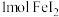 和
和 的溶液中通入
的溶液中通入 ,此时被氧化的离子是
,此时被氧化的离子是②某溶液中含有大量的
 、
、 、
、 ,若向
,若向 该混合溶液中通入一定量的
该混合溶液中通入一定量的 ,溶液中
,溶液中 、
、 、
、 的物质的量与通入
的物质的量与通入 的体积(标准状况)的关系如下表所示,分析后回答下列问题:
的体积(标准状况)的关系如下表所示,分析后回答下列问题: 的体积(标准状况) 的体积(标准状况) |  |  |  |
 | 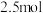 |  | 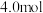 |
 |  | 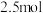 | 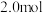 |
 |  | 0 | 0 |
原溶液中
 、
、 、
、 的物质的量浓度之比为
的物质的量浓度之比为
您最近半年使用:0次
3 . 下图是氮气及几种氮的化合物间的转换关系。请回答下列问题:

(1)请写出工业合成氨的化学方程式_______ 。
(2)工业上常用NH3制取NO,请写出反应的化学方程式_______ 。
(3)实验室里常用Cu与稀硝酸反应制取NO,当生成标准状况下3.36LNO时,转移的电子数为_______ 。
(4)生产硝酸时排放的NO会污染环境,一种治理方案是用氨气在催化剂作用下将NO还原成N2,请写出化学方程式:_______ 。
(5)有一瓶稀硫酸和稀硝酸的混合溶液,其中c(H2SO4)=2.0mol·L-1,c(HNO3)=1.0mol·L-1。取100mL该混合溶液与12.8g铜粉反应,标准状况下生成NO的体积为_______ L。

(1)请写出工业合成氨的化学方程式
(2)工业上常用NH3制取NO,请写出反应的化学方程式
(3)实验室里常用Cu与稀硝酸反应制取NO,当生成标准状况下3.36LNO时,转移的电子数为
(4)生产硝酸时排放的NO会污染环境,一种治理方案是用氨气在催化剂作用下将NO还原成N2,请写出化学方程式:
(5)有一瓶稀硫酸和稀硝酸的混合溶液,其中c(H2SO4)=2.0mol·L-1,c(HNO3)=1.0mol·L-1。取100mL该混合溶液与12.8g铜粉反应,标准状况下生成NO的体积为
您最近半年使用:0次
4 . 一种由CuO和KHC2O4溶液反应得到的蓝色结晶[KaCub(C2O4)c·dH2O]。为测定其组成,进行了如下实验:
步骤1:称取3.5400g该晶体,加入过量稀硫酸,待样品完全溶解后加入适量水,配制成100mL溶液A。
步骤2:量取20.00mLA溶液,滴加0.2000mol·L-1KMnO4溶液至恰好完全反应时,消耗KMnO4溶液8.00mL。
步骤3:另取20.00mLA溶液,加入足量NaOH溶液,充分反应后,经过滤、洗涤、灼烧、称重,得到黑色固体粉末0.16g。
已知:步骤2中发生反应如下,请配平:___ 。
 + H2C2O4+ H+= Mn2++ CO2↑+ H2O
+ H2C2O4+ H+= Mn2++ CO2↑+ H2O
(1)3.5400g该样品中含n( )=
)=___ mol。
(2)3.5400g该样品中含n(Cu2+)=___ mol。
(3)通过计算确定该蓝色晶体的化学式(计算过程)___ 。
步骤1:称取3.5400g该晶体,加入过量稀硫酸,待样品完全溶解后加入适量水,配制成100mL溶液A。
步骤2:量取20.00mLA溶液,滴加0.2000mol·L-1KMnO4溶液至恰好完全反应时,消耗KMnO4溶液8.00mL。
步骤3:另取20.00mLA溶液,加入足量NaOH溶液,充分反应后,经过滤、洗涤、灼烧、称重,得到黑色固体粉末0.16g。
已知:步骤2中发生反应如下,请配平:
 + H2C2O4+ H+= Mn2++ CO2↑+ H2O
+ H2C2O4+ H+= Mn2++ CO2↑+ H2O(1)3.5400g该样品中含n(
 )=
)=(2)3.5400g该样品中含n(Cu2+)=
(3)通过计算确定该蓝色晶体的化学式(计算过程)
您最近半年使用:0次
解题方法
5 . 大多数植物不能从空气中摄取氮,农作物生长需要通过合成氨,进行人工固氮。合成氨的某种催化剂P,主要成分为二价铁和三价铁的氧化物按一定比例形成的混合物。
(1)铁、氧的物质的量之比为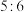 的由
的由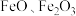 组成的混合物中,
组成的混合物中, 与
与 的物质的量之比为
的物质的量之比为_______ 。
(2)兴趣小组查阅相关资料,发现该合成氨催化剂活性最高时,催化剂P中 与
与 的物质的量之比为
的物质的量之比为 ,则此时该铁的氧化物混合物的平均摩尔质量为
,则此时该铁的氧化物混合物的平均摩尔质量为_______ ,其中氧元素的质量分数为_______ (保留2位有效数字)。
(3)兴趣小组发现以 为原料制备此催化剂的化学方程式为
为原料制备此催化剂的化学方程式为 。为制得这种活性最高的催化剂,理论上应向
。为制得这种活性最高的催化剂,理论上应向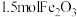 粉末中加入炭粉的质量为
粉末中加入炭粉的质量为_______ ,完全反应时生成 的体积为
的体积为_______ (折算成标准状况下)。
(4) 为剧毒物质,处理含有
为剧毒物质,处理含有 的废水常用的方法为在碱性条件下用
的废水常用的方法为在碱性条件下用 溶液将
溶液将 氧化为
氧化为 和一种单质气体,则该反应的离子方程式为
和一种单质气体,则该反应的离子方程式为_______ 。
(1)铁、氧的物质的量之比为
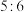 的由
的由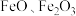 组成的混合物中,
组成的混合物中, 与
与 的物质的量之比为
的物质的量之比为(2)兴趣小组查阅相关资料,发现该合成氨催化剂活性最高时,催化剂P中
 与
与 的物质的量之比为
的物质的量之比为 ,则此时该铁的氧化物混合物的平均摩尔质量为
,则此时该铁的氧化物混合物的平均摩尔质量为(3)兴趣小组发现以
 为原料制备此催化剂的化学方程式为
为原料制备此催化剂的化学方程式为 。为制得这种活性最高的催化剂,理论上应向
。为制得这种活性最高的催化剂,理论上应向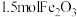 粉末中加入炭粉的质量为
粉末中加入炭粉的质量为 的体积为
的体积为(4)
 为剧毒物质,处理含有
为剧毒物质,处理含有 的废水常用的方法为在碱性条件下用
的废水常用的方法为在碱性条件下用 溶液将
溶液将 氧化为
氧化为 和一种单质气体,则该反应的离子方程式为
和一种单质气体,则该反应的离子方程式为
您最近半年使用:0次
6 . 请回答以下问题:
(1)氢化钠(NaH)为白色晶体,其中 有很强的还原性,因此常用氢化钠在高温下将TiCl4还原为Ti,自身被氧化为+1价。写出其化学反应方程式,并用单线桥标出电子的转移的方向与数目
有很强的还原性,因此常用氢化钠在高温下将TiCl4还原为Ti,自身被氧化为+1价。写出其化学反应方程式,并用单线桥标出电子的转移的方向与数目___________ ;NaH能与水剧烈反应NaH+H2O=NaOH+H2↑,NaH与液氨也有类似反应,写出反应的化学方程式___________ 。
(2)在3BrF3+5H2O=HBrO3+Br2+9HF+O2↑的反应中,3mol的BrF3参加反应时,被H2O所还原的BrF3的物质的量是___________ 。
(3)已知砒霜As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O
①请用双线桥法标出电子转移的方向和数目___________ 。
②若生成0.2molAsH3,则转移的电子数为___________ 。
(4)氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,制备ClO2有下列两种方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
①方法一中氧化剂与还原剂的物质的量之比为___________ ;
②若两种方法制备得到相同条件下相同体积的ClO2气体,则两方法中消耗的还原剂质量之比为___________ ;
③Cl2与ClO2均用作水处理剂,若它们中的氯元素均被还原为 ,则相同质量的ClO2是Cl2消毒效率的
,则相同质量的ClO2是Cl2消毒效率的___________ 倍。
(5)配平反应方程式(答题卡上写出完整的化学方程式)___________________ 。
______Al+_______NaNO3+_____H2O=____Al(OH)3+____N2↑+____NaAlO2
(1)氢化钠(NaH)为白色晶体,其中
 有很强的还原性,因此常用氢化钠在高温下将TiCl4还原为Ti,自身被氧化为+1价。写出其化学反应方程式,并用单线桥标出电子的转移的方向与数目
有很强的还原性,因此常用氢化钠在高温下将TiCl4还原为Ti,自身被氧化为+1价。写出其化学反应方程式,并用单线桥标出电子的转移的方向与数目(2)在3BrF3+5H2O=HBrO3+Br2+9HF+O2↑的反应中,3mol的BrF3参加反应时,被H2O所还原的BrF3的物质的量是
(3)已知砒霜As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4=2AsH3↑+6ZnSO4+3H2O
①请用双线桥法标出电子转移的方向和数目
②若生成0.2molAsH3,则转移的电子数为
(4)氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,制备ClO2有下列两种方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O
①方法一中氧化剂与还原剂的物质的量之比为
②若两种方法制备得到相同条件下相同体积的ClO2气体,则两方法中消耗的还原剂质量之比为
③Cl2与ClO2均用作水处理剂,若它们中的氯元素均被还原为
 ,则相同质量的ClO2是Cl2消毒效率的
,则相同质量的ClO2是Cl2消毒效率的(5)配平反应方程式(答题卡上写出完整的化学方程式)
______Al+_______NaNO3+_____H2O=____Al(OH)3+____N2↑+____NaAlO2
您最近半年使用:0次
名校
7 . (1)3.01×1023个OH-的物质的量为_______ ,含有电子的物质的量为_______ ,这些OH-和_______ g的Na+含有的电子数相同。
(2)某盐混合溶液中含有离子:Na+、Mg2+、Cl-、 ,测得Na+、Mg2+和Cl-的物质的量浓度依次为:0.2mol•L-1、0.25mol•L-1、0.4mol•L-1,则c(
,测得Na+、Mg2+和Cl-的物质的量浓度依次为:0.2mol•L-1、0.25mol•L-1、0.4mol•L-1,则c( )=
)=_______ 。
(3)实验室可用KMnO4和浓盐酸反应制取氯气。其变化可表述为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
①请将上述化学方程式改写为离子方程式_______ 。
②浓盐酸在反应中显示出来的性质是_______ (填字母)。
a.只有还原性 b.还原性和酸性 c.只有氧化性 d.氧化性和酸性
③此反应中氧化产物是_______ (填化学式),还原性Cl-______ Mn2+(填>、<或=)。
④用双线桥法表示该反应电子转移的方向和数目:_______ 。
(2)某盐混合溶液中含有离子:Na+、Mg2+、Cl-、
 ,测得Na+、Mg2+和Cl-的物质的量浓度依次为:0.2mol•L-1、0.25mol•L-1、0.4mol•L-1,则c(
,测得Na+、Mg2+和Cl-的物质的量浓度依次为:0.2mol•L-1、0.25mol•L-1、0.4mol•L-1,则c( )=
)=(3)实验室可用KMnO4和浓盐酸反应制取氯气。其变化可表述为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。
①请将上述化学方程式改写为离子方程式
②浓盐酸在反应中显示出来的性质是
a.只有还原性 b.还原性和酸性 c.只有氧化性 d.氧化性和酸性
③此反应中氧化产物是
④用双线桥法表示该反应电子转移的方向和数目:
您最近半年使用:0次
8 . 碱式硫酸铁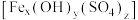 (Fe元素为+3价)是一种新型高效絮凝剂。为确定该碱式硫酸铁
(Fe元素为+3价)是一种新型高效絮凝剂。为确定该碱式硫酸铁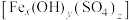 的化学式,进行了如下实验∶
的化学式,进行了如下实验∶
步骤 1.称取一定量样品完全溶于稀盐酸中,配成100.00mL溶液。
步骤2.取步骤1所得溶液25.00 mL,加入足量 BaCl2溶液,充分反应,静置、过滤、洗涤、干燥,称得沉淀 2.330 g。
步骤3.另取步骤1所得溶液25.00mL,加入足量的某试剂(与酸性KMnO4溶液不反应),将 Fe3+完全还原为 Fe2+,再向其中滴加 0.1000 mol·L-1酸性 KMnO4溶液,测得 Fe2+恰好完全反应时消耗 KMnO4溶液 16.00 mL。
已知∶ (未配平)
(未配平)
通过计算确定该碱式硫酸铁的化学式______ 。(写出计算过程)
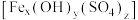 (Fe元素为+3价)是一种新型高效絮凝剂。为确定该碱式硫酸铁
(Fe元素为+3价)是一种新型高效絮凝剂。为确定该碱式硫酸铁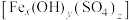 的化学式,进行了如下实验∶
的化学式,进行了如下实验∶步骤 1.称取一定量样品完全溶于稀盐酸中,配成100.00mL溶液。
步骤2.取步骤1所得溶液25.00 mL,加入足量 BaCl2溶液,充分反应,静置、过滤、洗涤、干燥,称得沉淀 2.330 g。
步骤3.另取步骤1所得溶液25.00mL,加入足量的某试剂(与酸性KMnO4溶液不反应),将 Fe3+完全还原为 Fe2+,再向其中滴加 0.1000 mol·L-1酸性 KMnO4溶液,测得 Fe2+恰好完全反应时消耗 KMnO4溶液 16.00 mL。
已知∶
 (未配平)
(未配平)通过计算确定该碱式硫酸铁的化学式
您最近半年使用:0次
名校
解题方法
9 . 兴趣小组用莫尔盐[化学式为(NH4)mFe(SO4)2·6H2O(Fe为+2价)]测定KMnO4溶液的物质的量浓度的过程如下:
①称取19.6g莫尔盐配成100mL溶液。
②量取10.00mL KMnO4溶液,向其中加入足量的H2SO4进行酸化,向酸化后的溶液中逐滴滴加莫尔盐溶液,反应完全时消耗莫尔盐溶液的体积20.00mL,所发生反应的离子方程式如下:Fe2++MnO +H+→Fe3++Mn2++H2O(未配平)请回答下列问题:
+H+→Fe3++Mn2++H2O(未配平)请回答下列问题:
(1)莫尔盐(NH4)mFe(SO4)2·6H2O中m=___________ 。
(2)上述20.00mL莫尔盐溶液中 c(Fe2+)=___________ 。
(3)计算KMnO4溶液的物质的量浓度(写出计算过程)________ 。
①称取19.6g莫尔盐配成100mL溶液。
②量取10.00mL KMnO4溶液,向其中加入足量的H2SO4进行酸化,向酸化后的溶液中逐滴滴加莫尔盐溶液,反应完全时消耗莫尔盐溶液的体积20.00mL,所发生反应的离子方程式如下:Fe2++MnO
 +H+→Fe3++Mn2++H2O(未配平)请回答下列问题:
+H+→Fe3++Mn2++H2O(未配平)请回答下列问题:(1)莫尔盐(NH4)mFe(SO4)2·6H2O中m=
(2)上述20.00mL莫尔盐溶液中 c(Fe2+)=
(3)计算KMnO4溶液的物质的量浓度(写出计算过程)
您最近半年使用:0次
2021-01-28更新
|
125次组卷
|
2卷引用:江苏省梁丰高级中学等六校2020-2021学年高一上学期12月联合调研测试化学试题
解题方法
10 . 氯的单质及其化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。
(1)常温下,可用氯酸钾固体与浓盐酸反应制备Cl2,写出反应的化学方程式___ ,若氧化产物比还原产物多1mol,则被氧化HCl的物质的量为___ mol。
(2)Cl2O为淡棕黄色气体,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为___ 。
(3)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力,Cl2O的有效氯含量为___ 。(计算结果保留两位小数)
(1)常温下,可用氯酸钾固体与浓盐酸反应制备Cl2,写出反应的化学方程式
(2)Cl2O为淡棕黄色气体,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为
(3)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力,Cl2O的有效氯含量为
您最近半年使用:0次



