名校
解题方法
1 . 综合题
 .铁在自然界中有多种存在形式,并且对环境也有重要影响,某化学兴趣小组对土壤中的铁的存在和含量进行了以下的研究:
.铁在自然界中有多种存在形式,并且对环境也有重要影响,某化学兴趣小组对土壤中的铁的存在和含量进行了以下的研究:
(1)土壤中的铁循环可用于水体脱氮(脱氮是指将氮元素从水体中除去),酸性环境中Fe2+脱除水体中硝态氮(NO )且无污染,写出该反应的离子方程式:
)且无污染,写出该反应的离子方程式:___________ 。
(2)土壤中的铁元素含量的测定:
乙二胺四乙酸又叫 ,是化学中一种良好的配合剂,形成的配合物又叫螯合物。
,是化学中一种良好的配合剂,形成的配合物又叫螯合物。 在配位滴定中用到,一般是测定金属离子的含量。已知:
在配位滴定中用到,一般是测定金属离子的含量。已知: 配离子结构如图,M为Fe3+。
配离子结构如图,M为Fe3+。 中氮原子杂化方式
中氮原子杂化方式___________ ,该配合物中Fe3+配位数是___________ 。
②土壤中的铁元素含量测定步骤:
第一步:取ag土壤试样溶解,加入足量H2O2,将溶液充分加热。
第二步:将上述液体配成100mL溶液,取25.00mL,,滴入两滴二甲酚橙作指示剂,用bmol·L-1EDTA(简写成H2Y2-)标准溶液滴定,反应的离子方程式为Fe3++H2Y2-=FeY-+2H+。达到滴定终点时,消耗EDTA标准溶液的平均体积为12.50mL。该土壤中的铁元素质量分数为___________ (用含a、b的代数式表示)。
③第一步加入足量H2O2的目的是:___________ 。
④若在滴定操作中一些不当操作可能会引起误差,下列操作会使土壤中的铁元素质量分数测定结果偏高的是:___________ 。
A.滴定终点读数时,俯视滴定管的刻度
B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点,读数时发现滴定管尖嘴处悬挂一滴溶液
D.盛放EDTA(简写成H2Y2-)标准溶液的滴定管用蒸馏水洗净后未用标准液润洗
 .铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。
.铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。___________ 。
(4)若该晶胞的边长为d nm,则该合金的密度为___________  。(列出计算式即可,设阿伏加德罗常数的值为NA)
。(列出计算式即可,设阿伏加德罗常数的值为NA)
(5)若该晶体储氢时,H2分子在晶胞的体心和棱心位置,则含镁 48g的该储氢合金可储存标准状况下H2的体积约为___________ L。
 .铁在自然界中有多种存在形式,并且对环境也有重要影响,某化学兴趣小组对土壤中的铁的存在和含量进行了以下的研究:
.铁在自然界中有多种存在形式,并且对环境也有重要影响,某化学兴趣小组对土壤中的铁的存在和含量进行了以下的研究:(1)土壤中的铁循环可用于水体脱氮(脱氮是指将氮元素从水体中除去),酸性环境中Fe2+脱除水体中硝态氮(NO
 )且无污染,写出该反应的离子方程式:
)且无污染,写出该反应的离子方程式:(2)土壤中的铁元素含量的测定:
乙二胺四乙酸又叫
 ,是化学中一种良好的配合剂,形成的配合物又叫螯合物。
,是化学中一种良好的配合剂,形成的配合物又叫螯合物。 在配位滴定中用到,一般是测定金属离子的含量。已知:
在配位滴定中用到,一般是测定金属离子的含量。已知: 配离子结构如图,M为Fe3+。
配离子结构如图,M为Fe3+。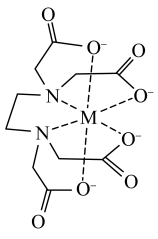
 中氮原子杂化方式
中氮原子杂化方式②土壤中的铁元素含量测定步骤:
第一步:取ag土壤试样溶解,加入足量H2O2,将溶液充分加热。
第二步:将上述液体配成100mL溶液,取25.00mL,,滴入两滴二甲酚橙作指示剂,用bmol·L-1EDTA(简写成H2Y2-)标准溶液滴定,反应的离子方程式为Fe3++H2Y2-=FeY-+2H+。达到滴定终点时,消耗EDTA标准溶液的平均体积为12.50mL。该土壤中的铁元素质量分数为
③第一步加入足量H2O2的目的是:
④若在滴定操作中一些不当操作可能会引起误差,下列操作会使土壤中的铁元素质量分数测定结果偏高的是:
A.滴定终点读数时,俯视滴定管的刻度
B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点,读数时发现滴定管尖嘴处悬挂一滴溶液
D.盛放EDTA(简写成H2Y2-)标准溶液的滴定管用蒸馏水洗净后未用标准液润洗
 .铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。
.铁镁合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图所示。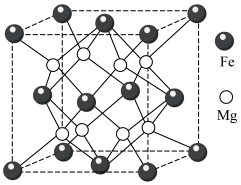
(4)若该晶胞的边长为d nm,则该合金的密度为
 。(列出计算式即可,设阿伏加德罗常数的值为NA)
。(列出计算式即可,设阿伏加德罗常数的值为NA)(5)若该晶体储氢时,H2分子在晶胞的体心和棱心位置,则含镁 48g的该储氢合金可储存标准状况下H2的体积约为
您最近半年使用:0次
解题方法
2 . A、B、C、D、E、F为短周期元素, 原子序数依次增大。非金属元素A 最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。E+与D2-具有相同的电子层结构。A单质在F单质中燃烧,产物溶于水得到一种强酸M。回答下列问题:
(1)画出E的离子结构示意图___________ 。
(2)F在周期表中的位置是___________ 。
(3)B、D、E组成的一种常见盐,其中D的质量分数约为 45%,该盐与少量M溶液反应的离子方程式为___________ 。
(4)由这些元素组成的物质,相关信息如下:
①a的电子式为___________ 。 写出其与水反应的化学方程式:___________ 。
②b的一种常见用途为___________ 。
③已知c中所有原子均满足8 电子稳定结构,该化合物的结构式为___________ 。
(1)画出E的离子结构示意图
(2)F在周期表中的位置是
(3)B、D、E组成的一种常见盐,其中D的质量分数约为 45%,该盐与少量M溶液反应的离子方程式为
(4)由这些元素组成的物质,相关信息如下:
| 物质 | 组成和结构信息 |
| a | 由 A、E组成的离子化合物 |
| b | 由D、E组成的含非极性键的离子化合物,阴阳离子数之比为1:2 |
| c | 化学式为BDF2的共价化合物 |
②b的一种常见用途为
③已知c中所有原子均满足8 电子稳定结构,该化合物的结构式为
您最近半年使用:0次
解题方法
3 . Co、La元素及其化合物在工业及生活方面有重要应用。回答下列问题:
(1)基态Co的价电子排布图_______ ,核外电子的空间运动状态有_______ 种。
(2)一定条件下, 、
、 、
、 和
和 反应可制得
反应可制得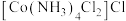 ,反应的方程式为
,反应的方程式为_______ ,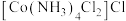 的配位数为
的配位数为_______ 。区别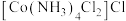 和
和 两种溶液的试剂是
两种溶液的试剂是_______ 。
(3) 的八配位金属羰基化合物
的八配位金属羰基化合物 的结构如图所示,
的结构如图所示, 作配体,配位原子为C,而不是O,其原因是
作配体,配位原子为C,而不是O,其原因是_______ ,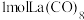 含
含_______  键。
键。 在储氢和超导等领域具有重要应用。高压下,
在储氢和超导等领域具有重要应用。高压下, 中的每个
中的每个 结合4个
结合4个 形成类似
形成类似 的结构独立存在,即得到晶体
的结构独立存在,即得到晶体 。则
。则
_______ 。晶体 的密度为
的密度为_______  。(写出计算式即可)
。(写出计算式即可)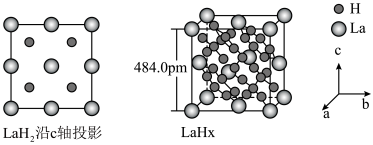
(1)基态Co的价电子排布图
(2)一定条件下,
 、
、 、
、 和
和 反应可制得
反应可制得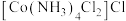 ,反应的方程式为
,反应的方程式为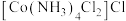 的配位数为
的配位数为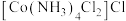 和
和 两种溶液的试剂是
两种溶液的试剂是(3)
 的八配位金属羰基化合物
的八配位金属羰基化合物 的结构如图所示,
的结构如图所示, 作配体,配位原子为C,而不是O,其原因是
作配体,配位原子为C,而不是O,其原因是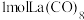 含
含 键。
键。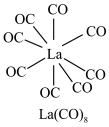
 在储氢和超导等领域具有重要应用。高压下,
在储氢和超导等领域具有重要应用。高压下, 中的每个
中的每个 结合4个
结合4个 形成类似
形成类似 的结构独立存在,即得到晶体
的结构独立存在,即得到晶体 。则
。则
 的密度为
的密度为 。(写出计算式即可)
。(写出计算式即可)
您最近半年使用:0次
解题方法
4 . 金属钛( )密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。
)密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。
(1) 元素在周期表中的分区是位于
元素在周期表中的分区是位于___________ 区。基态 原子中含有的未成对电子数是
原子中含有的未成对电子数是___________ 。
(2)金红石主要成分是钛的氧化物,该氧化物的晶胞形状为长方体,边长分别为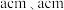 和
和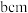 ,结构如下图所示。
,结构如下图所示。___________ , 位于距离最近的
位于距离最近的 构成的
构成的___________ 中心(填字母序号,下同)。
a.三角形 b.四面体 c.六面体 d.八面体
②该氧化物的晶体熔点为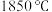 ,其晶体类型
,其晶体类型最不可 能是___________ 。
a.共价晶体 b.离子晶体 c.分子晶体
③若已知 该氧化物晶体体积为
该氧化物晶体体积为 ,则阿伏加德罗常数
,则阿伏加德罗常数 可表示为
可表示为___________  。
。
(3)以钓铁矿 为原料,用美还原法冶炼金属钓的生产流程图如下:
为原料,用美还原法冶炼金属钓的生产流程图如下: 元素在元素周期表中的位置是
元素在元素周期表中的位置是___________ 。
②“高温氯化”时还得到一种可燃性气体,写出反应的化学方程式:___________ 。
③结合流程及下表数据,“分离”时所需控制的最低温度应为___________  。
。
④已知 和
和 的晶胞类型相同,
的晶胞类型相同, 和
和 的离子半径大小相近,解释
的离子半径大小相近,解释 熔点高于
熔点高于 的原因:
的原因:___________ 。
 )密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。
)密度小,强度高,抗腐蚀性能好。含钛的矿石主要有金红石和铁铁矿。(1)
 元素在周期表中的分区是位于
元素在周期表中的分区是位于 原子中含有的未成对电子数是
原子中含有的未成对电子数是(2)金红石主要成分是钛的氧化物,该氧化物的晶胞形状为长方体,边长分别为
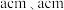 和
和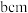 ,结构如下图所示。
,结构如下图所示。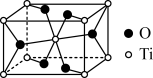
 位于距离最近的
位于距离最近的 构成的
构成的a.三角形 b.四面体 c.六面体 d.八面体
②该氧化物的晶体熔点为
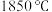 ,其晶体类型
,其晶体类型a.共价晶体 b.离子晶体 c.分子晶体
③若已知
 该氧化物晶体体积为
该氧化物晶体体积为 ,则阿伏加德罗常数
,则阿伏加德罗常数 可表示为
可表示为 。
。(3)以钓铁矿
 为原料,用美还原法冶炼金属钓的生产流程图如下:
为原料,用美还原法冶炼金属钓的生产流程图如下:
 元素在元素周期表中的位置是
元素在元素周期表中的位置是②“高温氯化”时还得到一种可燃性气体,写出反应的化学方程式:
③结合流程及下表数据,“分离”时所需控制的最低温度应为
 。
。 |  |  | |
熔点/ | 1668 | 651 | 714 |
沸点/ | 3287 | 1107 | 1412 |
 和
和 的晶胞类型相同,
的晶胞类型相同, 和
和 的离子半径大小相近,解释
的离子半径大小相近,解释 熔点高于
熔点高于 的原因:
的原因:
您最近半年使用:0次
5 . 早在几千年前,人类就掌握了发酵法酿酒的技术。各类酒中都含有浓度不等的乙醇( ),乙醇可以与酸性高锰酸钾(
),乙醇可以与酸性高锰酸钾( )溶液或酸性重铬酸钾(
)溶液或酸性重铬酸钾( )溶液反应,被氧化成乙酸(
)溶液反应,被氧化成乙酸( )。回答下列问题:
)。回答下列问题:
(1)基态K原子的价电子轨道表示式为___________ 。
(2)离子半径:Mn3+___________ (填“>”或“<”) Mn2+。
(3)C、H、O形成的化合物中:
①稳定性:H2O___________ (填“>”“<”或“=”) CH4。
②沸点:CH2CH2OH___________ (填“>”“<”或“=”) CH3COOH。
(4)第一电离能:Mn___________ (填“>”“<”或“=”)Cr,判断的理由为___________ 。
(5)乙醇与酸性高锰酸钾(KMnO4)溶液反应的离子方程式为___________ 。
(6)重铬酸钾(K2Cr2O7)溶液与浓盐酸混合会产生氯气,该反应中,每生成0.1mol氯气,此时转移的电子的物质的量为___________ mol。
 ),乙醇可以与酸性高锰酸钾(
),乙醇可以与酸性高锰酸钾( )溶液或酸性重铬酸钾(
)溶液或酸性重铬酸钾( )溶液反应,被氧化成乙酸(
)溶液反应,被氧化成乙酸( )。回答下列问题:
)。回答下列问题:(1)基态K原子的价电子轨道表示式为
(2)离子半径:Mn3+
(3)C、H、O形成的化合物中:
①稳定性:H2O
②沸点:CH2CH2OH
(4)第一电离能:Mn
(5)乙醇与酸性高锰酸钾(KMnO4)溶液反应的离子方程式为
(6)重铬酸钾(K2Cr2O7)溶液与浓盐酸混合会产生氯气,该反应中,每生成0.1mol氯气,此时转移的电子的物质的量为
您最近半年使用:0次
名校
6 . 氮族元素(N、P、As、Sb等)及其化合物在工农业生产、环境等方面有重要应用和影响。
Ⅰ.氮族元素氢化物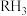 (
( 、
、 、
、 )的某种性质随R的核电荷数的Y变化趋势如图所示。
)的某种性质随R的核电荷数的Y变化趋势如图所示。
(1)Y轴可表示的氢化物(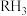 )性质可能是
)性质可能是________ 。
Ⅱ.磷化氢( )是粮食储备常用的高效熏蒸杀虫剂。工业制备的流程如图。
)是粮食储备常用的高效熏蒸杀虫剂。工业制备的流程如图。________ 。
(3)白磷和烧碱溶液反应的化学方程式为________ ,次磷酸属于________ (填“一”“二”或“三”)元酸。
(4)若起始时有 参加反应,则整个工业流程中共生成
参加反应,则整个工业流程中共生成________  (忽略产物的损失)。
(忽略产物的损失)。
(5)释放到大气中的 废气,可与
废气,可与 类温室气体竞争羟基自由基·OH,通过
类温室气体竞争羟基自由基·OH,通过 反应不断被消耗,进而减缓了大气中通过
反应不断被消耗,进而减缓了大气中通过 反应对
反应对 类温室气体进行化学清除的速率。请从物质结构角度解释
类温室气体进行化学清除的速率。请从物质结构角度解释 对·OH更具竞争优势的原因
对·OH更具竞争优势的原因________ 。
(6)用Ni/ /
/ 催化剂催化分解
催化剂催化分解 机理如下,实现了污染物资源化转化。
机理如下,实现了污染物资源化转化。________ 。
Ⅲ.雄黄( )、雌黄(
)、雌黄( )都是自然界中常见的砷的化合物,自古有“信口雌黄”、“雄黄入药”之说。
)都是自然界中常见的砷的化合物,自古有“信口雌黄”、“雄黄入药”之说。________ (填“是”或“否”)
(8)已知雌黄分子中没有π键且各原子最外层均达到8电子稳定结构,由此判断雌黄在水中的溶解性为________ (填“可溶”或“不溶”),原因是________ 。
Ⅰ.氮族元素氢化物
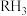 (
( 、
、 、
、 )的某种性质随R的核电荷数的Y变化趋势如图所示。
)的某种性质随R的核电荷数的Y变化趋势如图所示。(1)Y轴可表示的氢化物(
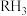 )性质可能是
)性质可能是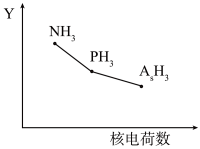
Ⅱ.磷化氢(
 )是粮食储备常用的高效熏蒸杀虫剂。工业制备的流程如图。
)是粮食储备常用的高效熏蒸杀虫剂。工业制备的流程如图。
(3)白磷和烧碱溶液反应的化学方程式为
(4)若起始时有
 参加反应,则整个工业流程中共生成
参加反应,则整个工业流程中共生成 (忽略产物的损失)。
(忽略产物的损失)。(5)释放到大气中的
 废气,可与
废气,可与 类温室气体竞争羟基自由基·OH,通过
类温室气体竞争羟基自由基·OH,通过 反应不断被消耗,进而减缓了大气中通过
反应不断被消耗,进而减缓了大气中通过 反应对
反应对 类温室气体进行化学清除的速率。请从物质结构角度解释
类温室气体进行化学清除的速率。请从物质结构角度解释 对·OH更具竞争优势的原因
对·OH更具竞争优势的原因(6)用Ni/
 /
/ 催化剂催化分解
催化剂催化分解 机理如下,实现了污染物资源化转化。
机理如下,实现了污染物资源化转化。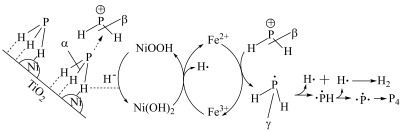
Ⅲ.雄黄(
 )、雌黄(
)、雌黄( )都是自然界中常见的砷的化合物,自古有“信口雌黄”、“雄黄入药”之说。
)都是自然界中常见的砷的化合物,自古有“信口雌黄”、“雄黄入药”之说。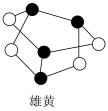
(8)已知雌黄分子中没有π键且各原子最外层均达到8电子稳定结构,由此判断雌黄在水中的溶解性为
您最近半年使用:0次
名校
7 . 现有部分元素的原子结构特点如表:
(1)画出W原子结构示意图____________ 。
(2)元素X与元素Z相比,非金属性较强的是__________ (填元素名称),写出一个能表示X、Z非金属性强弱关系的化学方程式:____________ 。
(3)X、Y、Z、W四种元素形成的一种离子化合物,其水溶液显强酸性,该化合物的化学式为__________ 。
(4)元素X和元素Y以原子个数比1∶1化合形成的化合物Q,写出Q的电子式:____________ 。元素W和元素Y化合形成的化合物M,Q和M的电子总数相等,写出M的结构式__________ 。以M为燃料,Q为氧化剂,可作火箭推进剂,最终生成无毒的、且在自然界中稳定存在的物质,写出该反应的化学方程式:________ 。
X | L层电子数是K层电子数的3倍 |
Y | 核外电子层数等于原子序数 |
Z | L层电子数是K层和M层电子数之和 |
W | 最外层电子数是次外层电子数的2.5倍 |
(2)元素X与元素Z相比,非金属性较强的是
(3)X、Y、Z、W四种元素形成的一种离子化合物,其水溶液显强酸性,该化合物的化学式为
(4)元素X和元素Y以原子个数比1∶1化合形成的化合物Q,写出Q的电子式:
您最近半年使用:0次
2024-04-08更新
|
23次组卷
|
2卷引用:河南省实验中学2023-2024学年高一下学期月考化学试卷
真题
解题方法
8 . 铜及其化合物在生产生活中有重要作用。
(1)基态Cu原子的价层电子排布式是______ , 与
与 相比较,离子半径较大的是
相比较,离子半径较大的是______ 。
(2)铜的一种化合物的晶胞如图所示,其化学式为______ 。 ,写出该反应化学方程式:
,写出该反应化学方程式:______ 。反应中,H2O2实际消耗量大于理论用量的原因是______ 。H2O2电子式为______ 。
(4)上述制备反应中,下列物质均可替代H2O2作氧化剂,最适合的是是______ (填序号)。
a.硝酸 b. c.
c.
(5)Cu2+和I-的反应可用于Cu含量的定量分析。向CuCl2溶液中滴入KI溶液,生成一种碘化物白色沉淀,且上层溶液可使淀粉溶液变蓝。该白色沉淀的化学式为______ 。反应中KI的作用为______ 。
(1)基态Cu原子的价层电子排布式是
 与
与 相比较,离子半径较大的是
相比较,离子半径较大的是(2)铜的一种化合物的晶胞如图所示,其化学式为

 ,写出该反应化学方程式:
,写出该反应化学方程式:(4)上述制备反应中,下列物质均可替代H2O2作氧化剂,最适合的是是
a.硝酸 b.
 c.
c.
(5)Cu2+和I-的反应可用于Cu含量的定量分析。向CuCl2溶液中滴入KI溶液,生成一种碘化物白色沉淀,且上层溶液可使淀粉溶液变蓝。该白色沉淀的化学式为
您最近半年使用:0次
名校
解题方法
9 . 钛是一种战略资源,广泛应用于国防、航天、航空和国民经济的许多领域,对于国民经济的发展具有战略意义。回答下列问题:
(1)钛的性质比较活泼,但金属钛具有较强的抗腐蚀性,其原因可能是___________ 。
(2) 可与
可与 互溶,从微观角度解释其原因为
互溶,从微观角度解释其原因为___________ ;高温下,用 、焦炭和氯气发生反应制取
、焦炭和氯气发生反应制取 ,同时生成一种可燃性气体,该反应中的还原产物为
,同时生成一种可燃性气体,该反应中的还原产物为___________ ,每生成 ,反应中转移的电子数目为
,反应中转移的电子数目为___________ 。
(3) 的四卤化物熔点如下表所示,由此可推知,
的四卤化物熔点如下表所示,由此可推知, 中的化学键类型是
中的化学键类型是___________ , 至
至 熔点依次升高,原因是
熔点依次升高,原因是___________ 。
(4) 具有重要的用途,可在高温下由
具有重要的用途,可在高温下由 与
与 反应制得,同时生成一种可用作保护气的单质气体和一种无色无味的液体,该反应的化学方程式为
反应制得,同时生成一种可用作保护气的单质气体和一种无色无味的液体,该反应的化学方程式为___________ 。
(1)钛的性质比较活泼,但金属钛具有较强的抗腐蚀性,其原因可能是
(2)
 可与
可与 互溶,从微观角度解释其原因为
互溶,从微观角度解释其原因为 、焦炭和氯气发生反应制取
、焦炭和氯气发生反应制取 ,同时生成一种可燃性气体,该反应中的还原产物为
,同时生成一种可燃性气体,该反应中的还原产物为 ,反应中转移的电子数目为
,反应中转移的电子数目为(3)
 的四卤化物熔点如下表所示,由此可推知,
的四卤化物熔点如下表所示,由此可推知, 中的化学键类型是
中的化学键类型是 至
至 熔点依次升高,原因是
熔点依次升高,原因是| 化合物 |  |  |  |  |
| 熔点/℃ | 377 | 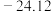 | 38.3 | 155 |
 具有重要的用途,可在高温下由
具有重要的用途,可在高温下由 与
与 反应制得,同时生成一种可用作保护气的单质气体和一种无色无味的液体,该反应的化学方程式为
反应制得,同时生成一种可用作保护气的单质气体和一种无色无味的液体,该反应的化学方程式为
您最近半年使用:0次
10 . 下列是都分短周期中第二、第三周期元素的原子半径及主要化合价.
回答下列问题:
(1)⑦在元素周期表中的位置是(周期、族)______________ 。
(2)七种元素的最高价氧化物的水化物中,酸性最强的是______________ ,碱性最强的是______________ (填化学式)。
(3)②、⑤、⑦的离子半径由大到小的顺序是______________ (填离子符号)。
(4)①、⑤、⑦按原子个数比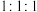 组成的盐是“84”消毒液的主要成分,与洁厕灵混合使用易发生中毒事件.从氧化还原反应的角度分析其原因是(用化学方程式表示)
组成的盐是“84”消毒液的主要成分,与洁厕灵混合使用易发生中毒事件.从氧化还原反应的角度分析其原因是(用化学方程式表示)______________ 。
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
原子半径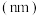 | 0.186 | 0.160 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 |  |  |  | +5、-3 | +7、-1 | +5、-3 | 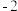 |
(1)⑦在元素周期表中的位置是(周期、族)
(2)七种元素的最高价氧化物的水化物中,酸性最强的是
(3)②、⑤、⑦的离子半径由大到小的顺序是
(4)①、⑤、⑦按原子个数比
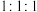 组成的盐是“84”消毒液的主要成分,与洁厕灵混合使用易发生中毒事件.从氧化还原反应的角度分析其原因是(用化学方程式表示)
组成的盐是“84”消毒液的主要成分,与洁厕灵混合使用易发生中毒事件.从氧化还原反应的角度分析其原因是(用化学方程式表示)
您最近半年使用:0次



