名校
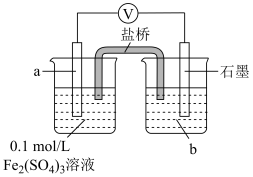
解题方法
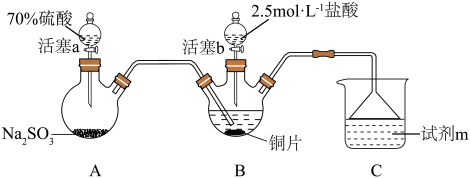
1 . 某小组按如下步骤探究二氧化硫与铜单质、Cu2+的反应:
ⅰ.按图示连接好装置。
ⅲ.关闭活塞b,打开活塞a.光亮的紫红色铜片很快变暗,并有黑色的Cu2S生成,同时溶液变为棕色,此时溶液中的铜元素以[CuCl3]2-(棕黄色)的形式存在。
ⅳ.静置后,取上层棕色的清液于试管中,加入一定量蒸馏水稀释,溶液中有白色沉淀CuCl析出。
(1)装置A中发生反应的化学方程式为___________ ,该反应中硫酸体现出的化学性质为___________ ;装置C的作用是___________ ,试剂m可选择___________ (填标号)。
a.饱和NaCl溶液 b.浓硫酸 c.NaOH浓溶液
(2)步骤ⅲ中,SO2在盐酸中与Cu反应的离子方程式为___________ ;步骤ⅳ中发生反应的离子方程式为[CuCl3]2-⇌CuCl↓+2Cl-,下列有关该反应的说法正确的是___________ (填标号)。
A.该反应中有电子的转移
B.反应经过足够长的时间后,[CuCl3]2-中的Cu元素能全部沉淀
C.溶液中,[CuCl3]2-和Cl-能同时存在
D.其他条件不变,当溶液的颜色不再改变时,表明该反应在该条件下达到最大限度
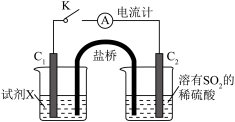
(3)在通风橱中利用如下装置进一步探究SO2与Cu2+的反应,盐桥(内有琼脂和饱和氯化钾溶液)用于连接两电极的电解质溶液。实验②中,闭合K后,C2电极上发生的电极反应为___________ ;不考虑其他副反应及Cu2+进入盐桥,实验②中,电路中转移0.02mole-时,左侧烧杯溶液中Cu2+的质量减少___________ g。
ⅰ.按图示连接好装置。
ⅲ.关闭活塞b,打开活塞a.光亮的紫红色铜片很快变暗,并有黑色的Cu2S生成,同时溶液变为棕色,此时溶液中的铜元素以[CuCl3]2-(棕黄色)的形式存在。
ⅳ.静置后,取上层棕色的清液于试管中,加入一定量蒸馏水稀释,溶液中有白色沉淀CuCl析出。
(1)装置A中发生反应的化学方程式为
a.饱和NaCl溶液 b.浓硫酸 c.NaOH浓溶液
(2)步骤ⅲ中,SO2在盐酸中与Cu反应的离子方程式为
A.该反应中有电子的转移
B.反应经过足够长的时间后,[CuCl3]2-中的Cu元素能全部沉淀
C.溶液中,[CuCl3]2-和Cl-能同时存在
D.其他条件不变,当溶液的颜色不再改变时,表明该反应在该条件下达到最大限度
(3)在通风橱中利用如下装置进一步探究SO2与Cu2+的反应,盐桥(内有琼脂和饱和氯化钾溶液)用于连接两电极的电解质溶液。实验②中,闭合K后,C2电极上发生的电极反应为
| 实验装置图 |
| ||
| 序号 | 试剂X | 实验现象 | |
| 电流计 | C1附近溶液 | ||
| ① | 0.1mol·L-1CuSO4溶液 | 指针几乎不偏转 | 无明显现象 |
| ② | 0.1mol·L-1NaCl和0.1mol·L-1CuSO4的混合溶液(足量) | 指针明显偏转 | 溶液变棕黄色 |
您最近半年使用:0次
名校
解题方法
2 . 亚硝酸钙 可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应
可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应 利用如下装置制备亚硝酸钙(加热及夹持装置略)。
利用如下装置制备亚硝酸钙(加热及夹持装置略)。 溶液能将NO氧化为
溶液能将NO氧化为 。
。
回答下列问题:
(1)检查装置气密性,加入相应的试剂。先通 ,其目的是
,其目的是________ 。通 后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开
后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开 ,使稀硝酸滴入三颈烧瓶中;(iv)关闭
,使稀硝酸滴入三颈烧瓶中;(iv)关闭 ,打开
,打开 ,通入
,通入 。操作(ii)是
。操作(ii)是________ 。
(2)仪器a的名称为________ ,装置D中盛装的试剂是________ (填名称),装置E的作用是________ 。
(3)制备的产品 样品中含有杂质
样品中含有杂质 ,通过下列方法可测定产品的纯度:称量mg样品溶于水,加
,通过下列方法可测定产品的纯度:称量mg样品溶于水,加 固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作:
固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作: ;“还原
;“还原 ”时加入
”时加入 的
的 标准液,“滴定剩余
标准液,“滴定剩余 ”时消耗
”时消耗 的
的 标准溶液VmL。“滴定剩余
标准溶液VmL。“滴定剩余 ”过程中发生反应的离子方程式为
”过程中发生反应的离子方程式为________ ,样品中 的纯度为
的纯度为________ (用含m、V的式子表示)。
 可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应
可用作化学合成反应中的催化剂、氧化剂、中间体等。实验室根据反应 利用如下装置制备亚硝酸钙(加热及夹持装置略)。
利用如下装置制备亚硝酸钙(加热及夹持装置略)。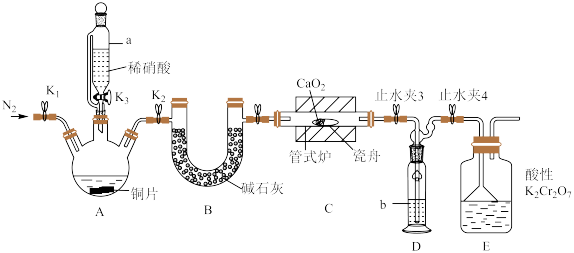
 溶液能将NO氧化为
溶液能将NO氧化为 。
。回答下列问题:
(1)检查装置气密性,加入相应的试剂。先通
 ,其目的是
,其目的是 后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开
后进行的操作为(i)打开管式炉,对瓷舟进行加热;(ii)……;(iii)打开 ,使稀硝酸滴入三颈烧瓶中;(iv)关闭
,使稀硝酸滴入三颈烧瓶中;(iv)关闭 ,打开
,打开 ,通入
,通入 。操作(ii)是
。操作(ii)是(2)仪器a的名称为
(3)制备的产品
 样品中含有杂质
样品中含有杂质 ,通过下列方法可测定产品的纯度:称量mg样品溶于水,加
,通过下列方法可测定产品的纯度:称量mg样品溶于水,加 固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作:
固体,充分振荡,过滤后将溶液转移到250mL容量瓶,配制溶液,取25mL溶液进行以下操作: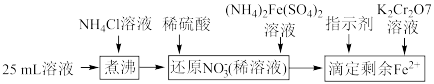
 ;“还原
;“还原 ”时加入
”时加入 的
的 标准液,“滴定剩余
标准液,“滴定剩余 ”时消耗
”时消耗 的
的 标准溶液VmL。“滴定剩余
标准溶液VmL。“滴定剩余 ”过程中发生反应的离子方程式为
”过程中发生反应的离子方程式为 的纯度为
的纯度为
您最近半年使用:0次
昨日更新
|
8次组卷
|
2卷引用:2024届青海省西宁市大通县高三下学期三模理科综合试题-高中化学
名校
解题方法
3 . 红磷可用于制备半导体化合物,还可以用于制造火柴、烟火,以及三氯化磷等。
Ⅰ.研究小组以无水甲苯为溶剂, (易水解)和
(易水解)和 (叠氮化钠)为反应物制备红磷。
(叠氮化钠)为反应物制备红磷。
实验步骤如下:
①甲苯的干燥和收集:装置如图1所示(夹持及加热装置略)
已知:二苯甲酮为指示剂,无水时体系呈蓝色,甲苯的沸点为110.6℃。 的作用是
的作用是___________ 。
(2)先小火加热控温100℃一段时间,打开活塞___________ ,达到除水的目的。再升温至120℃左右,打开活塞___________ ,达到分离收集甲苯的目的。
②红磷的制备:装置如图2所示(夹持、搅拌、加热装置已略)。___________ 。用氩气赶走空气的目的是___________ 。
(4)离心分离和洗涤得到产品,洗涤时先后使用乙醇和水,依次洗去的物质是___________ 。
Ⅱ.该实验所需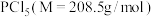 的纯度要求极高,对于的纯度测定如下:
的纯度要求极高,对于的纯度测定如下:
步骤Ⅰ:取 上述所用样品,置于盛有蒸馏水的水解瓶中摇动至完全水解,将水解液配成
上述所用样品,置于盛有蒸馏水的水解瓶中摇动至完全水解,将水解液配成 溶液;
溶液;
步骤Ⅱ:取 上述溶液于锥形瓶中,先加入足量稀硝酸,一段时间后再加入
上述溶液于锥形瓶中,先加入足量稀硝酸,一段时间后再加入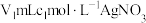 溶液(过量),使
溶液(过量),使 完全转化为
完全转化为 沉淀(
沉淀( 可溶于稀硝酸);
可溶于稀硝酸);
步骤Ⅲ:加入少量硝基苯,振荡,使沉淀表面被有机物覆盖。以硫酸铁溶液为指示剂,用 溶液滴定过量的
溶液滴定过量的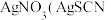 难溶于水),达到滴定终点时,共用去
难溶于水),达到滴定终点时,共用去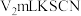 溶液。
溶液。
(5)产品中 的质量分数为
的质量分数为___________  ,若测定过程中没有加入硝基苯,则所测
,若测定过程中没有加入硝基苯,则所测 的含量会
的含量会___________ (填“偏大”“偏小”或“不变”)。
Ⅰ.研究小组以无水甲苯为溶剂,
 (易水解)和
(易水解)和 (叠氮化钠)为反应物制备红磷。
(叠氮化钠)为反应物制备红磷。实验步骤如下:
①甲苯的干燥和收集:装置如图1所示(夹持及加热装置略)
已知:二苯甲酮为指示剂,无水时体系呈蓝色,甲苯的沸点为110.6℃。
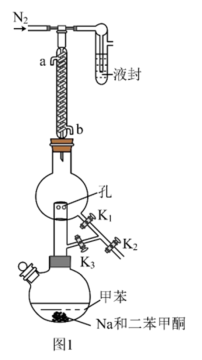
 的作用是
的作用是(2)先小火加热控温100℃一段时间,打开活塞
②红磷的制备:装置如图2所示(夹持、搅拌、加热装置已略)。
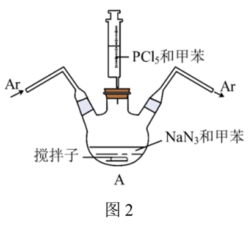
(4)离心分离和洗涤得到产品,洗涤时先后使用乙醇和水,依次洗去的物质是
Ⅱ.该实验所需
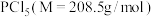 的纯度要求极高,对于的纯度测定如下:
的纯度要求极高,对于的纯度测定如下:步骤Ⅰ:取
 上述所用样品,置于盛有蒸馏水的水解瓶中摇动至完全水解,将水解液配成
上述所用样品,置于盛有蒸馏水的水解瓶中摇动至完全水解,将水解液配成 溶液;
溶液;步骤Ⅱ:取
 上述溶液于锥形瓶中,先加入足量稀硝酸,一段时间后再加入
上述溶液于锥形瓶中,先加入足量稀硝酸,一段时间后再加入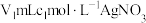 溶液(过量),使
溶液(过量),使 完全转化为
完全转化为 沉淀(
沉淀( 可溶于稀硝酸);
可溶于稀硝酸);步骤Ⅲ:加入少量硝基苯,振荡,使沉淀表面被有机物覆盖。以硫酸铁溶液为指示剂,用
 溶液滴定过量的
溶液滴定过量的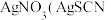 难溶于水),达到滴定终点时,共用去
难溶于水),达到滴定终点时,共用去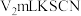 溶液。
溶液。(5)产品中
 的质量分数为
的质量分数为 ,若测定过程中没有加入硝基苯,则所测
,若测定过程中没有加入硝基苯,则所测 的含量会
的含量会
您最近半年使用:0次
名校
解题方法
4 . 氯化六氨合钴{ }是合成多种钴基功能材料和催化剂的中间体。已知:
}是合成多种钴基功能材料和催化剂的中间体。已知: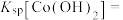
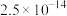 、
、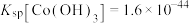 、
、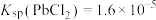 ;电对的标准电极电势(
;电对的标准电极电势( )越大,在水溶液中越容易发生还原反应,
)越大,在水溶液中越容易发生还原反应,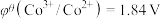 、
、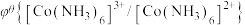
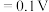 。某学习小组在实验室中制备氯化六氨合钴的步骤如下:
。某学习小组在实验室中制备氯化六氨合钴的步骤如下:
步骤一:称取3.0g CoCl2·6H2O,研磨后与4.0g NH4Cl混匀后溶于适量蒸馏水中,加入1.5g活性炭,搅拌均匀并冷却至室温;
步骤二;继续加入7mL浓氨水充分反应,再冷却至10℃后逐滴加入7mL 6%的双氧水,控制温度55℃充分反应;
步骤三:将反应后所得体系迅速冷却至2℃,过滤、洗涤;所得沉淀转入烧杯,加入20mL 80℃蒸馏水和1mL浓盐酸,趁热过滤,收集滤液;
步骤四:将滤液浓缩后加入3.5mL浓盐酸,并迅速冷却至2℃,抽滤、乙醇洗涤、干燥,收集得1.9g产品。
回答下列问题:
(1)步骤一中,下列仪器不需要使用的是___________ (填仪器名称)。___________ ;控制反应温度在55℃的原因为___________ 。
(3)相同条件下,氯化六氨合钴在稀盐酸中的溶解度___________ (填“大于”“小于”或“等于”)在浓盐酸中的。
(4)与步骤三中过滤相比,步骤四中抽滤的优点为___________ 。
(5)制备产品的总反应方程式为___________ ;步骤二中双氧水可用PbO2或KMnO4代替,其中更适合选用___________ (填化学式)代替双氧水,原因为___________ 。
(6)本实验所得产品的产率为___________ (列出计算式)。
 }是合成多种钴基功能材料和催化剂的中间体。已知:
}是合成多种钴基功能材料和催化剂的中间体。已知: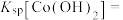
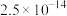 、
、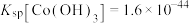 、
、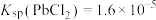 ;电对的标准电极电势(
;电对的标准电极电势( )越大,在水溶液中越容易发生还原反应,
)越大,在水溶液中越容易发生还原反应,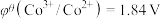 、
、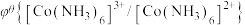
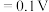 。某学习小组在实验室中制备氯化六氨合钴的步骤如下:
。某学习小组在实验室中制备氯化六氨合钴的步骤如下:步骤一:称取3.0g CoCl2·6H2O,研磨后与4.0g NH4Cl混匀后溶于适量蒸馏水中,加入1.5g活性炭,搅拌均匀并冷却至室温;
步骤二;继续加入7mL浓氨水充分反应,再冷却至10℃后逐滴加入7mL 6%的双氧水,控制温度55℃充分反应;
步骤三:将反应后所得体系迅速冷却至2℃,过滤、洗涤;所得沉淀转入烧杯,加入20mL 80℃蒸馏水和1mL浓盐酸,趁热过滤,收集滤液;
步骤四:将滤液浓缩后加入3.5mL浓盐酸,并迅速冷却至2℃,抽滤、乙醇洗涤、干燥,收集得1.9g产品。
回答下列问题:
(1)步骤一中,下列仪器不需要使用的是
(3)相同条件下,氯化六氨合钴在稀盐酸中的溶解度
(4)与步骤三中过滤相比,步骤四中抽滤的优点为
(5)制备产品的总反应方程式为
(6)本实验所得产品的产率为
您最近半年使用:0次
解题方法
5 . 某实验小组对 溶液和
溶液和 溶液的反应进行探究。
溶液的反应进行探究。
资料: 为白色固体,易溶于水。
为白色固体,易溶于水。
【实验1】
I.探究反应的产物
(1)经检验实验中的黑色固体均为 。实验1-1反应的离子方程式为
。实验1-1反应的离子方程式为_________ 。
【实验2】
①证明实验1-2所得固体洗涤干净的实验操作及现象是_________ 。
②依据实验2,推测S与NaOH反应的离子方程式为_________ 。
③实验2中,加入硝酸的目的是_________ 。
(3)实验证明红色固体为Cu。补全静置后红色固体转化为黑色固体反应的离子方程式:_____ 。
□ □
□ □___+□__
□___+□__ □__+□
□__+□
Ⅱ.探究影响反应产物的因素
【实验3】
说明:本实验中,电压表的读数越大,氧化剂的氧化性(或还原剂的还原性)越强。
(4)资料表明,对于电极反应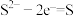 ,
, 对
对 还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是
还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是_________ 。
(5)小组同学用实验3装置补做实验3-5,排除了 的影响。他们所用试剂a为饱和
的影响。他们所用试剂a为饱和 溶液,b为
溶液,b为_________ 。
(6)综合上述实验可以得到的结论有_________ 。
 溶液和
溶液和 溶液的反应进行探究。
溶液的反应进行探究。资料:
 为白色固体,易溶于水。
为白色固体,易溶于水。【实验1】
序号 | 实验操作 | 实验现象 |
| 向 溶液中加入 溶液中加入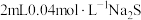 溶液 溶液 | 产生黑色固体 |
| 向 饱和 饱和 溶液(约为 溶液(约为 , , 约为3)中加入 约为3)中加入 饱和 饱和 溶液(约为 溶液(约为 , , 约为13) 约为13) | 迅速产生大量黑色固体、少量红色固体和黄色固体,静置后红色固体减少、黑色固体增多 |
(1)经检验实验中的黑色固体均为
 。实验1-1反应的离子方程式为
。实验1-1反应的离子方程式为【实验2】
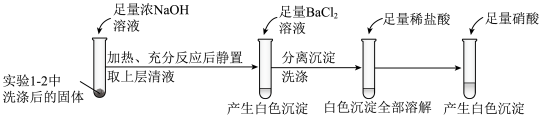
①证明实验1-2所得固体洗涤干净的实验操作及现象是
②依据实验2,推测S与NaOH反应的离子方程式为
③实验2中,加入硝酸的目的是
(3)实验证明红色固体为Cu。补全静置后红色固体转化为黑色固体反应的离子方程式:
□
 □
□ □___+□__
□___+□__ □__+□
□__+□
Ⅱ.探究影响反应产物的因素
【实验3】
序号 | 实验方案 | 实验现象 | |
3-1 |
| a:饱和 溶液 溶液b:饱和  溶液 溶液 | 电压表指针偏转,读数为0.85V |
3-2 | a: 溶液 溶液b: 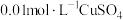 溶液 溶液 | 电压表指针偏转,读数为0.46V | |
3-3 | a: 溶液(pH调至13) 溶液(pH调至13)b: 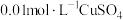 溶液 溶液 | 电压表指针偏转,读数为0.68V | |
3-4 | a: 溶液(pH调至13) 溶液(pH调至13)b: 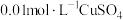 溶液 溶液 | 电压表指针略偏转,读数为0.10V | |
(4)资料表明,对于电极反应
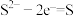 ,
, 对
对 还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是
还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是(5)小组同学用实验3装置补做实验3-5,排除了
 的影响。他们所用试剂a为饱和
的影响。他们所用试剂a为饱和 溶液,b为
溶液,b为(6)综合上述实验可以得到的结论有
您最近半年使用:0次
6 . 某科研小组通过以下方案制备连二亚硫酸钠( )并测定其纯度。
)并测定其纯度。
资料: 具有强还原性,空气中极易被氧化,易溶于水且随温度的升高溶解度增大,不溶于乙醇,在碱性介质中较稳定:低于52℃时
具有强还原性,空气中极易被氧化,易溶于水且随温度的升高溶解度增大,不溶于乙醇,在碱性介质中较稳定:低于52℃时 在水溶液中以
在水溶液中以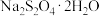 形态结晶,高于52℃时
形态结晶,高于52℃时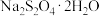 在碱性溶液中脱水成无水盐。
在碱性溶液中脱水成无水盐。
回答下列问题:
(1)无氧条件下,用锌粉还原 和
和 的混合液,即可制得连二亚硫酸钠;
的混合液,即可制得连二亚硫酸钠;

操作步骤:连接装置,关闭三通阀→___________ (填操作名称)→称取一定质量Zn置于三颈烧瓶中→___________ (填标号)pH传感→搅拌直至完全溶解。 和
和 的混合液→充入
的混合液→充入 →抽真空
→抽真空
B.抽真空→注入 和
和 的混合液→充入
的混合液→充入
C.抽真空→充入 →注入
→注入 和
和 的混合液
的混合液
(2)在上述所得溶液中滴加稍过量NaOH溶液控制pH在8.2~10.5之间,使 转化为
转化为 沉淀过滤除去:将所得溶液分批逐步加入一定量的NaCl固体搅拌,水蒸气加热略高于52℃左右结晶→
沉淀过滤除去:将所得溶液分批逐步加入一定量的NaCl固体搅拌,水蒸气加热略高于52℃左右结晶→___________ →用乙醇洗涤→干燥,可获得 。
。
(3)隔绝空气加热 固体完全分解得到固体产物
固体完全分解得到固体产物 、
、 和
和 ,但实验过程未能做到完全隔绝空气,设计实验证明该分解产物中含有
,但实验过程未能做到完全隔绝空气,设计实验证明该分解产物中含有 :
:___________ 。
(4)下图是硫的四种含氧酸根的结构推断具有强氧化性的是___________ (填标号); 转化为
转化为 的离子反应方程式为
的离子反应方程式为___________ 。
(5) 含量的测定
含量的测定
实验原理: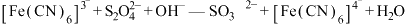 (未配平)。
(未配平)。
实验过程:称取0.25g产品加入三颈烧瓶中,维持氮气氛围,加入适量NaOH溶液,再滴加0.10
 标准溶液,达到滴定终点时消耗22.00mL标准溶液。则产品中
标准溶液,达到滴定终点时消耗22.00mL标准溶液。则产品中 的质量分数为
的质量分数为
___________ %(杂质不参与反应,保留四位有效数字)。
 )并测定其纯度。
)并测定其纯度。资料:
 具有强还原性,空气中极易被氧化,易溶于水且随温度的升高溶解度增大,不溶于乙醇,在碱性介质中较稳定:低于52℃时
具有强还原性,空气中极易被氧化,易溶于水且随温度的升高溶解度增大,不溶于乙醇,在碱性介质中较稳定:低于52℃时 在水溶液中以
在水溶液中以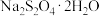 形态结晶,高于52℃时
形态结晶,高于52℃时 在碱性溶液中脱水成无水盐。
在碱性溶液中脱水成无水盐。回答下列问题:
(1)无氧条件下,用锌粉还原
 和
和 的混合液,即可制得连二亚硫酸钠;
的混合液,即可制得连二亚硫酸钠;
操作步骤:连接装置,关闭三通阀→
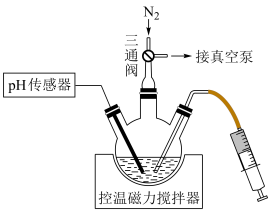
 和
和 的混合液→充入
的混合液→充入 →抽真空
→抽真空B.抽真空→注入
 和
和 的混合液→充入
的混合液→充入
C.抽真空→充入
 →注入
→注入 和
和 的混合液
的混合液(2)在上述所得溶液中滴加稍过量NaOH溶液控制pH在8.2~10.5之间,使
 转化为
转化为 沉淀过滤除去:将所得溶液分批逐步加入一定量的NaCl固体搅拌,水蒸气加热略高于52℃左右结晶→
沉淀过滤除去:将所得溶液分批逐步加入一定量的NaCl固体搅拌,水蒸气加热略高于52℃左右结晶→ 。
。(3)隔绝空气加热
 固体完全分解得到固体产物
固体完全分解得到固体产物 、
、 和
和 ,但实验过程未能做到完全隔绝空气,设计实验证明该分解产物中含有
,但实验过程未能做到完全隔绝空气,设计实验证明该分解产物中含有 :
:(4)下图是硫的四种含氧酸根的结构推断具有强氧化性的是
A.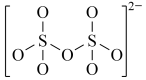 B.
B.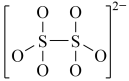 C.
C.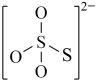 D.
D.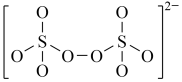
 转化为
转化为 的离子反应方程式为
的离子反应方程式为(5)
 含量的测定
含量的测定实验原理:
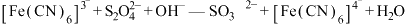 (未配平)。
(未配平)。实验过程:称取0.25g产品加入三颈烧瓶中,维持氮气氛围,加入适量NaOH溶液,再滴加0.10

 标准溶液,达到滴定终点时消耗22.00mL标准溶液。则产品中
标准溶液,达到滴定终点时消耗22.00mL标准溶液。则产品中 的质量分数为
的质量分数为
您最近半年使用:0次
解题方法
7 . 2023 年诺贝尔化学奖授予发现量子点的三位科学家,量子点的尺寸一般在1 nm~10 nm之间,是一种纳米级别的半导体。量子点的尺寸不同,则发光颜色不同,吸收光谱波长不同。实验室一种制备CdSe量子点的方法如下:
一、CdSe量子点前驱体的制备
Ⅰ.N2气氛中,取1 mmol Se粉于三颈烧瓶中,加入15 mL的十八烯溶剂,加热到280℃,Se粉完全溶解形成橙色透明溶液;
Ⅱ.N2气氛中,将1 mmol CdCl2溶于4 mL油酸,加热至120℃,使CdCl2完全溶于油酸,形成油酸镉澄清液体。
二、CdSe量子点的生长与制备
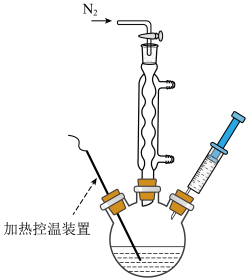
Ⅲ.将步骤Ⅱ中制备好的油酸镉溶液注射至步骤Ⅰ中含有Se粉的三颈烧瓶中,如下图所示,保持反应温度为260℃,反应45min。
Ⅳ.待反应液冷却后,加入20 mL乙醇溶液,CdSe析出,离心分离,加入正己烷分散后,再次加入乙醇,离心分离,重复2~3次后,用乙醇和丙酮洗涤 CdSe,即可得到干净的CdSe量子点。
回答下列问题:
(1)Cd为第五周期ⅡB族,则Cd的价层电子排布式为___________ 。
(2)步骤Ⅱ中N2的作用为___________ ,油酸与镉配位的原子为___________ 。
(3)Se的一种制备方法如下:向Na2SeO3水溶液中加入 进行还原,得Se单质,过滤,洗涤,干燥,静置。制备过程中,会产生一种对环境无污染的气体,则该反应的离子方程式为
进行还原,得Se单质,过滤,洗涤,干燥,静置。制备过程中,会产生一种对环境无污染的气体,则该反应的离子方程式为___________ ;此方法获得Se单质过程中无需使用的仪器是___________ (填名称)。___________ 现象时,证明CdSe量子点生长基本停止,制备完成。除此方法外,还可利用___________ 物理现象初步鉴定CdSe量子点制备成功。
(5)步骤Ⅳ中加入20 mL乙醇的作用是___________ 。
(6)CdSe洗涤干净的标志是___________ 。
一、CdSe量子点前驱体的制备
Ⅰ.N2气氛中,取1 mmol Se粉于三颈烧瓶中,加入15 mL的十八烯溶剂,加热到280℃,Se粉完全溶解形成橙色透明溶液;
Ⅱ.N2气氛中,将1 mmol CdCl2溶于4 mL油酸,加热至120℃,使CdCl2完全溶于油酸,形成油酸镉澄清液体。
二、CdSe量子点的生长与制备
Ⅲ.将步骤Ⅱ中制备好的油酸镉溶液注射至步骤Ⅰ中含有Se粉的三颈烧瓶中,如下图所示,保持反应温度为260℃,反应45min。
Ⅳ.待反应液冷却后,加入20 mL乙醇溶液,CdSe析出,离心分离,加入正己烷分散后,再次加入乙醇,离心分离,重复2~3次后,用乙醇和丙酮洗涤 CdSe,即可得到干净的CdSe量子点。
回答下列问题:
(1)Cd为第五周期ⅡB族,则Cd的价层电子排布式为
(2)步骤Ⅱ中N2的作用为
(3)Se的一种制备方法如下:向Na2SeO3水溶液中加入
 进行还原,得Se单质,过滤,洗涤,干燥,静置。制备过程中,会产生一种对环境无污染的气体,则该反应的离子方程式为
进行还原,得Se单质,过滤,洗涤,干燥,静置。制备过程中,会产生一种对环境无污染的气体,则该反应的离子方程式为
(5)步骤Ⅳ中加入20 mL乙醇的作用是
(6)CdSe洗涤干净的标志是
您最近半年使用:0次
7日内更新
|
43次组卷
|
2卷引用:东北三省四市教研联合体2024届高三下学期高考模拟(二)化学试题
解题方法
8 . 某化学小组探究硫酸铁铵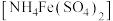 与
与 、
、 的反应。
的反应。
已知: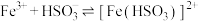 (棕红)
(棕红)
(1)①实验Ⅰ中产生红褐色沉淀与气泡的离子方程式为___________ 。
②由实验Ⅰ可得出与 结合的能力:
结合的能力:
___________  (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。
(2)资料显示, 可以氧化
可以氧化 。针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验。
。针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验。
①实验Ⅲ中 与
与 反应生成
反应生成 的离子方程式为
的离子方程式为___________ 。
②结合化学反应原理解释实验Ⅱ、Ⅳ中现象存在差异的可能原因___________ 。
(3)针对实验Ⅲ、Ⅳ的现象差异,小组同学提出猜想:pH影响了 的氧化性或
的氧化性或 的还原性,并实施实验。
的还原性,并实施实验。
①a、b分别是___________ 。
②结合电极反应解释步骤3中电压表示数减小的原因___________ 。
③补充实验Ⅵ:向实验Ⅱ得到的棕红色液体中加入3滴10%稀硫酸,棕红色迅速变黄,检测到 。结合化学用语解释实验Ⅵ中氧化还原反应明显加快的可能原因
。结合化学用语解释实验Ⅵ中氧化还原反应明显加快的可能原因___________ 。
(4)综合以上实验,盐溶液间反应的多样性与___________ 有关。
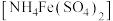 与
与 、
、 的反应。
的反应。| 实验 | 操作 | 现象 |
| Ⅰ | 向2mL 溶液(pH=2.03)中逐滴加入 溶液(pH=2.03)中逐滴加入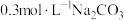 溶液 溶液 | 迅速产生大量红褐色沉淀和大量气泡;继续滴加,当气泡量明显减少时,试管口的湿润红色石蕊试纸开始逐渐变蓝 |
| Ⅱ | 向2mL 溶液(pH=2.03)中逐滴加入 溶液(pH=2.03)中逐滴加入 溶液 溶液 | 溶液立即变棕红(无丁达尔现象),继续滴加 溶液至过量,溶液依然为棕红色,放置两天无明显变化 溶液至过量,溶液依然为棕红色,放置两天无明显变化 |
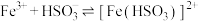 (棕红)
(棕红)(1)①实验Ⅰ中产生红褐色沉淀与气泡的离子方程式为
②由实验Ⅰ可得出与
 结合的能力:
结合的能力:
 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。(2)资料显示,
 可以氧化
可以氧化 。针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验。
。针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验。| 实验 | 操作 | 现象 |
| Ⅲ | 向2mL 溶液(pH=1.78)中加入0.5mL 溶液(pH=1.78)中加入0.5mL 溶液 溶液 | 溶液立即变棕红色,约2小时后,棕红色变为黄色,检测到 |
| Ⅳ | 向2mL 溶液(pH=2.03)中加入0.5mL 溶液(pH=2.03)中加入0.5mL 溶液 溶液 | 溶液立即变棕红色,约5小时后,棕红色变为黄色,检测到 |
 与
与 反应生成
反应生成 的离子方程式为
的离子方程式为②结合化学反应原理解释实验Ⅱ、Ⅳ中现象存在差异的可能原因
(3)针对实验Ⅲ、Ⅳ的现象差异,小组同学提出猜想:pH影响了
 的氧化性或
的氧化性或 的还原性,并实施实验。
的还原性,并实施实验。| 实验 | 实验装置 | 实验步骤及现象 |
| Ⅴ |
| 1.按如图搭好装置,接通电路,电压表读数为0.6V; 2.向a电极附近滴加3滴10%稀硫酸,电压表读数不变; 3.向石墨电极附近滴加3滴10%稀硫酸,电压表读数变为0.5V。 |
②结合电极反应解释步骤3中电压表示数减小的原因
③补充实验Ⅵ:向实验Ⅱ得到的棕红色液体中加入3滴10%稀硫酸,棕红色迅速变黄,检测到
 。结合化学用语解释实验Ⅵ中氧化还原反应明显加快的可能原因
。结合化学用语解释实验Ⅵ中氧化还原反应明显加快的可能原因(4)综合以上实验,盐溶液间反应的多样性与
您最近半年使用:0次
9 . 乙二胺四乙酸铁钠(化学式可用 表示,摩尔质量为
表示,摩尔质量为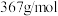 )可作为加铁盐和加铁酱油的铁剂。实验室利用废铁屑制备配合物乙二胺四乙酸铁钠的步骤如下:
)可作为加铁盐和加铁酱油的铁剂。实验室利用废铁屑制备配合物乙二胺四乙酸铁钠的步骤如下:
Ⅰ. 晶体制备
晶体制备
②快速搅拌条件下,向其中滴加氨水至过量,过滤并洗涤沉淀3次;
③将上述滤渣转移到三颈瓶中,保持80℃加热,边搅拌边逐滴滴加乙二胺四乙酸( )和碳酸钠溶液,调节
)和碳酸钠溶液,调节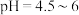 ,反应约1h;反应结束后将所得产品趁热减压过滤,将滤液加热浓缩至原体积
,反应约1h;反应结束后将所得产品趁热减压过滤,将滤液加热浓缩至原体积 ,冷却结晶得到土黄色高纯的
,冷却结晶得到土黄色高纯的 晶体。
晶体。
(1)步骤①盐酸过量的目的:一是作反应物,二是_______ 。
(2)写出上述颜色变为深棕色所发生离子反应方程式_______ 。
(3)滴加氨水时,滴加速率不宜过快且快速搅拌,其原因是_______ 。
(4)冷却水应从_______ (填“a”或“b”)口通入,仪器m的名称为_______ ;步骤③中宜采取的加热方式为_______ ;分离产品采取“趁热减压过滤”,趁热的目的是_______ 。
Ⅱ.纯度分析
准确称取20.00g产物放入 烧杯,加入
烧杯,加入 无氧蒸馏水和
无氧蒸馏水和 硫酸(
硫酸( ),搅拌溶解后,加入5g锌粉,加热反应30min,过滤,将得到的近无色溶液用
),搅拌溶解后,加入5g锌粉,加热反应30min,过滤,将得到的近无色溶液用 容量瓶定容。快速移取
容量瓶定容。快速移取 溶液至
溶液至 锥形瓶中,加入
锥形瓶中,加入
 混酸以掩蔽生成的
混酸以掩蔽生成的 的黄色,用
的黄色,用
 (
( )标准溶液平行滴定3次,平均消耗标准液
)标准溶液平行滴定3次,平均消耗标准液 。
。
(5) 标液应盛装在
标液应盛装在_______ (填“无色透明”或“棕色透明”)滴定管,滴定终点的现象为_______ 。
(6)上述 的纯度为
的纯度为_______ (保留4位有效数字)。
 表示,摩尔质量为
表示,摩尔质量为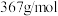 )可作为加铁盐和加铁酱油的铁剂。实验室利用废铁屑制备配合物乙二胺四乙酸铁钠的步骤如下:
)可作为加铁盐和加铁酱油的铁剂。实验室利用废铁屑制备配合物乙二胺四乙酸铁钠的步骤如下:Ⅰ.
 晶体制备
晶体制备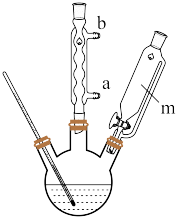
②快速搅拌条件下,向其中滴加氨水至过量,过滤并洗涤沉淀3次;
③将上述滤渣转移到三颈瓶中,保持80℃加热,边搅拌边逐滴滴加乙二胺四乙酸(
 )和碳酸钠溶液,调节
)和碳酸钠溶液,调节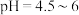 ,反应约1h;反应结束后将所得产品趁热减压过滤,将滤液加热浓缩至原体积
,反应约1h;反应结束后将所得产品趁热减压过滤,将滤液加热浓缩至原体积 ,冷却结晶得到土黄色高纯的
,冷却结晶得到土黄色高纯的 晶体。
晶体。(1)步骤①盐酸过量的目的:一是作反应物,二是
(2)写出上述颜色变为深棕色所发生离子反应方程式
(3)滴加氨水时,滴加速率不宜过快且快速搅拌,其原因是
(4)冷却水应从
Ⅱ.纯度分析
准确称取20.00g产物放入
 烧杯,加入
烧杯,加入 无氧蒸馏水和
无氧蒸馏水和 硫酸(
硫酸( ),搅拌溶解后,加入5g锌粉,加热反应30min,过滤,将得到的近无色溶液用
),搅拌溶解后,加入5g锌粉,加热反应30min,过滤,将得到的近无色溶液用 容量瓶定容。快速移取
容量瓶定容。快速移取 溶液至
溶液至 锥形瓶中,加入
锥形瓶中,加入
 混酸以掩蔽生成的
混酸以掩蔽生成的 的黄色,用
的黄色,用
 (
( )标准溶液平行滴定3次,平均消耗标准液
)标准溶液平行滴定3次,平均消耗标准液 。
。(5)
 标液应盛装在
标液应盛装在(6)上述
 的纯度为
的纯度为
您最近半年使用:0次
名校
解题方法
10 .  (三氯化六氨合钴)是一种橙黄色的晶体,溶于热水和稀盐酸中,在冷水、乙醇、浓盐酸中溶解度较小,可用于制备其他三价钴配合物。实验室制备
(三氯化六氨合钴)是一种橙黄色的晶体,溶于热水和稀盐酸中,在冷水、乙醇、浓盐酸中溶解度较小,可用于制备其他三价钴配合物。实验室制备 的装置和步骤如下:
的装置和步骤如下: 、4.00g
、4.00g  和5mL高纯水,加热溶解后加入1.5g催化剂活性炭,7mL浓氨水,搅拌,得到
和5mL高纯水,加热溶解后加入1.5g催化剂活性炭,7mL浓氨水,搅拌,得到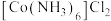 (二氯化六氨合钴)溶液;
(二氯化六氨合钴)溶液;
②将得到的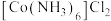 溶液冷却至10℃,加入7mL 4%的
溶液冷却至10℃,加入7mL 4%的 ,恒温55℃,搅拌15min后冷却至2℃,抽滤,收集沉淀;
,恒温55℃,搅拌15min后冷却至2℃,抽滤,收集沉淀;
③将沉淀转移入100mL烧杯中,用20mL、80℃的高纯水进行冲洗,再加入1mL的浓盐酸,搅拌均匀,___________,将活性炭滤出弃去;
④在滤液中加入3.5mL试剂甲,搅拌后用冰水浴冷却至2℃析出沉淀,之后快速抽滤,弃去滤液,用试剂乙洗涤沉淀3次,低温烘干,得到产品2.14g。
回答下列问题:
(1)仪器a盛装的试剂是___________ 。
(2)常温下, ,从平衡角度解释,步骤①中先加
,从平衡角度解释,步骤①中先加 ,后加浓氨水的原因是
,后加浓氨水的原因是___________ 。
(3)步骤②中温度控制在55℃左右的原因是___________ 。
(4)步骤③中缺少的操作名称为___________ 。
(5)步骤④中:试剂甲和试剂乙选择合理的是___________ (填标号);
A.甲为浓盐酸,乙为水 B.甲为乙醇,乙为水 C.甲为浓盐酸,乙为乙醇
该反应的产率为___________ (已知: 的摩尔质量为267.5g/mol)。
的摩尔质量为267.5g/mol)。
(6)由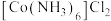 制备
制备 的化学方程式为
的化学方程式为___________ 。
 (三氯化六氨合钴)是一种橙黄色的晶体,溶于热水和稀盐酸中,在冷水、乙醇、浓盐酸中溶解度较小,可用于制备其他三价钴配合物。实验室制备
(三氯化六氨合钴)是一种橙黄色的晶体,溶于热水和稀盐酸中,在冷水、乙醇、浓盐酸中溶解度较小,可用于制备其他三价钴配合物。实验室制备 的装置和步骤如下:
的装置和步骤如下: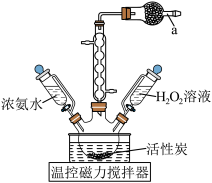
 、4.00g
、4.00g  和5mL高纯水,加热溶解后加入1.5g催化剂活性炭,7mL浓氨水,搅拌,得到
和5mL高纯水,加热溶解后加入1.5g催化剂活性炭,7mL浓氨水,搅拌,得到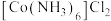 (二氯化六氨合钴)溶液;
(二氯化六氨合钴)溶液;②将得到的
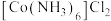 溶液冷却至10℃,加入7mL 4%的
溶液冷却至10℃,加入7mL 4%的 ,恒温55℃,搅拌15min后冷却至2℃,抽滤,收集沉淀;
,恒温55℃,搅拌15min后冷却至2℃,抽滤,收集沉淀;③将沉淀转移入100mL烧杯中,用20mL、80℃的高纯水进行冲洗,再加入1mL的浓盐酸,搅拌均匀,___________,将活性炭滤出弃去;
④在滤液中加入3.5mL试剂甲,搅拌后用冰水浴冷却至2℃析出沉淀,之后快速抽滤,弃去滤液,用试剂乙洗涤沉淀3次,低温烘干,得到产品2.14g。
回答下列问题:
(1)仪器a盛装的试剂是
(2)常温下,
 ,从平衡角度解释,步骤①中先加
,从平衡角度解释,步骤①中先加 ,后加浓氨水的原因是
,后加浓氨水的原因是(3)步骤②中温度控制在55℃左右的原因是
(4)步骤③中缺少的操作名称为
(5)步骤④中:试剂甲和试剂乙选择合理的是
A.甲为浓盐酸,乙为水 B.甲为乙醇,乙为水 C.甲为浓盐酸,乙为乙醇
该反应的产率为
 的摩尔质量为267.5g/mol)。
的摩尔质量为267.5g/mol)。(6)由
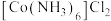 制备
制备 的化学方程式为
的化学方程式为
您最近半年使用:0次