解题方法
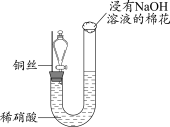
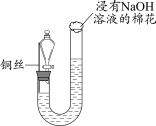
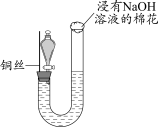
1 . 在中国古代,硫酸被炼丹术士称为“绿矾油”。这是因为生产硫酸最古老的方法是以绿矾为原料,在蒸馏釜中煅烧后,釜中逸出刺激性气味的气体,同时有油状液体流出,残留固体呈红棕色。

(1)请写出煅烧绿矾过程中发生反应的化学方程式:
①___________ ;
②___________ 。
(2)化学探究小组的同学用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去),其中b为干燥的试管。下列关于该反应说法正确的是___________。

(1)请写出煅烧绿矾过程中发生反应的化学方程式:
①
②
(2)化学探究小组的同学用如图所示装置模拟用绿矾制硫酸的实验,并检验生成的硫酸和二氧化硫(加热装置已略去),其中b为干燥的试管。下列关于该反应说法正确的是___________。
A.若将反应后的气体通入 溶液中,产生的沉淀为 溶液中,产生的沉淀为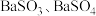 |
B.b中产物用紫色石蕊试液即可检验出其中 和 和 |
C.为检验反应的气态生成物是 ,试管c中应加入的试剂为NaOH溶液 ,试管c中应加入的试剂为NaOH溶液 |
| D.b中所得到的硫酸的质量分数为29.5% |
您最近一年使用:0次
名校
解题方法
2 . 连二亚硫酸钠(Na2S2O4)俗称保险粉,广泛应用于纺织业和造纸业。利用碱性NaBH4溶液或Zn还原含硫化合物是制备Na2S2O4常用方法。
已知:①Na2S2O4在水溶液可以发生歧化反应(只有S元素化合价的升降),受热易分解。
②NaBH4是一种强还原剂,酸性或受热条件下易与水反应产生氢气,在碱性溶液中比较稳定。
③生成物的ΔG越大,表示在该条件下转化成该物质的可能性较大。溶液中部分含硫组分的ΔG如图所示。

Ⅰ.NaBH4碱性溶液还原法
(1)12%NaBH4碱性溶液配制:在烧杯中加入48g水,再向其中加入___________ (请完成溶液配制,所需试剂为40gNaOH固体及12gNaBH4固体)。
(2)溶有饱和SO2的NaHSO3溶液制备:利用如图所示装置来制备该溶液,判断制备完成的方法是___________ 。

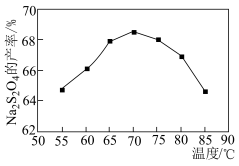
(3)将12%NaBH4碱性溶液与制备的NaHSO3溶液在无氧、水浴加热的条件下发生反应,相同时间内,Na2S2O4的产率随温度的变化如图所示,70℃后Na2S2O4的产率下降的原因是___________ 。Na2S2O4在水溶液中发生歧化反应的离子方程式为___________ 。
Ⅱ.锌粉还原法
已知:①Zn+2H2SO3 ZnS2O4(易溶于水)+2H2O;
ZnS2O4(易溶于水)+2H2O;
②二价锌在水溶液中的存在形式与pH的关系如图所示。
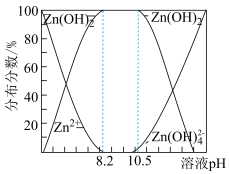
(4)请补充完整由锌粉制备Na2S2O4粗品的实验方案:向盛有水的烧杯中加入一定量的Zn粉,搅拌,___________ ,向滤液中加入氯化钠粉末至有大量晶体析出,过滤得到Na2S2O4粗品(实验中须使用的试剂:SO2、1mol·L-1NaOH溶液)。
已知:①Na2S2O4在水溶液可以发生歧化反应(只有S元素化合价的升降),受热易分解。
②NaBH4是一种强还原剂,酸性或受热条件下易与水反应产生氢气,在碱性溶液中比较稳定。
③生成物的ΔG越大,表示在该条件下转化成该物质的可能性较大。溶液中部分含硫组分的ΔG如图所示。

Ⅰ.NaBH4碱性溶液还原法
(1)12%NaBH4碱性溶液配制:在烧杯中加入48g水,再向其中加入
(2)溶有饱和SO2的NaHSO3溶液制备:利用如图所示装置来制备该溶液,判断制备完成的方法是

(3)将12%NaBH4碱性溶液与制备的NaHSO3溶液在无氧、水浴加热的条件下发生反应,相同时间内,Na2S2O4的产率随温度的变化如图所示,70℃后Na2S2O4的产率下降的原因是

Ⅱ.锌粉还原法
已知:①Zn+2H2SO3
 ZnS2O4(易溶于水)+2H2O;
ZnS2O4(易溶于水)+2H2O;②二价锌在水溶液中的存在形式与pH的关系如图所示。

(4)请补充完整由锌粉制备Na2S2O4粗品的实验方案:向盛有水的烧杯中加入一定量的Zn粉,搅拌,
您最近一年使用:0次
2024-02-22更新
|
325次组卷
|
2卷引用:江苏省南通市如东中学,如东一高等四校2023-2024学年高三上学期12月学情调研化学试题
3 . 氮、硫的化合物与人类生活和生产有着密切的联系。
Ⅰ.氨既是一种重要的化工产品,又是一种重要的化工原料。图1为合成氨以及氨氧化制硝酸的流程示意图。

(1)合成塔中发生反应的化学方程式为_____ 氧化炉中发生反应的化学方程式为_____ 。
(2)A为_____ ;向吸收塔中通入A的作用_____ 。
(3)工业生产中为了盛装大量浓硝酸,可选择_____ (填字母)作为罐体材料。
a.铜 b.铂 c.铝 d.镁
Ⅱ.浓硫酸与木炭在加热条件下可发生化学反应,为检验反应的产物,某同学设计了如图2所示的实验。请据此回答下列问题:
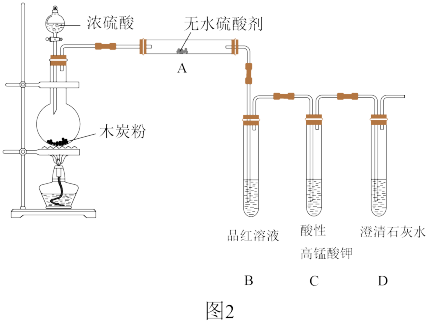
(4)浓硫酸与木炭反应的化学方程式:_____ 。
(5)装置B中的现象_____ ;证明产物中有_____ 。
(6)装置C的作用是_____ 。
Ⅰ.氨既是一种重要的化工产品,又是一种重要的化工原料。图1为合成氨以及氨氧化制硝酸的流程示意图。

(1)合成塔中发生反应的化学方程式为
(2)A为
(3)工业生产中为了盛装大量浓硝酸,可选择
a.铜 b.铂 c.铝 d.镁
Ⅱ.浓硫酸与木炭在加热条件下可发生化学反应,为检验反应的产物,某同学设计了如图2所示的实验。请据此回答下列问题:

(4)浓硫酸与木炭反应的化学方程式:
(5)装置B中的现象
(6)装置C的作用是
您最近一年使用:0次
解题方法
4 . 为避免硝酸生产尾气中的 污染环境,科学家开发了溶液吸收、催化氧化等尾气处理手段。某化学小组利用下列所示装置进行验证实验。
污染环境,科学家开发了溶液吸收、催化氧化等尾气处理手段。某化学小组利用下列所示装置进行验证实验。

已知: 能被酸性高锰酸钾溶液氧化成
能被酸性高锰酸钾溶液氧化成 ,此体系中产生的
,此体系中产生的 浓度较稀。
浓度较稀。
(1)写出仪器 的名称
的名称___________ 装置⑦的作用可能是___________
(2)写出装置②用铜和浓硝酸反应制取 的实验现象
的实验现象___________
(3)写出装置⑤中的化学方程式___________ 。
(4)写出装置⑥ 被
被 溶液吸收生成两种盐的离子方程式:
溶液吸收生成两种盐的离子方程式:___________ 。
(5)下列说法正确的是___________
 污染环境,科学家开发了溶液吸收、催化氧化等尾气处理手段。某化学小组利用下列所示装置进行验证实验。
污染环境,科学家开发了溶液吸收、催化氧化等尾气处理手段。某化学小组利用下列所示装置进行验证实验。

已知:
 能被酸性高锰酸钾溶液氧化成
能被酸性高锰酸钾溶液氧化成 ,此体系中产生的
,此体系中产生的 浓度较稀。
浓度较稀。(1)写出仪器
 的名称
的名称(2)写出装置②用铜和浓硝酸反应制取
 的实验现象
的实验现象(3)写出装置⑤中的化学方程式
(4)写出装置⑥
 被
被 溶液吸收生成两种盐的离子方程式:
溶液吸收生成两种盐的离子方程式:(5)下列说法正确的是___________
A.装置①中可加热氯化铵固体直接经碱石灰干燥制得 |
| B.装置②中用抽拉铜丝的优点易于控制反应进行的程度,随时可以发生、停止 |
| C.装置④中干燥剂可选择用浓硫酸 |
D.装置⑧中圆底烧瓶中氨气换成氯气,胶头滴管和烧杯中是浓的 溶液,也可能形成喷泉 溶液,也可能形成喷泉 |
您最近一年使用:0次
解题方法
5 . 铵态氮肥的过度使用会导致水体的富营养化,研究发现,可以用化学方法和生物方法去除氨氮。现探究去除溶液中氨氮的最适宜条件。
(1)化学方法一般用次氯酸钠氧化。次氯酸钠可以和水中溶解的氨气反应得到无毒无害物质,其离子方程式为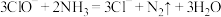 。次氯酸钠溶液中含氯的微粒有
。次氯酸钠溶液中含氯的微粒有_______ 。
(2)规定义:氨氮脱除率
氨氮脱除率受溶液pH 的影响。如表是不同pH下的氨氮脱除率:
的影响。如表是不同pH下的氨氮脱除率:
图示为最适宜pH条件,NaClO和 起始投料比例不同的情况下的氨氮脱除率。
起始投料比例不同的情况下的氨氮脱除率。

试分析为什么最佳pH时,按照3∶2投料氨氮脱除率较低,只有0.6,写出两个可能的原因:_____ 。
(3)由上述信息判断,反应的最佳pH范围是_______ ,最佳投料比是_______ 。
生物方法是利用硝化细菌,将土壤中的 转化为
转化为 后,土壤中的
后,土壤中的 进一步将
进一步将 氧化为
氧化为 。之后,在氧气较少的环境下,
。之后,在氧气较少的环境下, 又可以在反硝化细菌的作用下与
又可以在反硝化细菌的作用下与 反应,使氮以
反应,使氮以 形式放出。
形式放出。
(4)氧气与 反应时,反应物
反应时,反应物 与
与 的物质的量之比为
的物质的量之比为_______ 。写出 与
与 作用生成
作用生成 的离子方程式:
的离子方程式:_______ 。
(5)在VLamol·L 的氨水中滴加等体积0.01mol·L
的氨水中滴加等体积0.01mol·L 的盐酸,使
的盐酸,使 ,则产物中一水合氨浓度为
,则产物中一水合氨浓度为_______ 。
(1)化学方法一般用次氯酸钠氧化。次氯酸钠可以和水中溶解的氨气反应得到无毒无害物质,其离子方程式为
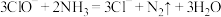 。次氯酸钠溶液中含氯的微粒有
。次氯酸钠溶液中含氯的微粒有(2)规定义:氨氮脱除率

氨氮脱除率受溶液pH
 的影响。如表是不同pH下的氨氮脱除率:
的影响。如表是不同pH下的氨氮脱除率:| pH | 反应前氮元素质量 | 反应后氮元素质量 | 氨氮脱除率 |
| 5.8 | 49.3 | 24.11 | 51.1% |
| 6.9 | 49.3 | 19.08 | 61.3% |
| 7.7 | 49.3 | 16.86 | 65.8% |
| 8.8 | 49.3 | 18.88 | 61.7% |
| 9.3 | 49.3 | 25.29 | x |
 起始投料比例不同的情况下的氨氮脱除率。
起始投料比例不同的情况下的氨氮脱除率。
试分析为什么最佳pH时,按照3∶2投料氨氮脱除率较低,只有0.6,写出两个可能的原因:
(3)由上述信息判断,反应的最佳pH范围是
生物方法是利用硝化细菌,将土壤中的
 转化为
转化为 后,土壤中的
后,土壤中的 进一步将
进一步将 氧化为
氧化为 。之后,在氧气较少的环境下,
。之后,在氧气较少的环境下, 又可以在反硝化细菌的作用下与
又可以在反硝化细菌的作用下与 反应,使氮以
反应,使氮以 形式放出。
形式放出。(4)氧气与
 反应时,反应物
反应时,反应物 与
与 的物质的量之比为
的物质的量之比为 与
与 作用生成
作用生成 的离子方程式:
的离子方程式:(5)在VLamol·L
 的氨水中滴加等体积0.01mol·L
的氨水中滴加等体积0.01mol·L 的盐酸,使
的盐酸,使 ,则产物中一水合氨浓度为
,则产物中一水合氨浓度为
您最近一年使用:0次
解题方法
6 . 高铁酸钾 是一种新型非氯高效消毒净水剂,实验室由
是一种新型非氯高效消毒净水剂,实验室由 氧化法制备制取
氧化法制备制取 的装置如下:
的装置如下:

(1)装置 中产生
中产生 ,反应中化合价降低的元素是
,反应中化合价降低的元素是_______ (填元素名称)。
(2)装置 中
中 被
被 氧化为高铁酸钠
氧化为高铁酸钠 溶液,该反应的离子方程式为
溶液,该反应的离子方程式为_______ 。
(3)充分反应后,在较低温度下向装置 所得溶液中加入浓
所得溶液中加入浓 溶液,析出
溶液,析出 粗产品,则该条件下
粗产品,则该条件下 的溶解度
的溶解度_______ (填“大于”“小于”或“等于”) 的溶解度。
的溶解度。
(4)测定 粗产品纯度的实验步骤如下:
粗产品纯度的实验步骤如下:
步骤一:称取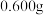 高铁酸钾粗产品配成
高铁酸钾粗产品配成 溶液。取
溶液。取 该溶液于锥形瓶内,向其中加入足量
该溶液于锥形瓶内,向其中加入足量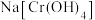 ,发生反应
,发生反应
步骤二:向锥形瓶内加入适量稀 ,发生反应
,发生反应 ;再滴加
;再滴加 硫酸亚铁铵
硫酸亚铁铵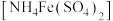 溶液至恰好完全反应,发生反应:
溶液至恰好完全反应,发生反应: 。
。
步骤三:重复以上步骤2~3次,平均消耗硫酸亚铁铵溶液 。
。
计算该 粗产品的纯度
粗产品的纯度______ (写出计算过程)。
 是一种新型非氯高效消毒净水剂,实验室由
是一种新型非氯高效消毒净水剂,实验室由 氧化法制备制取
氧化法制备制取 的装置如下:
的装置如下:
(1)装置
 中产生
中产生 ,反应中化合价降低的元素是
,反应中化合价降低的元素是(2)装置
 中
中 被
被 氧化为高铁酸钠
氧化为高铁酸钠 溶液,该反应的离子方程式为
溶液,该反应的离子方程式为(3)充分反应后,在较低温度下向装置
 所得溶液中加入浓
所得溶液中加入浓 溶液,析出
溶液,析出 粗产品,则该条件下
粗产品,则该条件下 的溶解度
的溶解度 的溶解度。
的溶解度。(4)测定
 粗产品纯度的实验步骤如下:
粗产品纯度的实验步骤如下:步骤一:称取
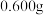 高铁酸钾粗产品配成
高铁酸钾粗产品配成 溶液。取
溶液。取 该溶液于锥形瓶内,向其中加入足量
该溶液于锥形瓶内,向其中加入足量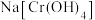 ,发生反应
,发生反应
步骤二:向锥形瓶内加入适量稀
 ,发生反应
,发生反应 ;再滴加
;再滴加 硫酸亚铁铵
硫酸亚铁铵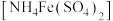 溶液至恰好完全反应,发生反应:
溶液至恰好完全反应,发生反应: 。
。步骤三:重复以上步骤2~3次,平均消耗硫酸亚铁铵溶液
 。
。计算该
 粗产品的纯度
粗产品的纯度
您最近一年使用:0次
2023-02-05更新
|
316次组卷
|
3卷引用:江苏省扬州市2022-2023学年高二上学期普通高中学业水平合格性模拟试卷(一)化学试题
江苏省扬州市2022-2023学年高二上学期普通高中学业水平合格性模拟试卷(一)化学试题江苏省徐州市沛县2023-2024学年高二上学期12月月考化学试题(已下线)题型四 以无机物制备为载体的综合实验-备战2024年高考化学答题技巧与模板构建
解题方法
7 . 某同学研究铜与稀硝酸的反应,实验如下(夹持装置已略去,气密性良好)。
(1)HNO3中的氮元素为+5价,是氮元素的最高价态,HNO3具有_______ (填“氧化”或“还原”)性。
(2)步骤III中分液漏斗内的红棕色气体是_______ 。
(3)补全铜与稀硝酸反应的化学方程式:_______ 。_______ (写出一条即可)。
| 步骤I | 步骤II | 步骤III |
|
|
|
| 如图组装仪器并加入药品,分液漏斗旋塞关闭,U型管左侧无气体 | 将铜丝下移,一段时间后,U型管左侧产生无色气体,溶液逐渐变蓝,当液面低于铜丝时,反应逐渐停止 | 将铜丝上移,打开分液漏斗旋塞,U型管内气体进入分液漏斗立即变为红棕色,待气体全部进入分液漏斗后关闭旋塞 |
(2)步骤III中分液漏斗内的红棕色气体是
(3)补全铜与稀硝酸反应的化学方程式:
3Cu+8HNO3(稀)=3Cu(NO3)2+ _______↑+4H2O
_______↑+4H2O
您最近一年使用:0次
2023-01-17更新
|
218次组卷
|
2卷引用:北京市2022-2023学年高二上学期第二次合格考化学试题
名校
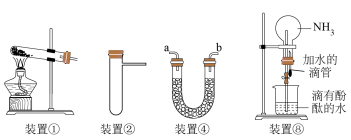
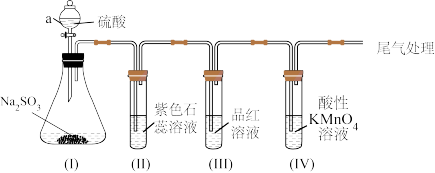
8 . 某化学兴趣小组利用如图装置制取并探究二氧化疏的性质。
(已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,部分夹持仪器已略去)
【实验探究】
(1)装置(I)仪器a的名称是___ 。
(2)实验进行一段时间后:
①装置(II)中观察到紫色石蕊试液颜色变为____ ,原因是SO2和水反应生成____ (填“H2SO3”或“H2SO4”)。
②装置(III)中品红溶液褪色,原因是____ 。
③装置(IV)中酸性KMnO4溶液褪色,证明SO2具有___ (填“氧化性”或“还原性”)。
(3)为防止SO2污染空气,尾气可用____ (填“NaOH溶液”或“稀硫酸”)吸收。
(4)用12.6gNa2SO3固体与足量硫酸反应,理论上可生成标准状况下SO2的体积为___ L。(已知Na2SO3的摩尔质量为126g•mol-1)
【实验拓展】
(5)将装置(IV)中酸性KMnO4溶液换成Na2S溶液,可观察到溶液中出现____ (填“白色”或“淡黄色”)浑浊,补充完整下面的离子方程式:____ 。
SO2+2S2-+4_____=3S↓+2H2O
【知识应用】
(6)二氧化硫可作为食品添加剂。查阅资料:
国家食品添加剂使用标准中二氧化硫最大使用量
说明在严格控制用量的情况下,二氧化硫可被添加到食品中作为漂白剂、防腐剂和____ (填“氧化剂”或“抗氧化剂”)。
(已知:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,部分夹持仪器已略去)

【实验探究】
(1)装置(I)仪器a的名称是
(2)实验进行一段时间后:
①装置(II)中观察到紫色石蕊试液颜色变为
②装置(III)中品红溶液褪色,原因是
③装置(IV)中酸性KMnO4溶液褪色,证明SO2具有
(3)为防止SO2污染空气,尾气可用
(4)用12.6gNa2SO3固体与足量硫酸反应,理论上可生成标准状况下SO2的体积为
【实验拓展】
(5)将装置(IV)中酸性KMnO4溶液换成Na2S溶液,可观察到溶液中出现
SO2+2S2-+4_____=3S↓+2H2O
【知识应用】
(6)二氧化硫可作为食品添加剂。查阅资料:
国家食品添加剂使用标准中二氧化硫最大使用量
| 食品名称 | 食糖 | 葡萄酒 | 水果干类 |
| SO2最大使用量 | 0.1g•kg-1 | 0.25g•kg-1 | 1g•kg-1 |
您最近一年使用:0次
2022-07-11更新
|
371次组卷
|
2卷引用:2022年01月福建省普通高中高一学业水平合格性考试真题化学试题
名校
解题方法
9 . 一氧化二氯(Cl2O)是一种氯化剂和氧化剂,极易溶于水,与水反应生成 HClO, 遇有机物易燃烧或爆炸,42℃以上易分解。制备出的Cl2O要冷却成固体才便于操作和保存,制取少量的Cl2O是用干燥的氧化汞和氯气反应:2HgO+2Cl2 = Cl2O+HgCl2·HgO (反应放热)。某化学兴趣小组设计如图装置以制备 Cl2O(支撑、加热及夹持装置已省略)。
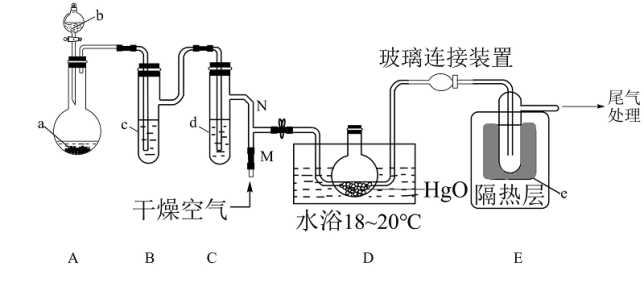
已知:① a中固体试剂是MnO2,b中试剂是浓盐酸。
②有关物质的熔沸点如下表。
请回答:
(1)仪器b的名称___________
(2)写出装置 A 中制备 Cl2的化学方程式___________ 。
(3)B中盛有的液体c应是___________ ,C中的液体d的作用___________
(4)E中的保温瓶中盛有液态制冷剂e是___________ (在“干冰”“冰水”“液态空气”“液氨”“液氯”中选择一种)
(5)据文献报道,Cl2O 的另一种制备方法是利用 Cl2与足量的 Na2CO3溶液 反应来制得,同时生成NaHCO3和NaCl两种盐,写出该反应的化学方程式___________ 。

已知:① a中固体试剂是MnO2,b中试剂是浓盐酸。
②有关物质的熔沸点如下表。
| Cl2O | N2 | O2 | CO2 | NH3 | Cl2 | |
| 熔点 | -120.6 ℃ | -209.86℃ | -218.4℃ | -78.5℃(升华) | -77.3℃ | -101℃ |
| 沸点 | 3.8℃ | -195.8℃ | -183℃ | -33.35℃ | -34.6℃ |
(1)仪器b的名称
(2)写出装置 A 中制备 Cl2的化学方程式
(3)B中盛有的液体c应是
(4)E中的保温瓶中盛有液态制冷剂e是
(5)据文献报道,Cl2O 的另一种制备方法是利用 Cl2与足量的 Na2CO3溶液 反应来制得,同时生成NaHCO3和NaCl两种盐,写出该反应的化学方程式
您最近一年使用:0次
2021-11-08更新
|
364次组卷
|
3卷引用:浙江省舟山中学2021-2022学年高一下学期学考考前质量检测化学试题
名校
解题方法
10 . 海带中含有丰富的碘。为了从海带中提取碘并测定海带中碘元素的百分含量,某研究性学习小组称量了一定量海带,设计并进行了以下实验:
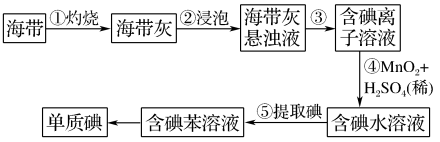
(1) 步骤①中高温灼烧海带时,除需要三脚架、泥三角、酒精灯、玻璃棒外,还需要用的实验仪器是___________ 。
(2)步骤④反应中能生成可溶性的Mn2+,写出该反应的离子方程式:___________ 。
(3) 请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:___________ 。

(1) 步骤①中高温灼烧海带时,除需要三脚架、泥三角、酒精灯、玻璃棒外,还需要用的实验仪器是
(2)步骤④反应中能生成可溶性的Mn2+,写出该反应的离子方程式:
(3) 请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法:
您最近一年使用:0次
2021-01-03更新
|
396次组卷
|
3卷引用:江苏省南京市第二十九中学2020-2021学年高二上学期合格性考试模化学试题
江苏省南京市第二十九中学2020-2021学年高二上学期合格性考试模化学试题江苏省涟水县第一中学2022-2023学年高二上学期学业水平合格性考试化学试题(已下线)专题01 物质的组成、分类、性质与变化-【好题汇编】备战2023-2024学年高二化学上学期期末真题分类汇编(江苏专用)