名校
1 . 三草酸合铁( )酸钾晶体
)酸钾晶体 (
(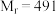 ),
), 时在水中溶解度为
时在水中溶解度为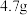 ,
, 时溶解度为
时溶解度为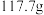 ,难溶于乙醇,是制备负载型活性铁催化剂的主要原料。实验室中先利用如图装置制备
,难溶于乙醇,是制备负载型活性铁催化剂的主要原料。实验室中先利用如图装置制备 (夹持装置略去),后续再制取三草酸合铁(
(夹持装置略去),后续再制取三草酸合铁( )酸钾晶体。
)酸钾晶体。
实验一: 晶体的制备
晶体的制备
(1)打开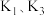 和
和 ,关闭
,关闭 ,向装置
,向装置 中加入稍过量的稀硫酸。
中加入稍过量的稀硫酸。
① 中盛放
中盛放 溶液的仪器名称为
溶液的仪器名称为___________ 。
②A中有气体产生,该气体的作用是___________ 。
(2)收集 并验纯后,打开
并验纯后,打开 ,关闭
,关闭___________ ,让A中浅绿色溶液流入 中,以生成
中,以生成 ,并分离得
,并分离得 晶体。
晶体。
实验二:三草酸合铁( )酸钾晶体的制备
)酸钾晶体的制备
(3)将实验一得到的 溶于水,加入
溶于水,加入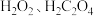 和
和 ,酒精灯微热并不断搅拌,反应制得
,酒精灯微热并不断搅拌,反应制得 ,冷却、过滤、洗涤、干燥。
,冷却、过滤、洗涤、干燥。
①写出该反应的化学方程式:___________ 。
②“微热、搅拌”过程中,温度不宜过高的原因是___________ 。
③过滤后需用___________ 洗涤,其优点是___________ 。
(4)产品纯度的测定
常温下,取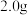 三草酸合铁(Ⅲ)酸钾晶体溶于水配制成
三草酸合铁(Ⅲ)酸钾晶体溶于水配制成 绿色溶液,取出25.00mL,用
绿色溶液,取出25.00mL,用 的酸性高锰酸钾标准液进行滴定,重复三次,平均消耗标准液20.00mL。
的酸性高锰酸钾标准液进行滴定,重复三次,平均消耗标准液20.00mL。
①滴定终点的判断依据是___________ 。
②该三草酸合铁( )酸钾晶体的纯度为
)酸钾晶体的纯度为___________ (保留三位有效数字)。
 )酸钾晶体
)酸钾晶体 (
( ),
), 时在水中溶解度为
时在水中溶解度为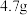 ,
, 时溶解度为
时溶解度为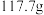 ,难溶于乙醇,是制备负载型活性铁催化剂的主要原料。实验室中先利用如图装置制备
,难溶于乙醇,是制备负载型活性铁催化剂的主要原料。实验室中先利用如图装置制备 (夹持装置略去),后续再制取三草酸合铁(
(夹持装置略去),后续再制取三草酸合铁( )酸钾晶体。
)酸钾晶体。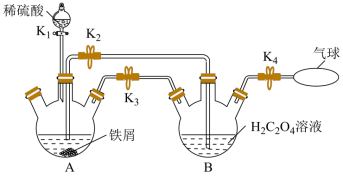
实验一:
 晶体的制备
晶体的制备(1)打开
 和
和 ,关闭
,关闭 ,向装置
,向装置 中加入稍过量的稀硫酸。
中加入稍过量的稀硫酸。①
 中盛放
中盛放 溶液的仪器名称为
溶液的仪器名称为②A中有气体产生,该气体的作用是
(2)收集
 并验纯后,打开
并验纯后,打开 ,关闭
,关闭 中,以生成
中,以生成 ,并分离得
,并分离得 晶体。
晶体。实验二:三草酸合铁(
 )酸钾晶体的制备
)酸钾晶体的制备(3)将实验一得到的
 溶于水,加入
溶于水,加入 和
和 ,酒精灯微热并不断搅拌,反应制得
,酒精灯微热并不断搅拌,反应制得 ,冷却、过滤、洗涤、干燥。
,冷却、过滤、洗涤、干燥。①写出该反应的化学方程式:
②“微热、搅拌”过程中,温度不宜过高的原因是
③过滤后需用
(4)产品纯度的测定
常温下,取
 三草酸合铁(Ⅲ)酸钾晶体溶于水配制成
三草酸合铁(Ⅲ)酸钾晶体溶于水配制成 绿色溶液,取出25.00mL,用
绿色溶液,取出25.00mL,用 的酸性高锰酸钾标准液进行滴定,重复三次,平均消耗标准液20.00mL。
的酸性高锰酸钾标准液进行滴定,重复三次,平均消耗标准液20.00mL。①滴定终点的判断依据是
②该三草酸合铁(
 )酸钾晶体的纯度为
)酸钾晶体的纯度为
您最近一年使用:0次
名校
2 . 焦亚硫酸钠 常用作葡萄酒、果脯等食品的抗氧化剂,在空气中、受热时均易分解,某实验小组通过实验制备焦亚硫酸钠并测定焦亚硫酸钠的纯度。回答下列问题:
常用作葡萄酒、果脯等食品的抗氧化剂,在空气中、受热时均易分解,某实验小组通过实验制备焦亚硫酸钠并测定焦亚硫酸钠的纯度。回答下列问题:
I.焦亚硫酸钠的制备
实验室制备少量 的装置如图所示。
的装置如图所示。 左右,向
左右,向 过饱和溶液中通入
过饱和溶液中通入 ,当溶液的
,当溶液的 为4.1时,停止通入
为4.1时,停止通入 ,
, 静置结晶,经减压抽滤、洗涤、
静置结晶,经减压抽滤、洗涤、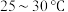 干燥,可获得
干燥,可获得 固体。
固体。
(1) 的VSEPR模型名称为
的VSEPR模型名称为__________ 。
(2)控制反应温度在 左右的原因是
左右的原因是_____________ 。
(3)装置 的作用是
的作用是__________ 。
(4)工业上亦可用 (固体)与
(固体)与 气体充分接触反应制备焦亚硫酸钠,此法常称为干法制备焦亚硫酸盐,写出反应的化学方程式:
气体充分接触反应制备焦亚硫酸钠,此法常称为干法制备焦亚硫酸盐,写出反应的化学方程式:_______________ 。
(5)因为 具有
具有_________ 性,所以产品 中不可避免地存在
中不可避免地存在 。检验产品中含有
。检验产品中含有 的方法是
的方法是_____________ 。
Ⅱ.焦亚硫酸钠纯度的测定
工业焦亚硫酸钠优质品要求焦亚硫酸钠的质量分数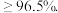 通过下列实验检测焦亚硫酸钠样品是否达到优质品标准。实验检测原理为
通过下列实验检测焦亚硫酸钠样品是否达到优质品标准。实验检测原理为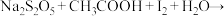
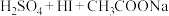 (未配平),
(未配平), 。
。
准确称取 样品,快速置于预先加入
样品,快速置于预先加入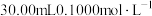 碘标准液及
碘标准液及 水的
水的 碘量瓶中,加入
碘量瓶中,加入 乙酸溶液,立即盖上瓶塞,水封,缓缓摇动溶解后,置于暗处
乙酸溶液,立即盖上瓶塞,水封,缓缓摇动溶解后,置于暗处 ,用
,用 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗 标准溶液
标准溶液 。
。
(6)滴定终点的现象是_____________ 。
(7)该样品中焦亚硫酸钠的质量分数为__________  ,
,__________ (填“是”或“不是”)优质品。
 常用作葡萄酒、果脯等食品的抗氧化剂,在空气中、受热时均易分解,某实验小组通过实验制备焦亚硫酸钠并测定焦亚硫酸钠的纯度。回答下列问题:
常用作葡萄酒、果脯等食品的抗氧化剂,在空气中、受热时均易分解,某实验小组通过实验制备焦亚硫酸钠并测定焦亚硫酸钠的纯度。回答下列问题:I.焦亚硫酸钠的制备
实验室制备少量
 的装置如图所示。
的装置如图所示。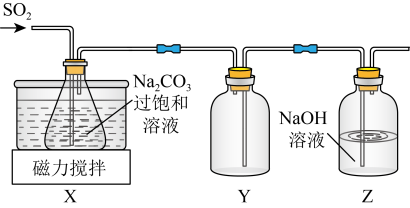
 左右,向
左右,向 过饱和溶液中通入
过饱和溶液中通入 ,当溶液的
,当溶液的 为4.1时,停止通入
为4.1时,停止通入 ,
, 静置结晶,经减压抽滤、洗涤、
静置结晶,经减压抽滤、洗涤、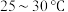 干燥,可获得
干燥,可获得 固体。
固体。(1)
 的VSEPR模型名称为
的VSEPR模型名称为(2)控制反应温度在
 左右的原因是
左右的原因是(3)装置
 的作用是
的作用是(4)工业上亦可用
 (固体)与
(固体)与 气体充分接触反应制备焦亚硫酸钠,此法常称为干法制备焦亚硫酸盐,写出反应的化学方程式:
气体充分接触反应制备焦亚硫酸钠,此法常称为干法制备焦亚硫酸盐,写出反应的化学方程式:(5)因为
 具有
具有 中不可避免地存在
中不可避免地存在 。检验产品中含有
。检验产品中含有 的方法是
的方法是Ⅱ.焦亚硫酸钠纯度的测定
工业焦亚硫酸钠优质品要求焦亚硫酸钠的质量分数
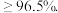 通过下列实验检测焦亚硫酸钠样品是否达到优质品标准。实验检测原理为
通过下列实验检测焦亚硫酸钠样品是否达到优质品标准。实验检测原理为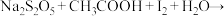
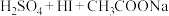 (未配平),
(未配平), 。
。准确称取
 样品,快速置于预先加入
样品,快速置于预先加入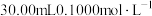 碘标准液及
碘标准液及 水的
水的 碘量瓶中,加入
碘量瓶中,加入 乙酸溶液,立即盖上瓶塞,水封,缓缓摇动溶解后,置于暗处
乙酸溶液,立即盖上瓶塞,水封,缓缓摇动溶解后,置于暗处 ,用
,用 标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗
标准溶液滴定至溶液呈微黄色,加入淀粉指示剂,继续滴定至终点,消耗 标准溶液
标准溶液 。
。(6)滴定终点的现象是
(7)该样品中焦亚硫酸钠的质量分数为
 ,
,
您最近一年使用:0次
昨日更新
|
131次组卷
|
3卷引用:河北省保定市九校2024届高三下学期二模化学试题
名校
解题方法
3 . 某研究小组用氨基钠( )与
)与 反应制备叠氮化钠(
反应制备叠氮化钠( )并对制得的叠氮化钠产品纯度进行测定。已知叠氮化钠为易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,NaOH溶于乙醇不溶于乙醚。氨基钠极易水解和氧化;
)并对制得的叠氮化钠产品纯度进行测定。已知叠氮化钠为易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,NaOH溶于乙醇不溶于乙醚。氨基钠极易水解和氧化; 不与酸或碱反应;
不与酸或碱反应; 具有较强还原性(Sn与碳同族)。回答下列问题:
具有较强还原性(Sn与碳同族)。回答下列问题:
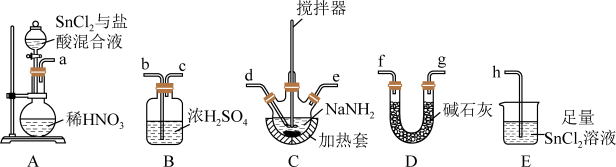
(1)制备叠氮化钠:连接好装置后,打开A中分液漏斗活塞,向圆底烧瓶中滴加溶液,充分反应。___________ 。
②装置的连接顺序为a→___________ →h(填仪器接口字母)。
③A中发生反应的化学方程式为___________ ,E装置的作用为___________ 。
④C中发生的反应为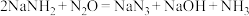 ,反应后待装置冷却,在混合物中加入
,反应后待装置冷却,在混合物中加入___________ ,过滤,用___________ (选填字母)洗涤,晾干得到粗产品。
A.冷水 B.乙醚 C.热水 D.乙醇
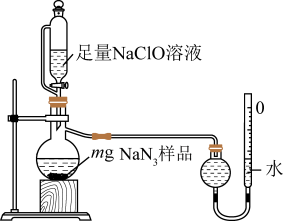
(2)测定产品纯度:取装置C中制得的叠氮化钠样品m克放入圆底烧瓶中进行纯度的测定,如图。___________ 。
②读取气体体积时,应注意冷却至室温、___________ 、视线与凹液面最低点水平相切。
③若量气管的初始读数为x mL、末读数为y mL,本实验条件下气体摩尔体积为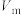 L/mol,则产品中
L/mol,则产品中 的质量分数为
的质量分数为___________ %(表达式)。(提示:量气管刻度与滴定管类似)
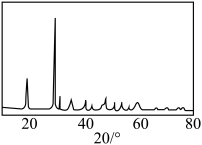
④若对所得产品进行X射线衍射实验得到图谱如图所示,该产品属于___________ (填“晶体”或“非晶体”)。
 )与
)与 反应制备叠氮化钠(
反应制备叠氮化钠( )并对制得的叠氮化钠产品纯度进行测定。已知叠氮化钠为易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,NaOH溶于乙醇不溶于乙醚。氨基钠极易水解和氧化;
)并对制得的叠氮化钠产品纯度进行测定。已知叠氮化钠为易溶于水的白色晶体,微溶于乙醇,不溶于乙醚,NaOH溶于乙醇不溶于乙醚。氨基钠极易水解和氧化; 不与酸或碱反应;
不与酸或碱反应; 具有较强还原性(Sn与碳同族)。回答下列问题:
具有较强还原性(Sn与碳同族)。回答下列问题:(1)制备叠氮化钠:连接好装置后,打开A中分液漏斗活塞,向圆底烧瓶中滴加溶液,充分反应。
②装置的连接顺序为a→
③A中发生反应的化学方程式为
④C中发生的反应为
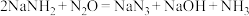 ,反应后待装置冷却,在混合物中加入
,反应后待装置冷却,在混合物中加入A.冷水 B.乙醚 C.热水 D.乙醇
(2)测定产品纯度:取装置C中制得的叠氮化钠样品m克放入圆底烧瓶中进行纯度的测定,如图。
②读取气体体积时,应注意冷却至室温、
③若量气管的初始读数为x mL、末读数为y mL,本实验条件下气体摩尔体积为
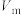 L/mol,则产品中
L/mol,则产品中 的质量分数为
的质量分数为④若对所得产品进行X射线衍射实验得到图谱如图所示,该产品属于
您最近一年使用:0次
解题方法
4 . 某小组同学探究Mg与 溶液的反应。
溶液的反应。
已知:i.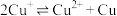
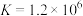
ⅱ.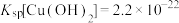
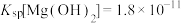
ⅲ. 为无色、
为无色、 为黄色
为黄色
实验I:将长约15cm打磨光亮的镁条放入2mL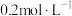
 溶液(溶液呈黄绿色)中,实验记录如下:
溶液(溶液呈黄绿色)中,实验记录如下:
(1)第一阶段析出红色固体发生反应的离子方程式是______ 。
(2)小组同学取第二阶段中淡蓝色溶液,加入少量NaCl固体,溶液颜色逐渐变黄绿色,请用离子方程式表示溶液由淡蓝色变为黄绿色的原因______ 。
(3)查阅资料:CuOH黄色,CuCl白色。
第三阶段产生的黄色沉淀可能含+1价铜的化合物,进行以下实验探究:
①取少量沉淀滴入浓氨水,沉淀完全溶解,溶液呈浅蓝色,在空气中放置一段时间后溶液成深蓝色,证实沉淀中含+1价铜的化合物,溶液由浅蓝色变为深蓝色的离子方程式是______ 。
②甲同学猜想第三阶段反应中先生成CuCl,随着反应的进行,逐渐转化为黄色的CuOH,用离子方程式表示生成CuCl的主要原因是______ 。
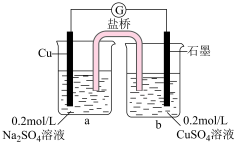
③小组同学采用电化学装置进行验证。______ 。从而证明了甲同学的猜想。
(4)查阅资料,CuOH在碱性环境下一部分发生非氧化还原分解反应,第四阶段中产生的橙色沉淀中混有的物质是______ 。
实验Ⅱ:改用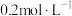
 溶液重复实验I,30min内剧烈反应,产生大量气体,镁条上出现红色固体,1h后产物中有大量红色物质且有蓝色沉淀。
溶液重复实验I,30min内剧烈反应,产生大量气体,镁条上出现红色固体,1h后产物中有大量红色物质且有蓝色沉淀。
(5)经验证蓝色沉淀为 ,下列有关产生蓝色沉淀分析合理的是
,下列有关产生蓝色沉淀分析合理的是______ (填序号)。
a.反应放热,促使 水解趋于完全,生成
水解趋于完全,生成 蓝色沉淀
蓝色沉淀
b.存在平衡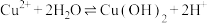 ,Mg与
,Mg与 反应,使
反应,使 下降,平衡移动,产生蓝色沉淀
下降,平衡移动,产生蓝色沉淀
c.由于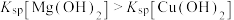 ,Mg与水反应生成的
,Mg与水反应生成的 逐渐转化为
逐渐转化为 蓝色沉淀
蓝色沉淀
(6)综上所述,影响Mg与 溶液反应的影响因素是
溶液反应的影响因素是______ 。
 溶液的反应。
溶液的反应。已知:i.
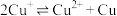
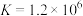
ⅱ.
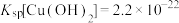
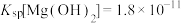
ⅲ.
 为无色、
为无色、 为黄色
为黄色实验I:将长约15cm打磨光亮的镁条放入2mL
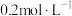
 溶液(溶液呈黄绿色)中,实验记录如下:
溶液(溶液呈黄绿色)中,实验记录如下:| 时间 | 第一阶段 0~1min | 第二阶段 1~8min | 第三阶段 8~25min | 第四阶段 25min~18h |
| 实验现象 | 镁条表面出现红色固体,伴有大量气体产生 | 仍然伴有大量气体,溶液变为淡蓝色,试管底部有蓝色沉淀产生 | 气体量不断减少,沉淀变为黄色 | 沉淀变为橙色,红色铜几乎不可见 |
(2)小组同学取第二阶段中淡蓝色溶液,加入少量NaCl固体,溶液颜色逐渐变黄绿色,请用离子方程式表示溶液由淡蓝色变为黄绿色的原因
(3)查阅资料:CuOH黄色,CuCl白色。
第三阶段产生的黄色沉淀可能含+1价铜的化合物,进行以下实验探究:
①取少量沉淀滴入浓氨水,沉淀完全溶解,溶液呈浅蓝色,在空气中放置一段时间后溶液成深蓝色,证实沉淀中含+1价铜的化合物,溶液由浅蓝色变为深蓝色的离子方程式是
②甲同学猜想第三阶段反应中先生成CuCl,随着反应的进行,逐渐转化为黄色的CuOH,用离子方程式表示生成CuCl的主要原因是
③小组同学采用电化学装置进行验证。
(4)查阅资料,CuOH在碱性环境下一部分发生非氧化还原分解反应,第四阶段中产生的橙色沉淀中混有的物质是
实验Ⅱ:改用
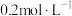
 溶液重复实验I,30min内剧烈反应,产生大量气体,镁条上出现红色固体,1h后产物中有大量红色物质且有蓝色沉淀。
溶液重复实验I,30min内剧烈反应,产生大量气体,镁条上出现红色固体,1h后产物中有大量红色物质且有蓝色沉淀。(5)经验证蓝色沉淀为
 ,下列有关产生蓝色沉淀分析合理的是
,下列有关产生蓝色沉淀分析合理的是a.反应放热,促使
 水解趋于完全,生成
水解趋于完全,生成 蓝色沉淀
蓝色沉淀b.存在平衡
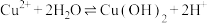 ,Mg与
,Mg与 反应,使
反应,使 下降,平衡移动,产生蓝色沉淀
下降,平衡移动,产生蓝色沉淀c.由于
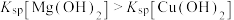 ,Mg与水反应生成的
,Mg与水反应生成的 逐渐转化为
逐渐转化为 蓝色沉淀
蓝色沉淀(6)综上所述,影响Mg与
 溶液反应的影响因素是
溶液反应的影响因素是
您最近一年使用:0次
解题方法
5 . 某实验小组对 溶液和
溶液和 溶液的反应进行探究。
溶液的反应进行探究。
资料: 为白色固体,易溶于水。
为白色固体,易溶于水。
【实验1】
I.探究反应的产物
(1)经检验实验中的黑色固体均为 。实验1-1反应的离子方程式为
。实验1-1反应的离子方程式为_________ 。
【实验2】
①证明实验1-2所得固体洗涤干净的实验操作及现象是_________ 。
②依据实验2,推测S与NaOH反应的离子方程式为_________ 。
③实验2中,加入硝酸的目的是_________ 。
(3)实验证明红色固体为Cu。补全静置后红色固体转化为黑色固体反应的离子方程式:_____ 。
□ □
□ □___+□__
□___+□__ □__+□
□__+□
Ⅱ.探究影响反应产物的因素
【实验3】
说明:本实验中,电压表的读数越大,氧化剂的氧化性(或还原剂的还原性)越强。
(4)资料表明,对于电极反应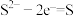 ,
, 对
对 还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是
还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是_________ 。
(5)小组同学用实验3装置补做实验3-5,排除了 的影响。他们所用试剂a为饱和
的影响。他们所用试剂a为饱和 溶液,b为
溶液,b为_________ 。
(6)综合上述实验可以得到的结论有_________ 。
 溶液和
溶液和 溶液的反应进行探究。
溶液的反应进行探究。资料:
 为白色固体,易溶于水。
为白色固体,易溶于水。【实验1】
序号 | 实验操作 | 实验现象 |
 | 向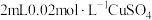 溶液中加入 溶液中加入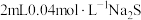 溶液 溶液 | 产生黑色固体 |
 | 向 饱和 饱和 溶液(约为 溶液(约为 , , 约为3)中加入 约为3)中加入 饱和 饱和 溶液(约为 溶液(约为 , , 约为13) 约为13) | 迅速产生大量黑色固体、少量红色固体和黄色固体,静置后红色固体减少、黑色固体增多 |
(1)经检验实验中的黑色固体均为
 。实验1-1反应的离子方程式为
。实验1-1反应的离子方程式为【实验2】
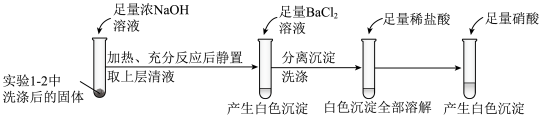
①证明实验1-2所得固体洗涤干净的实验操作及现象是
②依据实验2,推测S与NaOH反应的离子方程式为
③实验2中,加入硝酸的目的是
(3)实验证明红色固体为Cu。补全静置后红色固体转化为黑色固体反应的离子方程式:
□
 □
□ □___+□__
□___+□__ □__+□
□__+□
Ⅱ.探究影响反应产物的因素
【实验3】
| 序号 | 实验方案 | 实验现象 | |
| 3-1 |
| a:饱和 溶液 溶液b:饱和  溶液 溶液 | 电压表指针偏转,读数为0.85V |
| 3-2 | a: 溶液 溶液b: 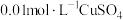 溶液 溶液 | 电压表指针偏转,读数为0.46V | |
| 3-3 | a: 溶液(pH调至13) 溶液(pH调至13)b: 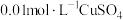 溶液 溶液 | 电压表指针偏转,读数为0.68V | |
| 3-4 | a: 溶液(pH调至13) 溶液(pH调至13)b: 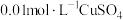 溶液 溶液 | 电压表指针略偏转,读数为0.10V | |
(4)资料表明,对于电极反应
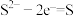 ,
, 对
对 还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是
还原性没有直接影响。实验3-3的电压表读数大于3-2的可能原因是(5)小组同学用实验3装置补做实验3-5,排除了
 的影响。他们所用试剂a为饱和
的影响。他们所用试剂a为饱和 溶液,b为
溶液,b为(6)综合上述实验可以得到的结论有
您最近一年使用:0次
名校
6 . 常温下,二甲基亚砜( )为无色无臭且能与水混溶的透明液体,熔点为18.4℃,沸点为189℃。实验室模拟“
)为无色无臭且能与水混溶的透明液体,熔点为18.4℃,沸点为189℃。实验室模拟“ 氧化法”制备二甲基亚砜的装置如图所示(加热装置及夹持装置已省略)。
氧化法”制备二甲基亚砜的装置如图所示(加热装置及夹持装置已省略)。

①制备二甲基亚砜的反应原理为
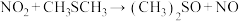 。
。②二甲基硫醚和二甲基亚砜的密度分别为
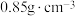 和
和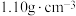 。
。③
 微热易分解为NO、
微热易分解为NO、 和
和 。
。实验过程:将仪器A中制得的气体通入15.00mL二甲基硫醚中,控制温度为60∼80℃,反应一段时间得到二甲基亚砜粗品,粗品经减压蒸馏后共收集到11.10mL二甲基亚砜纯品。回答下列问题:
(1)通入
 的目的是
的目的是a.碱石灰 b.
 c.硅胶
c.硅胶(2)冷凝管进出水的方向
(3)二甲基亚砜能与水混溶的原因可能为
(4)NaOH溶液吸收尾气中NO和
 生成亚硝酸盐的化学方程式为
生成亚硝酸盐的化学方程式为(5)本实验的产率是
您最近一年使用:0次
7日内更新
|
184次组卷
|
6卷引用:2024届河北省保定市唐县第一中学高三下学期二模化学试题
解题方法
7 . 硫脲 为白色晶体,可溶于水,易溶于乙酸乙酯,可代替氰化物用于提炼金。合成硫脲的原理为
为白色晶体,可溶于水,易溶于乙酸乙酯,可代替氰化物用于提炼金。合成硫脲的原理为 。
。
(1)仪器a的名称为__________ 。
(2)从结构角度分析,硫脲可溶于水的原因是__________ 。
(3)多孔球泡的作用是__________ 。
(4)B中反应完全的标志是__________ 。
(5)分离提纯的方法为萃取,应选用的绿色萃取剂为__________ (填标号)。
a.苯 b.四氯化碳 c.乙酸乙酯 d.乙醇
(6)滴定原理:
取mg硫脲的粗产品溶于水,用c mol∙L-1的酸性重铬酸钾标准溶液滴定到终点,平行三次实验平均消耗VmL标准溶液,则样品中硫脲的纯度为__________ 。
(7)在酸性溶液中,硫脲在Fe3+存在下能溶解金形成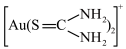 ,反应的离子方程式为
,反应的离子方程式为_______ 。溶解金的过程伴随着溶液变红的现象,原因可能为硫脲发生异构化生成__________ (填化学式)。
 为白色晶体,可溶于水,易溶于乙酸乙酯,可代替氰化物用于提炼金。合成硫脲的原理为
为白色晶体,可溶于水,易溶于乙酸乙酯,可代替氰化物用于提炼金。合成硫脲的原理为 。
。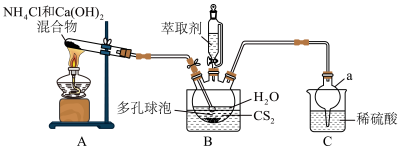
(1)仪器a的名称为
(2)从结构角度分析,硫脲可溶于水的原因是
(3)多孔球泡的作用是
(4)B中反应完全的标志是
(5)分离提纯的方法为萃取,应选用的绿色萃取剂为
a.苯 b.四氯化碳 c.乙酸乙酯 d.乙醇
(6)滴定原理:

取mg硫脲的粗产品溶于水,用c mol∙L-1的酸性重铬酸钾标准溶液滴定到终点,平行三次实验平均消耗VmL标准溶液,则样品中硫脲的纯度为
(7)在酸性溶液中,硫脲在Fe3+存在下能溶解金形成
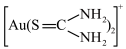 ,反应的离子方程式为
,反应的离子方程式为
您最近一年使用:0次
7日内更新
|
150次组卷
|
3卷引用:湖北省武汉市2024届高三毕业生四月调研考试(二模)化学试题
8 . 锰的化合物用途与性质的探究,有关物质及颜色: (白色)、
(白色)、 (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色)。回答问题:
(紫色)。回答问题:
Ⅰ.用 溶液氧化甲苯制苯甲酸,按如下流程分离苯甲酸和回收甲苯。
溶液氧化甲苯制苯甲酸,按如下流程分离苯甲酸和回收甲苯。
(1)操作Ⅰ为______ ,操作Ⅱ为______ 。
(2)无色液体A是______ ,.定性检验A的试剂是______ ,现象是____________ 。
(3)该同学推测白色固体B是苯甲酸与少量KCl的混合物,简述提纯过程____________ 。
Ⅱ.探究 在一定条件下被
在一定条件下被 或
或 氧化成的产物,实验装置如图(夹持装置略):
氧化成的产物,实验装置如图(夹持装置略): 前产生白色沉淀,在空气中缓慢变成棕黑色沉淀;通入
前产生白色沉淀,在空气中缓慢变成棕黑色沉淀;通入 后棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀。
后棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀。
实验ⅱ:物质a为40% KOH溶液,C中通入 前后与实验ⅰ现象一样。
前后与实验ⅰ现象一样。
(4)通入 前,C中沉淀由白色变为黑色的化学方程式为
前,C中沉淀由白色变为黑色的化学方程式为____________ 。
(5) 的氧化性与溶液的酸碱性无关,KClO的氧化性随碱性减弱而增强。取ⅰ中放置后的1 mL悬浊液,再加入4 mL水,溶液紫色缓慢加深,发生的反应是
的氧化性与溶液的酸碱性无关,KClO的氧化性随碱性减弱而增强。取ⅰ中放置后的1 mL悬浊液,再加入4 mL水,溶液紫色缓慢加深,发生的反应是____________ 。
(6)浓碱条件下, 可被
可被 还原为
还原为 。取ⅱ中放置后的1 mL悬浊液,再加4 mL 40% KOH溶液,溶液紫色迅速变为绿色,溶液紫色变为绿色的离子方程式为
。取ⅱ中放置后的1 mL悬浊液,再加4 mL 40% KOH溶液,溶液紫色迅速变为绿色,溶液紫色变为绿色的离子方程式为____________ 。
(7)从反应速率的角度,分析实验ⅱ未得到绿色溶液的可能原因____________ 。
 (白色)、
(白色)、 (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色)。回答问题:
(紫色)。回答问题:Ⅰ.用
 溶液氧化甲苯制苯甲酸,按如下流程分离苯甲酸和回收甲苯。
溶液氧化甲苯制苯甲酸,按如下流程分离苯甲酸和回收甲苯。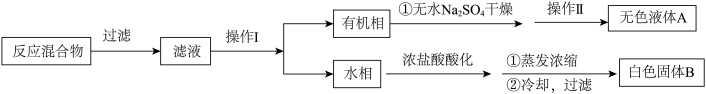
(1)操作Ⅰ为
(2)无色液体A是
(3)该同学推测白色固体B是苯甲酸与少量KCl的混合物,简述提纯过程
Ⅱ.探究
 在一定条件下被
在一定条件下被 或
或 氧化成的产物,实验装置如图(夹持装置略):
氧化成的产物,实验装置如图(夹持装置略):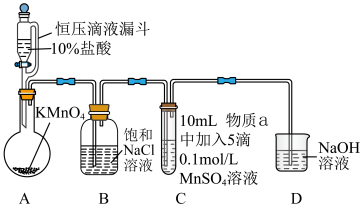
 前产生白色沉淀,在空气中缓慢变成棕黑色沉淀;通入
前产生白色沉淀,在空气中缓慢变成棕黑色沉淀;通入 后棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀。
后棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀。实验ⅱ:物质a为40% KOH溶液,C中通入
 前后与实验ⅰ现象一样。
前后与实验ⅰ现象一样。(4)通入
 前,C中沉淀由白色变为黑色的化学方程式为
前,C中沉淀由白色变为黑色的化学方程式为(5)
 的氧化性与溶液的酸碱性无关,KClO的氧化性随碱性减弱而增强。取ⅰ中放置后的1 mL悬浊液,再加入4 mL水,溶液紫色缓慢加深,发生的反应是
的氧化性与溶液的酸碱性无关,KClO的氧化性随碱性减弱而增强。取ⅰ中放置后的1 mL悬浊液,再加入4 mL水,溶液紫色缓慢加深,发生的反应是(6)浓碱条件下,
 可被
可被 还原为
还原为 。取ⅱ中放置后的1 mL悬浊液,再加4 mL 40% KOH溶液,溶液紫色迅速变为绿色,溶液紫色变为绿色的离子方程式为
。取ⅱ中放置后的1 mL悬浊液,再加4 mL 40% KOH溶液,溶液紫色迅速变为绿色,溶液紫色变为绿色的离子方程式为(7)从反应速率的角度,分析实验ⅱ未得到绿色溶液的可能原因
您最近一年使用:0次
名校
解题方法
9 . 次氯酸盐是常用的水处理剂。有效氯含量(COAC)指与含氯消毒剂氧化能力相当的氯气量,单位为 mol/L;物质氧化性越强,氧化还原电位(ORP)越高;相同条件下,次氯酸的氧化性大于次氯酸盐。温度及pH对Ca(ClO)2溶液有效氯含量(COAC)及氧化还原电位的影响。
(1)在不同温度下,用0.2 mol/L乙酸溶液调节pH得到Ca(ClO)2溶液COAC、ORP的关系如图1室温(25 ℃)、图2(70 ℃)所示。___________ (填“增大”或“减小”)。
②Ca(ClO)2溶液用于消毒时适宜的条件:温度为___________ (填字母,下同)、pH为___________ 。
A. 25 ℃ B. 70 ℃ C. 5.75 D. 6.85
(2)某小组探究70 ℃时,pH及稳定剂对NaClO溶液有效氯含量的影响。甲同学设计实验方案如下:
①设计实验1和2的目的是___________ 。
②实验5中的a___________ 0.935(填“大于”“小于”或“等于”)。
③根据实验3~5,可得出的结论是___________ 。
④下列物质中最适宜作为NaClO溶液稳定剂的是___________ (填字母)。
A. MgCl2 B. NaCl C. Na2S D. CH3COONa
资料:ⅰ.Mn2+在一定条件下被ClO-氧化成MnO2(棕黑色)、 (绿色)、
(绿色)、 (紫色)。
(紫色)。
ⅱ.浓碱条件下, 可被OH-还原为
可被OH-还原为 。
。
ⅲ.NaClO的氧化性随碱性增强而减弱。
实验记录如下:
(3)根据资料ⅱ,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因。
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将 氧化为
氧化为 。
。
①离子方程式表示可能导致溶液碱性减弱的原因:_______________ ,但通过实验测定溶液的碱性变化很小。
②取Ⅲ中放置后的1 mL悬浊液,加入4 mL 40% NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为___________ ,溶液绿色缓慢加深,原因是MnO2被___________ (填化学式)氧化,可证明Ⅲ的悬浊液中氧化剂过量。
③从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:___________ 。
(1)在不同温度下,用0.2 mol/L乙酸溶液调节pH得到Ca(ClO)2溶液COAC、ORP的关系如图1室温(25 ℃)、图2(70 ℃)所示。
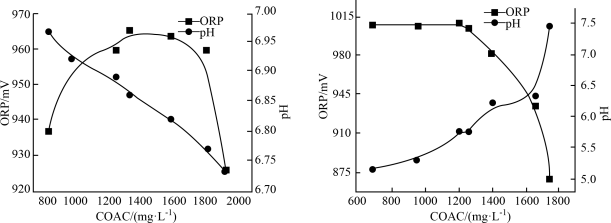
图1 图2
①由图1可知,随着少量乙酸的滴入,Ca(ClO)2溶液的pH在②Ca(ClO)2溶液用于消毒时适宜的条件:温度为
A. 25 ℃ B. 70 ℃ C. 5.75 D. 6.85
(2)某小组探究70 ℃时,pH及稳定剂对NaClO溶液有效氯含量的影响。甲同学设计实验方案如下:
| 序号 | 硅酸钠的质量分数 | 碳酸钠的质量分数 | 初始COAC | pH | 12 h后COAC | 12 h后COAC/初始COAC |
| 1 | 0 | 0 | 1 794 | 8.53 | 1 218 | 0.679 |
| 2 | 0 | 0 | 1 794 | 8.63 | 1 288 | 0.718 |
| 3 | 0.9% | 0.6% | 1 794 | 13.44 | 1 676 | 0.935 |
| 4 | 1.5% | 0 | 1 834 | 13.76 | 1 597 | 0.871 |
| 5 | 0 | 1.5% | 1 834 | 13.66 | - | a |
②实验5中的a
③根据实验3~5,可得出的结论是
④下列物质中最适宜作为NaClO溶液稳定剂的是
A. MgCl2 B. NaCl C. Na2S D. CH3COONa
资料:ⅰ.Mn2+在一定条件下被ClO-氧化成MnO2(棕黑色)、
 (绿色)、
(绿色)、 (紫色)。
(紫色)。ⅱ.浓碱条件下,
 可被OH-还原为
可被OH-还原为 。
。ⅲ.NaClO的氧化性随碱性增强而减弱。
实验记录如下:
| 序号 | Cl2的吸收液 | C中实验现象 | |
| 通入Cl2前 | 通入Cl2后 | ||
| Ⅰ | 10mL水+5滴0.1mol/L MnSO4溶液 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ | 10mL5% NaOH溶液+5滴0.1mol/L MnSO4溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| Ⅲ | 10mL40% NaOH溶液+5滴0.1mol/L MnSO4溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(3)根据资料ⅱ,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因。
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将
 氧化为
氧化为 。
。①离子方程式表示可能导致溶液碱性减弱的原因:
②取Ⅲ中放置后的1 mL悬浊液,加入4 mL 40% NaOH溶液,溶液紫色迅速变为绿色,且绿色缓慢加深。溶液紫色变为绿色的离子方程式为
③从反应速率的角度,分析实验Ⅲ未得到绿色溶液的可能原因:
您最近一年使用:0次
10 . 五氯化锑(SbCl5)主要用作氟化工的催化剂、纺织工业织物的阻燃剂、染料工业的中间体。实验室根据反应 ,利用如下装置制备SbCl5 (加热及夹持装置略)。
,利用如下装置制备SbCl5 (加热及夹持装置略)。
实验室制备SbCl5的步骤如下:
ⅰ.保持80℃的条件,在盛有SbCl3的三颈烧瓶中通入Cl2,反应生成SbCl5;
ⅱ.将三颈烧瓶中的反应混合物转移到双颈烧瓶中;
ⅲ.减压蒸馏,收集目标物质。
回答下列问题:
(1)写出用K2MnO4和浓盐酸制备Cl2的离子方程式___________ ,其中体现还原性和酸性的HCl的物质的量之比为___________ 。
(2)实验装置中,两个冷凝管___________ (填“能”或“不能”)交换使用,步骤ⅰ中对三颈烧瓶进行加热的最佳方式是___________ 加热。
(3)写出图示实验装置存在的一处弊端:___________ 。
(4)步骤ⅱ将反应后混合液转移至双颈烧瓶中的方法:在b处连接减压装置,使三颈烧瓶中的液体流入双颈烧瓶。进行该操作前,需___________ (填活塞1和2的开、关的情况)。
(5)步骤ⅲ采用减压蒸馏,而不是常压蒸馏的原因是___________ ;调节减压装置至1.86kPa,收集___________ ℃左右的馏分。减压蒸馏时,玻璃毛细管的作用有___________ (填字母)。
a.防止暴沸 b.搅拌 c.连通大气,保持常压
 ,利用如下装置制备SbCl5 (加热及夹持装置略)。
,利用如下装置制备SbCl5 (加热及夹持装置略)。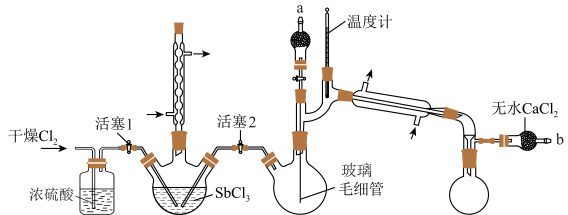
| 物质 | 熔点/℃ | 沸点/℃ | 性质 |
| SbCl3 | 73.4 | 223(101.3kPa) | 均极易水解 |
| SbCl5 | 2.8 | 176(101.3kPa,140℃)时分解 | |
| 68(1.86kPa)、79(2.90kPa) |
ⅰ.保持80℃的条件,在盛有SbCl3的三颈烧瓶中通入Cl2,反应生成SbCl5;
ⅱ.将三颈烧瓶中的反应混合物转移到双颈烧瓶中;
ⅲ.减压蒸馏,收集目标物质。
回答下列问题:
(1)写出用K2MnO4和浓盐酸制备Cl2的离子方程式
(2)实验装置中,两个冷凝管
(3)写出图示实验装置存在的一处弊端:
(4)步骤ⅱ将反应后混合液转移至双颈烧瓶中的方法:在b处连接减压装置,使三颈烧瓶中的液体流入双颈烧瓶。进行该操作前,需
(5)步骤ⅲ采用减压蒸馏,而不是常压蒸馏的原因是
a.防止暴沸 b.搅拌 c.连通大气,保持常压
您最近一年使用:0次
7日内更新
|
86次组卷
|
2卷引用:2024届陕西省西安市新城区高三下学期教学质量检测试题(三)理综能力测试-高中化学




