名校
解题方法
1 . 亚硝酸钙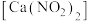 是水泥混凝土外加剂的主要原料,某学习小组设计实验制备亚硝酸钙,实验装置如图所示(夹持装置略去):
是水泥混凝土外加剂的主要原料,某学习小组设计实验制备亚硝酸钙,实验装置如图所示(夹持装置略去):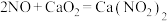 ;
; 。
。
请回答下列问题:
(1)请写出装置A中发生的化学反应方程式___________ 。
(2)装置D中盛装无水氯化钙的仪器名称是___________ ;装置B所加试剂是___________ 。
(3)加入稀硝酸之前,应向装置中通入一段时间的 ,原因是
,原因是___________ 。
(4)将 完全转化为
完全转化为 ,理论上需要铜的物质的量至少为
,理论上需要铜的物质的量至少为___________ mol。
(5)工业上可用石灰乳和硝酸工业的尾气(含NO、 )反应,既能净化尾气,又能获得应用广泛的
)反应,既能净化尾气,又能获得应用广泛的 ,反应原理为
,反应原理为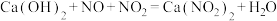 。其部分工艺流程如图所示:
。其部分工艺流程如图所示: 的物质的量之比接近1∶1。
的物质的量之比接近1∶1。
①若 ,则会导致
,则会导致___________ ;
②若 ,则会导致
,则会导致___________ 。
③已知 溶液需要保持弱碱性,因为其与酸会发生分解,产生NO气体。取2.5g某样品加入过量的稀硫酸中,发生反应产生0.448L(标准状况)气体,则该样品的纯度是
溶液需要保持弱碱性,因为其与酸会发生分解,产生NO气体。取2.5g某样品加入过量的稀硫酸中,发生反应产生0.448L(标准状况)气体,则该样品的纯度是___________ 。(结果保留两位小数)
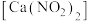 是水泥混凝土外加剂的主要原料,某学习小组设计实验制备亚硝酸钙,实验装置如图所示(夹持装置略去):
是水泥混凝土外加剂的主要原料,某学习小组设计实验制备亚硝酸钙,实验装置如图所示(夹持装置略去):
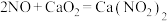 ;
; 。
。请回答下列问题:
(1)请写出装置A中发生的化学反应方程式
(2)装置D中盛装无水氯化钙的仪器名称是
(3)加入稀硝酸之前,应向装置中通入一段时间的
 ,原因是
,原因是(4)将
 完全转化为
完全转化为 ,理论上需要铜的物质的量至少为
,理论上需要铜的物质的量至少为(5)工业上可用石灰乳和硝酸工业的尾气(含NO、
 )反应,既能净化尾气,又能获得应用广泛的
)反应,既能净化尾气,又能获得应用广泛的 ,反应原理为
,反应原理为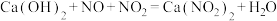 。其部分工艺流程如图所示:
。其部分工艺流程如图所示:
 的物质的量之比接近1∶1。
的物质的量之比接近1∶1。①若
 ,则会导致
,则会导致②若
 ,则会导致
,则会导致③已知
 溶液需要保持弱碱性,因为其与酸会发生分解,产生NO气体。取2.5g某样品加入过量的稀硫酸中,发生反应产生0.448L(标准状况)气体,则该样品的纯度是
溶液需要保持弱碱性,因为其与酸会发生分解,产生NO气体。取2.5g某样品加入过量的稀硫酸中,发生反应产生0.448L(标准状况)气体,则该样品的纯度是
您最近一年使用:0次
名校
解题方法
2 . 氮化钛( )是一种优良的结构材料,可用于喷汽推进器及火箭等。实验室用
)是一种优良的结构材料,可用于喷汽推进器及火箭等。实验室用 在高温条件制备
在高温条件制备 并测定产率的装置如图所示(夹持装置省略)。
并测定产率的装置如图所示(夹持装置省略)。
(1)仪器a的名称是___________ ,装置A中发生反应的化学方程式为___________ 。
(2)装置B中的试剂是___________ 。
(3)实验尾气为无色气体,写出制备 反应的化学方程式;
反应的化学方程式;___________ 。
(4)D中 的作用是
的作用是___________ 。
(5)反应前称取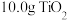 样品,反应后称得瓷舟中固体的质量为
样品,反应后称得瓷舟中固体的质量为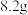 ,则
,则 的产率为
的产率为___________ 。
(6)已知 晶体的晶胞结构如图所示,氮原子位于钛原子围成的
晶体的晶胞结构如图所示,氮原子位于钛原子围成的___________ (填立体构型)的中心,假设钛原子与氮原子相切,则氮原子与钛原子半径的比值为_________ (列出计算式即可)。
 )是一种优良的结构材料,可用于喷汽推进器及火箭等。实验室用
)是一种优良的结构材料,可用于喷汽推进器及火箭等。实验室用 在高温条件制备
在高温条件制备 并测定产率的装置如图所示(夹持装置省略)。
并测定产率的装置如图所示(夹持装置省略)。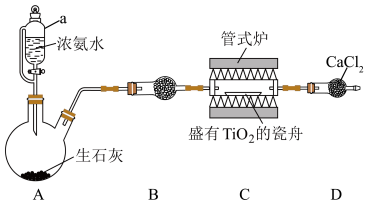
(1)仪器a的名称是
(2)装置B中的试剂是
(3)实验尾气为无色气体,写出制备
 反应的化学方程式;
反应的化学方程式;(4)D中
 的作用是
的作用是(5)反应前称取
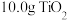 样品,反应后称得瓷舟中固体的质量为
样品,反应后称得瓷舟中固体的质量为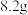 ,则
,则 的产率为
的产率为(6)已知
 晶体的晶胞结构如图所示,氮原子位于钛原子围成的
晶体的晶胞结构如图所示,氮原子位于钛原子围成的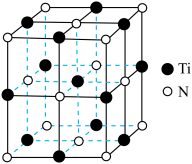
您最近一年使用:0次
解题方法
3 . 铁酸锌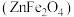 是一种性能优良的软磁材料,可作烯类有机化合物氧化脱氢的催化剂。实验室制备铁酸锌可采用如下步骤:
是一种性能优良的软磁材料,可作烯类有机化合物氧化脱氢的催化剂。实验室制备铁酸锌可采用如下步骤:
Ⅰ.制备前驱物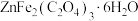
①分别配制 溶液和
溶液和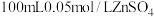 溶液,并将二者混合备用。
溶液,并将二者混合备用。
②另外称取 溶于
溶于 蒸馏水中。
蒸馏水中。
③将①和②所得溶液混合加热到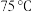 ,并在
,并在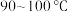 加热搅拌
加热搅拌 ;待溶液冷却后进行减压过滤、洗涤,干燥,得到前驱物。
;待溶液冷却后进行减压过滤、洗涤,干燥,得到前驱物。
Ⅱ.制备铁酸锌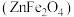
将步骤Ⅰ所得前驱物在 灼烧
灼烧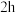 ,冷却后称量质量为
,冷却后称量质量为 ,计算产率。
,计算产率。
回答下列问题:
(1)步骤Ⅰ中配制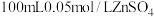 溶液需要的玻璃仪器有烧杯、量筒、胶头滴管、
溶液需要的玻璃仪器有烧杯、量筒、胶头滴管、 容量瓶和
容量瓶和___________ 。下列关于容量瓶的操作,正确的是___________ (填标号)。 晶体,加水溶解,滴加
晶体,加水溶解,滴加___________ (填写试剂名称),无明显现象,由此可知样品___________ (填“已”或“未”)变质。
(3)步骤Ⅰ中检验沉淀是否洗涤干净的操作是___________ 。
(4)步骤Ⅱ中“灼烧”发生的反应属于分解反应,其化学方程式为___________ 。
(5)该实验的总产率为___________ 。
(6)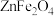 晶体的一种晶胞结构如图所示,晶胞可看成由A、B单元按C方式交替排布构成,“○”表示
晶体的一种晶胞结构如图所示,晶胞可看成由A、B单元按C方式交替排布构成,“○”表示 。则“●”表示的微粒是
。则“●”表示的微粒是___________ (填符号),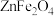 晶体的密度为
晶体的密度为___________  (已知晶胞参数为
(已知晶胞参数为 ,列出计算式)。
,列出计算式)。
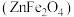 是一种性能优良的软磁材料,可作烯类有机化合物氧化脱氢的催化剂。实验室制备铁酸锌可采用如下步骤:
是一种性能优良的软磁材料,可作烯类有机化合物氧化脱氢的催化剂。实验室制备铁酸锌可采用如下步骤:Ⅰ.制备前驱物
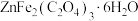
①分别配制
 溶液和
溶液和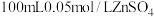 溶液,并将二者混合备用。
溶液,并将二者混合备用。②另外称取
 溶于
溶于 蒸馏水中。
蒸馏水中。③将①和②所得溶液混合加热到
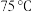 ,并在
,并在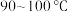 加热搅拌
加热搅拌 ;待溶液冷却后进行减压过滤、洗涤,干燥,得到前驱物。
;待溶液冷却后进行减压过滤、洗涤,干燥,得到前驱物。Ⅱ.制备铁酸锌
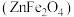
将步骤Ⅰ所得前驱物在
 灼烧
灼烧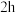 ,冷却后称量质量为
,冷却后称量质量为 ,计算产率。
,计算产率。回答下列问题:
(1)步骤Ⅰ中配制
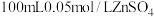 溶液需要的玻璃仪器有烧杯、量筒、胶头滴管、
溶液需要的玻璃仪器有烧杯、量筒、胶头滴管、 容量瓶和
容量瓶和
 晶体,加水溶解,滴加
晶体,加水溶解,滴加(3)步骤Ⅰ中检验沉淀是否洗涤干净的操作是
(4)步骤Ⅱ中“灼烧”发生的反应属于分解反应,其化学方程式为
(5)该实验的总产率为
(6)
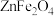 晶体的一种晶胞结构如图所示,晶胞可看成由A、B单元按C方式交替排布构成,“○”表示
晶体的一种晶胞结构如图所示,晶胞可看成由A、B单元按C方式交替排布构成,“○”表示 。则“●”表示的微粒是
。则“●”表示的微粒是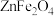 晶体的密度为
晶体的密度为 (已知晶胞参数为
(已知晶胞参数为 ,列出计算式)。
,列出计算式)。
您最近一年使用:0次
解题方法
4 . 三氯化六氨合钴( )是一种重要的化工产品。实验室以
)是一种重要的化工产品。实验室以 为原料制备三氯六氨合钴的方法如下,回答下列问题:
为原料制备三氯六氨合钴的方法如下,回答下列问题:
Ⅰ.制备氯化钴:已知 易潮解,可用高熔点金属钴与氯气反应制取。实验室可用下图装置进行制备
易潮解,可用高熔点金属钴与氯气反应制取。实验室可用下图装置进行制备_____ 。
(2)A中固体为高锰酸钾,则反应的离子方程式为______ 。装置B中试剂X为____ 。
(3)球形干燥管中试剂的作用为______ 。
Ⅱ.制备三氯化六氨合钴:将制备的 按下图流程操作:
按下图流程操作:____ 。
(5)利用 、
、 、浓氨水、
、浓氨水、 制备
制备 的总反应化学方程式
的总反应化学方程式___ 。
(6)操作X中,加入浓盐酸的作用是____ 。
Ⅲ.测定钴含量:准确称量3.0000g样品 ,加入硫酸酸化的KI溶液至样品恰好完全溶解,配成250mL溶液。量取25.00mL溶液,加入适量缓冲溶液,几滴淀粉溶液,用0.1000mol/L
,加入硫酸酸化的KI溶液至样品恰好完全溶解,配成250mL溶液。量取25.00mL溶液,加入适量缓冲溶液,几滴淀粉溶液,用0.1000mol/L  溶液滴定生成的
溶液滴定生成的 ,消耗
,消耗 溶液的体积为10.00mL。
溶液的体积为10.00mL。
(已知:① 将
将 氧化成
氧化成 ,自身被还原成
,自身被还原成 ;②
;② )。
)。
(7)计算样品中钴元素的质量分数为_______ %(保留至小数点后两位)。
 )是一种重要的化工产品。实验室以
)是一种重要的化工产品。实验室以 为原料制备三氯六氨合钴的方法如下,回答下列问题:
为原料制备三氯六氨合钴的方法如下,回答下列问题:Ⅰ.制备氯化钴:已知
 易潮解,可用高熔点金属钴与氯气反应制取。实验室可用下图装置进行制备
易潮解,可用高熔点金属钴与氯气反应制取。实验室可用下图装置进行制备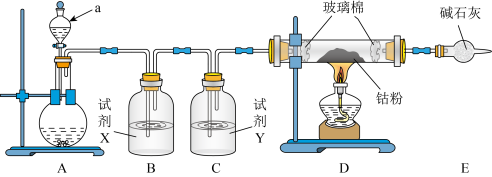
(2)A中固体为高锰酸钾,则反应的离子方程式为
(3)球形干燥管中试剂的作用为
Ⅱ.制备三氯化六氨合钴:将制备的
 按下图流程操作:
按下图流程操作:
(5)利用
 、
、 、浓氨水、
、浓氨水、 制备
制备 的总反应化学方程式
的总反应化学方程式(6)操作X中,加入浓盐酸的作用是
Ⅲ.测定钴含量:准确称量3.0000g样品
 ,加入硫酸酸化的KI溶液至样品恰好完全溶解,配成250mL溶液。量取25.00mL溶液,加入适量缓冲溶液,几滴淀粉溶液,用0.1000mol/L
,加入硫酸酸化的KI溶液至样品恰好完全溶解,配成250mL溶液。量取25.00mL溶液,加入适量缓冲溶液,几滴淀粉溶液,用0.1000mol/L  溶液滴定生成的
溶液滴定生成的 ,消耗
,消耗 溶液的体积为10.00mL。
溶液的体积为10.00mL。(已知:①
 将
将 氧化成
氧化成 ,自身被还原成
,自身被还原成 ;②
;② )。
)。(7)计算样品中钴元素的质量分数为
您最近一年使用:0次
5 . 环己酮(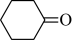 )是重要的化工原料和有机溶剂,可用于制造合成橡胶、合成纤维和药品等。实验室用次氯酸钠氧化法制备环已酮的原理与操作流程如下。
)是重要的化工原料和有机溶剂,可用于制造合成橡胶、合成纤维和药品等。实验室用次氯酸钠氧化法制备环已酮的原理与操作流程如下。
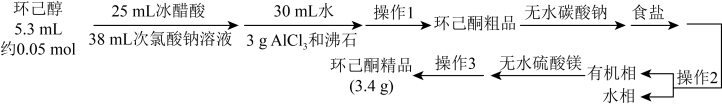
①环己酮的密度比水的密度小,能与水形成恒沸混合物,沸点为95℃。
②31℃时,环己酮在水中的溶解度为2.4 g。
回答下列问题:
(1)环己醇与次氯酸钠溶液反应的离子方程式为
(2)“操作1”和“操作3”是蒸馏,其蒸馏装置中用到的冷凝管是
A.  B.
B.  C.
C. 
(4)实验中加入无水硫酸镁的目的是
(5)制备环己酮粗品时:
①加入次氯酸钠溶液后,用淀粉-碘化钾试纸检验,试纸应呈蓝色,否则应再补加次氯酸钠溶液,其目的是
②次氯酸钠溶液的浓度可用间接碘量法测定。用移液管移取10.00mL次氯酸钠溶液于500mL容量瓶中,加蒸馏水至刻度线,摇匀后移取25.00mL该溶液于250mL锥形瓶中,加入50mL0.1 mol·L-1盐酸和2g碘化钾,用0.1mol·L-1硫代硫酸钠标准溶液滴定析出的碘。在滴定接近终点时加入1mL0.2%淀粉溶液。析出碘的反应的离子方程式为
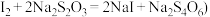
(6)本实验环己酮的产率最接近_______(填字母)。
| A.50% | B.60% | C.70% | D.80% |
您最近一年使用:0次
6 . 氧钒碱式碳酸铵晶体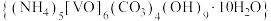 ,紫红色,难溶于水和乙醇。其制备及氮元素含量的测定实验如下(已知
,紫红色,难溶于水和乙醇。其制备及氮元素含量的测定实验如下(已知 易被
易被 氧化)。回答下列问题。
氧化)。回答下列问题。
Ⅰ.制备
步骤1:向 中加入足量盐酸酸化的
中加入足量盐酸酸化的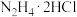 溶液,微沸数分钟。
溶液,微沸数分钟。
步骤2:向足量 溶液中缓慢加入制得的
溶液中缓慢加入制得的 溶液,有气泡产生并析出紫红色晶体。
溶液,有气泡产生并析出紫红色晶体。
步骤3:反应结束后抽滤,先后用饱和 溶液、无水乙醇洗涤,静置得产品。
溶液、无水乙醇洗涤,静置得产品。
(1)“步骤1”产生无色无污染的气体,该反应的化学方程式为______ 。
(2)用无水乙醇洗涤的目的是______ 。
(3)“步骤2”可在如图装置中进行。______ 。(按气流方向,用字母标号表示)。
②检查装置气密性,加入试剂。先打开 ,通入一段时间气体目的是
,通入一段时间气体目的是______ ,当观察到______ (填实验现象)时,再关闭 ,打开
,打开 ,进行实验。
,进行实验。
③生成氧钒碱式碳酸铵晶体的化学方程式为______ 。
Ⅱ.产品中氮元素含量的测定
精确称取wg晶体加入如图所示的三颈烧瓶中,然后逐滴加入足量10%NaOH溶液充分反应,通入水蒸气,将氨全部蒸出,并用蒸馏水冲洗导管内壁,用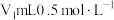 的饱和硼酸标准溶液完全吸收。取下接收瓶,用0.5
的饱和硼酸标准溶液完全吸收。取下接收瓶,用0.5 盐酸标准溶液滴定,到终点时消耗
盐酸标准溶液滴定,到终点时消耗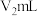 盐酸。
盐酸。
已知: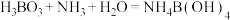 ,
, 。
。
(4)“冰盐水”的作用是______ 。
(5)样品中氮元素质量分数的表达式为______ 。
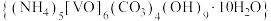 ,紫红色,难溶于水和乙醇。其制备及氮元素含量的测定实验如下(已知
,紫红色,难溶于水和乙醇。其制备及氮元素含量的测定实验如下(已知 易被
易被 氧化)。回答下列问题。
氧化)。回答下列问题。Ⅰ.制备
步骤1:向
 中加入足量盐酸酸化的
中加入足量盐酸酸化的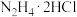 溶液,微沸数分钟。
溶液,微沸数分钟。步骤2:向足量
 溶液中缓慢加入制得的
溶液中缓慢加入制得的 溶液,有气泡产生并析出紫红色晶体。
溶液,有气泡产生并析出紫红色晶体。步骤3:反应结束后抽滤,先后用饱和
 溶液、无水乙醇洗涤,静置得产品。
溶液、无水乙醇洗涤,静置得产品。(1)“步骤1”产生无色无污染的气体,该反应的化学方程式为
(2)用无水乙醇洗涤的目的是
(3)“步骤2”可在如图装置中进行。
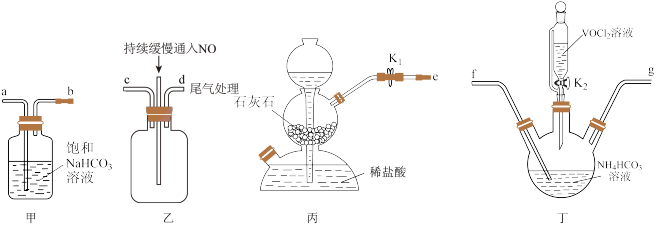
②检查装置气密性,加入试剂。先打开
 ,通入一段时间气体目的是
,通入一段时间气体目的是 ,打开
,打开 ,进行实验。
,进行实验。③生成氧钒碱式碳酸铵晶体的化学方程式为
Ⅱ.产品中氮元素含量的测定
精确称取wg晶体加入如图所示的三颈烧瓶中,然后逐滴加入足量10%NaOH溶液充分反应,通入水蒸气,将氨全部蒸出,并用蒸馏水冲洗导管内壁,用
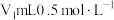 的饱和硼酸标准溶液完全吸收。取下接收瓶,用0.5
的饱和硼酸标准溶液完全吸收。取下接收瓶,用0.5 盐酸标准溶液滴定,到终点时消耗
盐酸标准溶液滴定,到终点时消耗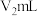 盐酸。
盐酸。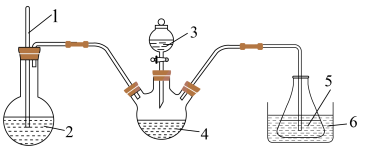
已知:
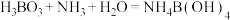 ,
, 。
。(4)“冰盐水”的作用是
(5)样品中氮元素质量分数的表达式为
您最近一年使用:0次
7 . 硫酸铁和硫酸亚铁均为重要的盐。实验室用废铁屑(含油污)制备 和
和 溶液,并进行相关探究。回答下列问题:
溶液,并进行相关探究。回答下列问题:
Ⅰ.制备0.01 mol⋅L
 溶液和0.04 mol⋅L
溶液和0.04 mol⋅L
 溶液。
溶液。
步骤一:将废铁屑(含油污)依次用热纯碱溶液、蒸馏水清洗后,加入足量 溶液,充分反应后过滤;
溶液,充分反应后过滤;
步骤二:向滤液中分批加入足量双氧水,充分反应后小心煮沸、冷至室温;
步骤三:标定所得 溶液浓度;
溶液浓度;
步骤四:配制100 mL 0.01 mol⋅L
 溶液;
溶液;
步骤五:取部分标定浓度后的 溶液,经转化后配制100 mL 0.04 mol⋅L
溶液,经转化后配制100 mL 0.04 mol⋅L
 溶液。
溶液。
(1)步骤一中用蒸馏水清洗的目的为___________ ;步骤二中,双氧水需足量并分批加入的原因为___________ 。
(2)步骤三标定 溶液浓度的操作:准确量取10.00 mL
溶液浓度的操作:准确量取10.00 mL  溶液于锥形瓶中,依次加入适当过量的
溶液于锥形瓶中,依次加入适当过量的 、适量的
、适量的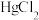 ,充分反应后用0.1000 mol⋅L
,充分反应后用0.1000 mol⋅L
 标准溶液滴定,达到滴定终点时消耗标准溶液的体积为20.00 mL(已知:Sn的常见化合价为+2、+4;该实验条件下
标准溶液滴定,达到滴定终点时消耗标准溶液的体积为20.00 mL(已知:Sn的常见化合价为+2、+4;该实验条件下 不与
不与 反应)。
反应)。
①向 溶液中加入
溶液中加入 反应的离子方程式为
反应的离子方程式为___________ ;加入适量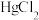 的作用为
的作用为___________ 。
② 溶液的物质的量浓度为
溶液的物质的量浓度为___________ 。
(3)制备0.01 mol⋅L
 溶液的实验中,如图所示仪器不需要使用的是
溶液的实验中,如图所示仪器不需要使用的是___________ (填仪器名称)。 与Ag生成
与Ag生成 和
和 的反应特点。
的反应特点。
提出猜想:上述反应为可逆反应。
验证猜想:取少量Ag粉,向其中加入0.01mol⋅L
 溶液,固体全部溶解;将0.01 mol⋅L
溶液,固体全部溶解;将0.01 mol⋅L
 溶液与0.04 mol⋅L
溶液与0.04 mol⋅L
 溶液等体积混合,产生灰黑色沉淀。
溶液等体积混合,产生灰黑色沉淀。
(4)验证猜想时,第二步实验中所加FeSO₄溶液过量的目的为___________ ;向所得灰黑色沉淀中加入适量浓硝酸,通过___________ (填实验现象),可证明灰黑色沉淀为Ag单质。
(5)实验结论:猜想___________ (填“成立”或“不成立”)。
 和
和 溶液,并进行相关探究。回答下列问题:
溶液,并进行相关探究。回答下列问题:Ⅰ.制备0.01 mol⋅L

 溶液和0.04 mol⋅L
溶液和0.04 mol⋅L
 溶液。
溶液。步骤一:将废铁屑(含油污)依次用热纯碱溶液、蒸馏水清洗后,加入足量
 溶液,充分反应后过滤;
溶液,充分反应后过滤;步骤二:向滤液中分批加入足量双氧水,充分反应后小心煮沸、冷至室温;
步骤三:标定所得
 溶液浓度;
溶液浓度;步骤四:配制100 mL 0.01 mol⋅L

 溶液;
溶液;步骤五:取部分标定浓度后的
 溶液,经转化后配制100 mL 0.04 mol⋅L
溶液,经转化后配制100 mL 0.04 mol⋅L
 溶液。
溶液。(1)步骤一中用蒸馏水清洗的目的为
(2)步骤三标定
 溶液浓度的操作:准确量取10.00 mL
溶液浓度的操作:准确量取10.00 mL  溶液于锥形瓶中,依次加入适当过量的
溶液于锥形瓶中,依次加入适当过量的 、适量的
、适量的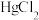 ,充分反应后用0.1000 mol⋅L
,充分反应后用0.1000 mol⋅L
 标准溶液滴定,达到滴定终点时消耗标准溶液的体积为20.00 mL(已知:Sn的常见化合价为+2、+4;该实验条件下
标准溶液滴定,达到滴定终点时消耗标准溶液的体积为20.00 mL(已知:Sn的常见化合价为+2、+4;该实验条件下 不与
不与 反应)。
反应)。①向
 溶液中加入
溶液中加入 反应的离子方程式为
反应的离子方程式为 的作用为
的作用为②
 溶液的物质的量浓度为
溶液的物质的量浓度为(3)制备0.01 mol⋅L

 溶液的实验中,如图所示仪器不需要使用的是
溶液的实验中,如图所示仪器不需要使用的是
 与Ag生成
与Ag生成 和
和 的反应特点。
的反应特点。提出猜想:上述反应为可逆反应。
验证猜想:取少量Ag粉,向其中加入0.01mol⋅L

 溶液,固体全部溶解;将0.01 mol⋅L
溶液,固体全部溶解;将0.01 mol⋅L
 溶液与0.04 mol⋅L
溶液与0.04 mol⋅L
 溶液等体积混合,产生灰黑色沉淀。
溶液等体积混合,产生灰黑色沉淀。(4)验证猜想时,第二步实验中所加FeSO₄溶液过量的目的为
(5)实验结论:猜想
您最近一年使用:0次
8 . 某课外小组采用廉价原料NH4VO3、TiO2和Fe2O3,制出含VO2+、TiO2+和Fe3+的金属盐溶液,然后选择氨水作沉淀剂进行共沉淀反应,对共沉淀物[含VO(OH)2、Ti(OH)4、Fe(OH)3]进行煅烧还原制备合金样品,钒基固溶体合金是一类重要的贮氢材料。制备共沉淀物的装置如下图:_______ 、_______ 、_______ 。
(2)装置C中支管插入三颈烧瓶中的作用是_______ 。
(3)制备VO2+时,用草酸将 还原得VO2+。若把草酸改为盐酸,也能得到VO2+,但会产生一种有毒气体,该反应的离子方程式为
还原得VO2+。若把草酸改为盐酸,也能得到VO2+,但会产生一种有毒气体,该反应的离子方程式为_______ 。
(4)反应过程需控制温度为60℃,三颈烧瓶的加热方式是_______ 。
(5)往三颈烧瓶中滴加含金属离子的混合液,得悬浊液,取出充分沉降。
①检测上层清液是否含Fe3+的实验方案是_______ 。
②经过滤、无水乙醇洗涤、低温干燥,得共沉淀物。使用无水乙醇洗涤的优点是_______ 。
(6)将(5)所得共沉淀物煅烧并还原后得钒基固溶体合金。为测定产品中铁的质量分数,取50.60g产品溶于足量稀硫酸(其中V、Ti不溶),过滤,将滤液配成250.00mL,取25.00mL溶液,用0.1000mol/L酸性KMnO4溶液滴定,进行平行实验后,平均消耗KMnO4溶液的体积为20.00mL。则产品中铁的质量分数为_______ 。
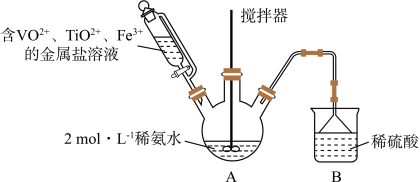
(2)装置C中支管插入三颈烧瓶中的作用是
(3)制备VO2+时,用草酸将
 还原得VO2+。若把草酸改为盐酸,也能得到VO2+,但会产生一种有毒气体,该反应的离子方程式为
还原得VO2+。若把草酸改为盐酸,也能得到VO2+,但会产生一种有毒气体,该反应的离子方程式为(4)反应过程需控制温度为60℃,三颈烧瓶的加热方式是
(5)往三颈烧瓶中滴加含金属离子的混合液,得悬浊液,取出充分沉降。
①检测上层清液是否含Fe3+的实验方案是
②经过滤、无水乙醇洗涤、低温干燥,得共沉淀物。使用无水乙醇洗涤的优点是
(6)将(5)所得共沉淀物煅烧并还原后得钒基固溶体合金。为测定产品中铁的质量分数,取50.60g产品溶于足量稀硫酸(其中V、Ti不溶),过滤,将滤液配成250.00mL,取25.00mL溶液,用0.1000mol/L酸性KMnO4溶液滴定,进行平行实验后,平均消耗KMnO4溶液的体积为20.00mL。则产品中铁的质量分数为
您最近一年使用:0次
解题方法
9 . 高锰酸钾在化工生产、医药、水处理等诸多领域有重要应用。某学习小组在实验室中制备少量 的步骤如下:
的步骤如下:
①向图1铁坩埚中加入KOH和 ,不断搅拌下小火加热至熔融;
,不断搅拌下小火加热至熔融; ,并不断搅拌、加热充分反应,制得墨绿色固体
,并不断搅拌、加热充分反应,制得墨绿色固体 ;
;
③坩埚冷却至室温后,将所得固体研细、移至烧杯,依次用适量蒸馏水、KOH稀溶液浸取,合并浸取液;
④将浸取液移至图2装置B中,通入 至溶液pH为10~11之间时停止实验;
至溶液pH为10~11之间时停止实验;
⑤将装置B中所得悬浊液过滤、洗涤沉淀,将滤液和洗涤液合并后蒸发浓缩、降温结晶、抽滤、洗涤、干燥,制得产品。
已知:相同温度下, 的溶解度大于
的溶解度大于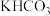 的溶解度。
的溶解度。
回答下列问题,
(1)步骤①中用铁坩埚和粗铁丝代替陶瓷和玻璃仪器的原因为_______ 。
(2)步骤②制备 反应中的还原产物为KCl,则该反应中氧化剂与还原剂的物质的量之比为
反应中的还原产物为KCl,则该反应中氧化剂与还原剂的物质的量之比为_______ 。
(3)步骤④中,测定溶液的pH时,用洁净的玻璃棒蘸取待测液并滴到pH试纸中央,一段时间后应观察pH试纸湿润环的_______ (填“中央”或“边缘”)颜色并与标准比色卡对比; 发生反应同时生成
发生反应同时生成 和
和 的离子方程式为
的离子方程式为_______ ;该步骤中,不宜通入足量 将
将 转化为
转化为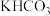 的原因为
的原因为_______ 。
(4)步骤⑤蒸发浓缩至_______ (填现象)时再降温结晶。
(5)测定产品纯度:准确称量m g产品(混有少量 ),溶于水配成溶液、酸化,用c
),溶于水配成溶液、酸化,用c 
 标准溶液滴定,达到滴定终点时,消耗标准溶液的体积为V mL。标准溶液应盛放在(填“酸式”或“碱式”)
标准溶液滴定,达到滴定终点时,消耗标准溶液的体积为V mL。标准溶液应盛放在(填“酸式”或“碱式”)_______ 滴定管中;产品中 的质量分数为
的质量分数为_______ (用含c、V、m的代数式表示),若达到滴定终点时俯视读数,会导致所测结果_______ (填“偏高”“偏低”或“无影响”)。
 的步骤如下:
的步骤如下:①向图1铁坩埚中加入KOH和
 ,不断搅拌下小火加热至熔融;
,不断搅拌下小火加热至熔融;
 ,并不断搅拌、加热充分反应,制得墨绿色固体
,并不断搅拌、加热充分反应,制得墨绿色固体 ;
;③坩埚冷却至室温后,将所得固体研细、移至烧杯,依次用适量蒸馏水、KOH稀溶液浸取,合并浸取液;
④将浸取液移至图2装置B中,通入
 至溶液pH为10~11之间时停止实验;
至溶液pH为10~11之间时停止实验;⑤将装置B中所得悬浊液过滤、洗涤沉淀,将滤液和洗涤液合并后蒸发浓缩、降温结晶、抽滤、洗涤、干燥,制得产品。
已知:相同温度下,
 的溶解度大于
的溶解度大于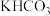 的溶解度。
的溶解度。回答下列问题,
(1)步骤①中用铁坩埚和粗铁丝代替陶瓷和玻璃仪器的原因为
(2)步骤②制备
 反应中的还原产物为KCl,则该反应中氧化剂与还原剂的物质的量之比为
反应中的还原产物为KCl,则该反应中氧化剂与还原剂的物质的量之比为(3)步骤④中,测定溶液的pH时,用洁净的玻璃棒蘸取待测液并滴到pH试纸中央,一段时间后应观察pH试纸湿润环的
 发生反应同时生成
发生反应同时生成 和
和 的离子方程式为
的离子方程式为 将
将 转化为
转化为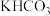 的原因为
的原因为(4)步骤⑤蒸发浓缩至
(5)测定产品纯度:准确称量m g产品(混有少量
 ),溶于水配成溶液、酸化,用c
),溶于水配成溶液、酸化,用c 
 标准溶液滴定,达到滴定终点时,消耗标准溶液的体积为V mL。标准溶液应盛放在(填“酸式”或“碱式”)
标准溶液滴定,达到滴定终点时,消耗标准溶液的体积为V mL。标准溶液应盛放在(填“酸式”或“碱式”) 的质量分数为
的质量分数为
您最近一年使用:0次
解题方法
10 . 硫脲 易溶于水,有较强的还原性,温度较高时能发生异构化,常用作橡胶促进剂和医药合成的原料.实验室先制备
易溶于水,有较强的还原性,温度较高时能发生异构化,常用作橡胶促进剂和医药合成的原料.实验室先制备 ,
, 再与
再与 反应制备硫脲,装置(夹持及加热装置略)如下图所示.
反应制备硫脲,装置(夹持及加热装置略)如下图所示.
(1)仪器a的名称为__________ ;试剂X为__________ 。
(2)关闭 、
、 ,打开
,打开 ,开启搅拌器,充分反应,装置C中发生的主要反应的离子方程式为
,开启搅拌器,充分反应,装置C中发生的主要反应的离子方程式为__________ 。
(3)关闭 ,打开
,打开 ,通入
,通入 一段时间,目的是
一段时间,目的是__________ 。
(4)关闭 ,撤走搅拌器,打开
,撤走搅拌器,打开 ,控制仪器a中温度为
,控制仪器a中温度为 发生反应,反应一段时间后,将反应混合物过滤后低温蒸发,减压过滤、洗涤,干燥,得粗产品.采用低温蒸发的原因为
发生反应,反应一段时间后,将反应混合物过滤后低温蒸发,减压过滤、洗涤,干燥,得粗产品.采用低温蒸发的原因为__________ ;为减少氧化,减压过滤和干燥时最好采用的仪器是__________ 。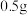 产品配成
产品配成 溶液,取
溶液,取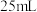 加入碘量瓶中,再加入
加入碘量瓶中,再加入 碘标准溶液和
碘标准溶液和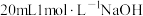 溶液,发生反应:
溶液,发生反应: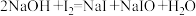 ;
;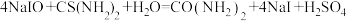 .充分反应后加稀硫酸至酸性,滴加两滴淀粉溶液,用
.充分反应后加稀硫酸至酸性,滴加两滴淀粉溶液,用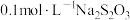 标准溶液滴定,发生反应:
标准溶液滴定,发生反应: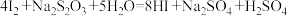 .至终点时消耗
.至终点时消耗 标准溶液
标准溶液 .达到滴定终点的现象为
.达到滴定终点的现象为__________ ;粗产品中硫脲的质量分数为__________ (用含V的代数式表示)。
 易溶于水,有较强的还原性,温度较高时能发生异构化,常用作橡胶促进剂和医药合成的原料.实验室先制备
易溶于水,有较强的还原性,温度较高时能发生异构化,常用作橡胶促进剂和医药合成的原料.实验室先制备 ,
, 再与
再与 反应制备硫脲,装置(夹持及加热装置略)如下图所示.
反应制备硫脲,装置(夹持及加热装置略)如下图所示.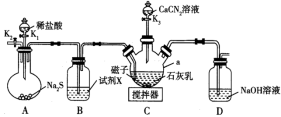
(1)仪器a的名称为
(2)关闭
 、
、 ,打开
,打开 ,开启搅拌器,充分反应,装置C中发生的主要反应的离子方程式为
,开启搅拌器,充分反应,装置C中发生的主要反应的离子方程式为(3)关闭
 ,打开
,打开 ,通入
,通入 一段时间,目的是
一段时间,目的是(4)关闭
 ,撤走搅拌器,打开
,撤走搅拌器,打开 ,控制仪器a中温度为
,控制仪器a中温度为 发生反应,反应一段时间后,将反应混合物过滤后低温蒸发,减压过滤、洗涤,干燥,得粗产品.采用低温蒸发的原因为
发生反应,反应一段时间后,将反应混合物过滤后低温蒸发,减压过滤、洗涤,干燥,得粗产品.采用低温蒸发的原因为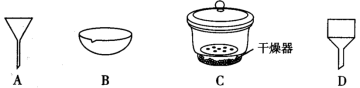
 产品配成
产品配成 溶液,取
溶液,取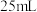 加入碘量瓶中,再加入
加入碘量瓶中,再加入 碘标准溶液和
碘标准溶液和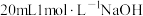 溶液,发生反应:
溶液,发生反应: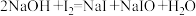 ;
;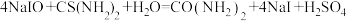 .充分反应后加稀硫酸至酸性,滴加两滴淀粉溶液,用
.充分反应后加稀硫酸至酸性,滴加两滴淀粉溶液,用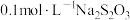 标准溶液滴定,发生反应:
标准溶液滴定,发生反应: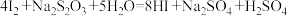 .至终点时消耗
.至终点时消耗 标准溶液
标准溶液 .达到滴定终点的现象为
.达到滴定终点的现象为
您最近一年使用:0次



