名校
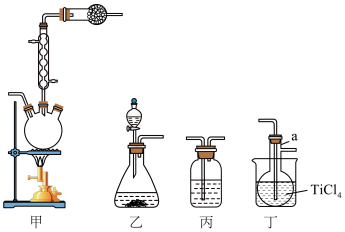
1 . 某校研究性学习小组设计实验,验证草酸受热分解的产物(草酸受热分解的化学方程式为: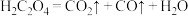 )。将草酸受热分解的产物依次通过以下装置:
)。将草酸受热分解的产物依次通过以下装置:
(1)草酸受热分解反应属于_______ (填“氧化还原”或“非氧化还原”)反应。
(2)A装置中无水硫酸铜变_______ 色,证明草酸分解产物之一为_______ 。
(3)B装置中的现象是_______ ,证明草酸分解的另一种产物为_______ 。
(4)C装置中浓硫酸的作用是_______ 。
(5)浓硫酸与碳反应的化学方程式为:_______
(6)金属铜与稀硝酸的反应方程式为:_______
(7)若制取标准状况下2.24LCO气体,至少需要草酸的质量为_______ g。
【实验讨论】
有些同学对上述实验判断草酸分解产物有CO的依据,持有不同看法:
①甲同学认为:D装置中CuO黑色变红色,可以证明草酸分解有CO生成。
②乙同学认为:E装置中澄清石灰水变浑浊,可以证明草酸分解有CO生成。
(8)你认为以上分析正确的同学是_______ (填“甲同学”或“乙同学”)。
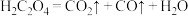 )。将草酸受热分解的产物依次通过以下装置:
)。将草酸受热分解的产物依次通过以下装置:
(1)草酸受热分解反应属于
(2)A装置中无水硫酸铜变
(3)B装置中的现象是
(4)C装置中浓硫酸的作用是
(5)浓硫酸与碳反应的化学方程式为:
(6)金属铜与稀硝酸的反应方程式为:
(7)若制取标准状况下2.24LCO气体,至少需要草酸的质量为
【实验讨论】
有些同学对上述实验判断草酸分解产物有CO的依据,持有不同看法:
①甲同学认为:D装置中CuO黑色变红色,可以证明草酸分解有CO生成。
②乙同学认为:E装置中澄清石灰水变浑浊,可以证明草酸分解有CO生成。
(8)你认为以上分析正确的同学是
您最近一年使用:0次
名校
解题方法
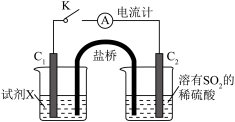
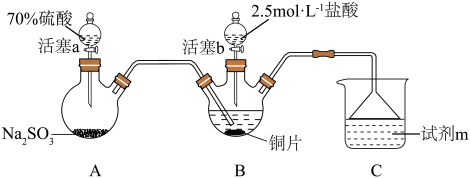
2 . 某小组按如下步骤探究二氧化硫与铜单质、Cu2+的反应:
ⅰ.按图示连接好装置。
ⅲ.关闭活塞b,打开活塞a.光亮的紫红色铜片很快变暗,并有黑色的Cu2S生成,同时溶液变为棕色,此时溶液中的铜元素以[CuCl3]2-(棕黄色)的形式存在。
ⅳ.静置后,取上层棕色的清液于试管中,加入一定量蒸馏水稀释,溶液中有白色沉淀CuCl析出。
(1)装置A中发生反应的化学方程式为___________ ,该反应中硫酸体现出的化学性质为___________ ;装置C的作用是___________ ,试剂m可选择___________ (填标号)。
a.饱和NaCl溶液 b.浓硫酸 c.NaOH浓溶液
(2)步骤ⅲ中,SO2在盐酸中与Cu反应的离子方程式为___________ ;步骤ⅳ中发生反应的离子方程式为[CuCl3]2-⇌CuCl↓+2Cl-,下列有关该反应的说法正确的是___________ (填标号)。
A.该反应中有电子的转移
B.反应经过足够长的时间后,[CuCl3]2-中的Cu元素能全部沉淀
C.溶液中,[CuCl3]2-和Cl-能同时存在
D.其他条件不变,当溶液的颜色不再改变时,表明该反应在该条件下达到最大限度
(3)在通风橱中利用如下装置进一步探究SO2与Cu2+的反应,盐桥(内有琼脂和饱和氯化钾溶液)用于连接两电极的电解质溶液。实验②中,闭合K后,C2电极上发生的电极反应为___________ ;不考虑其他副反应及Cu2+进入盐桥,实验②中,电路中转移0.02mole-时,左侧烧杯溶液中Cu2+的质量减少___________ g。
ⅰ.按图示连接好装置。
ⅲ.关闭活塞b,打开活塞a.光亮的紫红色铜片很快变暗,并有黑色的Cu2S生成,同时溶液变为棕色,此时溶液中的铜元素以[CuCl3]2-(棕黄色)的形式存在。
ⅳ.静置后,取上层棕色的清液于试管中,加入一定量蒸馏水稀释,溶液中有白色沉淀CuCl析出。
(1)装置A中发生反应的化学方程式为
a.饱和NaCl溶液 b.浓硫酸 c.NaOH浓溶液
(2)步骤ⅲ中,SO2在盐酸中与Cu反应的离子方程式为
A.该反应中有电子的转移
B.反应经过足够长的时间后,[CuCl3]2-中的Cu元素能全部沉淀
C.溶液中,[CuCl3]2-和Cl-能同时存在
D.其他条件不变,当溶液的颜色不再改变时,表明该反应在该条件下达到最大限度
(3)在通风橱中利用如下装置进一步探究SO2与Cu2+的反应,盐桥(内有琼脂和饱和氯化钾溶液)用于连接两电极的电解质溶液。实验②中,闭合K后,C2电极上发生的电极反应为
| 实验装置图 |
| ||
| 序号 | 试剂X | 实验现象 | |
| 电流计 | C1附近溶液 | ||
| ① | 0.1mol·L-1CuSO4溶液 | 指针几乎不偏转 | 无明显现象 |
| ② | 0.1mol·L-1NaCl和0.1mol·L-1CuSO4的混合溶液(足量) | 指针明显偏转 | 溶液变棕黄色 |
您最近一年使用:0次
解题方法
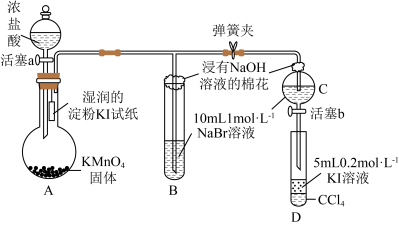
3 . 为证明卤族元素的非金属性强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检查)。
已知:①溴水呈黄色,而且颜色随浓度增大而加深。
② 容易从水中转移到
容易从水中转移到 中,导致下层(
中,导致下层( 层)因溶有
层)因溶有 显紫色。
显紫色。
实验过程:
①打开弹簧夹,打开活塞a,滴加浓盐酸。
②当B和C中的溶液都变为黄色时,夹紧弹簧夹。
③当B中溶液黄色加深时关闭活塞a。
④……
(1)NaOH的电子式为___________ 。
(2)A装置中制备氯气的离子方程式为___________ ,HCl的作用是做___________ 。
(3)B装置中主要反应的化学方程式为___________ 。
(4)为验证溴的氧化性强于碘,过程④的操作和现象分别是___________ 。
(5)过程③的实验目的是___________ 。
(6)结合元素周期表,从原子结构的角度解释氯、溴、碘单质的氧化性逐渐减弱的原因:___________ 。
(7)下列事实能说明元素Y的非金属性比硫元素强的是___________ 。
a.Y单质通入 溶液中,溶液出现淡黄色浑浊
溶液中,溶液出现淡黄色浑浊
b.与 反应时,1mol Y单质得到的电子比1mol S多
反应时,1mol Y单质得到的电子比1mol S多
c.Y和S的简单氢化物受热时,前者的分解温度较高
d.Y元素的氧化物对应水化物的酸性比S强
已知:①溴水呈黄色,而且颜色随浓度增大而加深。
②
 容易从水中转移到
容易从水中转移到 中,导致下层(
中,导致下层( 层)因溶有
层)因溶有 显紫色。
显紫色。实验过程:
①打开弹簧夹,打开活塞a,滴加浓盐酸。
②当B和C中的溶液都变为黄色时,夹紧弹簧夹。
③当B中溶液黄色加深时关闭活塞a。
④……
(1)NaOH的电子式为
(2)A装置中制备氯气的离子方程式为
(3)B装置中主要反应的化学方程式为
(4)为验证溴的氧化性强于碘,过程④的操作和现象分别是
(5)过程③的实验目的是
(6)结合元素周期表,从原子结构的角度解释氯、溴、碘单质的氧化性逐渐减弱的原因:
(7)下列事实能说明元素Y的非金属性比硫元素强的是
a.Y单质通入
 溶液中,溶液出现淡黄色浑浊
溶液中,溶液出现淡黄色浑浊b.与
 反应时,1mol Y单质得到的电子比1mol S多
反应时,1mol Y单质得到的电子比1mol S多c.Y和S的简单氢化物受热时,前者的分解温度较高
d.Y元素的氧化物对应水化物的酸性比S强
您最近一年使用:0次
名校
解题方法
4 . 硫酸是在工业生产中极为重要的一种化工产品,而硫酸的浓度不同,性质也会不同。现有甲、乙两研究小组分别进行了如下实验探究:
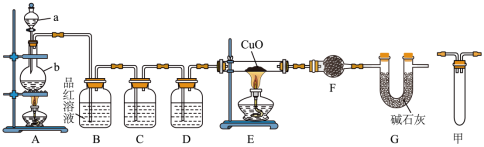
I.甲研究小组按下图装置进行实验,验证锌与浓硫酸反应生成物中的气体成分,取足量的Zn置于b中,向a中加入适量浓硫酸,经过一段时间的反应,Zn仍有剩余。_______ 。
(2)在反应初始阶段 ,装置A中发生的化学方程式为_______ 。
(3)装置C中若为酸性高锰酸钾溶液,则对应的离子方程式 为_____ 。
(4)装置G的名称为U形管,其作用为______ 。
(5)有同学认为A、B间应增加图中的甲装置,该装置的作用为______ 。
Ⅱ.乙研究小组为了利用稀硫酸制备CuSO4,进行了如下图所示的实验设计。
①2Fe3+ + Cu = 2Fe2+ + Cu2+
②∙∙∙∙∙∙
(6)反应②的离子方程式 为______ 。
(7)取CuSO4·5H2O晶体隔绝空气加热,剩余固体的质量随温度的变化如图所示,当达到120℃时,固体的成分为_______ 。
I.甲研究小组按下图装置进行实验,验证锌与浓硫酸反应生成物中的气体成分,取足量的Zn置于b中,向a中加入适量浓硫酸,经过一段时间的反应,Zn仍有剩余。
(2)在
(3)装置C中若为酸性高锰酸钾溶液,则对应的
(4)装置G的名称为U形管,其作用为
(5)有同学认为A、B间应增加图中的甲装置,该装置的作用为
Ⅱ.乙研究小组为了利用稀硫酸制备CuSO4,进行了如下图所示的实验设计。

①2Fe3+ + Cu = 2Fe2+ + Cu2+
②∙∙∙∙∙∙
(6)反应②的
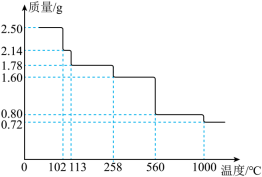
(7)取CuSO4·5H2O晶体隔绝空气加热,剩余固体的质量随温度的变化如图所示,当达到120℃时,固体的成分为
您最近一年使用:0次
解题方法
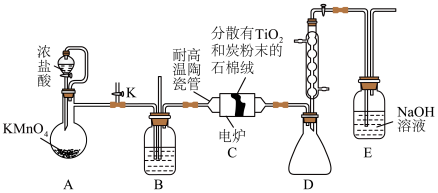
5 . 钛在医疗领域的应用非常广泛,如:制人造关节、主动心瓣等。实验室利用含杂质的二氧化钛做原料制取高纯度的二氧化钛,装置如图(夹持装置已略去)。
已知:① ;
;
② 为无色或淡黄色液体,熔点为-30℃,沸点为136.4℃,极易与水反应,能溶于有机溶剂,易挥发,与HCl不发生反应;
为无色或淡黄色液体,熔点为-30℃,沸点为136.4℃,极易与水反应,能溶于有机溶剂,易挥发,与HCl不发生反应;
③ 的盐酸溶液可吸收CO而生成黑色颗粒Pd;
的盐酸溶液可吸收CO而生成黑色颗粒Pd;
④ 在盐酸溶液中的存在形式为
在盐酸溶液中的存在形式为 。
。
a.制备
_______ (填序号)。
①先给陶瓷管通电加热,一段时间后,再打开分液漏斗活塞
②先打开分液漏斗活塞,一段时间后,再给陶瓷管通电加热
③先将陶瓷管断电停止加热,一段时间后,再关闭分液漏斗活塞
④先关闭分液漏斗活塞,一段时间后,再将陶瓷管断电停止加热
(2)装置B中盛放的试剂是_______ (填名称)。
(3)该实验设计存在的缺陷是_______ 、_______
(4)用 的盐酸溶液吸收CO的离子方程式为
的盐酸溶液吸收CO的离子方程式为_______ 。
(5)所得的 可用Mg制Ti,该过程可在
可用Mg制Ti,该过程可在_______ (填序号)氛围保护下进行。
①氮气 ②氩气 ③水蒸气 ④氧气
b. 气相氧化法制备
气相氧化法制备
_______ 。
(7)实验装置按从左到右的连接顺序为_______ 。
(8)写出装置甲三颈烧瓶内发生反应的化学方程式_______ 。
已知:①
 ;
;②
 为无色或淡黄色液体,熔点为-30℃,沸点为136.4℃,极易与水反应,能溶于有机溶剂,易挥发,与HCl不发生反应;
为无色或淡黄色液体,熔点为-30℃,沸点为136.4℃,极易与水反应,能溶于有机溶剂,易挥发,与HCl不发生反应;③
 的盐酸溶液可吸收CO而生成黑色颗粒Pd;
的盐酸溶液可吸收CO而生成黑色颗粒Pd;④
 在盐酸溶液中的存在形式为
在盐酸溶液中的存在形式为 。
。a.制备

①先给陶瓷管通电加热,一段时间后,再打开分液漏斗活塞
②先打开分液漏斗活塞,一段时间后,再给陶瓷管通电加热
③先将陶瓷管断电停止加热,一段时间后,再关闭分液漏斗活塞
④先关闭分液漏斗活塞,一段时间后,再将陶瓷管断电停止加热
(2)装置B中盛放的试剂是
(3)该实验设计存在的缺陷是
(4)用
 的盐酸溶液吸收CO的离子方程式为
的盐酸溶液吸收CO的离子方程式为(5)所得的
 可用Mg制Ti,该过程可在
可用Mg制Ti,该过程可在①氮气 ②氩气 ③水蒸气 ④氧气
b.
 气相氧化法制备
气相氧化法制备
(7)实验装置按从左到右的连接顺序为
(8)写出装置甲三颈烧瓶内发生反应的化学方程式
您最近一年使用:0次
名校
6 . 含硫石油、煤、天然气的燃烧,硫化矿石的熔炼和焙烧,及各种含硫原料的加工生产过程等均能产生二氧化硫。
(1)画出硫原子的原子结构示意图_______ 。
(2)实验室常用亚硫酸钠固体和70%的浓硫酸反应制取二氧化硫,该反应的化学方程式_______ ;用该方法制备 时,能随时控制反应速率的装置是
时,能随时控制反应速率的装置是_______ (填标号),原因是_______ 。 的含量,某小组同学将空气样品经过管道通入盛有
的含量,某小组同学将空气样品经过管道通入盛有 酸性
酸性 溶液的密闭容器中,若管道中空气流量为
溶液的密闭容器中,若管道中空气流量为 ,经过
,经过 恰好使酸性
恰好使酸性 溶液完全褪色(假定样品中的
溶液完全褪色(假定样品中的 可被溶液充分吸收且样品中其他成分不与
可被溶液充分吸收且样品中其他成分不与 反应)。
反应)。
①写出上述反应的离子方程式_______ 。
②该空气样品中 的含量为
的含量为_______  。
。
(4)为了减少二氧化硫产生的危害,可以采取的措施是_______ 。
(1)画出硫原子的原子结构示意图
(2)实验室常用亚硫酸钠固体和70%的浓硫酸反应制取二氧化硫,该反应的化学方程式
 时,能随时控制反应速率的装置是
时,能随时控制反应速率的装置是A. B.
B. C.
C. D.
D.
 的含量,某小组同学将空气样品经过管道通入盛有
的含量,某小组同学将空气样品经过管道通入盛有 酸性
酸性 溶液的密闭容器中,若管道中空气流量为
溶液的密闭容器中,若管道中空气流量为 ,经过
,经过 恰好使酸性
恰好使酸性 溶液完全褪色(假定样品中的
溶液完全褪色(假定样品中的 可被溶液充分吸收且样品中其他成分不与
可被溶液充分吸收且样品中其他成分不与 反应)。
反应)。①写出上述反应的离子方程式
②该空气样品中
 的含量为
的含量为 。
。(4)为了减少二氧化硫产生的危害,可以采取的措施是
您最近一年使用:0次
名校
7 . 某化学小组欲测定 与
与 反应的化学反应速率,并探究影响其化学反应速率的因素,请回答下列问题:
反应的化学反应速率,并探究影响其化学反应速率的因素,请回答下列问题:
Ⅰ.该小组同学设计了3组实验,探究影响化学反应速率的部分因素,具体情况如表所示.
(1)表中
__________ ,通过实验1和实验3可探究___________ 对化学反应速率的影响.
(2)写出 与
与 反应的离子方程式:
反应的离子方程式:___________
Ⅱ.该小组同学依据实验1的条件进行反应并测定其化学反应速率,所得数据如图所示. 的化学反应速率
的化学反应速率 为
为_______________ .
分析实验数据发现,反应过程中该反应的化学反应速率先增大后减小,探究化学反应速率先增大的原因,具体情况如表所示.
(4)补全方案1中的实验操作_________________ 。
(5)方案2中的假设为__________________ .
(6)除方案1、2中的假设外,还可提出的假设是____________________ .
(7)反应后期化学反应速率减小的原因是__________________ .
 与
与 反应的化学反应速率,并探究影响其化学反应速率的因素,请回答下列问题:
反应的化学反应速率,并探究影响其化学反应速率的因素,请回答下列问题:Ⅰ.该小组同学设计了3组实验,探究影响化学反应速率的部分因素,具体情况如表所示.
| 实验编号 | 加入 溶液的体积 溶液的体积 | 加入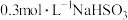 溶液的体积 溶液的体积 | 加入水的体积 | 反应温度 |
| 1 | 10 | 10 | 0 |  |
| 2 | 10 | 5 | a |  |
| 3 | 10 | 10 | 0 |  |
(1)表中

(2)写出
 与
与 反应的离子方程式:
反应的离子方程式:Ⅱ.该小组同学依据实验1的条件进行反应并测定其化学反应速率,所得数据如图所示.

 的化学反应速率
的化学反应速率 为
为分析实验数据发现,反应过程中该反应的化学反应速率先增大后减小,探究化学反应速率先增大的原因,具体情况如表所示.
| 方案 | 假设 | 实验操作 |
| 1 | 该反应放热,使溶液温度升高,化学反应速率加快 | 向烧杯中加入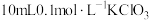 溶液和 溶液和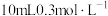 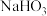 溶液,_________________ 溶液,_________________ |
| 2 | 取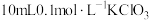 溶液加入烧杯中,向其中加入少量 溶液加入烧杯中,向其中加入少量 固体,再加入 固体,再加入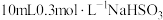 溶液. 溶液. |
(4)补全方案1中的实验操作
(5)方案2中的假设为
(6)除方案1、2中的假设外,还可提出的假设是
(7)反应后期化学反应速率减小的原因是
您最近一年使用:0次
名校
解题方法
8 . 某课外活动小组在实验室制备氨气、验证氨气的某些性质。
Ⅰ.氨气的制备
(1)图中三套装置中能制备干燥NH3的装置和发生的化学方程式分别是____ 。_____ 。
(3)B中试剂为___________ ,NaOH溶液的作用是___________ 。
(4)控制氨气和氧气的比例是制备硝酸的关键。
①当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟。红棕色气体的化学式是___________ ,白烟的化学式是___________ 。
②欲使氨气尽可能完全转化为硝酸,理论上n(NH3):n(O2)的最佳比例为___________ 。
Ⅰ.氨气的制备
(1)图中三套装置中能制备干燥NH3的装置和发生的化学方程式分别是


(3)B中试剂为
(4)控制氨气和氧气的比例是制备硝酸的关键。
①当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟。红棕色气体的化学式是
②欲使氨气尽可能完全转化为硝酸,理论上n(NH3):n(O2)的最佳比例为
您最近一年使用:0次
解题方法
9 . Ⅰ.铁及其化合物在生产生活中有极其重要的用途。 可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将
可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将 转化为
转化为 ,以利于人体吸收。为了验证这一猜想,设计了如下实验:
,以利于人体吸收。为了验证这一猜想,设计了如下实验:
(1)由上述实验能否得出“维生素C可将 转化为
转化为 ”的结论?请说明理由:
”的结论?请说明理由:______ 。
Ⅱ.高铁酸钾( )是一种高效多功能的新型非氯绿色消毒剂,为暗紫色有光泽粉末,极易溶于水而形成暗紫色溶液,静置后会分解并释放出大量氧气,同时生成KOH和
)是一种高效多功能的新型非氯绿色消毒剂,为暗紫色有光泽粉末,极易溶于水而形成暗紫色溶液,静置后会分解并释放出大量氧气,同时生成KOH和 胶体。工业上常用于制备高铁酸钾的方法有电解法、次氯酸盐氧化法和熔融法等。
胶体。工业上常用于制备高铁酸钾的方法有电解法、次氯酸盐氧化法和熔融法等。
(2)熔融法:在苛性碱存在的环境中,铁盐被过氧化钠高温氧化成高铁酸钠: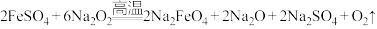 ,再加入适量饱和KOH溶液反应得到
,再加入适量饱和KOH溶液反应得到 。上述反应在熔融状态下进行,而不在水溶液中进行的原因是
。上述反应在熔融状态下进行,而不在水溶液中进行的原因是______ 。
(3)高铁酸钾可通过次氯酸钾氧化 溶液来制备。次氯酸钾的制备装置如图所示。
溶液来制备。次氯酸钾的制备装置如图所示。
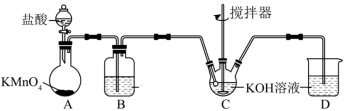
回答下列问题:
①装置A中 与盐酸反应生成
与盐酸反应生成 和
和 ,其化学方程式为
,其化学方程式为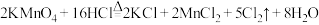 。
。
a.请用双线桥法标出电子转移方向与数目_______ 。
b.上述反应中的HCl体现了什么性质?_______ 。
②将制备的 通过装置B可除去杂质HCl,B中的溶液为
通过装置B可除去杂质HCl,B中的溶液为_____ 。
③ 和KOH溶液在较高温度下反应生成
和KOH溶液在较高温度下反应生成 。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是
。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是______ 。
④若实验制得的次氯酸钾溶液中 (N代表微粒个数),则
(N代表微粒个数),则
_______ 。
⑤装置D的作用是_______ 。
⑥次氯酸盐氧化法是在碱性条件下,KClO饱和溶液可将 转化为
转化为 ,写出反应的离子方程式:
,写出反应的离子方程式:________ 。
 可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将
可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将 转化为
转化为 ,以利于人体吸收。为了验证这一猜想,设计了如下实验:
,以利于人体吸收。为了验证这一猜想,设计了如下实验:| 实验方案 | 实验现象 |
取适量 溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液 溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液 | 紫色褪去 |
(1)由上述实验能否得出“维生素C可将
 转化为
转化为 ”的结论?请说明理由:
”的结论?请说明理由:Ⅱ.高铁酸钾(
 )是一种高效多功能的新型非氯绿色消毒剂,为暗紫色有光泽粉末,极易溶于水而形成暗紫色溶液,静置后会分解并释放出大量氧气,同时生成KOH和
)是一种高效多功能的新型非氯绿色消毒剂,为暗紫色有光泽粉末,极易溶于水而形成暗紫色溶液,静置后会分解并释放出大量氧气,同时生成KOH和 胶体。工业上常用于制备高铁酸钾的方法有电解法、次氯酸盐氧化法和熔融法等。
胶体。工业上常用于制备高铁酸钾的方法有电解法、次氯酸盐氧化法和熔融法等。(2)熔融法:在苛性碱存在的环境中,铁盐被过氧化钠高温氧化成高铁酸钠:
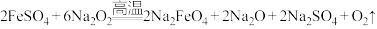 ,再加入适量饱和KOH溶液反应得到
,再加入适量饱和KOH溶液反应得到 。上述反应在熔融状态下进行,而不在水溶液中进行的原因是
。上述反应在熔融状态下进行,而不在水溶液中进行的原因是(3)高铁酸钾可通过次氯酸钾氧化
 溶液来制备。次氯酸钾的制备装置如图所示。
溶液来制备。次氯酸钾的制备装置如图所示。
回答下列问题:
①装置A中
 与盐酸反应生成
与盐酸反应生成 和
和 ,其化学方程式为
,其化学方程式为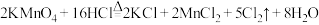 。
。a.请用双线桥法标出电子转移方向与数目
b.上述反应中的HCl体现了什么性质?
②将制备的
 通过装置B可除去杂质HCl,B中的溶液为
通过装置B可除去杂质HCl,B中的溶液为③
 和KOH溶液在较高温度下反应生成
和KOH溶液在较高温度下反应生成 。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是
。在不改变KOH溶液的浓度和体积的条件下,控制反应在0℃~5℃进行,实验中可采取的措施是④若实验制得的次氯酸钾溶液中
 (N代表微粒个数),则
(N代表微粒个数),则
⑤装置D的作用是
⑥次氯酸盐氧化法是在碱性条件下,KClO饱和溶液可将
 转化为
转化为 ,写出反应的离子方程式:
,写出反应的离子方程式:
您最近一年使用:0次
名校
解题方法
10 . 卤素单质及其化合物在科研和工农业生产中有着广泛的应用。
Ⅰ.某课小组在实验室模拟工业上以浓缩海水为原料提取溴的过程,设计了以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去)
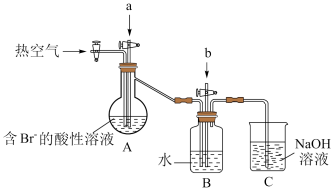
(1)反应过程中, 装置中
装置中 与
与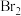 发生反应的化学方程式:
发生反应的化学方程式:______ 。
(2)C装置的作用是______ 。
(3)下列实验操作正确的顺序应为______ (填序号)
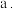 通入热空气
通入热空气 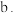 从
从 口通入
口通入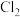
 从
从 口通入
口通入
(4)为提取 装置中的溴元素进行如下实验:向反应后
装置中的溴元素进行如下实验:向反应后 装置的溶液中通入氯气,充分反应得到混合液。再加入
装置的溶液中通入氯气,充分反应得到混合液。再加入 ,充分振荡、静置,待分层后,
,充分振荡、静置,待分层后,______ (将实验操作补充完整)。
Ⅱ.卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,一氯化碘 是一种卤素互化物,它与
是一种卤素互化物,它与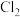 结构相似,性质相近。请回答下列问题:
结构相似,性质相近。请回答下列问题:
(5) 的电子式为
的电子式为______ 。
(6)某学习小组在实验室中拟用如图装置制取纯净、干燥的氯气,并利用氯气与碘反应制备一氯化碘。

查阅资料了解到以下内容:
ⅰ.碘与氯气的反应为放热反应
ⅱ. 是一种红棕色液体,沸点
是一种红棕色液体,沸点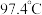 ,遇水反应。
,遇水反应。
①各装置连接顺序为______ 。
 ______→______→______→______。
______→______→______→______。
②B装置烧瓶需放在冷水中,其目的是:______ 。
③ 与稀
与稀 溶液可发生非氧化还原反应,请写出该反应的离子方程式
溶液可发生非氧化还原反应,请写出该反应的离子方程式______ 。
Ⅰ.某课小组在实验室模拟工业上以浓缩海水为原料提取溴的过程,设计了以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去)

(1)反应过程中,
 装置中
装置中 与
与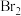 发生反应的化学方程式:
发生反应的化学方程式:(2)C装置的作用是
(3)下列实验操作正确的顺序应为
 通入热空气
通入热空气  从
从 口通入
口通入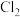
 从
从 口通入
口通入
(4)为提取
 装置中的溴元素进行如下实验:向反应后
装置中的溴元素进行如下实验:向反应后 装置的溶液中通入氯气,充分反应得到混合液。再加入
装置的溶液中通入氯气,充分反应得到混合液。再加入 ,充分振荡、静置,待分层后,
,充分振荡、静置,待分层后,Ⅱ.卤素互化物是指不同卤素原子之间以共价键结合形成的化合物,一氯化碘
 是一种卤素互化物,它与
是一种卤素互化物,它与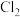 结构相似,性质相近。请回答下列问题:
结构相似,性质相近。请回答下列问题:(5)
 的电子式为
的电子式为(6)某学习小组在实验室中拟用如图装置制取纯净、干燥的氯气,并利用氯气与碘反应制备一氯化碘。

查阅资料了解到以下内容:
ⅰ.碘与氯气的反应为放热反应
ⅱ.
 是一种红棕色液体,沸点
是一种红棕色液体,沸点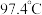 ,遇水反应。
,遇水反应。①各装置连接顺序为
 ______→______→______→______。
______→______→______→______。②B装置烧瓶需放在冷水中,其目的是:
③
 与稀
与稀 溶液可发生非氧化还原反应,请写出该反应的离子方程式
溶液可发生非氧化还原反应,请写出该反应的离子方程式
您最近一年使用:0次