三氯化六氨合钴( )是一种重要的化工产品。实验室以
)是一种重要的化工产品。实验室以 为原料制备三氯六氨合钴的方法如下,回答下列问题:
为原料制备三氯六氨合钴的方法如下,回答下列问题:
Ⅰ.制备氯化钴:已知 易潮解,可用高熔点金属钴与氯气反应制取。实验室可用下图装置进行制备
易潮解,可用高熔点金属钴与氯气反应制取。实验室可用下图装置进行制备_____ 。
(2)A中固体为高锰酸钾,则反应的离子方程式为______ 。装置B中试剂X为____ 。
(3)球形干燥管中试剂的作用为______ 。
Ⅱ.制备三氯化六氨合钴:将制备的 按下图流程操作:
按下图流程操作:____ 。
(5)利用 、
、 、浓氨水、
、浓氨水、 制备
制备 的总反应化学方程式
的总反应化学方程式___ 。
(6)操作X中,加入浓盐酸的作用是____ 。
Ⅲ.测定钴含量:准确称量3.0000g样品 ,加入硫酸酸化的KI溶液至样品恰好完全溶解,配成250mL溶液。量取25.00mL溶液,加入适量缓冲溶液,几滴淀粉溶液,用0.1000mol/L
,加入硫酸酸化的KI溶液至样品恰好完全溶解,配成250mL溶液。量取25.00mL溶液,加入适量缓冲溶液,几滴淀粉溶液,用0.1000mol/L  溶液滴定生成的
溶液滴定生成的 ,消耗
,消耗 溶液的体积为10.00mL。
溶液的体积为10.00mL。
(已知:① 将
将 氧化成
氧化成 ,自身被还原成
,自身被还原成 ;②
;② )。
)。
(7)计算样品中钴元素的质量分数为_______ %(保留至小数点后两位)。
 )是一种重要的化工产品。实验室以
)是一种重要的化工产品。实验室以 为原料制备三氯六氨合钴的方法如下,回答下列问题:
为原料制备三氯六氨合钴的方法如下,回答下列问题:Ⅰ.制备氯化钴:已知
 易潮解,可用高熔点金属钴与氯气反应制取。实验室可用下图装置进行制备
易潮解,可用高熔点金属钴与氯气反应制取。实验室可用下图装置进行制备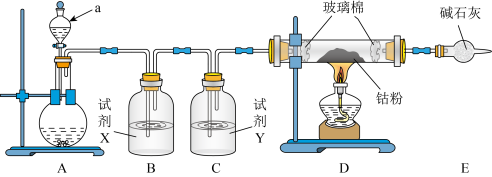
(2)A中固体为高锰酸钾,则反应的离子方程式为
(3)球形干燥管中试剂的作用为
Ⅱ.制备三氯化六氨合钴:将制备的
 按下图流程操作:
按下图流程操作:
(5)利用
 、
、 、浓氨水、
、浓氨水、 制备
制备 的总反应化学方程式
的总反应化学方程式(6)操作X中,加入浓盐酸的作用是
Ⅲ.测定钴含量:准确称量3.0000g样品
 ,加入硫酸酸化的KI溶液至样品恰好完全溶解,配成250mL溶液。量取25.00mL溶液,加入适量缓冲溶液,几滴淀粉溶液,用0.1000mol/L
,加入硫酸酸化的KI溶液至样品恰好完全溶解,配成250mL溶液。量取25.00mL溶液,加入适量缓冲溶液,几滴淀粉溶液,用0.1000mol/L  溶液滴定生成的
溶液滴定生成的 ,消耗
,消耗 溶液的体积为10.00mL。
溶液的体积为10.00mL。(已知:①
 将
将 氧化成
氧化成 ,自身被还原成
,自身被还原成 ;②
;② )。
)。(7)计算样品中钴元素的质量分数为
更新时间:2024-05-19 19:14:14
|
相似题推荐
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐1】短周期元素W、X、Y、Z、M原子序数依次增大,元素W的一种核素的中子数为0,X的原子最外层电子数是次外层的2倍,Z与M同主族,Z2-电子层结构与氖原子相同。
(1)M在元素周期表中的位置是__________________________ 。
(2)化合物p由W、X、Y、M四种元素组成。已知向p溶液中加入FeCl3溶液,溶液变血红色;向p溶液中加入NaOH溶液并加热可放出使湿润的红色石蕊试纸变蓝的气体。p的化学式为_____________ 。
(3)由X、Y、Z三种元素可组成摩尔质量为84g·mol-1的物质q,且q分子中三种元素的原子个数之比为1:1:1。已知q分子中各原子均达到8电子稳定结构,且分子中不含双键,但含极性键和非极性键,q分子的结构式为_____________________ 。
(4)(XY)2的性质与Cl2相似,(XY)2与NaOH溶液常温下反应的离子方程式为________ 。
(5)常温下,1molZ3能与Y的最简单氢化物反应,生成一种常见的盐和1molZ2,该反应的化学方程式为____________________________________________ 。
(1)M在元素周期表中的位置是
(2)化合物p由W、X、Y、M四种元素组成。已知向p溶液中加入FeCl3溶液,溶液变血红色;向p溶液中加入NaOH溶液并加热可放出使湿润的红色石蕊试纸变蓝的气体。p的化学式为
(3)由X、Y、Z三种元素可组成摩尔质量为84g·mol-1的物质q,且q分子中三种元素的原子个数之比为1:1:1。已知q分子中各原子均达到8电子稳定结构,且分子中不含双键,但含极性键和非极性键,q分子的结构式为
(4)(XY)2的性质与Cl2相似,(XY)2与NaOH溶液常温下反应的离子方程式为
(5)常温下,1molZ3能与Y的最简单氢化物反应,生成一种常见的盐和1molZ2,该反应的化学方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】氯气是一种重要的化工原料;可用于制备许多化合物。现用下图装置制取氯气并以氯气为原料制备其他物质。
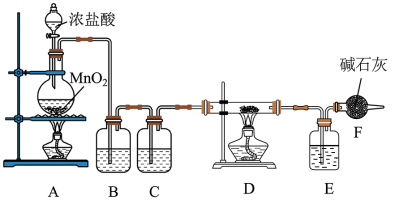
回答下列问题:
(1)装置A中圆底烧瓶内发生反应的离子方程式是___________ 。反应中HCl体现的性质是___________ 。
(2)若用D装置使氯气与铁粉反应制取少量氯化铁固体( 易吸水,在
易吸水,在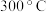 时升华),则:
时升华),则:
①装置B内盛装试剂为___________ ,作用是___________ 。
②装置C内盛装试剂为___________ 。
③D、E间导管短且粗的原因是___________ 。
④F装置的作用是___________ 。
(3)已知氯气与浓的NaOH溶液在加热条件下会生成 和NaCl,请写出该反应方程式:
和NaCl,请写出该反应方程式:___________ 。

回答下列问题:
(1)装置A中圆底烧瓶内发生反应的离子方程式是
(2)若用D装置使氯气与铁粉反应制取少量氯化铁固体(
 易吸水,在
易吸水,在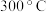 时升华),则:
时升华),则:①装置B内盛装试剂为
②装置C内盛装试剂为
③D、E间导管短且粗的原因是
④F装置的作用是
(3)已知氯气与浓的NaOH溶液在加热条件下会生成
 和NaCl,请写出该反应方程式:
和NaCl,请写出该反应方程式:
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】2019年6月5日美国商务部表示,美方将采取“空前行动”,确保对科技业和军方极其关键的战略性矿物及稀土供应无虞。我国稀土出口量世界第一。以氟碳铈矿(主要含CeFCO3,少量其他稀土盐LnFCO3、非稀土元素Fe、Al、Mg和SiO2等)为原料制备CeO2的一种工艺流程如图所示:

(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是_________________________________ 。“氧化焙烧”时,CeFCO3和其他稀土盐LnFCO3分别转化为CeO2和Ln2O3,请写出生成的CeO2化学方程式为:________________________ 。
(2)“氯化”过程的目的是将CeO2和Ln2O3分别转化为可溶性的CeCl3和LnCl3,除去Fe2O3、Al2O3、MgO、SiO2等杂质。若溶液中c(Ce3+)=0.01mol/L,为确保不析出Ce(OH)3沉淀,则溶液的pH________ (填pH的范围)。(已知Ksp[Ce(OH)3=1.0×10-20])
(3)CeO2和Ln2O3混合物中加入稀盐酸,Ln2O3溶解生成LnOCl的化学方程式为:___________________________________________________ 。
(4)化工生产条件的选择:
①“氯化”条件的选择
将氧化焙烧后氟碳铈矿和氯化铵按1:3、1:4、1:5、1:6、1:7质量比混合,在325℃下真空焙烧60min。稀土矿氧化物转化成稀土氯化物的氯化率如图所示:

氧化焙烧后氟碳铈矿和氯化铵的最佳质量比为________ 。
②“氧化”条件的选择
氧化过程中,反应温度、反应时间对混合稀土氯化物氧化率的关系如图所示:
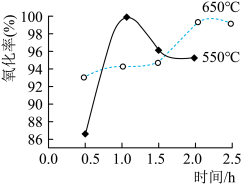
最佳温度和时间是_________ ,原因是_________________________________________ 。
(5)取上述流程中得到的CeO2产品0.4500g,加硫酸溶解后,用0.1000mol•L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其它杂质均不反应),消耗25.00mL标准溶液.该产品中CeO2的质量分数为___________ 。

(1)“氧化焙烧”前需将矿石粉碎成细颗粒,其目的是
(2)“氯化”过程的目的是将CeO2和Ln2O3分别转化为可溶性的CeCl3和LnCl3,除去Fe2O3、Al2O3、MgO、SiO2等杂质。若溶液中c(Ce3+)=0.01mol/L,为确保不析出Ce(OH)3沉淀,则溶液的pH
(3)CeO2和Ln2O3混合物中加入稀盐酸,Ln2O3溶解生成LnOCl的化学方程式为:
(4)化工生产条件的选择:
①“氯化”条件的选择
将氧化焙烧后氟碳铈矿和氯化铵按1:3、1:4、1:5、1:6、1:7质量比混合,在325℃下真空焙烧60min。稀土矿氧化物转化成稀土氯化物的氯化率如图所示:

氧化焙烧后氟碳铈矿和氯化铵的最佳质量比为
②“氧化”条件的选择
氧化过程中,反应温度、反应时间对混合稀土氯化物氧化率的关系如图所示:

最佳温度和时间是
(5)取上述流程中得到的CeO2产品0.4500g,加硫酸溶解后,用0.1000mol•L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+,其它杂质均不反应),消耗25.00mL标准溶液.该产品中CeO2的质量分数为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅的过程如下:
I.高温下用过量的碳还原二氧化硅制得粗硅;
II.粗硅与干燥的HCl气体反应制得SiHCl3(Si+3HCl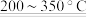 SiHCl3+H2);
SiHCl3+H2);
III.SiHCl3与过量的H2在1100~1200℃的温度下反应制得纯硅,已知SiHCl3能与水剧烈反应。
(1)第一步用焦炭与石英砂制取粗硅,其反应的化学方程式为_______ ;上述反应中的氧化剂是_______ ,还原剂是_______ 。
(2)粗硅与HCl气体反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为_______ 。
(3)实验室用SiHCl3与过量的H2反应制取纯硅装置如图所示(加热和夹持装置略去):

①装置B中的试剂是_______ ,装置C中的烧杯需要加热,目的是_______ 。
②反应一段时间后,装置D中观察到的现象是_______ ,装置D不能采用普通玻璃管的原因是_______ ,装置D中发生反应的化学方程式是_______ 。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及_____ 。
I.高温下用过量的碳还原二氧化硅制得粗硅;
II.粗硅与干燥的HCl气体反应制得SiHCl3(Si+3HCl
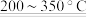 SiHCl3+H2);
SiHCl3+H2);III.SiHCl3与过量的H2在1100~1200℃的温度下反应制得纯硅,已知SiHCl3能与水剧烈反应。
(1)第一步用焦炭与石英砂制取粗硅,其反应的化学方程式为
(2)粗硅与HCl气体反应完全后,经冷凝得到的SiHCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiHCl3采用的方法为
(3)实验室用SiHCl3与过量的H2反应制取纯硅装置如图所示(加热和夹持装置略去):

①装置B中的试剂是
②反应一段时间后,装置D中观察到的现象是
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】醋酸亚铬水合物{[Cr(CH3COO)2]2•2H2O,相对分子质量为376}是一种深红色晶体,不溶于冷水,是常用的氧气吸收剂。实验室中以锌粒、三氯化铬溶液、醋酸钠溶液和盐酸为主要原料制备醋酸亚铬水合物,其装置如右图所示,且仪器2中预先加入锌粒.已知二价铬不稳定,极易被氧气氧化,不与锌反应。制备过程中发生的相关反应如下:
Zn(s)+2HCl(aq)═ZnCl2(aq)+H2(g)
2CrCl3(aq)+Zn(s)═2CrCl2(aq)+ZnCl2(aq)
2Cr2+(aq)+4CH3COO-(aq)+2H2O(l)═[Cr(CH3COO)2]2•2H2O(s)
请回答下列问题:
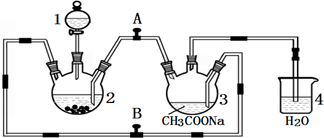
(1)仪器1的名称是_____________ 。
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是_____________ (选下面的A、B或C);目的是_____________ 。
A.盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液一段时间后再加盐酸
C.先加盐酸一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应关闭阀门_____________ (填“A”或“B”,下同),打开阀门_____________ 。
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与CH3COONa溶液反应外,另一个作用是_____________ 。
(5)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[Cr(CH3COO)2]2•2H2O 9.4g,则该实验所得产品的产率为_____________ (不考虑溶解的醋酸亚铬水合物)。
(6)铬的离子会污染水,常温下要除去上述实验中多余的Cr2+,最好往废液中通入足量的_____________ ,再加入碱液,调节pH至少为_____________ 才能使铬的离子沉淀完全(铬的离子浓度应小于10-5mol/L)。已知Cr(OH)3的溶度积为6.3×10-31,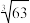 ≈4,lg2≈0.3
≈4,lg2≈0.3
Zn(s)+2HCl(aq)═ZnCl2(aq)+H2(g)
2CrCl3(aq)+Zn(s)═2CrCl2(aq)+ZnCl2(aq)
2Cr2+(aq)+4CH3COO-(aq)+2H2O(l)═[Cr(CH3COO)2]2•2H2O(s)
请回答下列问题:

(1)仪器1的名称是
(2)往仪器2中加盐酸和三氯化铬溶液的顺序最好是
A.盐酸和三氯化铬溶液同时加入
B.先加三氯化铬溶液一段时间后再加盐酸
C.先加盐酸一段时间后再加三氯化铬溶液
(3)为使生成的CrCl2溶液与CH3COONa溶液顺利混合,应关闭阀门
(4)本实验中锌粒要过量,其原因除了让产生的H2将CrCl2溶液压入装置3与CH3COONa溶液反应外,另一个作用是
(5)已知其它反应物足量,实验时取用的CrCl3溶液中含溶质9.51g,取用的醋酸钠溶液为1.5L0.1mol/L;实验后得干燥纯净的[Cr(CH3COO)2]2•2H2O 9.4g,则该实验所得产品的产率为
(6)铬的离子会污染水,常温下要除去上述实验中多余的Cr2+,最好往废液中通入足量的
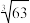 ≈4,lg2≈0.3
≈4,lg2≈0.3
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】水合肼(N2H4·H2O)又称水合联氨,为无色透明的油状液体。有淡氨味,常用作火箭燃料、医药等,实验室可用次氯酸钠氨化法制备。回答下列问题:
(1)将氨气通入次氯酸钠溶液中,在一定条件进行反应得水合肼混合溶液,经除氨、蒸发脱盐和蒸馏可得水合肼。写出上述反应的化学方程式:_______ 。
(2)制取氨气不可选择下图中的_______ 装置(填字母)。。

(3)制备NaClO溶液(受热易分解)实验如下:
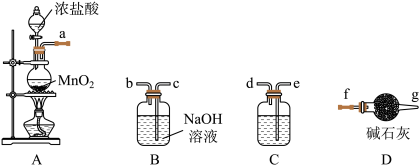
①C是除杂装置,应盛装的试剂为_______ ;仪器的连接顺序为a→_______ 。
②A中发生反应的离子方程式为_______ 。
③若Cl2与NaOH溶液反应温度过高,NaClO的产率将_______ (填“增大“减小”或“不变")。
(1)将氨气通入次氯酸钠溶液中,在一定条件进行反应得水合肼混合溶液,经除氨、蒸发脱盐和蒸馏可得水合肼。写出上述反应的化学方程式:
(2)制取氨气不可选择下图中的

(3)制备NaClO溶液(受热易分解)实验如下:

①C是除杂装置,应盛装的试剂为
②A中发生反应的离子方程式为
③若Cl2与NaOH溶液反应温度过高,NaClO的产率将
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】过氧乙酸(含有少量 杂质)的含量测定流程如图。
杂质)的含量测定流程如图。

(1)判断 恰好除尽的实验现象是
恰好除尽的实验现象是_______ 。
(2)过氧乙酸被 还原,还原产物之一为乙酸,其离子方程式为
还原,还原产物之一为乙酸,其离子方程式为_______ 。
(3)若样品体积为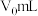 ,加入
,加入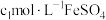 溶液
溶液 ,消耗
,消耗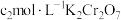 溶液
溶液 。则过氧乙酸的含量为
。则过氧乙酸的含量为_______  。
。
 杂质)的含量测定流程如图。
杂质)的含量测定流程如图。
(1)判断
 恰好除尽的实验现象是
恰好除尽的实验现象是(2)过氧乙酸被
 还原,还原产物之一为乙酸,其离子方程式为
还原,还原产物之一为乙酸,其离子方程式为(3)若样品体积为
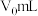 ,加入
,加入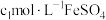 溶液
溶液 ,消耗
,消耗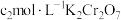 溶液
溶液 。则过氧乙酸的含量为
。则过氧乙酸的含量为 。
。
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】欲用浓硝酸法(测定反应后生成气体的量)测定某铜银合金中铜的质量分数,但资料表明:①反应中除生成NO2气体外还会有少量的NO生成;②常温下NO2和N2O4混合存在,在低于0℃时几乎只有无色的N2O4液体或晶体存在。为完成测定并验证确有NO生成,有人设计如图所示的实验装置。
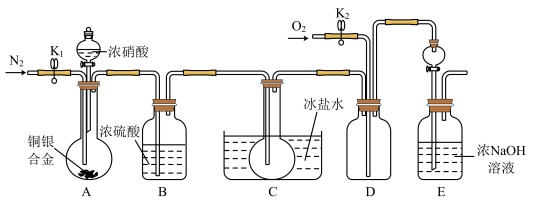
(1)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是___________ 。
(2)写出A瓶中Cu与硝酸可能反应的离子方程式___________ 。
(3)装置中B瓶的作用是___________ 。
(4)A中的反应停止后,打开D中的活塞K2,并通入氧气,若反应确有NO产生,则D中应出现的现象是___________ 。
(5)为减少测量误差,在A中反应完成和D中出现现象后,还应继续进行的操作是___________ 。
(6)C装置烧瓶中的物质是___________ ,用简单的实验证实你的判断:___________ 。
(7)实验已测出一定质量的铜银合金完全反应后E装置的生成物中含氮元素的质量,为确定合金中铜的质量分数还需测定的数据是___________ 。
(8)若实验只测定Cu的质量分数,不验证NO的产生,则在铜银合金与浓硝酸反应后,只需简单的实验操作就可以达到目的,请简述实验过程:___________ 。

(1)实验开始前要先打开A部分的活塞K1,持续通一段时间的氮气再关闭K1,这样做的目的是
(2)写出A瓶中Cu与硝酸可能反应的离子方程式
(3)装置中B瓶的作用是
(4)A中的反应停止后,打开D中的活塞K2,并通入氧气,若反应确有NO产生,则D中应出现的现象是
(5)为减少测量误差,在A中反应完成和D中出现现象后,还应继续进行的操作是
(6)C装置烧瓶中的物质是
(7)实验已测出一定质量的铜银合金完全反应后E装置的生成物中含氮元素的质量,为确定合金中铜的质量分数还需测定的数据是
(8)若实验只测定Cu的质量分数,不验证NO的产生,则在铜银合金与浓硝酸反应后,只需简单的实验操作就可以达到目的,请简述实验过程:
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】硫代硫酸钠( )是化学实验室中常用的分析试剂,易溶于水,在中性或碱性环境中稳定,在酸性环境中易分解为S和
)是化学实验室中常用的分析试剂,易溶于水,在中性或碱性环境中稳定,在酸性环境中易分解为S和 。实验室常将
。实验室常将 通入
通入 和
和 的物质的量之比为2∶1的混合溶液中制备
的物质的量之比为2∶1的混合溶液中制备 ,某实验小组设计如下装置:
,某实验小组设计如下装置: 可用作脱氯剂除去自来水中残留的二氧化氯(
可用作脱氯剂除去自来水中残留的二氧化氯( ),在此过程中
),在此过程中 做
做_________ (填“氧化”或“还原”)剂。
(2)装置Ⅲ中的氢氧化钠溶液的作用是__________________________ 。
(3)虚线部分导管的作用是________________________ 。
(4)实验前要向装置中鼓入 的目的是
的目的是____________ ,多孔球泡的作用有____________________ 。
(5)写出装置Ⅱ中发生反应的化学方程式________________________ 。
(6)当装置Ⅱ中的pH约为7时,应关闭分液漏斗的活塞,否则产率下降,原因是______________ 。
(7)小组成员提出用 测定实验制得的硫代硫酸钠的纯度,已知
测定实验制得的硫代硫酸钠的纯度,已知 与
与 反应生成连四亚硫酸钠(
反应生成连四亚硫酸钠( ),现称取c g样品配成100mL溶液,加入b mL a mol/L碘水恰好完全反应,则样品中硫代硫酸钠的含量为
),现称取c g样品配成100mL溶液,加入b mL a mol/L碘水恰好完全反应,则样品中硫代硫酸钠的含量为___________ 。(已知: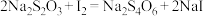 )
)
 )是化学实验室中常用的分析试剂,易溶于水,在中性或碱性环境中稳定,在酸性环境中易分解为S和
)是化学实验室中常用的分析试剂,易溶于水,在中性或碱性环境中稳定,在酸性环境中易分解为S和 。实验室常将
。实验室常将 通入
通入 和
和 的物质的量之比为2∶1的混合溶液中制备
的物质的量之比为2∶1的混合溶液中制备 ,某实验小组设计如下装置:
,某实验小组设计如下装置:
 可用作脱氯剂除去自来水中残留的二氧化氯(
可用作脱氯剂除去自来水中残留的二氧化氯( ),在此过程中
),在此过程中 做
做(2)装置Ⅲ中的氢氧化钠溶液的作用是
(3)虚线部分导管的作用是
(4)实验前要向装置中鼓入
 的目的是
的目的是(5)写出装置Ⅱ中发生反应的化学方程式
(6)当装置Ⅱ中的pH约为7时,应关闭分液漏斗的活塞,否则产率下降,原因是
(7)小组成员提出用
 测定实验制得的硫代硫酸钠的纯度,已知
测定实验制得的硫代硫酸钠的纯度,已知 与
与 反应生成连四亚硫酸钠(
反应生成连四亚硫酸钠( ),现称取c g样品配成100mL溶液,加入b mL a mol/L碘水恰好完全反应,则样品中硫代硫酸钠的含量为
),现称取c g样品配成100mL溶液,加入b mL a mol/L碘水恰好完全反应,则样品中硫代硫酸钠的含量为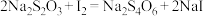 )
)
您最近一年使用:0次



