1 . 五氯化锑(SbCl5)主要用作氟化工的催化剂、纺织工业织物的阻燃剂、染料工业的中间体。实验室根据反应 ,利用如下装置制备SbCl5 (加热及夹持装置略)。
,利用如下装置制备SbCl5 (加热及夹持装置略)。
实验室制备SbCl5的步骤如下:
ⅰ.保持80℃的条件,在盛有SbCl3的三颈烧瓶中通入Cl2,反应生成SbCl5;
ⅱ.将三颈烧瓶中的反应混合物转移到双颈烧瓶中;
ⅲ.减压蒸馏,收集目标物质。
回答下列问题:
(1)写出用K2MnO4和浓盐酸制备Cl2的离子方程式___________ ,其中体现还原性和酸性的HCl的物质的量之比为___________ 。
(2)实验装置中,两个冷凝管___________ (填“能”或“不能”)交换使用,步骤ⅰ中对三颈烧瓶进行加热的最佳方式是___________ 加热。
(3)写出图示实验装置存在的一处弊端:___________ 。
(4)步骤ⅱ将反应后混合液转移至双颈烧瓶中的方法:在b处连接减压装置,使三颈烧瓶中的液体流入双颈烧瓶。进行该操作前,需___________ (填活塞1和2的开、关的情况)。
(5)步骤ⅲ采用减压蒸馏,而不是常压蒸馏的原因是___________ ;调节减压装置至1.86kPa,收集___________ ℃左右的馏分。减压蒸馏时,玻璃毛细管的作用有___________ (填字母)。
a.防止暴沸 b.搅拌 c.连通大气,保持常压
 ,利用如下装置制备SbCl5 (加热及夹持装置略)。
,利用如下装置制备SbCl5 (加热及夹持装置略)。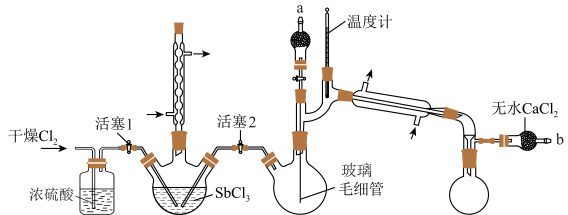
| 物质 | 熔点/℃ | 沸点/℃ | 性质 |
| SbCl3 | 73.4 | 223(101.3kPa) | 均极易水解 |
| SbCl5 | 2.8 | 176(101.3kPa,140℃)时分解 | |
| 68(1.86kPa)、79(2.90kPa) |
ⅰ.保持80℃的条件,在盛有SbCl3的三颈烧瓶中通入Cl2,反应生成SbCl5;
ⅱ.将三颈烧瓶中的反应混合物转移到双颈烧瓶中;
ⅲ.减压蒸馏,收集目标物质。
回答下列问题:
(1)写出用K2MnO4和浓盐酸制备Cl2的离子方程式
(2)实验装置中,两个冷凝管
(3)写出图示实验装置存在的一处弊端:
(4)步骤ⅱ将反应后混合液转移至双颈烧瓶中的方法:在b处连接减压装置,使三颈烧瓶中的液体流入双颈烧瓶。进行该操作前,需
(5)步骤ⅲ采用减压蒸馏,而不是常压蒸馏的原因是
a.防止暴沸 b.搅拌 c.连通大气,保持常压
您最近一年使用:0次
解题方法
2 .  (
(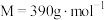 )是一种白色固体,微溶于水,不溶于醇,溶于高氯酸,可用作防臭剂、药物和食品添加剂。实验室采用如下方法制备
)是一种白色固体,微溶于水,不溶于醇,溶于高氯酸,可用作防臭剂、药物和食品添加剂。实验室采用如下方法制备
 并测定其纯度:
并测定其纯度:
Ⅰ.制备
ⅰ.如图连接装置,向三颈烧瓶中依次加入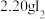 、
、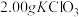 和
和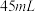 水,然后控制均匀速度滴加少量浓度为
水,然后控制均匀速度滴加少量浓度为 的盐酸,加热搅拌至反应完全,反应过程中有黄绿色气体产生,同时生成
的盐酸,加热搅拌至反应完全,反应过程中有黄绿色气体产生,同时生成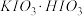 。
。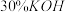 溶液,然后逐滴加入
溶液,然后逐滴加入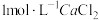 溶液,不断搅拌,生成
溶液,不断搅拌,生成 沉淀;
沉淀;
ⅲ.将混合物冷却后抽滤、依次水洗、醇洗,晾干后得产品;
Ⅱ.测定 产品纯度
产品纯度
ⅳ.称取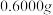 产品于烧杯中,加入
产品于烧杯中,加入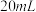 一定浓度
一定浓度 溶液(高氯酸不参与反应),将所得溶液冷却后转移至
溶液(高氯酸不参与反应),将所得溶液冷却后转移至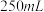 容量瓶中,定容;
容量瓶中,定容;
ⅴ.移取 溶液,加入
溶液,加入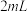 一定浓度
一定浓度 溶液和
溶液和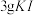 (过量),加
(过量),加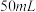 水,用
水,用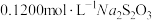 标准液(发生反应:
标准液(发生反应: )滴定至浅黄色,滴加指示剂,继续滴定至终点,重复测定2次,平均消耗标准液体积
)滴定至浅黄色,滴加指示剂,继续滴定至终点,重复测定2次,平均消耗标准液体积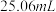 ;
;
ⅵ.做空白实验,平均消耗标准液体积 。
。
回答下列问题:
(1)装置中A处应安装的仪器为________ (填名称);三颈烧瓶的容积最适合的是________ (填选项字母);
A.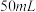 B.
B.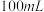 C.
C.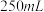 D.
D.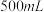
(2)滴加盐酸的仪器选用了恒压滴液漏斗,与分液漏斗相比该仪器的优点为________ ;
(3)步骤ⅰ中,生成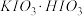 的化学方程式为
的化学方程式为________________ ;
(4)步骤ⅱ中,能够生成 的原因为
的原因为________________ ;
(5)步骤ⅲ中,醇洗的目的是________________ ;
(6)步骤ⅴ中,滴加的指示剂为________ ;滴定终点溶液颜色变化为________ ;
(7) 产品纯度为
产品纯度为________ %(保留两位有效数字)。
 (
(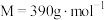 )是一种白色固体,微溶于水,不溶于醇,溶于高氯酸,可用作防臭剂、药物和食品添加剂。实验室采用如下方法制备
)是一种白色固体,微溶于水,不溶于醇,溶于高氯酸,可用作防臭剂、药物和食品添加剂。实验室采用如下方法制备 并测定其纯度:
并测定其纯度:Ⅰ.制备

ⅰ.如图连接装置,向三颈烧瓶中依次加入
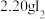 、
、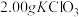 和
和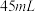 水,然后控制均匀速度滴加少量浓度为
水,然后控制均匀速度滴加少量浓度为 的盐酸,加热搅拌至反应完全,反应过程中有黄绿色气体产生,同时生成
的盐酸,加热搅拌至反应完全,反应过程中有黄绿色气体产生,同时生成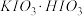 。
。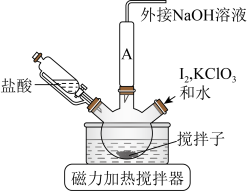
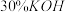 溶液,然后逐滴加入
溶液,然后逐滴加入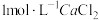 溶液,不断搅拌,生成
溶液,不断搅拌,生成 沉淀;
沉淀;ⅲ.将混合物冷却后抽滤、依次水洗、醇洗,晾干后得产品;
Ⅱ.测定
 产品纯度
产品纯度ⅳ.称取
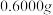 产品于烧杯中,加入
产品于烧杯中,加入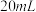 一定浓度
一定浓度 溶液(高氯酸不参与反应),将所得溶液冷却后转移至
溶液(高氯酸不参与反应),将所得溶液冷却后转移至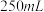 容量瓶中,定容;
容量瓶中,定容;ⅴ.移取
 溶液,加入
溶液,加入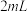 一定浓度
一定浓度 溶液和
溶液和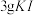 (过量),加
(过量),加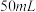 水,用
水,用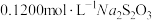 标准液(发生反应:
标准液(发生反应: )滴定至浅黄色,滴加指示剂,继续滴定至终点,重复测定2次,平均消耗标准液体积
)滴定至浅黄色,滴加指示剂,继续滴定至终点,重复测定2次,平均消耗标准液体积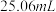 ;
;ⅵ.做空白实验,平均消耗标准液体积
 。
。回答下列问题:
(1)装置中A处应安装的仪器为
A.
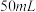 B.
B.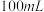 C.
C.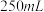 D.
D.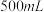
(2)滴加盐酸的仪器选用了恒压滴液漏斗,与分液漏斗相比该仪器的优点为
(3)步骤ⅰ中,生成
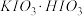 的化学方程式为
的化学方程式为(4)步骤ⅱ中,能够生成
 的原因为
的原因为(5)步骤ⅲ中,醇洗的目的是
(6)步骤ⅴ中,滴加的指示剂为
(7)
 产品纯度为
产品纯度为
您最近一年使用:0次
2024·陕西榆林·三模
名校
3 .  (三氯化六氨合钴,
(三氯化六氨合钴,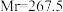 )是合成其他含钴配合物的重要原料,实验室中可由金属钴及其他原料制备
)是合成其他含钴配合物的重要原料,实验室中可由金属钴及其他原料制备 。
。
已知:①在 时,
时, 恰好完全沉淀为
恰好完全沉淀为 ;
;
②不同温度下 在水中的溶解度如图所示;
在水中的溶解度如图所示; 易潮解,Co(Ⅲ)的氧化性强于
易潮解,Co(Ⅲ)的氧化性强于 。
。
制备步骤如下:
Ⅰ. 的制备:用金属钴与氯气反应制备
的制备:用金属钴与氯气反应制备 ,实验中利用如图装置(连接处橡胶管省略)进行制备。
,实验中利用如图装置(连接处橡胶管省略)进行制备。 锥形瓶内加入
锥形瓶内加入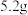 研细的
研细的 、
、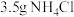 和
和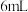 水,加热溶解后加入
水,加热溶解后加入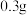 活性炭作催化剂。
活性炭作催化剂。
Ⅲ.冷却后,加入浓氨水混合均匀。控制温度在10℃以下并缓慢加入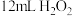 溶液。
溶液。
Ⅳ.在60℃下反应一段时间后,经过___________、过滤、洗涤、干燥等操作,得到橙黄色的 晶体
晶体 。
。
请回答下列问题:
(1)仪器a的名称为___________ 。
(2)用图中的装置组合制备 ,仪器的连接顺序为
,仪器的连接顺序为___________ 。装置B的作用是___________ 。
(3)制备三氯化六氨合钴的反应方程式为___________ 。
(4)在制备 时,加入浓氨水前,需在步骤Ⅱ中加入
时,加入浓氨水前,需在步骤Ⅱ中加入 ,请结合平衡移动原理解释原因
,请结合平衡移动原理解释原因___________ 。
(5)步骤Ⅲ中在加入 溶液时,控制温度在10℃以下缓慢加入的目的是
溶液时,控制温度在10℃以下缓慢加入的目的是___________ 。
(6)在步骤Ⅳ中过滤、洗涤、干燥之前的操作为___________ 、___________ 。
(7)制得 产品的产率为
产品的产率为___________ %(精确到0.1%)。
 (三氯化六氨合钴,
(三氯化六氨合钴,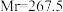 )是合成其他含钴配合物的重要原料,实验室中可由金属钴及其他原料制备
)是合成其他含钴配合物的重要原料,实验室中可由金属钴及其他原料制备 。
。已知:①在
 时,
时, 恰好完全沉淀为
恰好完全沉淀为 ;
;②不同温度下
 在水中的溶解度如图所示;
在水中的溶解度如图所示;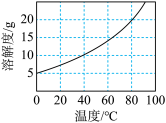
 易潮解,Co(Ⅲ)的氧化性强于
易潮解,Co(Ⅲ)的氧化性强于 。
。制备步骤如下:
Ⅰ.
 的制备:用金属钴与氯气反应制备
的制备:用金属钴与氯气反应制备 ,实验中利用如图装置(连接处橡胶管省略)进行制备。
,实验中利用如图装置(连接处橡胶管省略)进行制备。
 锥形瓶内加入
锥形瓶内加入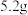 研细的
研细的 、
、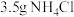 和
和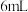 水,加热溶解后加入
水,加热溶解后加入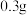 活性炭作催化剂。
活性炭作催化剂。Ⅲ.冷却后,加入浓氨水混合均匀。控制温度在10℃以下并缓慢加入
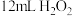 溶液。
溶液。Ⅳ.在60℃下反应一段时间后,经过___________、过滤、洗涤、干燥等操作,得到橙黄色的
 晶体
晶体 。
。请回答下列问题:
(1)仪器a的名称为
(2)用图中的装置组合制备
 ,仪器的连接顺序为
,仪器的连接顺序为(3)制备三氯化六氨合钴的反应方程式为
(4)在制备
 时,加入浓氨水前,需在步骤Ⅱ中加入
时,加入浓氨水前,需在步骤Ⅱ中加入 ,请结合平衡移动原理解释原因
,请结合平衡移动原理解释原因(5)步骤Ⅲ中在加入
 溶液时,控制温度在10℃以下缓慢加入的目的是
溶液时,控制温度在10℃以下缓慢加入的目的是(6)在步骤Ⅳ中过滤、洗涤、干燥之前的操作为
(7)制得
 产品的产率为
产品的产率为
您最近一年使用:0次
4 . 亚氯酸钠是一种高效漂白剂和氧化剂,常用于纸浆和纤维的漂白、饮水净化和污水处理等。温度高于60℃时, 会分解成
会分解成 和NaCl。某化学实验探究小组设计如图实验制备亚氯酸钠(
和NaCl。某化学实验探究小组设计如图实验制备亚氯酸钠( )晶体。
)晶体。
①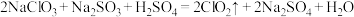 。
。
② 极易溶于水而不与水反应,几乎不发生水解,沸点11℃。
极易溶于水而不与水反应,几乎不发生水解,沸点11℃。
③ 饱和溶液在低于38℃时析出
饱和溶液在低于38℃时析出 ,高于38℃时析出
,高于38℃时析出 。
。
(1)C装置仪器名称是___________ ,它的作用是___________ 。
(2)B中使用浓硫酸而不用稀硫酸的原因是___________ 。
(3)向B中加入浓硫酸的操作方法是___________ 。
(4) 气体与装置D中混合溶液反应生成
气体与装置D中混合溶液反应生成 ,生成
,生成 的离子方程式为
的离子方程式为___________ 。
(5)反应后,经___________ 等步骤可从装置D的溶液获得 晶体。干燥时通常要求低温晾干,温度过高可能导致产品中混有的杂质是
晶体。干燥时通常要求低温晾干,温度过高可能导致产品中混有的杂质是___________ 。
(6)测定样品中 的纯度(假设杂质不参与反应)。测定时进行如下实验:准确称取0.200 g的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生反应:
的纯度(假设杂质不参与反应)。测定时进行如下实验:准确称取0.200 g的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生反应: ,将所得混合液稀释成100 mL待测溶液。取25.00 mL待测溶液,加入淀粉溶液做指示剂,用0.1 mol⋅L
,将所得混合液稀释成100 mL待测溶液。取25.00 mL待测溶液,加入淀粉溶液做指示剂,用0.1 mol⋅L
 标准液滴定至终点,测得消耗标准溶液体积的平均值为20.00 mL(已知:
标准液滴定至终点,测得消耗标准溶液体积的平均值为20.00 mL(已知: )。
)。
所称取的样品中 的质量分数为
的质量分数为___________ 。
 会分解成
会分解成 和NaCl。某化学实验探究小组设计如图实验制备亚氯酸钠(
和NaCl。某化学实验探究小组设计如图实验制备亚氯酸钠( )晶体。
)晶体。
①
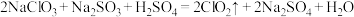 。
。②
 极易溶于水而不与水反应,几乎不发生水解,沸点11℃。
极易溶于水而不与水反应,几乎不发生水解,沸点11℃。③
 饱和溶液在低于38℃时析出
饱和溶液在低于38℃时析出 ,高于38℃时析出
,高于38℃时析出 。
。(1)C装置仪器名称是
(2)B中使用浓硫酸而不用稀硫酸的原因是
(3)向B中加入浓硫酸的操作方法是
(4)
 气体与装置D中混合溶液反应生成
气体与装置D中混合溶液反应生成 ,生成
,生成 的离子方程式为
的离子方程式为(5)反应后,经
 晶体。干燥时通常要求低温晾干,温度过高可能导致产品中混有的杂质是
晶体。干燥时通常要求低温晾干,温度过高可能导致产品中混有的杂质是(6)测定样品中
 的纯度(假设杂质不参与反应)。测定时进行如下实验:准确称取0.200 g的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生反应:
的纯度(假设杂质不参与反应)。测定时进行如下实验:准确称取0.200 g的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生反应: ,将所得混合液稀释成100 mL待测溶液。取25.00 mL待测溶液,加入淀粉溶液做指示剂,用0.1 mol⋅L
,将所得混合液稀释成100 mL待测溶液。取25.00 mL待测溶液,加入淀粉溶液做指示剂,用0.1 mol⋅L
 标准液滴定至终点,测得消耗标准溶液体积的平均值为20.00 mL(已知:
标准液滴定至终点,测得消耗标准溶液体积的平均值为20.00 mL(已知: )。
)。所称取的样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
解题方法
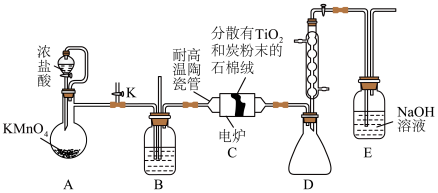
5 . 钛在医疗领域的应用非常广泛,如:制人造关节、主动心瓣等。实验室利用含杂质的二氧化钛做原料制取高纯度的二氧化钛,装置如图(夹持装置已略去)。
已知:① ;
;
② 为无色或淡黄色液体,熔点为-30℃,沸点为136.4℃,极易与水反应,能溶于有机溶剂,易挥发,与HCl不发生反应;
为无色或淡黄色液体,熔点为-30℃,沸点为136.4℃,极易与水反应,能溶于有机溶剂,易挥发,与HCl不发生反应;
③ 的盐酸溶液可吸收CO而生成黑色颗粒Pd;
的盐酸溶液可吸收CO而生成黑色颗粒Pd;
④ 在盐酸溶液中的存在形式为
在盐酸溶液中的存在形式为 。
。
a.制备
_______ (填序号)。
①先给陶瓷管通电加热,一段时间后,再打开分液漏斗活塞
②先打开分液漏斗活塞,一段时间后,再给陶瓷管通电加热
③先将陶瓷管断电停止加热,一段时间后,再关闭分液漏斗活塞
④先关闭分液漏斗活塞,一段时间后,再将陶瓷管断电停止加热
(2)装置B中盛放的试剂是_______ (填名称)。
(3)该实验设计存在的缺陷是_______ 、_______
(4)用 的盐酸溶液吸收CO的离子方程式为
的盐酸溶液吸收CO的离子方程式为_______ 。
(5)所得的 可用Mg制Ti,该过程可在
可用Mg制Ti,该过程可在_______ (填序号)氛围保护下进行。
①氮气 ②氩气 ③水蒸气 ④氧气
b. 气相氧化法制备
气相氧化法制备
_______ 。
(7)实验装置按从左到右的连接顺序为_______ 。
(8)写出装置甲三颈烧瓶内发生反应的化学方程式_______ 。
已知:①
 ;
;②
 为无色或淡黄色液体,熔点为-30℃,沸点为136.4℃,极易与水反应,能溶于有机溶剂,易挥发,与HCl不发生反应;
为无色或淡黄色液体,熔点为-30℃,沸点为136.4℃,极易与水反应,能溶于有机溶剂,易挥发,与HCl不发生反应;③
 的盐酸溶液可吸收CO而生成黑色颗粒Pd;
的盐酸溶液可吸收CO而生成黑色颗粒Pd;④
 在盐酸溶液中的存在形式为
在盐酸溶液中的存在形式为 。
。a.制备

①先给陶瓷管通电加热,一段时间后,再打开分液漏斗活塞
②先打开分液漏斗活塞,一段时间后,再给陶瓷管通电加热
③先将陶瓷管断电停止加热,一段时间后,再关闭分液漏斗活塞
④先关闭分液漏斗活塞,一段时间后,再将陶瓷管断电停止加热
(2)装置B中盛放的试剂是
(3)该实验设计存在的缺陷是
(4)用
 的盐酸溶液吸收CO的离子方程式为
的盐酸溶液吸收CO的离子方程式为(5)所得的
 可用Mg制Ti,该过程可在
可用Mg制Ti,该过程可在①氮气 ②氩气 ③水蒸气 ④氧气
b.
 气相氧化法制备
气相氧化法制备
(7)实验装置按从左到右的连接顺序为
(8)写出装置甲三颈烧瓶内发生反应的化学方程式
您最近一年使用:0次
名校
6 . 为测定草酸钴晶体(CoC2O4·2H2O)样品的纯度,某实验小组进行如下实验:
Ⅰ.取草酸钴晶体样品3.000 g,加稀H2SO4溶解,再加入100.00 mL 0.1000 mol/L酸性KMnO4溶液,充分反应至不再有CO2气体产生(常温下,草酸钴晶体难溶于水,该条件下Co2+不被氧化,杂质也不参与反应)。
Ⅱ.将溶液冷却,加水稀释定容至250 mL。
Ⅲ.取25.00 mL溶液,用0.1000 mol/L FeSO4标准溶液滴定。
Ⅳ.再重复步骤Ⅲ中的实验过程两次,三次的实验数据如表:
(1)步骤Ⅰ中加酸性KMnO4溶液时发生反应的离子方程式为______________ 。
(2)实验室使用的酸性KMnO4溶液一般是用________ 酸化(填酸的化学式)。
(3)步骤Ⅱ中,不会用到下列仪器中的_______ (填标号)。_______ (填“酸式”或“碱式”)滴定管;某次滴定中,开始时滴定管读数正确,结束时仰视,则所测草酸钴晶体样品的纯度会_______ (填“偏大”“偏小”或“不变”)﹔某次实验中所有实验操作和读数均无误,所测草酸钴晶体样品的纯度的误差却偏小,则可能的原因是___________ 。
(5)草酸钴晶体样品的纯度为______ %。
Ⅰ.取草酸钴晶体样品3.000 g,加稀H2SO4溶解,再加入100.00 mL 0.1000 mol/L酸性KMnO4溶液,充分反应至不再有CO2气体产生(常温下,草酸钴晶体难溶于水,该条件下Co2+不被氧化,杂质也不参与反应)。
Ⅱ.将溶液冷却,加水稀释定容至250 mL。
Ⅲ.取25.00 mL溶液,用0.1000 mol/L FeSO4标准溶液滴定。
Ⅳ.再重复步骤Ⅲ中的实验过程两次,三次的实验数据如表:
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗FeSO4溶液标准的体积/mL | 18.96 | 18.03 | 17.97 |
(1)步骤Ⅰ中加酸性KMnO4溶液时发生反应的离子方程式为
(2)实验室使用的酸性KMnO4溶液一般是用
(3)步骤Ⅱ中,不会用到下列仪器中的
a.  b.
b.  c.
c.  d.
d.
(5)草酸钴晶体样品的纯度为
您最近一年使用:0次
名校
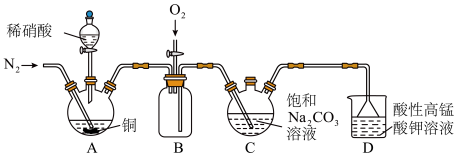
7 . 亚硝酸钠( )主要用于医药、染料和漂白等行业,也常用于食品保鲜剂。某小组拟利用氮氧化物(可用
)主要用于医药、染料和漂白等行业,也常用于食品保鲜剂。某小组拟利用氮氧化物(可用 表示)制备亚硝酸钠,简易流程如图。
表示)制备亚硝酸钠,简易流程如图。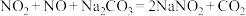 ,
,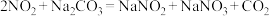
 溶液和饱和
溶液和饱和 溶液在加热条件下反应可制得
溶液在加热条件下反应可制得 ,该反应的化学方程式为
,该反应的化学方程式为_______ ;实验时装置B中应间断性通入适量的 ,其目的是
,其目的是_______ 。
(2)装置C中盛装饱和 溶液的仪器的名称是
溶液的仪器的名称是_______ ;NO不能单独被纯碱溶液吸收,为了使 完全被纯碱溶液吸收且产品纯度最高,
完全被纯碱溶液吸收且产品纯度最高,
_______ 。
(3)装置D的作用是_______ ,采用“倒置漏斗”措施的目的是_______ 。
(4)设计实验探究 的性质。制备
的性质。制备 实验完毕后,从装置C中分离出
实验完毕后,从装置C中分离出 固体粗产品(不含
固体粗产品(不含 杂质),取少量上述产品配制成溶液,分成三份分别进行甲、乙、丙三组实验,实验操作及现象、结论如下表。
杂质),取少量上述产品配制成溶液,分成三份分别进行甲、乙、丙三组实验,实验操作及现象、结论如下表。
上述实验_______ (填标号)的结论不可靠。经实验测得实验丙反应后的溶液中氮元素仅以 的形式存在,酸性
的形式存在,酸性 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为_______ 。
 )主要用于医药、染料和漂白等行业,也常用于食品保鲜剂。某小组拟利用氮氧化物(可用
)主要用于医药、染料和漂白等行业,也常用于食品保鲜剂。某小组拟利用氮氧化物(可用 表示)制备亚硝酸钠,简易流程如图。
表示)制备亚硝酸钠,简易流程如图。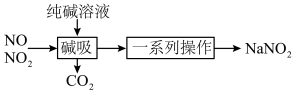
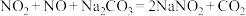 ,
,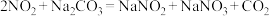
 溶液和饱和
溶液和饱和 溶液在加热条件下反应可制得
溶液在加热条件下反应可制得 ,该反应的化学方程式为
,该反应的化学方程式为 ,其目的是
,其目的是(2)装置C中盛装饱和
 溶液的仪器的名称是
溶液的仪器的名称是 完全被纯碱溶液吸收且产品纯度最高,
完全被纯碱溶液吸收且产品纯度最高,
(3)装置D的作用是
(4)设计实验探究
 的性质。制备
的性质。制备 实验完毕后,从装置C中分离出
实验完毕后,从装置C中分离出 固体粗产品(不含
固体粗产品(不含 杂质),取少量上述产品配制成溶液,分成三份分别进行甲、乙、丙三组实验,实验操作及现象、结论如下表。
杂质),取少量上述产品配制成溶液,分成三份分别进行甲、乙、丙三组实验,实验操作及现象、结论如下表。| 实验 | 实验操作及现象 | 结论 |
| 甲 | 滴入无色酚酞溶液中,无色酚酞溶液变红 |  是弱酸 是弱酸 |
| 乙 | 滴入少量酸性KI-淀粉溶液中,振荡,酸性KI-淀粉溶液变蓝 | 酸性条件下 具有氧化性 具有氧化性 |
| 丙 | 滴入少量酸性 溶液中,振荡,酸性 溶液中,振荡,酸性 溶液褪色 溶液褪色 | 酸性条件 具有还原性 具有还原性 |
 的形式存在,酸性
的形式存在,酸性 溶液与
溶液与 反应的离子方程式为
反应的离子方程式为
您最近一年使用:0次
8 . 铜(Ⅰ)配合物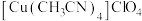 的制备及纯度分析步骤如下。
的制备及纯度分析步骤如下。
1.制备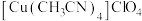
将乙腈的 ,
, ,过量钢材混合于圆底烧瓶,控温85°C、磁力搅拌,至反应完全(装置如图),经一系列操作,得到白色固体产品。
,过量钢材混合于圆底烧瓶,控温85°C、磁力搅拌,至反应完全(装置如图),经一系列操作,得到白色固体产品。
取 产品完全溶解于足量浓硝酸中,再加水、醋酸钠溶液配成250.0mL溶液。取25.0mL溶液,加入指示剂后,再用
产品完全溶解于足量浓硝酸中,再加水、醋酸钠溶液配成250.0mL溶液。取25.0mL溶液,加入指示剂后,再用 EDTA标准溶液滴定至终点。平行滴定三次,消耗EDTA溶液的平均体积为
EDTA标准溶液滴定至终点。平行滴定三次,消耗EDTA溶液的平均体积为 。
。
已知:① 沸点为81℃.酸性条件下遇水生成
沸点为81℃.酸性条件下遇水生成
②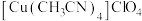 (
(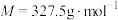 )较易被空气氧化:
)较易被空气氧化:
③EDTA与 形成1:1配合物:
形成1:1配合物:
④滴定需在弱碱性条件下进行。
回答下列问题:
(1)图中仪器 的作用是
的作用是______ , 中应加入
中应加入______ 作为最佳传热介质。
(2)加入过量铜粉能提高产物的纯度,可能的原因是______ .
(3)“一系列操作”依次为过滤分离出滤液、______ 冷却结晶、过滤、洗涤、干燥。
(4) 与足量浓硝酸发生反应的离子方程式为
与足量浓硝酸发生反应的离子方程式为______ .
(5)加入醋酸钠溶液的主要目的是______ .
(6)测得产品的纯度为______ (用含 、
、 、
、 的代数式表示)。
的代数式表示)。
(7)下列情况会导致产品纯度测定结果偏高的有______.
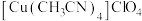 的制备及纯度分析步骤如下。
的制备及纯度分析步骤如下。1.制备
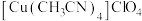
将乙腈的
 ,
, ,过量钢材混合于圆底烧瓶,控温85°C、磁力搅拌,至反应完全(装置如图),经一系列操作,得到白色固体产品。
,过量钢材混合于圆底烧瓶,控温85°C、磁力搅拌,至反应完全(装置如图),经一系列操作,得到白色固体产品。
取
 产品完全溶解于足量浓硝酸中,再加水、醋酸钠溶液配成250.0mL溶液。取25.0mL溶液,加入指示剂后,再用
产品完全溶解于足量浓硝酸中,再加水、醋酸钠溶液配成250.0mL溶液。取25.0mL溶液,加入指示剂后,再用 EDTA标准溶液滴定至终点。平行滴定三次,消耗EDTA溶液的平均体积为
EDTA标准溶液滴定至终点。平行滴定三次,消耗EDTA溶液的平均体积为 。
。已知:①
 沸点为81℃.酸性条件下遇水生成
沸点为81℃.酸性条件下遇水生成
②
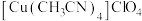 (
(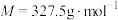 )较易被空气氧化:
)较易被空气氧化:③EDTA与
 形成1:1配合物:
形成1:1配合物:④滴定需在弱碱性条件下进行。
回答下列问题:
(1)图中仪器
 的作用是
的作用是 中应加入
中应加入(2)加入过量铜粉能提高产物的纯度,可能的原因是
(3)“一系列操作”依次为过滤分离出滤液、
(4)
 与足量浓硝酸发生反应的离子方程式为
与足量浓硝酸发生反应的离子方程式为(5)加入醋酸钠溶液的主要目的是
(6)测得产品的纯度为
 、
、 、
、 的代数式表示)。
的代数式表示)。(7)下列情况会导致产品纯度测定结果偏高的有______.
A.产品中含有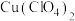 | B.滴定终点时俯视读数 |
| C.盛装EDTA溶液的滴定管未润洗 | D.产品干燥不充分 |
您最近一年使用:0次
9 . 钛酸钡( )因其优良的电学性能被广泛应用于多层陶瓷电容器(MLCC)等电子元器件。某同学以
)因其优良的电学性能被广泛应用于多层陶瓷电容器(MLCC)等电子元器件。某同学以 和高活性偏钛酸(
和高活性偏钛酸( )为原料,在实验室中采用低温固相法制备亚微米级钛酸钡粉体。
)为原料,在实验室中采用低温固相法制备亚微米级钛酸钡粉体。
已知:①氧化性: ;
; 。
。
②四氯化钛极易水解,易挥发。
I.制备偏钛酸(装置如图) 固体于三颈烧瓶中,加入浓盐酸配成
固体于三颈烧瓶中,加入浓盐酸配成 溶液,然后加水稀释转化成一定浓度的
溶液,然后加水稀释转化成一定浓度的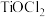 溶液,最后将装在仪器B中的氨水缓慢滴入
溶液,最后将装在仪器B中的氨水缓慢滴入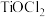 溶液中,搅拌,析出
溶液中,搅拌,析出 。反应过程中注意控制温度,以免反应过于剧烈。
。反应过程中注意控制温度,以免反应过于剧烈。
(1)仪器B的名称是_______ 。
(2)仪器A的作用是_______ ,冷凝水从_______ (填“a”或“b”)口通入。
(3)写出氨水与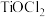 溶液反应产生
溶液反应产生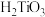 的化学方程式
的化学方程式_______ 。
Ⅱ.制备钛酸钡
将上述制得的作为反应原料,与按照物质的量之比为 混合后放入球磨罐中,放置于“罐磨机”上按照700r/min罐磨5h后倒入坩埚中,并置于烘箱中
混合后放入球磨罐中,放置于“罐磨机”上按照700r/min罐磨5h后倒入坩埚中,并置于烘箱中 反应3h,得到亚微米级白色钛酸钡样品粉体。
反应3h,得到亚微米级白色钛酸钡样品粉体。
(4)写出 与
与 反应的化学方程式
反应的化学方程式_______ 。
(5)在固相反应过程中,会经历“接触扩散—化学反应—成核—晶粒生长”的历程,则“罐磨机”的作用是_______ ,若想获得比亚微米级钛酸钡晶体更大颗粒的晶体,应置于_______ (填“<”或“>”)100℃的烘箱中反应3h。
Ⅲ.测定产品纯度
取 产品溶于稍过量的稀硫酸中配制成250mL溶液,取25.00mL溶液于锥形瓶中,加入过量
产品溶于稍过量的稀硫酸中配制成250mL溶液,取25.00mL溶液于锥形瓶中,加入过量 溶液,充分反应后,用
溶液,充分反应后,用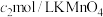 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。(
。( 的摩尔质量为Mg/mol)
的摩尔质量为Mg/mol)
(6)实验中所用滴定管为_______ (填“酸式”或“碱式”或“酸式和碱式”)滴定管。
(7)产品的纯度为_______ %。
 )因其优良的电学性能被广泛应用于多层陶瓷电容器(MLCC)等电子元器件。某同学以
)因其优良的电学性能被广泛应用于多层陶瓷电容器(MLCC)等电子元器件。某同学以 和高活性偏钛酸(
和高活性偏钛酸( )为原料,在实验室中采用低温固相法制备亚微米级钛酸钡粉体。
)为原料,在实验室中采用低温固相法制备亚微米级钛酸钡粉体。已知:①氧化性:
 ;
; 。
。②四氯化钛极易水解,易挥发。
I.制备偏钛酸(装置如图)

 固体于三颈烧瓶中,加入浓盐酸配成
固体于三颈烧瓶中,加入浓盐酸配成 溶液,然后加水稀释转化成一定浓度的
溶液,然后加水稀释转化成一定浓度的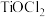 溶液,最后将装在仪器B中的氨水缓慢滴入
溶液,最后将装在仪器B中的氨水缓慢滴入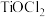 溶液中,搅拌,析出
溶液中,搅拌,析出 。反应过程中注意控制温度,以免反应过于剧烈。
。反应过程中注意控制温度,以免反应过于剧烈。(1)仪器B的名称是
(2)仪器A的作用是
(3)写出氨水与
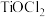 溶液反应产生
溶液反应产生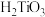 的化学方程式
的化学方程式Ⅱ.制备钛酸钡
将上述制得的作为反应原料,与按照物质的量之比为
 混合后放入球磨罐中,放置于“罐磨机”上按照700r/min罐磨5h后倒入坩埚中,并置于烘箱中
混合后放入球磨罐中,放置于“罐磨机”上按照700r/min罐磨5h后倒入坩埚中,并置于烘箱中 反应3h,得到亚微米级白色钛酸钡样品粉体。
反应3h,得到亚微米级白色钛酸钡样品粉体。(4)写出
 与
与 反应的化学方程式
反应的化学方程式(5)在固相反应过程中,会经历“接触扩散—化学反应—成核—晶粒生长”的历程,则“罐磨机”的作用是
Ⅲ.测定产品纯度
取
 产品溶于稍过量的稀硫酸中配制成250mL溶液,取25.00mL溶液于锥形瓶中,加入过量
产品溶于稍过量的稀硫酸中配制成250mL溶液,取25.00mL溶液于锥形瓶中,加入过量 溶液,充分反应后,用
溶液,充分反应后,用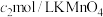 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液
溶液 。(
。( 的摩尔质量为Mg/mol)
的摩尔质量为Mg/mol)(6)实验中所用滴定管为
(7)产品的纯度为
您最近一年使用:0次
解题方法
10 . 某兴趣小组探究电镀银实验。回答下列问题:
I.实验准备。
(1)用 固体配制
固体配制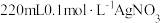 溶液,不需要使用的仪器是
溶液,不需要使用的仪器是___________ (填字母)。___________ 。
Ⅱ.探究银离子对镀层的影响。
【提出猜想】
镀层外观与 浓度有关。
浓度有关。
【查阅资料】
络合反应: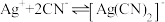 ,
,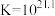 。
。
【设计实验】
【问题讨论】
(3)实验a中,溶液变红色的可能原因是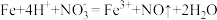 和
和___________ (用离子方程式表示,已知氧化性: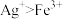 )。
)。
(4)①实验a、b的阴极都伴随有气泡,其原因是___________ (写电极反应式)。
②实验b比实验a产生的镀层光亮、致密,其原理是___________ 。
③一段时间后,实验b中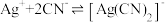 平衡不移动,其原因是
平衡不移动,其原因是___________ 。
【实验结论】
其他条件不变, 浓度很小时,银镀层光亮、致密。
浓度很小时,银镀层光亮、致密。
Ⅲ.探究温度、含量对镀层的影响。
表1:其他条件不变,与
 溶液等体积混合的溶液中含量对镀层外观的影响。
溶液等体积混合的溶液中含量对镀层外观的影响。
表2:其他条件不变,温度对镀层外观的影响。
(5)表1中 含量为
含量为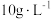 时,镀层模糊、无光泽的原因是
时,镀层模糊、无光泽的原因是___________ ;
表2中温度为 时镀层光亮不均匀的主要原因是
时镀层光亮不均匀的主要原因是___________ 。
Ⅳ.探究新配方电镀银。
由于电镀液使用氰化钾,在电镀过程中会产生有毒气体,以及废液含剧毒的氰化物,不符合环境要求。由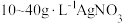 溶液和
溶液和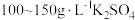 溶液组成电镀液也可以得到光亮、致密的镀层。
溶液组成电镀液也可以得到光亮、致密的镀层。
(6)使用新配方可以达到同样的目的,其原理是___________ 。已知: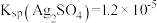 。
。
I.实验准备。
(1)用
 固体配制
固体配制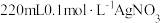 溶液,不需要使用的仪器是
溶液,不需要使用的仪器是A. B.
B. C.
C. D.
D. E.
E.
Ⅱ.探究银离子对镀层的影响。
【提出猜想】
镀层外观与
 浓度有关。
浓度有关。【查阅资料】
络合反应:
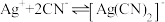 ,
,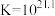 。
。【设计实验】
| 实验 | 装置 | 现象 |
| a |
 的 的 溶液(含少量 溶液(含少量 ) ) | 阴极表面有疏松的黑色物质生成并伴随有无色气泡,一段时间后,取阴极区电解质溶液于试管,滴加 溶液,溶液变为红色。 溶液,溶液变为红色。 |
| b |
 的 的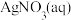 与过量 与过量 混合(含少量 混合(含少量 ) ) | 阴极表面有光亮、致密的银白色物质生成,仍然有少量无色气泡。一段时间后,取少量阴极区溶液于试管,滴加 溶液,溶液不变红。 溶液,溶液不变红。 |
(3)实验a中,溶液变红色的可能原因是
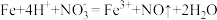 和
和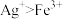 )。
)。(4)①实验a、b的阴极都伴随有气泡,其原因是
②实验b比实验a产生的镀层光亮、致密,其原理是
③一段时间后,实验b中
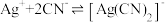 平衡不移动,其原因是
平衡不移动,其原因是【实验结论】
其他条件不变,
 浓度很小时,银镀层光亮、致密。
浓度很小时,银镀层光亮、致密。Ⅲ.探究温度、含量对镀层的影响。
表1:其他条件不变,与

 溶液等体积混合的溶液中含量对镀层外观的影响。
溶液等体积混合的溶液中含量对镀层外观的影响。 含量( 含量(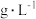 ) ) | 镀层外观表象 |
| 10 | 镀层模糊,无光泽 |
| 25 | 镀层呈雾状,光泽不足 |
| 50 | 镀层光亮、致密 |
温度/ | 镀层外观表象 |
| 25 | 光亮 |
| 35 | 光亮 |
| 40 | 光亮 |
| 55 | 光亮不均匀 |
(5)表1中
 含量为
含量为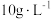 时,镀层模糊、无光泽的原因是
时,镀层模糊、无光泽的原因是表2中温度为
 时镀层光亮不均匀的主要原因是
时镀层光亮不均匀的主要原因是Ⅳ.探究新配方电镀银。
由于电镀液使用氰化钾,在电镀过程中会产生有毒气体,以及废液含剧毒的氰化物,不符合环境要求。由
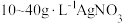 溶液和
溶液和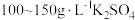 溶液组成电镀液也可以得到光亮、致密的镀层。
溶液组成电镀液也可以得到光亮、致密的镀层。(6)使用新配方可以达到同样的目的,其原理是
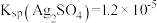 。
。
您最近一年使用:0次
2024-04-16更新
|
269次组卷
|
5卷引用:2024届陕西省商洛市高三下学期第三次尖子生学情诊断考试理综试题-高中化学
2024届陕西省商洛市高三下学期第三次尖子生学情诊断考试理综试题-高中化学2024届青海省西宁市大通县高三下学期第二次模拟考试理科综合试题-高中化学2024届青海省玉树州高三下学期第四次联考理综试题-高中化学2024届河南省TOP二十名校联考高三下学期5月猜题(一)理科综合试卷-高中化学(已下线)压轴题12?化学实验综合题(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)