 (三氯化六氨合钴,
(三氯化六氨合钴,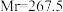 )是合成其他含钴配合物的重要原料,实验室中可由金属钴及其他原料制备
)是合成其他含钴配合物的重要原料,实验室中可由金属钴及其他原料制备 。
。已知:①在
 时,
时, 恰好完全沉淀为
恰好完全沉淀为 ;
;②不同温度下
 在水中的溶解度如图所示;
在水中的溶解度如图所示;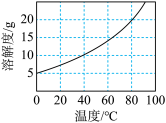
 易潮解,Co(Ⅲ)的氧化性强于
易潮解,Co(Ⅲ)的氧化性强于 。
。制备步骤如下:
Ⅰ.
 的制备:用金属钴与氯气反应制备
的制备:用金属钴与氯气反应制备 ,实验中利用如图装置(连接处橡胶管省略)进行制备。
,实验中利用如图装置(连接处橡胶管省略)进行制备。
 锥形瓶内加入
锥形瓶内加入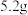 研细的
研细的 、
、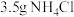 和
和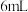 水,加热溶解后加入
水,加热溶解后加入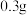 活性炭作催化剂。
活性炭作催化剂。Ⅲ.冷却后,加入浓氨水混合均匀。控制温度在10℃以下并缓慢加入
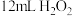 溶液。
溶液。Ⅳ.在60℃下反应一段时间后,经过___________、过滤、洗涤、干燥等操作,得到橙黄色的
 晶体
晶体 。
。请回答下列问题:
(1)仪器a的名称为
(2)用图中的装置组合制备
 ,仪器的连接顺序为
,仪器的连接顺序为(3)制备三氯化六氨合钴的反应方程式为
(4)在制备
 时,加入浓氨水前,需在步骤Ⅱ中加入
时,加入浓氨水前,需在步骤Ⅱ中加入 ,请结合平衡移动原理解释原因
,请结合平衡移动原理解释原因(5)步骤Ⅲ中在加入
 溶液时,控制温度在10℃以下缓慢加入的目的是
溶液时,控制温度在10℃以下缓慢加入的目的是(6)在步骤Ⅳ中过滤、洗涤、干燥之前的操作为
(7)制得
 产品的产率为
产品的产率为
2024·陕西榆林·三模 查看更多[4]
(已下线)2024届陕西省榆林市高三下学期第四次模拟检测(三模)理综试题-高中化学(已下线)江苏省姜堰中学、如东中学、前黄中学三校2023-2024学年高三下学期联考化学试题(已下线)江苏省南京市第十三中学2024届高三下学期适应性考试化学试题2024届陕西省榆林市高三第四次模拟理综试题-高中化学
更新时间:2024-05-22 10:49:11
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】将某黄铜矿(主要成分为CuFeS2)和O2在一定温度范围内发生反应,反应所得固体混合物X中含有CuSO4、FeSO4、Fe2(SO4)3及少量SiO2等,除杂后可制得纯净的胆矾晶体(CuSO4·5H2O)。
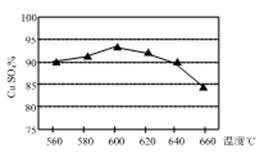
(1)实验测得温度对反应所得固体混合物中水溶性铜(CuSO4)的含量的影响如图所示。生产过程中应将温度控制在_____ 左右,温度升高至一定程度后,水溶性铜含量下降的可能原因是_____ 。
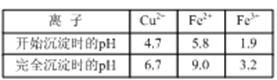
(2)下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。实验中可选用的试剂和用品:稀硫酸、3 % H2O2溶液、CuO、玻璃棒、精密pH试纸。
①实验时需用约3 %的H2O2溶液100 mL,现用市售30%(密度近似为1g•cm-3)的H2O2来配制,其具体配制方法是_____ 。
②补充完整由反应所得固体混合物X制得纯净胆矾晶体的实验步骤:
第一步:将混合物加入过量稀硫酸,搅拌、充分反应,过滤。
第二步:_____ 。
第三步:_____ ,过滤。
第四步:_____ 、冷却结晶。
第五步:过滤、洗涤,低温干燥。
(3)在酸性、有氧条件下,一种叫Thibacillus ferroxidans的细菌能将黄铜矿转化成硫酸盐,该过程反应的离子方程式为_________ 。
(1)实验测得温度对反应所得固体混合物中水溶性铜(CuSO4)的含量的影响如图所示。生产过程中应将温度控制在

(2)下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。实验中可选用的试剂和用品:稀硫酸、3 % H2O2溶液、CuO、玻璃棒、精密pH试纸。

①实验时需用约3 %的H2O2溶液100 mL,现用市售30%(密度近似为1g•cm-3)的H2O2来配制,其具体配制方法是
②补充完整由反应所得固体混合物X制得纯净胆矾晶体的实验步骤:
第一步:将混合物加入过量稀硫酸,搅拌、充分反应,过滤。
第二步:
第三步:
第四步:
第五步:过滤、洗涤,低温干燥。
(3)在酸性、有氧条件下,一种叫Thibacillus ferroxidans的细菌能将黄铜矿转化成硫酸盐,该过程反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
【推荐2】铂(78Pt)被誉为“第一重要的高技术金属”,因独特的物理化学性质,被广泛应用于汽车、石油化工、电气电子等现代工业中。水合肼还原精炼法是铂精炼的方法之一,流程如下:

已知:①氯铂酸铵[(NH4)2PtCl6],黄色,难溶于水,易溶于盐酸并生成H2PtCl6;
②氯亚铂酸铵[(NH4)2PtCl4],红色,易溶于水。
回答下列问题:
(1)铂位于周期表中第______ 周期,试写出一种金属铂在中学化学中的应用____________
(2)工业原料粗氯铂酸铵中含有大量氯化铵等可溶性的盐,在实验室中预处理时,需将样品溶解过滤后洗涤,洗涤沉淀方法是____________
(3)在还原溶解中观察到的现象:__________
(4)氧化沉淀过程的反应方程式为:___________
(5)有研究表明,氯铂酸铵制取金属铂,除了煅烧外,也可将其溶解于盐酸中,加入Zn,得到产品,反应过程有Zn+2HCl = ZnCl2+H2↑;_________
(6)水合肼还原精炼法在溶解时的固液比、溶液的酸度(盐酸浓度)、反应时间等对于精炼铂的产率,均有较大的影响。在不同酸度下达到较高产率所需时间,以及不同固液比在最佳酸度下反应时间与产率关系如图所示,由此可得最佳的反应条件是_________


已知:①氯铂酸铵[(NH4)2PtCl6],黄色,难溶于水,易溶于盐酸并生成H2PtCl6;
②氯亚铂酸铵[(NH4)2PtCl4],红色,易溶于水。
回答下列问题:
(1)铂位于周期表中第
(2)工业原料粗氯铂酸铵中含有大量氯化铵等可溶性的盐,在实验室中预处理时,需将样品溶解过滤后洗涤,洗涤沉淀方法是
(3)在还原溶解中观察到的现象:
(4)氧化沉淀过程的反应方程式为:
(5)有研究表明,氯铂酸铵制取金属铂,除了煅烧外,也可将其溶解于盐酸中,加入Zn,得到产品,反应过程有Zn+2HCl = ZnCl2+H2↑;
(6)水合肼还原精炼法在溶解时的固液比、溶液的酸度(盐酸浓度)、反应时间等对于精炼铂的产率,均有较大的影响。在不同酸度下达到较高产率所需时间,以及不同固液比在最佳酸度下反应时间与产率关系如图所示,由此可得最佳的反应条件是

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐3】某科研小组利用硫铁矿(主要成分是FeS2,含Fe2O3、SiO2、Al2O3等杂质)制备重要的化工原料纳米Fe2O3的工艺流程如图所示。

回答下列问题:
(1)煅烧前硫铁矿粉碎的目的是__ ,硫铁矿煅烧得到的气体需回收,该气体在工业上的主要用途是__ 。
(2)用稀硫酸浸取硫铁矿烧渣的主要反应的离子方程式为__ ,浸取后过滤得到的滤渣的化学式为__ 。
(3)加入FeS2的主要目的是还原滤液中的Fe3+,反应的化学方程式为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,反应中每消耗1molFeS2,转移的电子数目为__ ,检验Fe3+是否完全被还原,应选择__ (填标号)。
A.KMnO4溶液 B.K3[Fe(CN)6]溶液 C.KSCN溶液
(4)加FeCO3调溶液pH到5.8左右,其目的为__ 。
(5)加入NH4HCO3生成FeCO3的离子方程式为__ ,若煅烧得到160g纳米Fe2O3,则消耗的气体和生成的气体的物质的量之比为__ 。

回答下列问题:
(1)煅烧前硫铁矿粉碎的目的是
(2)用稀硫酸浸取硫铁矿烧渣的主要反应的离子方程式为
(3)加入FeS2的主要目的是还原滤液中的Fe3+,反应的化学方程式为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,反应中每消耗1molFeS2,转移的电子数目为
A.KMnO4溶液 B.K3[Fe(CN)6]溶液 C.KSCN溶液
(4)加FeCO3调溶液pH到5.8左右,其目的为
(5)加入NH4HCO3生成FeCO3的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】FeCl3是重要的化工原料,无水氯化铁在300℃以上升华,遇潮湿空气极易潮解,现用下列装置来制备无水氯化铁,回答有关问题:

①装置的连接顺序为a→_____ →j,k→_____ (按气流方向,用小写字母表示)。
②实验结束后,取少量F中的固体加水溶解,经检测发现溶液中含有Fe2+,其原因为_______ (请用化学用语表述)。
③实验结束后,取适量F中的固体加水溶解形成溶液,取少量向其中滴加KSCN溶液溶液变红,向原溶液通入SO2反应的离子方程式为_______ 。

①装置的连接顺序为a→
②实验结束后,取少量F中的固体加水溶解,经检测发现溶液中含有Fe2+,其原因为
③实验结束后,取适量F中的固体加水溶解形成溶液,取少量向其中滴加KSCN溶液溶液变红,向原溶液通入SO2反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐2】我国食品行业广泛使用漂白粉作为杀菌消毒剂,因为漂白粉价格低廉,杀菌能力强,消毒效果好。某实验小组利用如图装置制备漂白粉及探究氯气的部分性质。回答下列问题:

(1)甲装置中圆底烧瓶内发生反应的离子方程式为___________ ,浓盐酸体现了___________ (填化学性质);乙装置内的试剂为___________ (填标号)。
a.浓盐酸 b.浓硫酸 c.饱和NaOH溶液 d.饱和食盐水
(2)氯气与石灰乳反应的化学方程式为___________ ,漂白粉的有效成分为___________ 。
(3)一段时间后,丁装置内液体变为浅黄绿色,分别取适量该浅黄绿色液体于试管A、B中。
①往试管A中滴加几滴硝酸银溶液,产生白色沉淀,该反应的离子方程式为___________ 。
②往试管B中滴加几滴紫色石蕊溶液,观察到的现象为___________ 。
(4)漂白粉暴露在空气中易失效,漂白粉在空气中失效发生反应的化学方程式为 、
、___________ 。

(1)甲装置中圆底烧瓶内发生反应的离子方程式为
a.浓盐酸 b.浓硫酸 c.饱和NaOH溶液 d.饱和食盐水
(2)氯气与石灰乳反应的化学方程式为
(3)一段时间后,丁装置内液体变为浅黄绿色,分别取适量该浅黄绿色液体于试管A、B中。
①往试管A中滴加几滴硝酸银溶液,产生白色沉淀,该反应的离子方程式为
②往试管B中滴加几滴紫色石蕊溶液,观察到的现象为
(4)漂白粉暴露在空气中易失效,漂白粉在空气中失效发生反应的化学方程式为
 、
、
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】某学校学习小组利用如下装置制取氯气,并对氯气、次氯酸钠溶液的性质进行探究(夹持装置部分省略)。请回答下列问题:
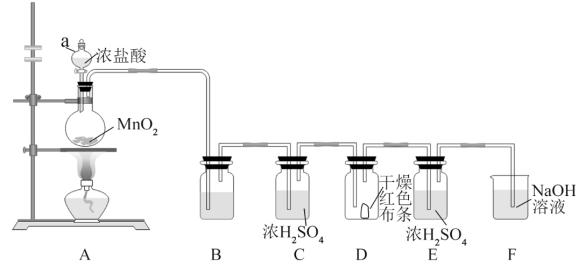
(1)仪器a的名称为___________ ;装置A中发生反应的离子方程式为___________ ;当有 与足量的浓盐酸共热反应完全时,生成的
与足量的浓盐酸共热反应完全时,生成的 在标准状况下的体积为
在标准状况下的体积为___________ L。
(2)装置B中的试剂为___________ ;装置E的作用是___________ 。
(3)装置D中干燥的红色布条不褪色,该实验现象说明___________ 。
(4)实验时,缓慢搅拌装置F中的溶液使溶液略呈淡绿色,停止实验,稍后取下烧杯加热,直至溶液颜色褪去。将上述烧杯中的溶液平均分成二份,加入下图内置有红布条的试管中放置相同的时间,根据现象得出溶液中起漂白作用的微粒主要是___________ (填化学式)。使装置F中溶液略呈淡绿色的目的是___________ 。


(1)仪器a的名称为
 与足量的浓盐酸共热反应完全时,生成的
与足量的浓盐酸共热反应完全时,生成的 在标准状况下的体积为
在标准状况下的体积为(2)装置B中的试剂为
(3)装置D中干燥的红色布条不褪色,该实验现象说明
(4)实验时,缓慢搅拌装置F中的溶液使溶液略呈淡绿色,停止实验,稍后取下烧杯加热,直至溶液颜色褪去。将上述烧杯中的溶液平均分成二份,加入下图内置有红布条的试管中放置相同的时间,根据现象得出溶液中起漂白作用的微粒主要是

您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】硫代硫酸钠(Na2S2O3),又名大苏打、海波,它是无色透明的单斜晶体,熔点48℃。硫代硫酸钠(Na2S2O3)可作为照相业的定影剂,反应原理为AgBr+2Na2S2O3=Na3[Ag(S2O3)2]+NaBr。
Ⅰ.为了从废定影液中提取 AgNO3,设计如下实验流程。
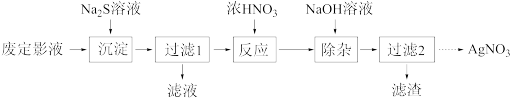
(1)“沉淀”步骤中生成 Ag2S 沉淀,检验沉淀完全的操作是________ 。
(2)“反应”步骤中会生成淡黄色固体,该反应的化学方程式为________ 。
(3)“过滤 2”的溶液获取 AgNO3晶体的操作是蒸发浓缩、冷却结晶、________ 、________ 、干燥。
Ⅱ.下图是实验室模拟工业制备 Na2S2O3的装置图。
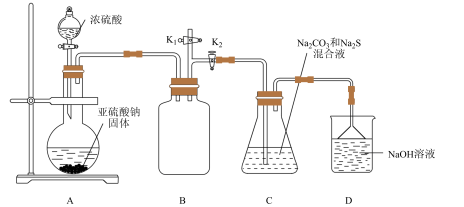
依据图示回答下列问题:
(4)装置 A 中盛放亚硫酸钠固体的玻璃仪器名称是________ ,装置 B 的作用是________ 。
(5)分液漏斗中如直接用 98%的浓硫酸,烧瓶中固体易产生“结块”现象,使反应速率变慢。产生“结块”现象的原因是________ 。
(6)设置 K1导管的目的是为了防止拆除装置时造成空气污染。请简述操作方法________ 。
(7)硫代硫酸钠还可用于除去鞣制皮革时过量的重铬酸盐,将其还原成 Cr3+,理论上处理1mol Cr2O72-需要 Na2S2O3的质量为________ 。
Ⅰ.为了从废定影液中提取 AgNO3,设计如下实验流程。

(1)“沉淀”步骤中生成 Ag2S 沉淀,检验沉淀完全的操作是
(2)“反应”步骤中会生成淡黄色固体,该反应的化学方程式为
(3)“过滤 2”的溶液获取 AgNO3晶体的操作是蒸发浓缩、冷却结晶、
Ⅱ.下图是实验室模拟工业制备 Na2S2O3的装置图。

依据图示回答下列问题:
(4)装置 A 中盛放亚硫酸钠固体的玻璃仪器名称是
(5)分液漏斗中如直接用 98%的浓硫酸,烧瓶中固体易产生“结块”现象,使反应速率变慢。产生“结块”现象的原因是
(6)设置 K1导管的目的是为了防止拆除装置时造成空气污染。请简述操作方法
(7)硫代硫酸钠还可用于除去鞣制皮革时过量的重铬酸盐,将其还原成 Cr3+,理论上处理1mol Cr2O72-需要 Na2S2O3的质量为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】由废铁制备FeCl2并测定FeCl2的含量。主要过程如下所示:
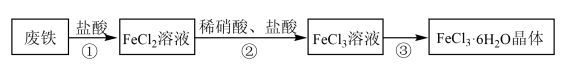
I.按上图所示过程制备FeCl3·6H2O。
(1)用离子方程式表示过程②中稀硝酸的作用:_________________________ 。
(2)在过程②中要不断向溶液中补充盐酸,目的是___________________ 。
(3)步骤③的操作是_______________________ 。
Ⅱ.由FeCl3·6H2O制得干燥FeCl2的过程如下所示:
①向盛有FeCl3·6H2O的容器中加入SOCl2,加热,获得无水FeCl3;
②将无水FeCl3置于反应管中,通入过程①中产生的气体一段时间后加热,生成FeCl2;
③收集FeCl2保存备用。
(4)上述过程2中产生FeCl2的化学方程式是________________________ 。
Ⅲ.测定FeCl2的含量。
分析方法:①取a g样品配制成100 mL溶液;②用移液管吸取所配溶液5.00 mL,放入500 mL、锥形瓶内并加水200 mL;③加硫酸锰溶液20.00mL,用0.1 mol/L酸性高锰酸钾标准溶液滴定,终点时消耗酸性高锰酸钾标准溶液V mL。
(5)滴定终点的判断依据是______________________ 。
(6)滴定时如果不加入硫酸锰很容易导致测定结果偏高,则加入硫酸锰可使测定结果准确的原因可能是_____________________ 。
(7)若所配溶液中 (FeC12) (g/L) =kV(式中V—消耗的酸性高锰酸钾标准溶液的毫升数),则k=
(FeC12) (g/L) =kV(式中V—消耗的酸性高锰酸钾标准溶液的毫升数),则k=_____________ (保留四位有效数字)。

I.按上图所示过程制备FeCl3·6H2O。
(1)用离子方程式表示过程②中稀硝酸的作用:
(2)在过程②中要不断向溶液中补充盐酸,目的是
(3)步骤③的操作是
Ⅱ.由FeCl3·6H2O制得干燥FeCl2的过程如下所示:
①向盛有FeCl3·6H2O的容器中加入SOCl2,加热,获得无水FeCl3;
②将无水FeCl3置于反应管中,通入过程①中产生的气体一段时间后加热,生成FeCl2;
③收集FeCl2保存备用。
(4)上述过程2中产生FeCl2的化学方程式是
Ⅲ.测定FeCl2的含量。
分析方法:①取a g样品配制成100 mL溶液;②用移液管吸取所配溶液5.00 mL,放入500 mL、锥形瓶内并加水200 mL;③加硫酸锰溶液20.00mL,用0.1 mol/L酸性高锰酸钾标准溶液滴定,终点时消耗酸性高锰酸钾标准溶液V mL。
(5)滴定终点的判断依据是
(6)滴定时如果不加入硫酸锰很容易导致测定结果偏高,则加入硫酸锰可使测定结果准确的原因可能是
(7)若所配溶液中
 (FeC12) (g/L) =kV(式中V—消耗的酸性高锰酸钾标准溶液的毫升数),则k=
(FeC12) (g/L) =kV(式中V—消耗的酸性高锰酸钾标准溶液的毫升数),则k=
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
【推荐3】硼氢化钠(NaBH4)是有机合成中常用的还原剂。一种制备硼氢化钠的工艺如下(部分条件和产物省略):

已知: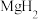 、
、 遇水蒸气剧烈反应并放出
遇水蒸气剧烈反应并放出 。
。
回答下列问题:
(1)下列硼原子电子排布图表示的状态中,能量最低和最高的分别为___________ 、___________ (填标号)。
A. B.
B.
C. D.
D.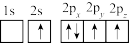
(2)难溶的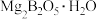 与浓氢氧化钠溶液反应的离子方程式为
与浓氢氧化钠溶液反应的离子方程式为___________ 。
(3)已知 溶于水能产生两种气体,其中一种气体能使品红溶液褪色,则灼烧
溶于水能产生两种气体,其中一种气体能使品红溶液褪色,则灼烧 时加入
时加入 的目的是
的目的是___________ 。
(4)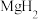 和
和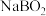 必须在干燥条件下合成
必须在干燥条件下合成 ,其原因是
,其原因是___________ ,二者反应生成 的化学方程式为
的化学方程式为___________ 。
(5) 的电子式为
的电子式为___________ 。其中三种元素的电负性由大到小的顺序是___________ 。其中 的立体构型为
的立体构型为___________ 。

已知:
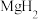 、
、 遇水蒸气剧烈反应并放出
遇水蒸气剧烈反应并放出 。
。回答下列问题:
(1)下列硼原子电子排布图表示的状态中,能量最低和最高的分别为
A.
 B.
B.
C.
 D.
D.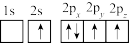
(2)难溶的
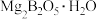 与浓氢氧化钠溶液反应的离子方程式为
与浓氢氧化钠溶液反应的离子方程式为(3)已知
 溶于水能产生两种气体,其中一种气体能使品红溶液褪色,则灼烧
溶于水能产生两种气体,其中一种气体能使品红溶液褪色,则灼烧 时加入
时加入 的目的是
的目的是(4)
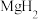 和
和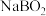 必须在干燥条件下合成
必须在干燥条件下合成 ,其原因是
,其原因是 的化学方程式为
的化学方程式为(5)
 的电子式为
的电子式为 的立体构型为
的立体构型为
您最近一年使用:0次



