解题方法
1 . 将CO2转化为CO是利用CO2的重要途径,由CO出发可以制备多种液体燃料。
(1)我国在CO2催化加氢制取汽油方面取得突破性进展,转化过程如下所示。
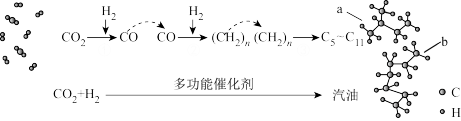
①图中a的名称是_______ 。
②CO2、a中碳原子的杂化轨道类型分别为_______ 。
(2)Cu、Cu2O可应用于CO2转化CO的研究。以CuSO4·5H2O、Na2SO3、Na2CO3为原料能制备Cu2O。
①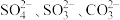 空间结构为平面三角形的是
空间结构为平面三角形的是_______ 。
②[Cu(H2O)4]2+离子中,配体是_______ 。
③除配位键外,CuSO4·5H2O中存在的化学键还有_______ 。
④将生成Cu2O的反应补充完整。______
(3)在Cu催化剂作用下,反应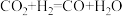 的可能机理如下。
的可能机理如下。
ⅰ.
ⅱ._______ 。(写出反应方程式)
(4)Cu的晶胞(图1)、Cu2O的晶胞(图2)如下所示。
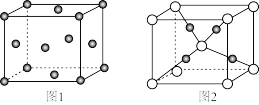
金属铜的一个晶胞中的铜原子数与Cu2O一个晶胞中的铜原子数之比为_______ 。
(1)我国在CO2催化加氢制取汽油方面取得突破性进展,转化过程如下所示。

①图中a的名称是
②CO2、a中碳原子的杂化轨道类型分别为
(2)Cu、Cu2O可应用于CO2转化CO的研究。以CuSO4·5H2O、Na2SO3、Na2CO3为原料能制备Cu2O。
①
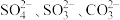 空间结构为平面三角形的是
空间结构为平面三角形的是②[Cu(H2O)4]2+离子中,配体是
③除配位键外,CuSO4·5H2O中存在的化学键还有
④将生成Cu2O的反应补充完整。
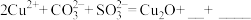
(3)在Cu催化剂作用下,反应
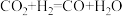 的可能机理如下。
的可能机理如下。ⅰ.

ⅱ.
(4)Cu的晶胞(图1)、Cu2O的晶胞(图2)如下所示。

金属铜的一个晶胞中的铜原子数与Cu2O一个晶胞中的铜原子数之比为
您最近一年使用:0次
2 . 氮及其化合物在工业、农业、生活中有着重要的应用。如二元氮化物(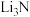 、CrN等)、三元锂过渡金属氮化物(
、CrN等)、三元锂过渡金属氮化物( 等)等在储氢领域、化学电源领域都有着重要的应用。
等)等在储氢领域、化学电源领域都有着重要的应用。
(1)Cr原子的核外电子排布式为_______ ;第一电离能:N_______ (填“>”或“<”)0。
(2) 可用于制备许多其他的含氮化合物{如
可用于制备许多其他的含氮化合物{如 、
、 、
、 、
、 等}以满足我们生产、生活的需要。
等}以满足我们生产、生活的需要。 中N的杂化类型为
中N的杂化类型为_______ , 中Fe的配位数为
中Fe的配位数为_______ 。
(3)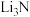 是很好的储氢材料,与
是很好的储氢材料,与 发生反应生成
发生反应生成 和LiH,写出该反应的化学方程式:
和LiH,写出该反应的化学方程式:_______ ,该反应中氧化剂与还原剂的物质的量之比为_______ 。
(4) 晶体中,
晶体中, 为面心立方堆积,
为面心立方堆积, 填充了其中一半的四面体空隙,晶胞如图1所示,则一个
填充了其中一半的四面体空隙,晶胞如图1所示,则一个 晶胞中共含有
晶胞中共含有_______ 个共价键;设该晶胞的边长为acm,用NA表示阿伏加德罗常数的值,则该晶体的密度为_______ (用含a和NA的代数式表示) 。
。

(5) 、
、 和
和 形成立方晶体,其结构可以看作NaCl型结构,其中
形成立方晶体,其结构可以看作NaCl型结构,其中 和
和 分别占据体心和棱心,
分别占据体心和棱心, 占据面心,立方晶胞如图2所示,该晶体的化学式为
占据面心,立方晶胞如图2所示,该晶体的化学式为_______ 。

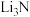 、CrN等)、三元锂过渡金属氮化物(
、CrN等)、三元锂过渡金属氮化物( 等)等在储氢领域、化学电源领域都有着重要的应用。
等)等在储氢领域、化学电源领域都有着重要的应用。(1)Cr原子的核外电子排布式为
(2)
 可用于制备许多其他的含氮化合物{如
可用于制备许多其他的含氮化合物{如 、
、 、
、 、
、 等}以满足我们生产、生活的需要。
等}以满足我们生产、生活的需要。 中N的杂化类型为
中N的杂化类型为 中Fe的配位数为
中Fe的配位数为(3)
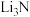 是很好的储氢材料,与
是很好的储氢材料,与 发生反应生成
发生反应生成 和LiH,写出该反应的化学方程式:
和LiH,写出该反应的化学方程式:(4)
 晶体中,
晶体中, 为面心立方堆积,
为面心立方堆积, 填充了其中一半的四面体空隙,晶胞如图1所示,则一个
填充了其中一半的四面体空隙,晶胞如图1所示,则一个 晶胞中共含有
晶胞中共含有 。
。
(5)
 、
、 和
和 形成立方晶体,其结构可以看作NaCl型结构,其中
形成立方晶体,其结构可以看作NaCl型结构,其中 和
和 分别占据体心和棱心,
分别占据体心和棱心, 占据面心,立方晶胞如图2所示,该晶体的化学式为
占据面心,立方晶胞如图2所示,该晶体的化学式为
您最近一年使用:0次
名校
解题方法
3 . 钒具有广泛用途,利用含钒废催化剂(主要含有V2O5、VOSO4和不溶性硅酸盐)制备V2O5的新工艺流程如图:

已知:滤液1和滤液2中钒以VO2+的形式存在。回答下列问题:
(1)写出V基态原子核外电子排布式_______ 。
(2)在实验室中操作Ⅰ用到的玻璃仪器有_______ 。
(3)在滤渣1中加入Na2SO3和过量稀H2SO4溶液发生氧化还原反应,氧化剂和还原剂的物质的量之比为_______ 。
(4)混合溶液中加入KClO3,发生反应的离子方程式是_______ 。
(5)钒最后以NH4VO3的形式沉淀出来。沉钒率(NH4VO3沉淀中V的质量和废催化剂中V的质量之比)表示该工艺钒的回收率。图中是沉钒率随温度变化的关系曲线,“沉钒”时,温度超过80℃以后,沉钒率下降的可能原因是_______ (写一条即可)。

(6)称取w g所得产品,先用硫酸溶解,得到(VO2)2SO4溶液,再加入 的(NH4)2Fe(SO4)2溶液,最后用
的(NH4)2Fe(SO4)2溶液,最后用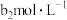 酸性KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗溶液KMnO4的体积为
酸性KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗溶液KMnO4的体积为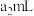 。假设杂质不参与反应,锰元素被还原为Mn2+。求产品中V2O5的质量分数为
。假设杂质不参与反应,锰元素被还原为Mn2+。求产品中V2O5的质量分数为_______ (写出计算过程)[已知(VO2)2SO4和(NH4)2Fe(SO4)2溶液反应的离子方程式为VO +2H++Fe2+=VO2++Fe3++H2O]
+2H++Fe2+=VO2++Fe3++H2O]

已知:滤液1和滤液2中钒以VO2+的形式存在。回答下列问题:
(1)写出V基态原子核外电子排布式
(2)在实验室中操作Ⅰ用到的玻璃仪器有
(3)在滤渣1中加入Na2SO3和过量稀H2SO4溶液发生氧化还原反应,氧化剂和还原剂的物质的量之比为
(4)混合溶液中加入KClO3,发生反应的离子方程式是
(5)钒最后以NH4VO3的形式沉淀出来。沉钒率(NH4VO3沉淀中V的质量和废催化剂中V的质量之比)表示该工艺钒的回收率。图中是沉钒率随温度变化的关系曲线,“沉钒”时,温度超过80℃以后,沉钒率下降的可能原因是

(6)称取w g所得产品,先用硫酸溶解,得到(VO2)2SO4溶液,再加入
 的(NH4)2Fe(SO4)2溶液,最后用
的(NH4)2Fe(SO4)2溶液,最后用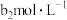 酸性KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗溶液KMnO4的体积为
酸性KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗溶液KMnO4的体积为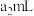 。假设杂质不参与反应,锰元素被还原为Mn2+。求产品中V2O5的质量分数为
。假设杂质不参与反应,锰元素被还原为Mn2+。求产品中V2O5的质量分数为 +2H++Fe2+=VO2++Fe3++H2O]
+2H++Fe2+=VO2++Fe3++H2O]
您最近一年使用:0次
2022-06-24更新
|
333次组卷
|
2卷引用:江苏省南京市六校联合体2021-2022学年高二下学期期末联考化学试题
4 . 氨基磺酸(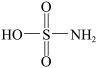 )是一种固体强酸,制备原理:CO(NH2)2+H2SO4+SO3
)是一种固体强酸,制备原理:CO(NH2)2+H2SO4+SO3 2HOSO2NH2+CO2,完成下列填空:
2HOSO2NH2+CO2,完成下列填空:
(1)O、S属同一主族,该族元素的最外层电子轨道表示式为___ ;CO2的电子式是___ 。
(2)反应原理中涉及的第二周期元素的非金属性由强到弱的顺序是_______ 。
(3)完成氨基磺酸受热分解的化学方程式_______ ,其中还原产物是_______ 。
____HOSO2NH2 SO2↑+____SO3↑+____N2↑+2H2↑+______H2O
SO2↑+____SO3↑+____N2↑+2H2↑+______H2O
(4)用过量的NaOH(aq)充分吸收氨基磺酸热解产生的混合气体,所得吸收液中含硫微粒浓度由大到小的顺序是_______ 。向吸收液中加入_______ 试剂,有_______ 现象,说明氨基磺酸热解产生SO3。
(5)氨基磺酸趋向于形成内盐:H2NSO3H→H3NSO3,可作氯水的稳定剂。H3NSO3与Cl2经取代反应生成的一氯代物缓慢水解成HClO,写出该一氯代物水解的化学方程式_______ 。
 )是一种固体强酸,制备原理:CO(NH2)2+H2SO4+SO3
)是一种固体强酸,制备原理:CO(NH2)2+H2SO4+SO3 2HOSO2NH2+CO2,完成下列填空:
2HOSO2NH2+CO2,完成下列填空:(1)O、S属同一主族,该族元素的最外层电子轨道表示式为
(2)反应原理中涉及的第二周期元素的非金属性由强到弱的顺序是
(3)完成氨基磺酸受热分解的化学方程式
____HOSO2NH2
 SO2↑+____SO3↑+____N2↑+2H2↑+______H2O
SO2↑+____SO3↑+____N2↑+2H2↑+______H2O(4)用过量的NaOH(aq)充分吸收氨基磺酸热解产生的混合气体,所得吸收液中含硫微粒浓度由大到小的顺序是
(5)氨基磺酸趋向于形成内盐:H2NSO3H→H3NSO3,可作氯水的稳定剂。H3NSO3与Cl2经取代反应生成的一氯代物缓慢水解成HClO,写出该一氯代物水解的化学方程式
您最近一年使用:0次
解题方法
5 . Na、K属于碱金属元素,其形成的物质在生活生产中有广泛应用。NaCl不仅可以作调味剂,在工业生产中也占据着重要地位。
(1)写出Na+电子式____ ,比较Na+和Cl-的半径大小____ ,NaCl属于___ 晶体。
(2)NaCl是氯碱工业的原料,此工业可以制取的产品有____ (至少写出2种)。
(3)KIO3常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步反应为:______I2+______KClO3+______→______KH(IO3)2+5KCl+3Cl2↑。配平该反应的化学方程式____ 。反应中生成的Cl2可用____ 吸收制备漂粉精。
NaHCO3俗称小苏打,可用于治疗胃酸过多。
(4)有实验小组利用pH传感器探究Na2CO3和NaHCO3的性质,实验过程如表所示。
写出Na2CO3与澄清石灰水反应的离子方程式___ ,OH-未参与该反应的实验证据是____ 。
(5)结合离子方程式说明NaHCO3可用于治疗胃酸过多的原因____ 。胃酸过多易引起胃溃疡,小苏打可用于治疗胃溃疡,如果处于胃溃疡的活动期,医生不建议服用小苏打,请猜测医生不建议的原因____ 。
(1)写出Na+电子式
(2)NaCl是氯碱工业的原料,此工业可以制取的产品有
(3)KIO3常用作食盐中的补碘剂,可用“氯酸钾氧化法”制备,该方法的第一步反应为:______I2+______KClO3+______→______KH(IO3)2+5KCl+3Cl2↑。配平该反应的化学方程式
NaHCO3俗称小苏打,可用于治疗胃酸过多。
(4)有实验小组利用pH传感器探究Na2CO3和NaHCO3的性质,实验过程如表所示。
| 实验操作 | 实验数据 |
 |  |
写出Na2CO3与澄清石灰水反应的离子方程式
(5)结合离子方程式说明NaHCO3可用于治疗胃酸过多的原因
您最近一年使用:0次
解题方法
6 . 硫、氮、氯、氧、钠、铝、铁等是人们熟悉的元素,它们的单质及其化合物对工农业有着很重要的地位。
(1)硫原子的最外层电子排布式_______ 。铝原子核外电子占据轨道有_______ 个,氯原子能量最高的电子亚层是_______ 。过氧化钠的电子式_______ ;氮原子的电子云形状有_______ 种。
(2)氯化钠晶体的熔点高于氯化钾,原因是_______ 。
(3)用Fe2(SO4)3溶液吸收H2S生成FeSO4。FeSO4被氧化使Fe2(SO4)3再生,其原理为:_______FeSO4+_______O2+_______H2SO4 _______Fe2(SO4)3+_______H2O
_______Fe2(SO4)3+_______H2O
①配平上面Fe2(SO4)3再生的化学方程式,并标出电子转移的数目和方向_______ 。
②硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍。由图1和图2判断,使用硫杆菌的最佳条件为_______ ;若反应温度过高,反应速率下降,其原因是_______ 。

(4)常压下,取不同浓度、不同温度的氨水测定,得到下表实验数据。
①温度升高,NH3·H2O的电离平衡向_______ (填“左”、“右”)移动。
②表中c(OH-)基本不变的原因是_______ 。
(1)硫原子的最外层电子排布式
(2)氯化钠晶体的熔点高于氯化钾,原因是
(3)用Fe2(SO4)3溶液吸收H2S生成FeSO4。FeSO4被氧化使Fe2(SO4)3再生,其原理为:_______FeSO4+_______O2+_______H2SO4
 _______Fe2(SO4)3+_______H2O
_______Fe2(SO4)3+_______H2O①配平上面Fe2(SO4)3再生的化学方程式,并标出电子转移的数目和方向
②硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍。由图1和图2判断,使用硫杆菌的最佳条件为

(4)常压下,取不同浓度、不同温度的氨水测定,得到下表实验数据。
| 温度(℃) | c(氨水)(mol/L) | 电离度(%) | c(OH-)(mol/L) |
| 0 | 16.56 | 9.098 | 1.507×10-2 |
| 10 | 15.16 | 10.18 | 1.543×10-2 |
| 20 | 13.63 | 11.2 | 1.527×10-2 |
①温度升高,NH3·H2O的电离平衡向
②表中c(OH-)基本不变的原因是
您最近一年使用:0次
解题方法
7 . 氮化镓 是智能手机的快速充电器中使用的一种半导体材料,可通过单质与氨气在高温下反应可制得。镓在周期表中的位置如图。
是智能手机的快速充电器中使用的一种半导体材料,可通过单质与氨气在高温下反应可制得。镓在周期表中的位置如图。
(1)配平反应:___________ 
 ___________
___________ ___________
___________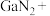 ___________
___________ ;其中氧化剂的电子式
;其中氧化剂的电子式___________ 。
(2)N原子的电子排布式为___________ 。Ga原子核外未成对电子数为___________ 个。
(3)氢化物的热稳定性:
___________  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
Ga分别与N、P、 形成化合物的晶体结构与金刚石相似,其熔点如下表所示:
形成化合物的晶体结构与金刚石相似,其熔点如下表所示:
(4) 晶体中含有的化学键类型为
晶体中含有的化学键类型为___________ 。从结构的角度分析、推测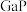 的熔点范围
的熔点范围___________ ,理由是___________ 。
 是智能手机的快速充电器中使用的一种半导体材料,可通过单质与氨气在高温下反应可制得。镓在周期表中的位置如图。
是智能手机的快速充电器中使用的一种半导体材料,可通过单质与氨气在高温下反应可制得。镓在周期表中的位置如图。| Al | P |
| Ga | As |
(1)配平反应:

 ___________
___________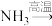 ___________
___________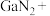 ___________
___________ ;其中氧化剂的电子式
;其中氧化剂的电子式(2)N原子的电子排布式为
(3)氢化物的热稳定性:

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。 Ga分别与N、P、
 形成化合物的晶体结构与金刚石相似,其熔点如下表所示:
形成化合物的晶体结构与金刚石相似,其熔点如下表所示:| 物质 |  | 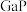 |  |
| 熔点/℃ | 1700 | x | 1238 |
 晶体中含有的化学键类型为
晶体中含有的化学键类型为 的熔点范围
的熔点范围
您最近一年使用:0次
2022-06-15更新
|
190次组卷
|
2卷引用:上海市黄浦区2022届高三6月学业等级考调研测试化学试题
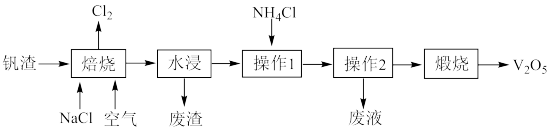
8 . 用工业钒渣(含 、
、 、Fe)制备工业催化剂
、Fe)制备工业催化剂 的流程如图所示:
的流程如图所示:
已知:
① 为白色或淡黄色晶体,易溶于水。
为白色或淡黄色晶体,易溶于水。
② 为白色的结晶性粉末,微溶于冷水,溶于热水。
为白色的结晶性粉末,微溶于冷水,溶于热水。
(1)硫酸工业中, 转化为
转化为 选用
选用 作催化剂,催化过程分两步完成,第二步方程式为
作催化剂,催化过程分两步完成,第二步方程式为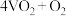
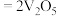 ,则第一步方程式为
,则第一步方程式为_______ 。
(2)“焙烧”过程的产物之一为 ,写出生成
,写出生成 的化学方程式:
的化学方程式:_______ 。废渣的主要成分为氧化铁和_______ 。
(3)“操作1”需要加入过量氯化铵,其目的是_______ ;实验室完成“操作2”时需要用到的玻璃仪器有_______ ;若操作后得到的目标产物纯度不够,则提纯目标产物的方法是_______ 。
(4)“煅烧”中,除生成 外,还生成
外,还生成_______ 。
(5)测定产品纯度的实验步骤如下:
①称取样品ag,加入硫酸,得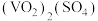 溶液;
溶液;
②加入b
 溶液V1mL(过量),发生如下反应:
溶液V1mL(过量),发生如下反应: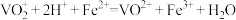
③过量的 用c
用c
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液体积为
溶液体积为 mL。
mL。
当加入最后一滴 溶液时,溶液变为
溶液时,溶液变为_______ ,且半分钟内不恢复原色,说明达到滴定终点。假设杂质不参与反应,则产品中 的质量分数为
的质量分数为_______ %。
 、
、 、Fe)制备工业催化剂
、Fe)制备工业催化剂 的流程如图所示:
的流程如图所示:
已知:
①
 为白色或淡黄色晶体,易溶于水。
为白色或淡黄色晶体,易溶于水。②
 为白色的结晶性粉末,微溶于冷水,溶于热水。
为白色的结晶性粉末,微溶于冷水,溶于热水。(1)硫酸工业中,
 转化为
转化为 选用
选用 作催化剂,催化过程分两步完成,第二步方程式为
作催化剂,催化过程分两步完成,第二步方程式为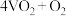
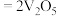 ,则第一步方程式为
,则第一步方程式为(2)“焙烧”过程的产物之一为
 ,写出生成
,写出生成 的化学方程式:
的化学方程式:(3)“操作1”需要加入过量氯化铵,其目的是
(4)“煅烧”中,除生成
 外,还生成
外,还生成(5)测定产品纯度的实验步骤如下:
①称取样品ag,加入硫酸,得
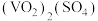 溶液;
溶液;②加入b

 溶液V1mL(过量),发生如下反应:
溶液V1mL(过量),发生如下反应: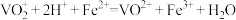
③过量的
 用c
用c
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液体积为
溶液体积为 mL。
mL。当加入最后一滴
 溶液时,溶液变为
溶液时,溶液变为 的质量分数为
的质量分数为
您最近一年使用:0次
2022-05-22更新
|
178次组卷
|
2卷引用:重庆市第八中学校2022届高三高考适应性月考卷(七)化学试题
名校
解题方法
9 . 第VA族元素氮、磷、砷的化合物用途广泛。回答下列问题:
(1)实验中常用 检验
检验 ,
, 中
中 的配位数为
的配位数为_______ ,其中碳原子的杂化轨道类型为_______ 杂化。1mol 中含有
中含有 键的数目为
键的数目为_______ 。
(2)铁和氨在640℃可发生置换反应,产物之一的立方晶胞结构如图所示,写出该反应的化学方程式:_______ 。

(3)阿伏加德罗常数的值为 ,X射线衍实验测得该晶胞参数为anm,则晶胞的密度为
,X射线衍实验测得该晶胞参数为anm,则晶胞的密度为_______  (写出表达式即可)。
(写出表达式即可)。
(4)用铬原子代替部分铜原子,可以形成一系列铜—铬合金。其中两种铜—铬合金的晶体结构如图所示。

①晶体a中铬原子的配位数为_______ 。
②晶体b中铬原子填充在由铜原子构成的_______ (填“四面体”“六面体”或“八面体”)空隙中, 表示阿伏加德罗常数的值,铜原子半径为
表示阿伏加德罗常数的值,铜原子半径为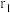 cm,铬原子半径为
cm,铬原子半径为 cm,则晶体b的空间利用率为
cm,则晶体b的空间利用率为_______ 。(写出表达式即可)
(1)实验中常用
 检验
检验 ,
, 中
中 的配位数为
的配位数为 中含有
中含有 键的数目为
键的数目为(2)铁和氨在640℃可发生置换反应,产物之一的立方晶胞结构如图所示,写出该反应的化学方程式:

(3)阿伏加德罗常数的值为
 ,X射线衍实验测得该晶胞参数为anm,则晶胞的密度为
,X射线衍实验测得该晶胞参数为anm,则晶胞的密度为 (写出表达式即可)。
(写出表达式即可)。(4)用铬原子代替部分铜原子,可以形成一系列铜—铬合金。其中两种铜—铬合金的晶体结构如图所示。

①晶体a中铬原子的配位数为
②晶体b中铬原子填充在由铜原子构成的
 表示阿伏加德罗常数的值,铜原子半径为
表示阿伏加德罗常数的值,铜原子半径为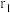 cm,铬原子半径为
cm,铬原子半径为 cm,则晶体b的空间利用率为
cm,则晶体b的空间利用率为
您最近一年使用:0次
10 .  常应用于电池、催化剂、染料等方面。含钴废水会污染环境,须经处理后才能排放。
常应用于电池、催化剂、染料等方面。含钴废水会污染环境,须经处理后才能排放。
(1) 中钴离子的基态核外电子排布式为
中钴离子的基态核外电子排布式为_______ 。
(2)以废旧锂离子电池的正极材料(主要含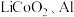 )为原料可以制备
)为原料可以制备 。
。
主要步骤如下:
①碱浸:将正极材料浸没于 溶液中,充分反应后过滤洗涤,取滤渣(LiCoO2)。写出该步反应的离子方程式
溶液中,充分反应后过滤洗涤,取滤渣(LiCoO2)。写出该步反应的离子方程式_______ 。
②还原:将滤渣浸入稀 与
与 的混合溶液中,该反应的化学方程式为
的混合溶液中,该反应的化学方程式为_______ ,酸化用 不用盐酸其主要原因:I.盐酸挥发利用率低;II.
不用盐酸其主要原因:I.盐酸挥发利用率低;II._______ 。
③沉钴:向步骤②反应后的溶液中,滴加 溶液,可得
溶液,可得 。
。
(3)氧化石墨烯/硅基杂化膜是一种主要基于“阴阳离子之间的静电吸附”处理含重金属离子废水的常用材料。利用氧化石墨烯/硅基杂化膜处理某含钴(Co2+)废水,在不同 的条件下,对钴离子的吸附效果如图所示,A点吸附率比B点低原因是
的条件下,对钴离子的吸附效果如图所示,A点吸附率比B点低原因是_______ ,C点吸附率比B点低的原因是_______ 。[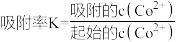 ]
]

 常应用于电池、催化剂、染料等方面。含钴废水会污染环境,须经处理后才能排放。
常应用于电池、催化剂、染料等方面。含钴废水会污染环境,须经处理后才能排放。(1)
 中钴离子的基态核外电子排布式为
中钴离子的基态核外电子排布式为(2)以废旧锂离子电池的正极材料(主要含
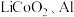 )为原料可以制备
)为原料可以制备 。
。主要步骤如下:
①碱浸:将正极材料浸没于
 溶液中,充分反应后过滤洗涤,取滤渣(LiCoO2)。写出该步反应的离子方程式
溶液中,充分反应后过滤洗涤,取滤渣(LiCoO2)。写出该步反应的离子方程式②还原:将滤渣浸入稀
 与
与 的混合溶液中,该反应的化学方程式为
的混合溶液中,该反应的化学方程式为 不用盐酸其主要原因:I.盐酸挥发利用率低;II.
不用盐酸其主要原因:I.盐酸挥发利用率低;II.③沉钴:向步骤②反应后的溶液中,滴加
 溶液,可得
溶液,可得 。
。(3)氧化石墨烯/硅基杂化膜是一种主要基于“阴阳离子之间的静电吸附”处理含重金属离子废水的常用材料。利用氧化石墨烯/硅基杂化膜处理某含钴(Co2+)废水,在不同
 的条件下,对钴离子的吸附效果如图所示,A点吸附率比B点低原因是
的条件下,对钴离子的吸附效果如图所示,A点吸附率比B点低原因是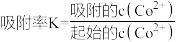 ]
]
您最近一年使用:0次



