名校
解题方法
1 . 合理应用和处理氮的化合物,在生产生活中有重要意义。完成下列填空:
(1)尿素[CO(NH2)2]是一种高效化肥,其分子中各原子的原子半径由大到小顺序为______ ;碳原子核外电子排布式______ ,其最外层______ 种能量不同的电子,有______ 种不同形状的电子云。
(2)氰化钠(NaCN)中,N元素显—3价,则非金属性N______ C(填“<”、“=”或“>”),从原子结构角度解释非金属性强弱的原因______ 。
(3)C3N4是一种硬度可以和金刚石媲美的而在自然界中尚未发现的新的共价化合物,结合所学知识解释它高硬度的性质______ 。
(4)氰化钠属于剧毒物质,可用双氧水或硫代硫酸钠处理。
①用双氧水处理,发生的反应为:NaCN+H2O2+H2O=A+NH3↑,则A的化学式为______ 。
②NaCN与Na2S2O3二者等物质的量反应可得到两种含硫元素的离子,其中一种遇到Fe3+显血红色。写出该反应的离子方程式______ 。
(5)NO2会污染环境,可用Na2CO3溶液吸收NO2并放出CO2。已知9.2gNO2和Na2CO3溶液完全反应时转移电子0.1mol,此反应的离子方程式是______ ;恰好反应后,所得溶液呈弱碱性,则溶液中各离子浓度大小关系是______ 。
(1)尿素[CO(NH2)2]是一种高效化肥,其分子中各原子的原子半径由大到小顺序为
(2)氰化钠(NaCN)中,N元素显—3价,则非金属性N
(3)C3N4是一种硬度可以和金刚石媲美的而在自然界中尚未发现的新的共价化合物,结合所学知识解释它高硬度的性质
(4)氰化钠属于剧毒物质,可用双氧水或硫代硫酸钠处理。
①用双氧水处理,发生的反应为:NaCN+H2O2+H2O=A+NH3↑,则A的化学式为
②NaCN与Na2S2O3二者等物质的量反应可得到两种含硫元素的离子,其中一种遇到Fe3+显血红色。写出该反应的离子方程式
(5)NO2会污染环境,可用Na2CO3溶液吸收NO2并放出CO2。已知9.2gNO2和Na2CO3溶液完全反应时转移电子0.1mol,此反应的离子方程式是
您最近一年使用:0次
解题方法
2 . 咔咯(corrole)及其配合物作为人工合成的大环配体之一,咔咯的合成及其与金属离子的配位化学备受关注。利用咔咯作为反应配体,可实现过渡金属离子的非常规氧化态,制备功能材料,探索新型催化剂,等等。下图(a)给出三(五氟苯基)咔咯分子(A)的示意图,简写为H3(tpfc)。它与金属离子结合时四个氮原子均参与配位。室温下,空气中,Cr(CO)6和A在甲苯中回流得到深红色晶体B(反应1),B显顺磁性,有效磁矩为1.72μB,其中金属离子的配位几何为四方锥;在惰性气氛保护下,B与三苯基膦(PPh3)和三苯基氧膦(OPPh3)按1:1:1在甲苯中反应得到绿色晶体C(反应2);在氩气保护下,CrCl2和A在吡啶(简写为py)中反应,得到深绿色晶体D(反应3),D中金属离子为八面体配位,配位原子均为氮原子。在一定的条件下,B、C和D之间可以发生转化(下图b),这一过程被认为有可能用于O2的活化或消除。
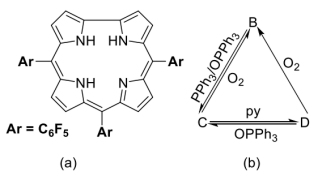
(1)A中的咔咯环是否有芳香性______ ?与之对应的π电子数是______ 。
(2)写出B、C、D的化学式(要求:配体用简写符号表示):
B______ 、C______ 、D______ 。
(3)写出B、C、D中金属离子的价电子组态(均用dn方式表示)。
B______ 、C______ 、D______ 。
(4)写出制备B、C、D的反应方程式(要求:配体用简写符号,系数为最简整数比)。
B______ 、C______ 、D______ 。
(5)利用电化学处理,B可以得电子转化为B-,也可以失去电子转化为B+。与预期的磁性相反,B+依然显示顺磁性。进一步光谱分析发现,与咔咯环配体相关的吸收峰位置发生了显著变化。推测金属离子的价电子组态______ (用dn方式表示),指出磁性与光谱变化的原因______ 。

(1)A中的咔咯环是否有芳香性
(2)写出B、C、D的化学式(要求:配体用简写符号表示):
B
(3)写出B、C、D中金属离子的价电子组态(均用dn方式表示)。
B
(4)写出制备B、C、D的反应方程式(要求:配体用简写符号,系数为最简整数比)。
B
(5)利用电化学处理,B可以得电子转化为B-,也可以失去电子转化为B+。与预期的磁性相反,B+依然显示顺磁性。进一步光谱分析发现,与咔咯环配体相关的吸收峰位置发生了显著变化。推测金属离子的价电子组态
您最近一年使用:0次
解题方法
3 . 金属元素A的单质为面心立方结构,晶胞参数a=383.9pm,密度为22.50g/cm3。A与氟气反应得到一种八面体型的氟化物分子B。B与氢气按2:1计量关系反应,得到分子C,C为四聚体,其理想模型有四次旋转轴。A在空气中加热得氧化物D,D属四方晶系,晶胞如下图所示。B与水反应亦可得到D。C与A的单质按1:1计量关系在400℃下反应得化合物E。近期在质谱中捕捉到A的一种四面体型氧合正离子F。(阿伏加德罗常数6.022×1023mol-1)
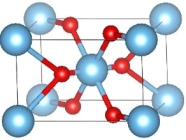
(1)通过计算,确定A是哪种元素______ 。
(2)写出B~F的分子式(或化学式):B______ ,C______ ,D______ ,E______ ,F______ 。
(3)画出C分子的结构示意图______ 。
(4)写出如下反应方程式(要求系数为最简整数比)。
①B与水反应______ ;
②C和A反应生成E______ 。

(1)通过计算,确定A是哪种元素
(2)写出B~F的分子式(或化学式):B
(3)画出C分子的结构示意图
(4)写出如下反应方程式(要求系数为最简整数比)。
①B与水反应
②C和A反应生成E
您最近一年使用:0次
4 . Goodenough等人因在锂离子电池及磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)LiFePO4是一种潜在的锂离子电池正极材料,它可以通过(NH4)2Fe(SO4)2、H3PO4与LiOH溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而值得。
①共沉淀反应投料时,不将(NH4)2Fe(SO4)2和LiOH溶液直接混合的原因是___ ,共沉淀反应的化学方程式为___ 。
②参与反应的H3PO4能与水以任意比互溶的原因是___ 。
③高温成型前,常向LiFePO4中加入少量活性炭黑,其作用除了可以改善成型后的LiFePO4的导电性能外,还能___ 。
(2)LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。
①每个晶胞中含有LiFePO4的单元数有___ 个。
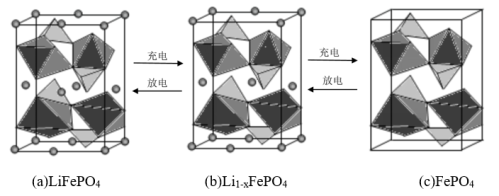
②电池充电时,LiFePO4脱出部分Li+,形成Li1-xFePO4,结构示意图如(b)所示,则x=___ ,n(Fe2+)∶n(Fe3+)=___ 。
(1)LiFePO4是一种潜在的锂离子电池正极材料,它可以通过(NH4)2Fe(SO4)2、H3PO4与LiOH溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而值得。
①共沉淀反应投料时,不将(NH4)2Fe(SO4)2和LiOH溶液直接混合的原因是
②参与反应的H3PO4能与水以任意比互溶的原因是
③高温成型前,常向LiFePO4中加入少量活性炭黑,其作用除了可以改善成型后的LiFePO4的导电性能外,还能
(2)LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。
①每个晶胞中含有LiFePO4的单元数有

②电池充电时,LiFePO4脱出部分Li+,形成Li1-xFePO4,结构示意图如(b)所示,则x=
您最近一年使用:0次
解题方法
5 . 氮元素可形成很多重要的化合物,其中叠氮化钠(NaN3)被广泛应用于汽车安全气囊。叠氮化钠的制取方法是:①金属钠与液态氨反应得NaNH2,②NaNH2与N2O按物质的量2:1反应可生成NaN3、NaOH和一种气体。
(1)请写出反应②的化学方程式为:___ 。
(2)比较NH 和NH3的键角∠HNH的大小:NH
和NH3的键角∠HNH的大小:NH
____ NH3(填“>”或“<”或“=”),请用价层电子对互斥规律解释____ 。
(3)小汽车的防撞气囊中叠氮化钠的工作原理是基于反应:6NaN3+Fe2O3=3Na2O+2Fe+9N2;铁晶体有三种堆积方式,其中两种堆积方式分别如图甲、图乙所示(其晶胞特征如图所示):
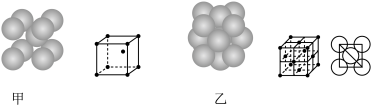
晶胞甲中铁原子的配位数为:___ ,晶胞乙中铁原子的堆积方式为:___ 。晶胞乙中铁原子半径为a pm,NA表示阿伏加德罗常数,摩尔质量为Mg/mol。则该晶体的密度可表示为:___ g/cm3。
(1)请写出反应②的化学方程式为:
(2)比较NH
 和NH3的键角∠HNH的大小:NH
和NH3的键角∠HNH的大小:NH
(3)小汽车的防撞气囊中叠氮化钠的工作原理是基于反应:6NaN3+Fe2O3=3Na2O+2Fe+9N2;铁晶体有三种堆积方式,其中两种堆积方式分别如图甲、图乙所示(其晶胞特征如图所示):

晶胞甲中铁原子的配位数为:
您最近一年使用:0次
名校
6 . Ⅰ.(1)按要求写出方程式:硫酸铁和氢氧化钡溶液反应(离子方程式)________ 。
(2)高铁酸钠(Na2FeO4)(铁为+6价)是一种新型的净水剂,可以通过下述反应制取:2Fe(OH)3+4NaOH+3NaClO=2Na2FeO4+3NaCl+5H2O
①该反应中氧化剂是_______ (用化学式表示,下同),______ 元素被氧化,氧化产物为______ 。
②用单线桥在方程式中标出电子转移的情况:___________ 。
③当反应中有1 mol Na2FeO4生成,转移的电子有________ mol。
Ⅱ.(1)在KIO3+5KI+3H2SO4 = 3I2+3K2SO4+3H2O中,氧化产物与还原产物的物质的量之比:_______ 。
(2)将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量之比为3∶2 ,完成下列化学方程式(横线上填系数,括号内填物质):___ KMnO4+____ K2S+______ =___ K2MnO4+___ K2SO4+___ S↓+______ H2O 。
(3)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染,化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气),若反应中消耗Cl2 1.5mol则被氧化的NH3在标准状况下的体积为__________ L。
(2)高铁酸钠(Na2FeO4)(铁为+6价)是一种新型的净水剂,可以通过下述反应制取:2Fe(OH)3+4NaOH+3NaClO=2Na2FeO4+3NaCl+5H2O
①该反应中氧化剂是
②用单线桥在方程式中标出电子转移的情况:
③当反应中有1 mol Na2FeO4生成,转移的电子有
Ⅱ.(1)在KIO3+5KI+3H2SO4 = 3I2+3K2SO4+3H2O中,氧化产物与还原产物的物质的量之比:
(2)将高锰酸钾逐滴加入到硫化钾溶液中发生如下反应,其中K2SO4和S的物质的量之比为3∶2 ,完成下列化学方程式(横线上填系数,括号内填物质):
(3)Cl2是一种有毒气体,如果泄漏会造成严重的环境污染,化工厂可用浓氨水来检验Cl2是否泄漏,有关反应的化学方程式为:3Cl2(气)+8NH3(气)=6NH4Cl(固)+N2(气),若反应中消耗Cl2 1.5mol则被氧化的NH3在标准状况下的体积为
您最近一年使用:0次
名校
解题方法
7 . 磷化铝(AlP)和磷化氢(PH3)都是粮食储备常用的高效熏蒸杀虫剂。AlP 晶体的熔点高达 2000℃。
(1)P 原子最外层共有__ 种不同运动状态的电子,AlP 中两种微粒的 p 电子数之比为__________________ 。
(2) PH3分子的空间构型为_________________ ,其热稳定性比 AsH3_________________ 。
(3) AlP遇水蒸气会发生水解反应放出 PH3气体,该反应的另一种产物的电离方程式为___________________ 。
(4) PH3具有强还原性,能与 CuSO4溶液反应,配平该反应的化学方程式:
____ CuSO4+____ PH3+ ____ H2O→_____ Cu3P +_____ H3PO4+_____ H2SO4
工业制备 PH3 的流程如图所示。

(5)次磷酸和足量烧碱溶液反应的化学方程式为___________ 。
(6)若开始时有 1mol P4参加反应,则整个工业流程中共生成___________ mol PH3(不考虑产物的损失)。
(1)P 原子最外层共有
(2) PH3分子的空间构型为
(3) AlP遇水蒸气会发生水解反应放出 PH3气体,该反应的另一种产物的电离方程式为
(4) PH3具有强还原性,能与 CuSO4溶液反应,配平该反应的化学方程式:
工业制备 PH3 的流程如图所示。

(5)次磷酸和足量烧碱溶液反应的化学方程式为
(6)若开始时有 1mol P4参加反应,则整个工业流程中共生成
您最近一年使用:0次
解题方法
8 . 氮是动植物生长过程中不可缺少的元素,其单质及其化合物有着广泛的用途。回答下列问题:
(1)肼(N2H4)、偏二甲肼(C2H8N2)、四氧化二氮(N2O4)都可用作火箭的燃料。
①N2H4、C2H8N2、N2O4中氮元素的质量分数由小到大的顺序为__ 。
②液态肼与液态四氧化二氨发生反应生成空气中含量最多的气体和水蒸气,写出该反应的化学方程式:___ 。
(2)将28gFe完全溶于一定量的HNO3溶液中,若只产生N2O、NO两种气体,该混合气体体积为5.6L(标准状况下),并且检测到溶液中金属阳离子只有Fe2+。
①与N2O互为等电子体的一种分子为__ ,其空间构型为___ 。
②写出上述Fe与HNO3反应生成N2O的离子方程式:___ 。
③生成的N2O、NO的物质的量之比为___ 。
(1)肼(N2H4)、偏二甲肼(C2H8N2)、四氧化二氮(N2O4)都可用作火箭的燃料。
①N2H4、C2H8N2、N2O4中氮元素的质量分数由小到大的顺序为
②液态肼与液态四氧化二氨发生反应生成空气中含量最多的气体和水蒸气,写出该反应的化学方程式:
(2)将28gFe完全溶于一定量的HNO3溶液中,若只产生N2O、NO两种气体,该混合气体体积为5.6L(标准状况下),并且检测到溶液中金属阳离子只有Fe2+。
①与N2O互为等电子体的一种分子为
②写出上述Fe与HNO3反应生成N2O的离子方程式:
③生成的N2O、NO的物质的量之比为
您最近一年使用:0次
名校
解题方法
9 . 不锈钢是由铁、铬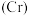 、镍
、镍 、碳、硅及众多不同元素组成的合金。
、碳、硅及众多不同元素组成的合金。
(1)写出碳原子最外层电子的轨道表示式________ ,该化学用语不能表达出碳原子最外层电子的(填序号)________ 。
a 电子层 b 电子亚层 C 所有电子云的伸展方向 d 自旋状态
(2)硅烷 可用于制备高纯硅。已知硅烷的分解温度远低于甲烷,请从原子结构角度解释硅元素与碳元素非金属性强弱的原因
可用于制备高纯硅。已知硅烷的分解温度远低于甲烷,请从原子结构角度解释硅元素与碳元素非金属性强弱的原因________ 。
(3)下面是工业上冶炼 时会涉及到的反应:
时会涉及到的反应:
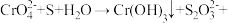 ________
________
①请将方程式补充完整并配平。________
②上述反应中,若转移了 电子,得到的还原产物是
电子,得到的还原产物是________  。
。
③ 和
和 类似,也是两性氢氧化物,写出
类似,也是两性氢氧化物,写出 的电离方程式
的电离方程式_________ 。
(4)铁和镍 位于周期表的同一周期同一族,请写出铁和镍在周期表中的位置
位于周期表的同一周期同一族,请写出铁和镍在周期表中的位置__________ 。
(5)镍粉在 中低温加热,生成无色挥发性液态
中低温加热,生成无色挥发性液态 ,呈四面体构型。
,呈四面体构型。 是
是________ 晶体, 易溶于下列(填序号)
易溶于下列(填序号)________ 。
a 水 b 四氯化碳 c 苯 d 硫酸镍溶液
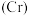 、镍
、镍 、碳、硅及众多不同元素组成的合金。
、碳、硅及众多不同元素组成的合金。(1)写出碳原子最外层电子的轨道表示式
a 电子层 b 电子亚层 C 所有电子云的伸展方向 d 自旋状态
(2)硅烷
 可用于制备高纯硅。已知硅烷的分解温度远低于甲烷,请从原子结构角度解释硅元素与碳元素非金属性强弱的原因
可用于制备高纯硅。已知硅烷的分解温度远低于甲烷,请从原子结构角度解释硅元素与碳元素非金属性强弱的原因(3)下面是工业上冶炼
 时会涉及到的反应:
时会涉及到的反应: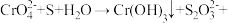 ________
________①请将方程式补充完整并配平。
②上述反应中,若转移了
 电子,得到的还原产物是
电子,得到的还原产物是 。
。③
 和
和 类似,也是两性氢氧化物,写出
类似,也是两性氢氧化物,写出 的电离方程式
的电离方程式(4)铁和镍
 位于周期表的同一周期同一族,请写出铁和镍在周期表中的位置
位于周期表的同一周期同一族,请写出铁和镍在周期表中的位置(5)镍粉在
 中低温加热,生成无色挥发性液态
中低温加热,生成无色挥发性液态 ,呈四面体构型。
,呈四面体构型。 是
是 易溶于下列(填序号)
易溶于下列(填序号)a 水 b 四氯化碳 c 苯 d 硫酸镍溶液
您最近一年使用:0次
2020-08-19更新
|
343次组卷
|
4卷引用:上海市交通大学附属中学2018-2019学年高三上学期开学摸底考试化学试题
上海市交通大学附属中学2018-2019学年高三上学期开学摸底考试化学试题(已下线)三轮冲刺卷1-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(上海卷)河南省郑州市部分高中2023-2024学年高三11月联考理科综合试题河南省洛阳市部分高中2023-2024学年高三上学期11月联考理科综合试题
2014·上海杨浦·三模
解题方法
10 . 不锈钢是由铁、铬(Cr)、镍(Ni)、碳、硅及众多不同元素组成的合金。完成下列填空:
(1)写出碳原子最外层电子的轨道表示式___ ,该化学用语不能表达出碳原子最外层电子的(填序号)___ 。
a.电子层 b.电子亚层 c.所有电子云的伸展方向 d.自旋状态
(2)硅烷(SiH4)可用于制备高纯硅,已知硅烷的分解温度远低于甲烷,从原子结构角度解释其原因:___ ,所以硅元素的非金属性弱于碳元素,硅烷的热稳定性弱于甲烷。
(4)下面是工业上冶炼Cr时会涉及到的反应: CrO42-+ S+ H2O→ Cr(OH)3↓+ S2O32-+___
①请将方程式补充完整并配平。
②上述反应中,若转移了3mol电子,得到的还原产物是___ mol。
③Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,写出Cr(OH)3的电离方程式___ 。
(5)铁和镍(Ni)位于周期表的同一周期同一族,铁和镍在___ 周期___ 族。
(6)镍粉在CO中低温加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。150℃时,Ni(CO)4分解为Ni和CO。Ni(CO)4是___ 晶体,Ni(CO)4易溶于下列___ (填序号)。
a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
(1)写出碳原子最外层电子的轨道表示式
a.电子层 b.电子亚层 c.所有电子云的伸展方向 d.自旋状态
(2)硅烷(SiH4)可用于制备高纯硅,已知硅烷的分解温度远低于甲烷,从原子结构角度解释其原因:
(4)下面是工业上冶炼Cr时会涉及到的反应: CrO42-+ S+ H2O→ Cr(OH)3↓+ S2O32-+
①请将方程式补充完整并配平。
②上述反应中,若转移了3mol电子,得到的还原产物是
③Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,写出Cr(OH)3的电离方程式
(5)铁和镍(Ni)位于周期表的同一周期同一族,铁和镍在
(6)镍粉在CO中低温加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。150℃时,Ni(CO)4分解为Ni和CO。Ni(CO)4是
a.水 b.四氯化碳 c.苯 d.硫酸镍溶液
您最近一年使用:0次



