解题方法
1 . 中国载人潜水器“奋斗者”号,在西太平洋马里亚纳海沟成功下潜突破10000米,达到10909米,创造了中国载人深潜的新纪录。“奋斗者”号抗压关键——坚固、宽大的球形载人仓是由钛合金制成的。以钛铁矿[主要成分钛酸亚铁( )]为主要原料冶炼金属钛,同时还可得到副产物绿矾,其生产的工艺流程如图所示:
)]为主要原料冶炼金属钛,同时还可得到副产物绿矾,其生产的工艺流程如图所示:
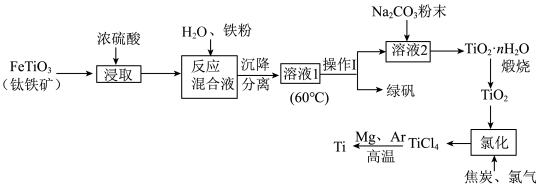
已知:钛铁矿与浓硫酸发生反应的化学方程式为 ;
; 易水解,只能存于强酸性溶液中。
易水解,只能存于强酸性溶液中。
回答下列问题:
(1) 中Ti的化合价为
中Ti的化合价为___________ ;反应混合液中加入铁粉的目的是___________ 。
(2)溶液1经“操作I”可得副产品绿矾,则操作I的名称为___________ ;在此操作过程中,需控制溶液的温度,若溶液1的温度过高,会使最终钛的产率___________ (填“升高”或“降低”),理由是___________ 。
(3)溶液2中含有的主要离子是 ,加入
,加入 粉末可得到固体
粉末可得到固体 ,请结合原理和化学用语解释其原因:
,请结合原理和化学用语解释其原因:___________ 。
(4)“氯化”是焦炭、氯气在高温下发生反应制取 ,并得到一种可燃性气体,其化学方程式为
,并得到一种可燃性气体,其化学方程式为___________ 。
(5)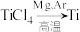 反应后得到Mg、
反应后得到Mg、 、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,蒸馏时需加热的温度应略高于
、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,蒸馏时需加热的温度应略高于___________ ℃即可。
(6)钛酸锂( )是一种理想型嵌入材料,插入与脱嵌对材料结构几乎没影响。某新型钛酸锂电池的总反应为
)是一种理想型嵌入材料,插入与脱嵌对材料结构几乎没影响。某新型钛酸锂电池的总反应为 ,则放电时其负极反应式为
,则放电时其负极反应式为___________ 。
 )]为主要原料冶炼金属钛,同时还可得到副产物绿矾,其生产的工艺流程如图所示:
)]为主要原料冶炼金属钛,同时还可得到副产物绿矾,其生产的工艺流程如图所示:
已知:钛铁矿与浓硫酸发生反应的化学方程式为
 ;
; 易水解,只能存于强酸性溶液中。
易水解,只能存于强酸性溶液中。回答下列问题:
(1)
 中Ti的化合价为
中Ti的化合价为(2)溶液1经“操作I”可得副产品绿矾,则操作I的名称为
(3)溶液2中含有的主要离子是
 ,加入
,加入 粉末可得到固体
粉末可得到固体 ,请结合原理和化学用语解释其原因:
,请结合原理和化学用语解释其原因:(4)“氯化”是焦炭、氯气在高温下发生反应制取
 ,并得到一种可燃性气体,其化学方程式为
,并得到一种可燃性气体,其化学方程式为(5)
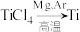 反应后得到Mg、
反应后得到Mg、 、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,蒸馏时需加热的温度应略高于
、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,蒸馏时需加热的温度应略高于| 物质 |  | Mg |  | Ti |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
(6)钛酸锂(
 )是一种理想型嵌入材料,插入与脱嵌对材料结构几乎没影响。某新型钛酸锂电池的总反应为
)是一种理想型嵌入材料,插入与脱嵌对材料结构几乎没影响。某新型钛酸锂电池的总反应为 ,则放电时其负极反应式为
,则放电时其负极反应式为
您最近一年使用:0次
名校
解题方法
2 . 用纳米Fe/Ni复合材料能去除污染水体的 ,Ni不参与反应。离子在材料表面的活性位点吸附后发生反应,活性位点被其他附着物占据会导致速率减慢(
,Ni不参与反应。离子在材料表面的活性位点吸附后发生反应,活性位点被其他附着物占据会导致速率减慢( 无法占据活性位点)。反应过程如图所示:
无法占据活性位点)。反应过程如图所示:
(1)酸性环境中,纳米Fe/Ni去除NO 分两步,将步骤ii补充完整:
分两步,将步骤ii补充完整:_______ 。
i.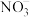 +Fe+2H+=
+Fe+2H+= +Fe2++H2O
+Fe2++H2O
ii. ______+
______+ ______+
______+ H+=
H+= Fe2++
Fe2++ ______+
______+ ______
______
(2)初始pH=2.0的废液反应15min后,出现大量白色絮状物,过滤后很快变成红褐色,结合化学用语解释整个变化过程的原因______ 。
(3)水体初始pH会影响反应速率,不同pH的硝酸盐溶液与纳米Fe/Ni反应时,溶液中 随时间的变化如图所示。(注:
随时间的变化如图所示。(注: 为初始时NO
为初始时NO 的浓度。)
的浓度。)

①为达到最高去除率,应调水体的初始pH=______ 。
②t<10min,pH=2.0的溶液反应速率最快,t>15min,其反应速率迅速降低,原因分别是______ 。
(4)总氮量指溶液中自由移动的所有含氮微粒浓度之和,纳米Fe/Ni处理某浓度硝酸盐溶液时,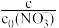 随时间的变化如图所示。40min时总氮量较初始时下降,可能的原因是
随时间的变化如图所示。40min时总氮量较初始时下降,可能的原因是______ 。

(5)利用电解无害化处理水体中的NO ,最终生成N2逸出。其装置及转化图如图所示:
,最终生成N2逸出。其装置及转化图如图所示:


①阴极的电极反应式为______ 。
②生成N2的离子方程式为______ 。
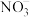 ,Ni不参与反应。离子在材料表面的活性位点吸附后发生反应,活性位点被其他附着物占据会导致速率减慢(
,Ni不参与反应。离子在材料表面的活性位点吸附后发生反应,活性位点被其他附着物占据会导致速率减慢( 无法占据活性位点)。反应过程如图所示:
无法占据活性位点)。反应过程如图所示:(1)酸性环境中,纳米Fe/Ni去除NO
 分两步,将步骤ii补充完整:
分两步,将步骤ii补充完整:i.
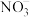 +Fe+2H+=
+Fe+2H+= +Fe2++H2O
+Fe2++H2Oii.
 ______+
______+ ______+
______+ H+=
H+= Fe2++
Fe2++ ______+
______+ ______
______(2)初始pH=2.0的废液反应15min后,出现大量白色絮状物,过滤后很快变成红褐色,结合化学用语解释整个变化过程的原因
(3)水体初始pH会影响反应速率,不同pH的硝酸盐溶液与纳米Fe/Ni反应时,溶液中
 随时间的变化如图所示。(注:
随时间的变化如图所示。(注: 为初始时NO
为初始时NO 的浓度。)
的浓度。)
①为达到最高去除率,应调水体的初始pH=
②t<10min,pH=2.0的溶液反应速率最快,t>15min,其反应速率迅速降低,原因分别是
(4)总氮量指溶液中自由移动的所有含氮微粒浓度之和,纳米Fe/Ni处理某浓度硝酸盐溶液时,
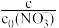 随时间的变化如图所示。40min时总氮量较初始时下降,可能的原因是
随时间的变化如图所示。40min时总氮量较初始时下降,可能的原因是
(5)利用电解无害化处理水体中的NO
 ,最终生成N2逸出。其装置及转化图如图所示:
,最终生成N2逸出。其装置及转化图如图所示:

①阴极的电极反应式为
②生成N2的离子方程式为
您最近一年使用:0次
2023-05-30更新
|
247次组卷
|
5卷引用:【区级联考】北京市市昌平区2019届高三下学期二模考试化学试题
3 . 在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系。
(1)为了提高煤的利用率,常将其气化为可燃性气体,主要反应是碳和水蒸气反应生成水煤气,化学反应方程式为_______ ,其中氧化剂是_______ 。
(2)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2(g)+3H2(g) 2NH3(g)。
2NH3(g)。
①合成氨的反应中的能量变化如图所示。该反应是_______ 反应(填“吸热”或“放热”),其原因是反应物化学键断裂吸收的总能量_______ (填“大于”或“小于”)生成物化学键形成放出的总能量。

②在一定条件下,将一定量的N2和H2的混合气体充入某密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是_______ (填序号)。
A. 容器中N2、H2、NH3共存
B. N2、NH3浓度相等
C. N2、H2、NH3的物质的量之比为1:3:2
D. 容器中的压强不随时间变化
(3)工业上用电解饱和食盐水的方法制取氯气、烧碱和氢气。其化学反应方程式为_______ 。用氯气和烧碱可进一步反应,制得消毒液,反应的离子方程式为_______ 。
(1)为了提高煤的利用率,常将其气化为可燃性气体,主要反应是碳和水蒸气反应生成水煤气,化学反应方程式为
(2)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2(g)+3H2(g)
 2NH3(g)。
2NH3(g)。①合成氨的反应中的能量变化如图所示。该反应是

②在一定条件下,将一定量的N2和H2的混合气体充入某密闭容器中,一段时间后,下列叙述能说明该反应达到平衡状态的是
A. 容器中N2、H2、NH3共存
B. N2、NH3浓度相等
C. N2、H2、NH3的物质的量之比为1:3:2
D. 容器中的压强不随时间变化
(3)工业上用电解饱和食盐水的方法制取氯气、烧碱和氢气。其化学反应方程式为
您最近一年使用:0次
解题方法
4 . KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。请回答下列问题:
(1)KIO3的化学名称是___________ 。
(2)KIO3具有一定的氧化性,能与H2S反应生成淡黄色沉淀,请配平该离子反应方程式: +H2S=I-+S↓+H2O,
+H2S=I-+S↓+H2O,___________ 。
(3)炒菜使用加碘盐,最好等出锅时再放盐,理由是___________ (请用化学反应方程式表示)。
(4)KIO3可采用“电解法”制备,某同学查阅资料,设计将NO2、O2和熔融盐组成的燃料电池(装置1)与装置2相连,主要原理如图所示。电解前,在a极区先将一定量的碘溶于过量KOH溶液,发生反应3I2+6KOH=5KI+KIO3+3H2O,电解后在该区获得KIO3。

①装置1,熔融盐中NO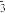 移向
移向___________ (填“石墨I”或“石墨II”);在使用过程中石墨I电极反应生成一种氧化物Y,请写出该氧化物Y的化学式是___________ 。
②请写出装置1中石墨II的电极反应式是___________ 。
③装置2,用惰性电极和不锈钢两种作为电极材料,请写出电极a可采用的材料是___________ (填“石墨”或“不锈钢”或“两者皆可”),该电极上发生的电极反应式是___________ 。
④装置2,电解过程中通过离子交换膜的离子主要是___________ ;电解后,b极区周围的pH会___________ (填“升高”或“降低”)。
(1)KIO3的化学名称是
(2)KIO3具有一定的氧化性,能与H2S反应生成淡黄色沉淀,请配平该离子反应方程式:
 +H2S=I-+S↓+H2O,
+H2S=I-+S↓+H2O,(3)炒菜使用加碘盐,最好等出锅时再放盐,理由是
(4)KIO3可采用“电解法”制备,某同学查阅资料,设计将NO2、O2和熔融盐组成的燃料电池(装置1)与装置2相连,主要原理如图所示。电解前,在a极区先将一定量的碘溶于过量KOH溶液,发生反应3I2+6KOH=5KI+KIO3+3H2O,电解后在该区获得KIO3。

①装置1,熔融盐中NO
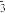 移向
移向②请写出装置1中石墨II的电极反应式是
③装置2,用惰性电极和不锈钢两种作为电极材料,请写出电极a可采用的材料是
④装置2,电解过程中通过离子交换膜的离子主要是
您最近一年使用:0次
名校
解题方法
5 . 硼酸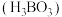 在食品、医药领域应用广泛。
在食品、医药领域应用广泛。
(1)硼在元素周期表中的位置_______
(2)请完成 气体与水反应的化学方程式:
气体与水反应的化学方程式:
_______
(3)在其他条件相同时,反应 中,
中, 的转化率
的转化率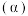 在同温度下随反应时间
在同温度下随反应时间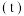 的变化见图,由此可得出:
的变化见图,由此可得出:

①温度对该反应的反应速率和平衡移动的影响是_______
②该反应的
_______ 0(填“<”“=”或“>”)。
(4) 溶液中存在如下反应:
溶液中存在如下反应: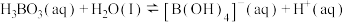 ,已知
,已知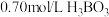 溶液中,上述反应于
溶液中,上述反应于 达到平衡时,
达到平衡时,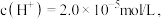
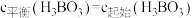 ,水的电离可忽略不计,此温度下该反应的平衡常数
,水的电离可忽略不计,此温度下该反应的平衡常数
_______ ( 的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)。
的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)。
(5)已知室温下, 的电离常数为
的电离常数为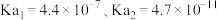 。向盛有饱和硼酸溶液的试管中,滴加
。向盛有饱和硼酸溶液的试管中,滴加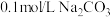 溶液,
溶液,_______ (填“能”或“不能”)观察到气泡逸出。
(6) 与足量
与足量 溶液反应的离子方程式为
溶液反应的离子方程式为_______
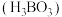 在食品、医药领域应用广泛。
在食品、医药领域应用广泛。(1)硼在元素周期表中的位置
(2)请完成
 气体与水反应的化学方程式:
气体与水反应的化学方程式:
(3)在其他条件相同时,反应
 中,
中, 的转化率
的转化率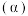 在同温度下随反应时间
在同温度下随反应时间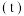 的变化见图,由此可得出:
的变化见图,由此可得出:
①温度对该反应的反应速率和平衡移动的影响是
②该反应的

(4)
 溶液中存在如下反应:
溶液中存在如下反应: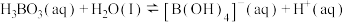 ,已知
,已知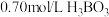 溶液中,上述反应于
溶液中,上述反应于 达到平衡时,
达到平衡时,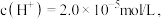
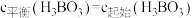 ,水的电离可忽略不计,此温度下该反应的平衡常数
,水的电离可忽略不计,此温度下该反应的平衡常数
 的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)。
的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)。(5)已知室温下,
 的电离常数为
的电离常数为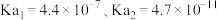 。向盛有饱和硼酸溶液的试管中,滴加
。向盛有饱和硼酸溶液的试管中,滴加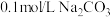 溶液,
溶液,(6)
 与足量
与足量 溶液反应的离子方程式为
溶液反应的离子方程式为
您最近一年使用:0次
名校
解题方法
6 . 脱除烟气中的氮氧化物(主要是指NO和NO2)可净化空气、改善环境,是环境保护的主要课题。
(1)NO2的消除。可以用碳酸钠溶液来进行吸收,在产生CO2的同时,会生成NaNO2,NaNO2是工业盐的主要成分,在漂白、电镀等方面应用广泛。
①写出碳酸钠溶液消除NO2的化学方程式:___________ 。
②经过一系列后续操作可以得到产品NaNO2,但一般会混有一定量___________ 的杂质。
(2)NO的消除。
①HClO可有效脱除NO,但HClO不稳定,实际应用中常用其盐。C12和Ca(OH)2制取漂白粉的化学方程式是___________ 。
次氯酸盐脱除NO的主要过程如下:
a.NO+HClO=NO2+HCl b.NO+NO2+H2O 2HNO2
2HNO2
c.HClO+HNO2=HNO3+HCl
②下列分析正确的是___________ 。
A.烟气中含有的少量O2能提高NO的脱除率
B.NO2单独存在时不能被脱除
C.脱除过程中,次氯酸盐溶液的pH下降
③研究不同温度下Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。脱除过程中往往有Cl2产生,原因是___________ (用离子方程式表示); 60~80 ℃ NO脱除率下降的原因是___________ 。

(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如下图所示。当NO2与NO的物质的量之比为1∶1时,与足量氨气在一定条件下发生脱氮反应。该反应的化学方程式为___________ 。


(4)利用电化学装置可消除氮氧化物污染,变废为宝。上图为电解NO制备NH4NO3的装置,该装置中阳极的电极反应式为___________ 。
(1)NO2的消除。可以用碳酸钠溶液来进行吸收,在产生CO2的同时,会生成NaNO2,NaNO2是工业盐的主要成分,在漂白、电镀等方面应用广泛。
①写出碳酸钠溶液消除NO2的化学方程式:
②经过一系列后续操作可以得到产品NaNO2,但一般会混有一定量
(2)NO的消除。
①HClO可有效脱除NO,但HClO不稳定,实际应用中常用其盐。C12和Ca(OH)2制取漂白粉的化学方程式是
次氯酸盐脱除NO的主要过程如下:
a.NO+HClO=NO2+HCl b.NO+NO2+H2O
 2HNO2
2HNO2c.HClO+HNO2=HNO3+HCl
②下列分析正确的是
A.烟气中含有的少量O2能提高NO的脱除率
B.NO2单独存在时不能被脱除
C.脱除过程中,次氯酸盐溶液的pH下降
③研究不同温度下Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。脱除过程中往往有Cl2产生,原因是

(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如下图所示。当NO2与NO的物质的量之比为1∶1时,与足量氨气在一定条件下发生脱氮反应。该反应的化学方程式为


(4)利用电化学装置可消除氮氧化物污染,变废为宝。上图为电解NO制备NH4NO3的装置,该装置中阳极的电极反应式为
您最近一年使用:0次
解题方法
7 . 某硫酸工厂的酸性废水中砷(As)元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如下表。请回答以下问题:
表1几种盐的Ksp
表2工厂污染物排放浓度及允许排放标准
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=___________ mol·L-1。
(2)若酸性废水中Fe3+的浓度为1.0×10-4 mol·L-1,c(AsO )=
)=___________ mol·L-1。
(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),MnO2被还原为Mn2+,反应的离子方程式为___________ 。
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为___________ 。
②砷酸(H3AsO4)分步电离的平衡常数(25℃)为:K1=5.6×10-3,K2=1.7×10-7,K3=4.0×10-12,第三步电离的平衡常数的表达式为K3=___________ 。Na3AsO4的第一步水解的离子方程式为:AsO +H2O
+H2O HAsO
HAsO +OH-,该步水解的平衡常数(25℃)为
+OH-,该步水解的平衡常数(25℃)为___________ (保留两位有效数字)。
表1几种盐的Ksp
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-19 |
| CaSO4 | 9.1×10-6 |
| FeAsO4 | 5.7×10-21 |
| 污染物 | H2SO4 | As |
| 废水浓度 | 29.4 g·L-1 | 1.6 g·L-1 |
| 排放标准 | pH 6~9 | 0.5 mg·L-1 |
(2)若酸性废水中Fe3+的浓度为1.0×10-4 mol·L-1,c(AsO
 )=
)=(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),MnO2被还原为Mn2+,反应的离子方程式为
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降。
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为
②砷酸(H3AsO4)分步电离的平衡常数(25℃)为:K1=5.6×10-3,K2=1.7×10-7,K3=4.0×10-12,第三步电离的平衡常数的表达式为K3=
 +H2O
+H2O HAsO
HAsO +OH-,该步水解的平衡常数(25℃)为
+OH-,该步水解的平衡常数(25℃)为
您最近一年使用:0次
解题方法
8 . 金属钛无毒、密度小而强度高,广泛用于航天材料、人造骨骼的制造等,有航天金属和生命金属的美誉。
(1)A为+ 4价钛的卤化物,A在潮湿的空气中因水解而冒白烟。向硝酸银-硝酸溶液中滴入A,有白色沉淀B生成,B易溶于氨水。取少量锌粉投入A的盐酸溶液中,可得到含TiCl3的紫色溶液C。将C溶液与适量氯化铜溶液混合有白色沉淀D生成,混合溶液褪为无色。
①B的化学式为:_______ ;B溶于氨水所得产物为:_______ ;
②A水解的化学反应方程式为:_______ ,理论计算可知,该反应的平衡常数很大,增加HCl浓度不足以抑制反应的进行,可是在浓盐酸中,A却几乎不水解,原因是:_______ ;
③C溶液与适量氯化铜溶液反应的化学方程式为:_______
(2)已知钛的元素电势图(E /V)为:
/V)为:
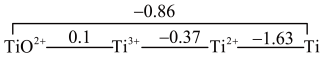
则:Ti2+_______ (填“能”或“不能”)在水溶液中稳定存在;Ti溶于热浓盐酸的化学反应方程式为_______ 。
(1)A为+ 4价钛的卤化物,A在潮湿的空气中因水解而冒白烟。向硝酸银-硝酸溶液中滴入A,有白色沉淀B生成,B易溶于氨水。取少量锌粉投入A的盐酸溶液中,可得到含TiCl3的紫色溶液C。将C溶液与适量氯化铜溶液混合有白色沉淀D生成,混合溶液褪为无色。
①B的化学式为:
②A水解的化学反应方程式为:
③C溶液与适量氯化铜溶液反应的化学方程式为:
(2)已知钛的元素电势图(E
 /V)为:
/V)为: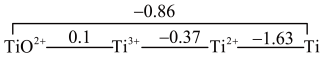
则:Ti2+
您最近一年使用:0次
9 . 回答下列问题:
(1)按如图所示操作,充分反应后:

①I中发生反应的离子方程式为_______ ;
②II中铜丝上观察到的现象是_______ ;
③结合I、II实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为_______ 。
(2)某一反应体系中有反应物和生成物共5种物质:S、H2S、 HNO3、NO、H2O。该反应体系中的还原产物是_______ 。
(3)将Cl2通入HBr溶液中,发生反应Cl2+2Br-=2Cl-+Br2,而将少量 Cl2通入FeBr2的溶液中,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,这个事实说明具有还原性的粒子的还原性强弱顺序为_______ 。
(1)按如图所示操作,充分反应后:

①I中发生反应的离子方程式为
②II中铜丝上观察到的现象是
③结合I、II实验现象可知Fe2+、Cu2+、Ag+的氧化性由强到弱的顺序为
(2)某一反应体系中有反应物和生成物共5种物质:S、H2S、 HNO3、NO、H2O。该反应体系中的还原产物是
(3)将Cl2通入HBr溶液中,发生反应Cl2+2Br-=2Cl-+Br2,而将少量 Cl2通入FeBr2的溶液中,反应的离子方程式为2Fe2++Cl2=2Fe3++2Cl-,这个事实说明具有还原性的粒子的还原性强弱顺序为
您最近一年使用:0次
10 . 据报道,2002年某市一辆满载砒霜的大货车翻下山坡,少量砒霜散落河水中。有关部门紧急采取措施。已知砒霜的化学式为:As2O3,剧毒,在低温下微溶于水,溶于水后生成亚砷酸,亚砷酸为三元弱酸。请回答下列问题:
(1)有关部门采取措施中加入一种物质。这种物质是___ (写名称),写出与亚砷酸在水中反应的化学方程式___ 。
(2)古时确定人是否是砒霜中毒死亡,常用马氏试砷法。其原理是在含砒霜的物质中加入Zn和稀H2SO4,得到一种气体A。加热A,在试管中得到砷镜。写出上述两个化学方程式___ 、___ 。
(3)砒霜与面粉、淀粉、味精及小苏打极其相似,容易误食中毒,急救方法之一是,立即将中毒者移离现场,灌服氢氧化铁胶体或悬浊液(12%硫酸亚铁溶液与20%氧化镁等量混合)并进行催吐,写出制备氢氧化铁胶体或悬浊液的反应原理___ (用方程式表示)。经过上述催吐后再进一步药物处理,即可得救。
(1)有关部门采取措施中加入一种物质。这种物质是
(2)古时确定人是否是砒霜中毒死亡,常用马氏试砷法。其原理是在含砒霜的物质中加入Zn和稀H2SO4,得到一种气体A。加热A,在试管中得到砷镜。写出上述两个化学方程式
(3)砒霜与面粉、淀粉、味精及小苏打极其相似,容易误食中毒,急救方法之一是,立即将中毒者移离现场,灌服氢氧化铁胶体或悬浊液(12%硫酸亚铁溶液与20%氧化镁等量混合)并进行催吐,写出制备氢氧化铁胶体或悬浊液的反应原理
您最近一年使用:0次



