第24届(2010年)全国高中学生化学竞赛(江苏赛区)夏令营暨选拔赛试题
江苏
高二
竞赛
2021-08-24
1093次
整体难度:
适中
考查范围:
物质结构与性质、竞赛、认识化学科学、常见无机物及其应用、有机化学基础、化学反应原理、化学实验基础
第24届(2010年)全国高中学生化学竞赛(江苏赛区)夏令营暨选拔赛试题
江苏
高二
竞赛
2021-08-24
1093次
整体难度:
适中
考查范围:
物质结构与性质、竞赛、认识化学科学、常见无机物及其应用、有机化学基础、化学反应原理、化学实验基础
一、填空题 添加题型下试题
填空题
|
适中(0.65)
解题方法
1. 将氟气通入氢氧化钠溶液中,可得OF2。OF2是一种无色、几乎无味的剧毒气体,主要用于氧化氟化反应、火箭工程助燃剂等。请回答下列问题:
(1)OF2的中文名称是_______ ,OF2中O的化合价为_______ ,OF2中O原子的杂化轨道类型是_______ ,OF2分子的空间构型为_______ 。
(2)与H2O分子相比,OF2分子的键角更_______ (填“大”或“小”)。
(3)与H2O分子相比, OF2分子的极性更_______ (填“大” 或“小”),原因是_______ ;
(4)OF2 在常温下就能与干燥空气反应生成二氧化氮和无色气体氟化氮,该反应的化学方程式为(已知反应中N2与O2的物质的量之比为4:1)_______ 。
(1)OF2的中文名称是
(2)与H2O分子相比,OF2分子的键角更
(3)与H2O分子相比, OF2分子的极性更
(4)OF2 在常温下就能与干燥空气反应生成二氧化氮和无色气体氟化氮,该反应的化学方程式为(已知反应中N2与O2的物质的量之比为4:1)
您最近一年使用:0次
二、解答题 添加题型下试题
解答题-原理综合题
|
较难(0.4)
解题方法
2. 金属钛无毒、密度小而强度高,广泛用于航天材料、人造骨骼的制造等,有航天金属和生命金属的美誉。
(1)A为+ 4价钛的卤化物,A在潮湿的空气中因水解而冒白烟。向硝酸银-硝酸溶液中滴入A,有白色沉淀B生成,B易溶于氨水。取少量锌粉投入A的盐酸溶液中,可得到含TiCl3的紫色溶液C。将C溶液与适量氯化铜溶液混合有白色沉淀D生成,混合溶液褪为无色。
①B的化学式为:_______ ;B溶于氨水所得产物为:_______ ;
②A水解的化学反应方程式为:_______ ,理论计算可知,该反应的平衡常数很大,增加HCl浓度不足以抑制反应的进行,可是在浓盐酸中,A却几乎不水解,原因是:_______ ;
③C溶液与适量氯化铜溶液反应的化学方程式为:_______
(2)已知钛的元素电势图(E /V)为:
/V)为:
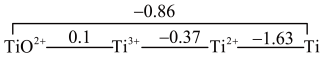
则:Ti2+_______ (填“能”或“不能”)在水溶液中稳定存在;Ti溶于热浓盐酸的化学反应方程式为_______ 。
(1)A为+ 4价钛的卤化物,A在潮湿的空气中因水解而冒白烟。向硝酸银-硝酸溶液中滴入A,有白色沉淀B生成,B易溶于氨水。取少量锌粉投入A的盐酸溶液中,可得到含TiCl3的紫色溶液C。将C溶液与适量氯化铜溶液混合有白色沉淀D生成,混合溶液褪为无色。
①B的化学式为:
②A水解的化学反应方程式为:
③C溶液与适量氯化铜溶液反应的化学方程式为:
(2)已知钛的元素电势图(E
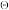 /V)为:
/V)为: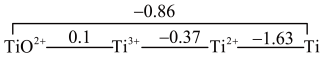
则:Ti2+
您最近一年使用:0次
三、填空题 添加题型下试题
填空题
|
适中(0.65)
3. 具有独特的P、N杂化结构和突出的热学、电学性能的环境友好的磷腈化合物是目前无卤阻燃研究的热点之一,尤其是HPCTP更引起人们的关注。HPCTP的合成路线如下:
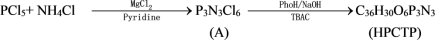
Pyridine、TBAC和PhOH分别为吡啶、四丁基溴化铵和苯酚。HPCTP的红外光谱表明分子中存在P-N、P-O-C、P= N的吸收峰以及单取代苯环的特征峰; HPCTP 的核磁共振磷谱表明分子中只有1种化学环境的磷;X射线衍射分析表明A和HPCTP分子结构均具有很好的对称性。
(1)分别写出化合物A、HPCTP的结构式:A_______ ,HPCTP_______ 。
(2)化合物 A反应生成HPCTP的反应类型是_______ 。
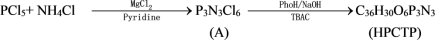
Pyridine、TBAC和PhOH分别为吡啶、四丁基溴化铵和苯酚。HPCTP的红外光谱表明分子中存在P-N、P-O-C、P= N的吸收峰以及单取代苯环的特征峰; HPCTP 的核磁共振磷谱表明分子中只有1种化学环境的磷;X射线衍射分析表明A和HPCTP分子结构均具有很好的对称性。
(1)分别写出化合物A、HPCTP的结构式:A
(2)化合物 A反应生成HPCTP的反应类型是
您最近一年使用:0次
填空题
|
较难(0.4)
4. 葡萄糖是自然界分布最广且最为重要的一种单糖,它是一种多羟基醛。葡萄糖是生物体内新陈代谢不可缺少的营养物质。口服葡萄糖(ORALGLUCOSE)一般呈粉状,是最基本的医药原料,它能迅速增加入体的能量、耐力,可用作血糖过低、感冒发烧、头晕虚脱、四肢无力及心肌炎等症的补充液。葡萄糖含量的测定可用碘量法,某样品测定过程如下:称取约10.00g葡萄糖试样于100mL烧杯中,加少量水溶解后定量转移到250mL容量瓶中,定容并摇匀。用移液管吸取该试液50.00mL于250mL碘量瓶中,准确加入0.05000mol·L-1标准溶液30.00mL(过量)。在摇动下缓缓滴加1.0mol·L-1NaOH溶液,直至溶液变成浅黄色。盖上表面皿,放置约15min,使之反应完全。用少量水冲洗表面皿和碘量瓶内壁,然后加入8mL0.5mol·L-1HCl,析出的I2立即用0.1000mol·L-1Na2S2O3标准溶液滴定至浅黄色。加2mL淀粉指示剂,继续滴定至蓝色恰好消失即为终点,消耗了Na2S2O39.96mL。[M(C6H12O6)=180.2]
(1)写出下列离子反应方程式:
①碘标准溶液与NaOH溶液反应_______
②葡萄糖在碱性条件下与IO-反应_______
③硫代硫酸钠与碘反应_______
(2)该样品葡萄糖含量为_______ 。
(1)写出下列离子反应方程式:
①碘标准溶液与NaOH溶液反应
②葡萄糖在碱性条件下与IO-反应
③硫代硫酸钠与碘反应
(2)该样品葡萄糖含量为
【知识点】 酸碱理论和水溶液中的离子平衡
您最近一年使用:0次
四、解答题 添加题型下试题
解答题-结构与性质
|
较难(0.4)
5. 回答下列问题:
(1)CaC2的晶体结构如图所示,其中C-C键长为0.119nm,图中所给的晶胞_______ (填“是”或“不是”)正当晶胞。该结构有_______ 个对称面。

碱金属或碱土金属都可以和氧原子形成具有与CaC2相同结构的化合物如KO2、BaO2。若KO2、BaO2中O -O 键长、CaC2中C- C键长分别为a、b、c ,其相对大小为_______ 。
(2)以CaC2为还原剂,以MgO为原料可以炼镁,还原温度为1150°C左右,反应产物中基本没有CO,反应需抽真空进行。则该反应的化学方程式为:_______ ,产物中基本没有CO的原因是:_______ ,反应需抽真空进行的理由是:_______ 。
(3)工业上用焦炭和生石灰在2000°C左右反应制备CaC2,原料中往往含有MgO、SiO2、Fe2O3、Al2O3、S、P等杂质,这些都不利于电石的生产。其中S的存在形式一般为FeS2或硫酸盐,产品中S的主要存在形式是_______ 。
(4)欲分析电石中CaC2含量,可称取mg试样于150mL锥形瓶中,加5mL水,再加8mL硝酸(浓度c1mol·L-1)、4-5滴氢氟酸(浓度c2 mol·L-1)、5 mL高氯酸(浓度c3 mol·L-1),在电热板上加热溶解并蒸发冒白烟至试液体积约为2~3mL,取下稍冷却加15mL盐酸(浓度c4 mol·L-1)使盐类溶解后,移入250mL容量瓶中,以水稀释至刻度,摇匀。准确移取25mL试液于500mL锥形瓶中,加100mL水,10mL三乙醇胺溶液,约20mL氢氧化钾溶液调整pH≥12.5,I mL半胱胺酸溶液,5 mL硫酸镁溶液,摇匀,加钙指示剂少许.用EDTA标准溶液(浓度c mol·L-1)滴定至紫红色变蓝色为终点,用去V mL EDTA(已知EDTA与Ca2+,反应时物质的量之比为1: 1)
①写出CaC2百分含量的表达式_______ (注:表达式中只允许有一个具体的数值):
②为什么要先加5 mL水?否则将会发生什么结果_______ 。
(1)CaC2的晶体结构如图所示,其中C-C键长为0.119nm,图中所给的晶胞

碱金属或碱土金属都可以和氧原子形成具有与CaC2相同结构的化合物如KO2、BaO2。若KO2、BaO2中O -O 键长、CaC2中C- C键长分别为a、b、c ,其相对大小为
(2)以CaC2为还原剂,以MgO为原料可以炼镁,还原温度为1150°C左右,反应产物中基本没有CO,反应需抽真空进行。则该反应的化学方程式为:
(3)工业上用焦炭和生石灰在2000°C左右反应制备CaC2,原料中往往含有MgO、SiO2、Fe2O3、Al2O3、S、P等杂质,这些都不利于电石的生产。其中S的存在形式一般为FeS2或硫酸盐,产品中S的主要存在形式是
(4)欲分析电石中CaC2含量,可称取mg试样于150mL锥形瓶中,加5mL水,再加8mL硝酸(浓度c1mol·L-1)、4-5滴氢氟酸(浓度c2 mol·L-1)、5 mL高氯酸(浓度c3 mol·L-1),在电热板上加热溶解并蒸发冒白烟至试液体积约为2~3mL,取下稍冷却加15mL盐酸(浓度c4 mol·L-1)使盐类溶解后,移入250mL容量瓶中,以水稀释至刻度,摇匀。准确移取25mL试液于500mL锥形瓶中,加100mL水,10mL三乙醇胺溶液,约20mL氢氧化钾溶液调整pH≥12.5,I mL半胱胺酸溶液,5 mL硫酸镁溶液,摇匀,加钙指示剂少许.用EDTA标准溶液(浓度c mol·L-1)滴定至紫红色变蓝色为终点,用去V mL EDTA(已知EDTA与Ca2+,反应时物质的量之比为1: 1)
①写出CaC2百分含量的表达式
②为什么要先加5 mL水?否则将会发生什么结果
您最近一年使用:0次
解答题-原理综合题
|
较难(0.4)
6. ZnSe是一种光电性能优异的II~VI族半导体材料,人们开发出了多种制备ZnSe纳米粒子的方法。某研究小组用如下方法制备了ZnSe纳米粒子。
①将1mmol的Zn(NO3)2·6H2O溶于去离子水中形成无色澄清溶液,往该溶液中加入1mmolSeO2,超声完全溶解后形成无色澄清溶液;
②再加入过量的水合肼(N2H4·H2O),超声几分钟后将溶液转移到内衬聚四氟乙烯套的不锈钢高压反应釜中,将高压反应釜拧紧密封后放在160°C的恒温干燥箱中保温12小时(已知肼有强还原性,Se在碱性条件下可发生岐化反应);
③反应结束后自然冷却至室温,得到淡黄色沉淀,将产物用蒸馏水和无水乙醇洗涤数次,干燥后得到产物。将产物用X-射线粉末衍射仪(XRD)和X射线能谱仪进行物相和成分分析,发现其Zn和Se的原子个数比接近1:1。
(1)写出过程①中的化学方程式:_______
(2)写出过程②中的离子方程式:_______
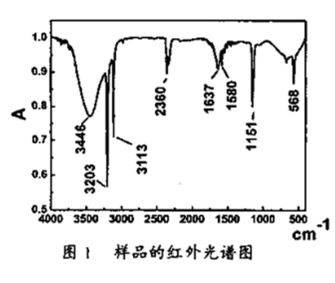
(3)产物样品的红外光谱分析结果如图1所示,该谱图反映出产物有明显的N-H、N-N吸收峰。这是因为产物中可能含有:_______ 。
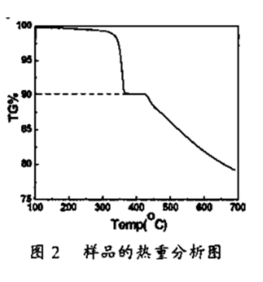
(4)产物样品的热重(重量-温度关系图)分析结果如图2所示,根据图1和图2提供的信息,推测产物的化学式可能为:_______ 。
①将1mmol的Zn(NO3)2·6H2O溶于去离子水中形成无色澄清溶液,往该溶液中加入1mmolSeO2,超声完全溶解后形成无色澄清溶液;
②再加入过量的水合肼(N2H4·H2O),超声几分钟后将溶液转移到内衬聚四氟乙烯套的不锈钢高压反应釜中,将高压反应釜拧紧密封后放在160°C的恒温干燥箱中保温12小时(已知肼有强还原性,Se在碱性条件下可发生岐化反应);
③反应结束后自然冷却至室温,得到淡黄色沉淀,将产物用蒸馏水和无水乙醇洗涤数次,干燥后得到产物。将产物用X-射线粉末衍射仪(XRD)和X射线能谱仪进行物相和成分分析,发现其Zn和Se的原子个数比接近1:1。
(1)写出过程①中的化学方程式:
(2)写出过程②中的离子方程式:
(3)产物样品的红外光谱分析结果如图1所示,该谱图反映出产物有明显的N-H、N-N吸收峰。这是因为产物中可能含有:

(4)产物样品的热重(重量-温度关系图)分析结果如图2所示,根据图1和图2提供的信息,推测产物的化学式可能为:

您最近一年使用:0次
解答题-有机推断题
|
困难(0.15)
7. 癌症是威胁人类健康的主要疾病之一。肿瘤的发病涉及到多种因素多个步骤的病理过程。研究表明,肿瘤的发生与核小体核心组蛋白N-端的赖氨酸残基的乙酰化和去乙酰化的失衡有着密切的关系。组蛋白去乙酰化酶(histone deacetylases,HDACs)抑制剂通过调节组蛋白N-端的赖氨酸残基的乙酰化和去乙酰化,激活抑癌基因,从而抑制肿瘤细胞生长,诱导肿瘤细胞凋亡,因此是近几年来抗肿瘤药物的研究热点之一。下面是一种HDAC抑制剂(F)的合成路线,请根据该路线回答问题。
(甲)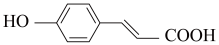
 (A)
(A)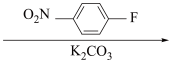 (B)
(B) (C)
(C)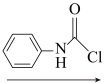 (D)
(D) (E)
(E)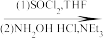 (F)
(F)
(1)写出A、B、D、E的结构式:A_______ B_______ D_______ E_______
(2)F与Zn2+配位是其发挥作用的前提之一。F中哪个部位最易与Zn2+配位?为什么_______ 。
(3)以3-(2-异丁基-4-羟基)苯基丙烯酸为原料,也可合成一种HDAC,该原料可能的立体异构体有_______ 种。
(甲)

 (A)
(A) (B)
(B) (C)
(C) (D)
(D) (E)
(E)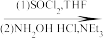 (F)
(F)
(1)写出A、B、D、E的结构式:A
(2)F与Zn2+配位是其发挥作用的前提之一。F中哪个部位最易与Zn2+配位?为什么
(3)以3-(2-异丁基-4-羟基)苯基丙烯酸为原料,也可合成一种HDAC,该原料可能的立体异构体有
您最近一年使用:0次
五、填空题 添加题型下试题
填空题
|
适中(0.65)
8. 卡巴拉丁(合成路线中化合物G)是老年人认知障碍的重要治疗药物。国内外临床试验证明该药物对改善痴呆患者的认知症状及日常活动能力具有一定的作用,且副作用少。它的合成方法如下:

请回答下列问题:
(1)由A到B的试剂和反应类型是:_______
(2)由B到C的试剂为:_______
(3)H 的结构简式为:_______
(4)如何由E获得F_______
(5)用系统命名法命名F_______

请回答下列问题:
(1)由A到B的试剂和反应类型是:
(2)由B到C的试剂为:
(3)H 的结构简式为:
(4)如何由E获得F
(5)用系统命名法命名F
【知识点】 有机化学
您最近一年使用:0次
六、解答题 添加题型下试题
解答题-有机推断题
|
较难(0.4)
9. 替米哌隆 (Timiperone)是一种抗精神病药,主要用于治疗精神分裂症。其合成路线如下:
 A(C10H10ClFO)
A(C10H10ClFO) 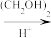 B(C12H14ClFO2)
B(C12H14ClFO2)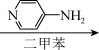 C(C17H20ClFN2O2)
C(C17H20ClFN2O2) 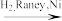
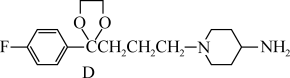
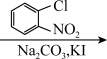
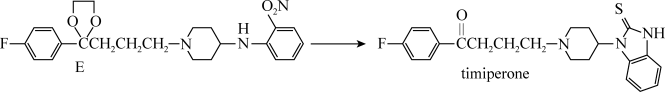
(1)写出A、B、C的结构式:A_______ 、B_______ 、C_______ 。
(2)将A转化为B的目的是:_______ 。
(3)4-氨基吡啶与B的反应中是环上的N而不是氨基N参与了反应,原因是:_______ 。
 A(C10H10ClFO)
A(C10H10ClFO) 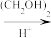 B(C12H14ClFO2)
B(C12H14ClFO2) C(C17H20ClFN2O2)
C(C17H20ClFN2O2) 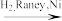
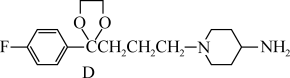


(1)写出A、B、C的结构式:A
(2)将A转化为B的目的是:
(3)4-氨基吡啶与B的反应中是环上的N而不是氨基N参与了反应,原因是:
您最近一年使用:0次
解答题-结构与性质
|
较难(0.4)
10. 随着哥本哈根气候大会的结束,气候变暖牵动全球,“低碳生活”渐人人心。世界各国也纷纷将发展解决化石能源危机和缓解环境污染问题的绿色能源作为21世纪的国家战略之一。 氢能是最为理想的能源之一, 氢能的发展最关键的技术难题是氢的储存。在储氢材料研究领域,新加坡国立大学Ping Chen等人的研究成果成为一 个重要的里程碑,他们在《Nature》上撰文,宣布Li3N可以作为一种新型无机贮氢材料,并指出Li3N的吸氢反应过程按如下两步进行:
Li3N(s) +H2(g)⇌Li2NH(s)+ LiH(s) (1)
Li2NH(s) +H2(g)⇌LiNH2(s) + LiH(s) (2)
在这两步,反应中,四种固体化合物之间的转化也伴随着四种不同的晶体结构之间的转化。
(1)LiH属于立方晶系,晶胞参数a= 4.075A。晶体中H原子作A1堆积,A、B、C表示H的堆积层,a、b、c表示Li的堆积层,那么LiH沿正当晶胞体对角线方向的堆积周期是| AcBaCb |。则: LiH的晶胞类型是_______ ;请画出LiH正当晶胞沿着体对角线方向的投影(用实线圆圈“ ”表示H的投影,用虚线圆圈“
”表示H的投影,用虚线圆圈“ ”表示Li的投影,如投影重合则用“
”表示Li的投影,如投影重合则用“ ”表示,每种原子不少于7个)
”表示,每种原子不少于7个) _______ 。
(2)Li2NH 是吸氢反应过程中的关键产物,确定Li2NH晶体中各原子的存在状态是揭示其储氢机理和对该类材料进行改进的关键。实验已经确定Li以正离子Li+形式存在。然而,由于目前实验手段的限制,H的位置很难准确确定,因而Li2NH的结构前还存在争议。现在普遍认可的是日本学者Noritake等利用同步加速器X-射线衍射方法测得的结构:Li2NH属于立方晶系,晶胞参数a= 5.074Å ;N和H的原子坐标:N(0.00,0.00,0.00),H(0.11,0.11,0.00)。已知H和N的共价半径分别为0.37Å和0.74Å,试通过计算说明Li2NH中N和H的存在状态_______ 。
(3)若Li2NH晶体中Li填充在四面体空隙中,并采取简单立方堆积,则Li2NH与常见的_______ 晶体的结构相似,且做出上述推断的前提是Li2NH晶体中N、H为_______ 结构。
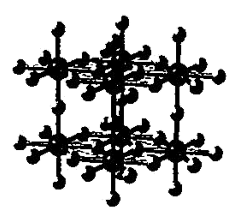
(4)α- Li3N属于六方晶系,晶体结构如图所示,据图请画出一个α- Li3N的六方晶胞(大球表示N原子,小球表示Li原子)_______ 。
(5)晶体结构测试表明:LiNH2 属于四方晶系,晶胞参数a=5.037 Å,c= 10. 278 Å,一个晶胞中包含4个LiNH2。若以材料中H的密度作为材料的储氢能力,通过计算比较Li2NH、LiH、LiNH2的储氢能力_______ 。
Li3N(s) +H2(g)⇌Li2NH(s)+ LiH(s) (1)
Li2NH(s) +H2(g)⇌LiNH2(s) + LiH(s) (2)
在这两步,反应中,四种固体化合物之间的转化也伴随着四种不同的晶体结构之间的转化。
(1)LiH属于立方晶系,晶胞参数a= 4.075A。晶体中H原子作A1堆积,A、B、C表示H的堆积层,a、b、c表示Li的堆积层,那么LiH沿正当晶胞体对角线方向的堆积周期是| AcBaCb |。则: LiH的晶胞类型是
 ”表示H的投影,用虚线圆圈“
”表示H的投影,用虚线圆圈“ ”表示Li的投影,如投影重合则用“
”表示Li的投影,如投影重合则用“ ”表示,每种原子不少于7个)
”表示,每种原子不少于7个) (2)Li2NH 是吸氢反应过程中的关键产物,确定Li2NH晶体中各原子的存在状态是揭示其储氢机理和对该类材料进行改进的关键。实验已经确定Li以正离子Li+形式存在。然而,由于目前实验手段的限制,H的位置很难准确确定,因而Li2NH的结构前还存在争议。现在普遍认可的是日本学者Noritake等利用同步加速器X-射线衍射方法测得的结构:Li2NH属于立方晶系,晶胞参数a= 5.074Å ;N和H的原子坐标:N(0.00,0.00,0.00),H(0.11,0.11,0.00)。已知H和N的共价半径分别为0.37Å和0.74Å,试通过计算说明Li2NH中N和H的存在状态
(3)若Li2NH晶体中Li填充在四面体空隙中,并采取简单立方堆积,则Li2NH与常见的
(4)α- Li3N属于六方晶系,晶体结构如图所示,据图请画出一个α- Li3N的六方晶胞(大球表示N原子,小球表示Li原子)

(5)晶体结构测试表明:LiNH2 属于四方晶系,晶胞参数a=5.037 Å,c= 10. 278 Å,一个晶胞中包含4个LiNH2。若以材料中H的密度作为材料的储氢能力,通过计算比较Li2NH、LiH、LiNH2的储氢能力
您最近一年使用:0次
试卷分析
整体难度:较难
考查范围:物质结构与性质、竞赛、认识化学科学、常见无机物及其应用、有机化学基础、化学反应原理、化学实验基础
试卷题型(共 10题)
题型
数量
填空题
4
解答题
6
试卷难度
知识点分析
细目表分析 导出
| 题号 | 难度系数 | 详细知识点 | 备注 |
| 一、填空题 | |||
| 1 | 0.65 | 利用杂化轨道理论判断分子的空间构型 利用杂化轨道理论判断化学键杂化类型 极性分子和非极性分子 分子结构 | |
| 3 | 0.65 | 有机反应类型 核磁共振氢谱 | |
| 4 | 0.4 | 酸碱理论和水溶液中的离子平衡 | |
| 8 | 0.65 | 有机化学 | |
| 二、解答题 | |||
| 2 | 0.4 | 离子方程式的书写 氧化还原反应方程式的配平 无机综合推断 氧化还原 | 原理综合题 |
| 5 | 0.4 | 酸碱中和滴定原理的应用 物质结构与性质综合考查 晶胞的有关计算 晶体 | 结构与性质 |
| 6 | 0.4 | 离子反应在化合物组成的分析、鉴定的应用 红外光谱 探究物质组成或测量物质的含量 有机化学 | 原理综合题 |
| 7 | 0.15 | 同分异构体的数目的确定 有机推断综合考查 简单配合物的成键 有机化学 | 有机推断题 |
| 9 | 0.4 | 有机合成综合考查 有机化学 | 有机推断题 |
| 10 | 0.4 | 分子结构 晶体 | 结构与性质 |



