1 . 二氧化氯( )是国际公认的新一代高效、广谱、安全杀菌保鲜剂。
)是国际公认的新一代高效、广谱、安全杀菌保鲜剂。 沸点为11℃,性质不稳定,温度较高或浓度较大时易爆炸,通常用化学方法将其稳定在水溶液中,使用时再释放出来。实验室制备
沸点为11℃,性质不稳定,温度较高或浓度较大时易爆炸,通常用化学方法将其稳定在水溶液中,使用时再释放出来。实验室制备 并转化为“稳定态二氧化氯(
并转化为“稳定态二氧化氯( )”的装置如下(夹持装置省略):
)”的装置如下(夹持装置省略):
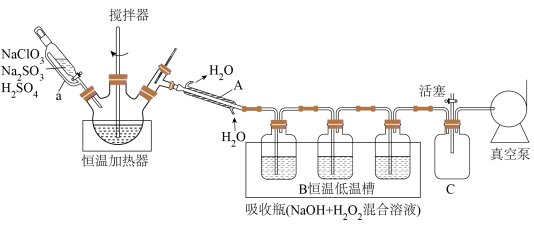
回答下列问题:
(1)仪器A的名称为___________ ,恒压分液漏斗导管a的作用是___________ ;恒温加热器内三颈瓶中发生反应生成 的化学方程式为
的化学方程式为___________ 。
(2)三个吸收瓶( 混合溶液)中发生反应的离子方程式为
混合溶液)中发生反应的离子方程式为___________ ,装置B“恒温低温槽”选择低温的原因是___________ 。
(3)装置C的作用是___________ 。
(4) 溶液中存在
溶液中存在 、
、 、
、 、
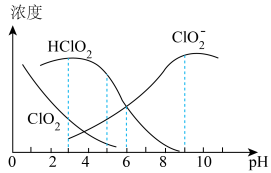
、 等四种含氧元素的微粒。经测定,25℃时
等四种含氧元素的微粒。经测定,25℃时 溶液中部分含氯元素微粒的浓度随pH变化情况如图所示(
溶液中部分含氯元素微粒的浓度随pH变化情况如图所示( 没有标出),则25℃时
没有标出),则25℃时 的电离平衡常数为
的电离平衡常数为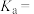
___________ ;pH=5时含氯元素的微粒浓度由大到小的关系为___________ 。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克 的氧化能力。
的氧化能力。 的有效氯含量为
的有效氯含量为___________ g。(计算结果保留两位小数)
 )是国际公认的新一代高效、广谱、安全杀菌保鲜剂。
)是国际公认的新一代高效、广谱、安全杀菌保鲜剂。 沸点为11℃,性质不稳定,温度较高或浓度较大时易爆炸,通常用化学方法将其稳定在水溶液中,使用时再释放出来。实验室制备
沸点为11℃,性质不稳定,温度较高或浓度较大时易爆炸,通常用化学方法将其稳定在水溶液中,使用时再释放出来。实验室制备 并转化为“稳定态二氧化氯(
并转化为“稳定态二氧化氯( )”的装置如下(夹持装置省略):
)”的装置如下(夹持装置省略):
回答下列问题:
(1)仪器A的名称为
 的化学方程式为
的化学方程式为(2)三个吸收瓶(
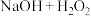 混合溶液)中发生反应的离子方程式为
混合溶液)中发生反应的离子方程式为(3)装置C的作用是
(4)
 溶液中存在
溶液中存在 、
、 、
、 、
、 等四种含氧元素的微粒。经测定,25℃时
等四种含氧元素的微粒。经测定,25℃时 溶液中部分含氯元素微粒的浓度随pH变化情况如图所示(
溶液中部分含氯元素微粒的浓度随pH变化情况如图所示( 没有标出),则25℃时
没有标出),则25℃时 的电离平衡常数为
的电离平衡常数为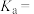

(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克
 的氧化能力。
的氧化能力。 的有效氯含量为
的有效氯含量为
您最近半年使用:0次
解题方法
2 . 中国载人潜水器“奋斗者”号,在西太平洋马里亚纳海沟成功下潜突破10000米,达到10909米,创造了中国载人深潜的新纪录。“奋斗者”号抗压关键——坚固、宽大的球形载人仓是由钛合金制成的。以钛铁矿[主要成分钛酸亚铁( )]为主要原料冶炼金属钛,同时还可得到副产物绿矾,其生产的工艺流程如图所示:
)]为主要原料冶炼金属钛,同时还可得到副产物绿矾,其生产的工艺流程如图所示:
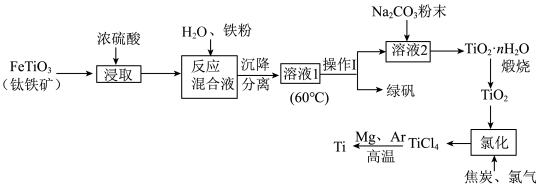
已知:钛铁矿与浓硫酸发生反应的化学方程式为 ;
; 易水解,只能存于强酸性溶液中。
易水解,只能存于强酸性溶液中。
回答下列问题:
(1) 中Ti的化合价为
中Ti的化合价为___________ ;反应混合液中加入铁粉的目的是___________ 。
(2)溶液1经“操作I”可得副产品绿矾,则操作I的名称为___________ ;在此操作过程中,需控制溶液的温度,若溶液1的温度过高,会使最终钛的产率___________ (填“升高”或“降低”),理由是___________ 。
(3)溶液2中含有的主要离子是 ,加入
,加入 粉末可得到固体
粉末可得到固体 ,请结合原理和化学用语解释其原因:
,请结合原理和化学用语解释其原因:___________ 。
(4)“氯化”是焦炭、氯气在高温下发生反应制取 ,并得到一种可燃性气体,其化学方程式为
,并得到一种可燃性气体,其化学方程式为___________ 。
(5)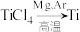 反应后得到Mg、
反应后得到Mg、 、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,蒸馏时需加热的温度应略高于
、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,蒸馏时需加热的温度应略高于___________ ℃即可。
(6)钛酸锂(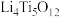 )是一种理想型嵌入材料,插入与脱嵌对材料结构几乎没影响。某新型钛酸锂电池的总反应为
)是一种理想型嵌入材料,插入与脱嵌对材料结构几乎没影响。某新型钛酸锂电池的总反应为 ,则放电时其负极反应式为
,则放电时其负极反应式为___________ 。
 )]为主要原料冶炼金属钛,同时还可得到副产物绿矾,其生产的工艺流程如图所示:
)]为主要原料冶炼金属钛,同时还可得到副产物绿矾,其生产的工艺流程如图所示:
已知:钛铁矿与浓硫酸发生反应的化学方程式为
 ;
; 易水解,只能存于强酸性溶液中。
易水解,只能存于强酸性溶液中。回答下列问题:
(1)
 中Ti的化合价为
中Ti的化合价为(2)溶液1经“操作I”可得副产品绿矾,则操作I的名称为
(3)溶液2中含有的主要离子是
 ,加入
,加入 粉末可得到固体
粉末可得到固体 ,请结合原理和化学用语解释其原因:
,请结合原理和化学用语解释其原因:(4)“氯化”是焦炭、氯气在高温下发生反应制取
 ,并得到一种可燃性气体,其化学方程式为
,并得到一种可燃性气体,其化学方程式为(5)
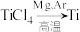 反应后得到Mg、
反应后得到Mg、 、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,蒸馏时需加热的温度应略高于
、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,蒸馏时需加热的温度应略高于| 物质 |  | Mg |  | Ti |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
(6)钛酸锂(
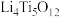 )是一种理想型嵌入材料,插入与脱嵌对材料结构几乎没影响。某新型钛酸锂电池的总反应为
)是一种理想型嵌入材料,插入与脱嵌对材料结构几乎没影响。某新型钛酸锂电池的总反应为 ,则放电时其负极反应式为
,则放电时其负极反应式为
您最近半年使用:0次
名校
解题方法
3 . 在 胶体中,逐滴加入
胶体中,逐滴加入 稀溶液,会出现一系列变化。
稀溶液,会出现一系列变化。
(1)先出现红褐色沉淀,原因是_____ 。
(2)随后沉淀溶解,溶液呈黄色,写出此反应的离子方程式_____ 。
(3)最后溶液颜色加深,原因是_____ ,此反应的离子方程式是_____ 。
(4)若用稀盐酸代替 稀溶液,能出现上述哪些相同的变化现象?
稀溶液,能出现上述哪些相同的变化现象?_____ 。(写序号)
 胶体中,逐滴加入
胶体中,逐滴加入 稀溶液,会出现一系列变化。
稀溶液,会出现一系列变化。(1)先出现红褐色沉淀,原因是
(2)随后沉淀溶解,溶液呈黄色,写出此反应的离子方程式
(3)最后溶液颜色加深,原因是
(4)若用稀盐酸代替
 稀溶液,能出现上述哪些相同的变化现象?
稀溶液,能出现上述哪些相同的变化现象?
您最近半年使用:0次
名校
4 . NiSO4主要用于电镀工业,作为电镀镍和化学镍的主要原料,也用于生产其他镍盐(如氧化镍、硫酸镍铵、碳酸镍等),从矿渣[含NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等]中回收NiSO4的工艺流程如图:
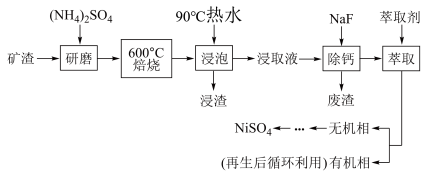
已知(NH4)2SO4在350℃分解生成NH3和H2SO4,回答下列问题:
(1)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有___________ (写化学式)。
(2)矿渣中部分FeO焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为___________ 。
(3)向“浸取液”中加入NaF以除去溶液中Ca2+(浓度为1.0×10-3mol•L﹣1),当溶液中c(F﹣)=2.0×10-3.5mol•L-1时,除钙率为___________ [Ksp(CaF2)=4.0×10-11]。
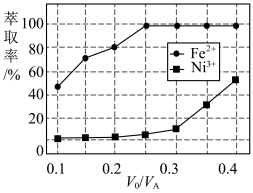
(4)溶剂萃取可用于对溶液中的金属离子进行富集与分离:Fe2+(水相)+2RH(有机相) FeR(有机相)+2H+(水相)。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为
FeR(有机相)+2H+(水相)。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为 ___________ 。在 ___________ (填“强碱性”“强酸性”或“中性”)介质中“反萃取”能使有机相再生而循环利用。
(5)以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的FeO 。
。
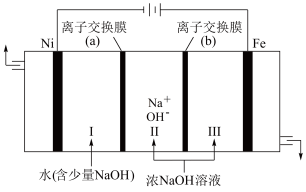
①电解时阳极的电极反应式为___________ ,离子交换膜(b)为 ___________ (填“阴”或“阳”)离子交换膜。
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为___________ 。

已知(NH4)2SO4在350℃分解生成NH3和H2SO4,回答下列问题:
(1)“浸渣”的成分有Fe2O3、FeO(OH)、CaSO4外,还含有
(2)矿渣中部分FeO焙烧时与H2SO4反应生成Fe2(SO4)3的化学方程式为
(3)向“浸取液”中加入NaF以除去溶液中Ca2+(浓度为1.0×10-3mol•L﹣1),当溶液中c(F﹣)=2.0×10-3.5mol•L-1时,除钙率为
(4)溶剂萃取可用于对溶液中的金属离子进行富集与分离:Fe2+(水相)+2RH(有机相)
 FeR(有机相)+2H+(水相)。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为
FeR(有机相)+2H+(水相)。萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值为 
(5)以Fe、Ni为电极制取Na2FeO4的原理如图所示。通电后,在铁电极附近生成紫红色的FeO
 。
。
①电解时阳极的电极反应式为
②向铁电极区出现的红褐色物质中加入少量的NaClO溶液,沉淀溶解。该反应的离子方程式为
您最近半年使用:0次
2023-10-03更新
|
436次组卷
|
6卷引用:【市级联考】山东省威海市2019届高三下学期5月高考模拟考试理科综合化学试题
10-11高三·山东聊城·阶段练习
名校
解题方法
5 . 高铁酸钾(K2FeO4)是一种既能杀菌消毒又能絮凝净水的水处理剂。工业制备高铁酸钾反应的离子方程式为Fe(OH)3+ClO-+OH-→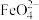 +Cl-+H2O(未配平)。下列有关说法不正确的是
+Cl-+H2O(未配平)。下列有关说法不正确的是
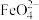 +Cl-+H2O(未配平)。下列有关说法不正确的是
+Cl-+H2O(未配平)。下列有关说法不正确的是| A.上述反应中氧化剂和还原剂的物质的量之比为3:2 |
| B.高铁酸钾中铁显+6价 |
C.由上述反应可知,Fe(OH)3的氧化性强于FeO |
| D.K2FeO4处理水时,不仅能杀菌消毒,而且生成的Fe3+水解形成Fe(OH)3胶体能吸附水中的悬浮杂质 |
您最近半年使用:0次
2023-08-23更新
|
422次组卷
|
26卷引用:2012届山东莘县实验高中高三第三次月考化学试卷
(已下线)2012届山东莘县实验高中高三第三次月考化学试卷2016届北京市通州区潞河中学高三上学期期中测试化学试卷2017届四川省泸州市泸化中学高三上10月月考化学卷新疆生产建设兵团第二中学2017-2018学年高一上学期期中考试化学试题福建省龙海市第二中学2019届高三年级上学期开学考化学试题【全国百强校】黑龙江省哈尔滨市第三中学校2019届高三上学期第二次调研考试化学试题【全国百强校】黑龙江省哈尔滨市第六中学2018-2019学年高一上学期12月月考化学试题广东省佛山市第一中学2020届高三10月月考化学试题甘肃省武威市第六中学2019-2020学年高一上学期第二次段考化学试题2020届高考化学小题狂练(全国通用版)专练5 氧化还原反应福建省永春第一中学2018-2019学年高二下学期期末考试化学试题内蒙古包钢第一中学2020届高三上学期10月月考化学试题山东省潍坊第四中学2021-2022学年高三上学期10月月考化学试题山东省潍坊市昌乐二中2021-2022学年高三10月月考化学试题(已下线)考点04 氧化还原反应-备战2022年高考化学学霸纠错(全国通用)辽宁省沈阳市新民市第一高级中学2021-2022学年高三上学期第二次阶段测试化学试题浙江省杭州地区(含周边)重点中学2022-2023学年高一上学期期中考试化学试卷【2022】【高一上】【杭师大附中】【期中考】【高中化学】【徐外兰收集】(已下线)山东省济南市2022届高三3月高考模拟考试(一模)(选择题1-5)(已下线)第二章 单元测试卷黑龙江省黑河市第九中学2023-2024学年高三上学期摸底考试化学试题河北省衡水市武强中学2023-2024学年高一上学期期中考试化学试题河北省石家庄精英中学2023-2024学年高一上学期期中考试化学试题福建省福州高新区第一中学(闽侯县第三中学)2023-20024学年高三上学期第一次月考化学试题河南省郑州市第四高级中学2023-2024学年高一上学期第二次月考 化学试题陕西省兴平市南郊高级中学2023-2024学年高一上学期第三次化学质量检测题
名校
解题方法
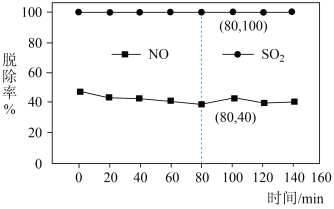
6 . 煤燃烧排放的烟气中含有 和
和 ,是大气的主要污染源之一。用
,是大气的主要污染源之一。用 溶液对烟气
溶液对烟气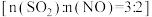 同时脱硫脱硝(分别生成
同时脱硫脱硝(分别生成 、
、 ,得到
,得到 、
、 )脱除率如图,下列说法不正确的是
)脱除率如图,下列说法不正确的是
 和
和 ,是大气的主要污染源之一。用
,是大气的主要污染源之一。用 溶液对烟气
溶液对烟气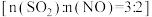 同时脱硫脱硝(分别生成
同时脱硫脱硝(分别生成 、
、 ,得到
,得到 、
、 )脱除率如图,下列说法不正确的是
)脱除率如图,下列说法不正确的是
A.脱除 的反应: 的反应: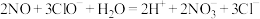 |
B.依据图中信息,在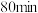 时,吸收液中 时,吸收液中 |
C. 脱除率高于 脱除率高于 的原因可能是 的原因可能是 在水中的溶解度大于 在水中的溶解度大于 |
D.随着脱除反应的进行,吸收剂溶液的 逐渐减小 逐渐减小 |
您最近半年使用:0次
2023-08-16更新
|
158次组卷
|
10卷引用:北京大兴区2020届高三一模考试化学试题
北京大兴区2020届高三一模考试化学试题山东省师范大学附属中学2021届高三上学期第二次考试化学试题河南省三门峡市2021届高三10月阶段性考试化学试题辽宁省丹东市2021届高三上学期10月阶段测试化学试题黑龙江省大庆铁人、鸡西一中、鹤岗一中三校2021届高三上学期联考化学试题(已下线)专项特训2 非金属及其化合物对环境的影响黑龙江省齐齐哈尔市实验中学等3校2022-2023学年高三上学期11月期中考试化学试题山东省滕州市2023-2024学年高三上学期期中考试化学试题河南省周口恒大中学2023-2024学年高一上学期10月月考化学试题北京市顺义区第一中学2023-2024学年高一下学期3月月考化学试题
7 . 化学与人类生产、生活密切相关,按要求回答下列问题。
(1)工业上制造光导纤维的基本原料是_______ (填化学式)。
(2)钠的化合物中,可用作潜水艇中供氧剂的是_______ ,其与 发生反应的化学方程式为
发生反应的化学方程式为_______ 。
(3)饮用水质量是关系人类健康的重要问题。暴雨过后,井水混浊无法饮用。为了能让井水变澄清,可向井水中投入_______(填字母)。
(4)工业上以氯气和石灰乳为原料制造漂白粉,漂白粉的有效成分是_______ (填化学式)。
(5)新型陶瓷氮化铝可用氧化铝高温还原法制备: (未配平),配平该化学反应方程式并用单线桥法标出电子转移的方向和数目
(未配平),配平该化学反应方程式并用单线桥法标出电子转移的方向和数目_______ 。若反应中共转移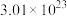 个电子,则产生
个电子,则产生 气体的体积为
气体的体积为_______ L(标准状况下)。
(1)工业上制造光导纤维的基本原料是
(2)钠的化合物中,可用作潜水艇中供氧剂的是
 发生反应的化学方程式为
发生反应的化学方程式为(3)饮用水质量是关系人类健康的重要问题。暴雨过后,井水混浊无法饮用。为了能让井水变澄清,可向井水中投入_______(填字母)。
A. | B. | C. | D. |
(5)新型陶瓷氮化铝可用氧化铝高温还原法制备:
 (未配平),配平该化学反应方程式并用单线桥法标出电子转移的方向和数目
(未配平),配平该化学反应方程式并用单线桥法标出电子转移的方向和数目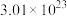 个电子,则产生
个电子,则产生 气体的体积为
气体的体积为
您最近半年使用:0次
2023-07-31更新
|
354次组卷
|
4卷引用:陕西省汉中市2020-2021学年高一上学期期末考试化学试题
陕西省汉中市2020-2021学年高一上学期期末考试化学试题(已下线)结构与性质(已下线)期末测试卷02-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册) 2023-2024学年高一上学期化学人教版(2019)必修第一册 期末综合测试题(一)
解题方法
8 . 消毒剂在生活中应用广泛, 、
、 、
、 、
、 、
、 是生活中不同领域的消毒剂。根据下列反应回答问题:
是生活中不同领域的消毒剂。根据下列反应回答问题:
①
②
③ (未配平)
(未配平)
④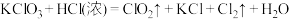 (未配平)
(未配平)
(1)储存过氧化氢的试剂瓶上最适合贴上的标签是_____(填字母)。
(2)反应①中,氧化剂与还原剂的物质的量之比为_____ 。
(3)反应②中,当有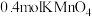 参加反应时,做酸性介质的
参加反应时,做酸性介质的 的物质的量为
的物质的量为_____  。
。
(4)配平并用双线桥法表示反应③中电子转移的方向和数目_____ 。
(5)若反应④中有 (标准状况下)氯气生成,则转移的电子数为
(标准状况下)氯气生成,则转移的电子数为_____
(6)某强酸反应体系中会发生氧化还原反应,反应物和生成物共六种微粒: 、
、 、
、 、
、 、
、 、
、 ,已知该反应中
,已知该反应中 只发生过程
只发生过程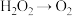 。
。
i.该反应体系选择的酸是_____ (填字母)。
A盐酸 B.稀硫酸 C.醋酸
ii.该反应的离子方程式为_____ 。
 、
、 、
、 、
、 、
、 是生活中不同领域的消毒剂。根据下列反应回答问题:
是生活中不同领域的消毒剂。根据下列反应回答问题:①

②

③
 (未配平)
(未配平)④
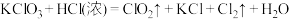 (未配平)
(未配平)(1)储存过氧化氢的试剂瓶上最适合贴上的标签是_____(填字母)。
A. | B. |
C. | D. |
(3)反应②中,当有
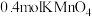 参加反应时,做酸性介质的
参加反应时,做酸性介质的 的物质的量为
的物质的量为 。
。(4)配平并用双线桥法表示反应③中电子转移的方向和数目
(5)若反应④中有
 (标准状况下)氯气生成,则转移的电子数为
(标准状况下)氯气生成,则转移的电子数为(6)某强酸反应体系中会发生氧化还原反应,反应物和生成物共六种微粒:
 、
、 、
、 、
、 、
、 、
、 ,已知该反应中
,已知该反应中 只发生过程
只发生过程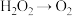 。
。i.该反应体系选择的酸是
A盐酸 B.稀硫酸 C.醋酸
ii.该反应的离子方程式为
您最近半年使用:0次
9 . 高锰酸钾是一种典型的强氧化剂。
Ⅰ.用 酸性溶液处理
酸性溶液处理 和CuS的混合物时,发生如下反应:
和CuS的混合物时,发生如下反应:
①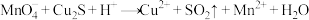 (未配平)
(未配平)
②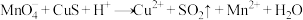 (未配平)
(未配平)
(1)反应①中被氧化的元素是__________ ,氧化剂与还原剂的物质的量之比为__________ 。
(2)当反应①中转移0.8mol电子,生成 的体积为
的体积为__________ L(标准状况下)。
(3)配平并用单线桥法标出反应②中电子转移的方向和数目______________ 。
Ⅱ.在稀硫酸中, 和
和 能发生氧化还原反应:
能发生氧化还原反应:
氧化反应:
还原反应:
(4)写出该氧化还原反应的离子方程式______________________________ 。
(5)反应中若有 参加此反应,转移电子的个数为
参加此反应,转移电子的个数为__________ 。
(6)由上述反应得出物质氧化性强弱的结论是
__________ (填“>”或“<”) 。
。
(7)实验中发现,当加入的少量 完全反应后,
完全反应后, 仍能发生反应放出气体,其原因可能是
仍能发生反应放出气体,其原因可能是__________ 。
Ⅰ.用
 酸性溶液处理
酸性溶液处理 和CuS的混合物时,发生如下反应:
和CuS的混合物时,发生如下反应:①
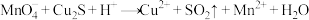 (未配平)
(未配平)②
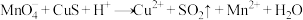 (未配平)
(未配平)(1)反应①中被氧化的元素是
(2)当反应①中转移0.8mol电子,生成
 的体积为
的体积为(3)配平并用单线桥法标出反应②中电子转移的方向和数目
Ⅱ.在稀硫酸中,
 和
和 能发生氧化还原反应:
能发生氧化还原反应:氧化反应:

还原反应:

(4)写出该氧化还原反应的离子方程式
(5)反应中若有
 参加此反应,转移电子的个数为
参加此反应,转移电子的个数为(6)由上述反应得出物质氧化性强弱的结论是

 。
。(7)实验中发现,当加入的少量
 完全反应后,
完全反应后, 仍能发生反应放出气体,其原因可能是
仍能发生反应放出气体,其原因可能是
您最近半年使用:0次
2014高三·全国·专题练习
名校
解题方法
10 . 某研究小组利用下图装置探究温度对CO还原Fe2O3的影响(固定装置略)。

(1)MgCO3的分解产物为____________________________________________________ 。
(2)装置C的作用是__________________________ ,处理尾气的方法为_____________ 。
(3)将研究小组分为两组,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
①乙组得到的黑色粉末是____________ 。
②甲组步骤1中反应的离子方程式为_________________________________________ 。
③乙组步骤4中,溶液变血红的原因为_______________________________________ ;溶液褪色可能的原因及其验证方法为________________________________________ 。
④从实验安全考虑,上图装置还可采取的改进措施是__________________________ 。

(1)MgCO3的分解产物为
(2)装置C的作用是
(3)将研究小组分为两组,按上图装置进行对比实验,甲组用酒精灯、乙组用酒精喷灯对装置D加热,反应产物均为黑色粉末(纯净物),两组分别用产物进行以下实验。
| 步骤 | 操作 | 甲组现象 | 乙组现象 |
| 1 | 取黑色粉末加入稀盐酸 | 溶解,无气泡 | 溶解,有气泡 |
| 2 | 取步骤1中溶液,滴加K3[Fe(CN)6]溶液 | 蓝色沉淀 | 蓝色沉淀 |
| 3 | 取步骤1中溶液,滴加KSCN溶液 | 变血红 | 无现象 |
| 4 | 向步骤3溶液中滴加新制氯水 | 红色褪去 | 先变血红,后褪色 |
②甲组步骤1中反应的离子方程式为
③乙组步骤4中,溶液变血红的原因为
④从实验安全考虑,上图装置还可采取的改进措施是
您最近半年使用:0次
2023-07-06更新
|
641次组卷
|
12卷引用:2014届高考化学二轮冲刺非选择题增分专练 综合实验设计练习卷
(已下线)2014届高考化学二轮冲刺非选择题增分专练 综合实验设计练习卷2015届广东省广州市十三中高三上学期期中理综化学试卷2016届广西桂林市第十八中学高三第一次月考化学试卷贵州省习水县一中2018-2019学年高一上学期12月份考试化学试题云南省玉溪市新平彝族傣族自治县第三中学2019-2020学年高一上学期期中考试化学试题云南省永平县第二中学2019-2020学年高一上学期期末考试化学试题人教版高中化学必修一第三章《金属及其化合物》测试卷2贵州省惠水县第一高级中学2019-2020学年高一上学期期末考试化学试题(已下线)第2讲 离子反应和离子方程式(已下线)第6讲 铁及其重要化合物(已下线)专题突破卷12 化学实验基础(一)-2024年高考化学一轮复习考点通关卷(新教材新高考)江西省宜春市百树学校2023-2024学年高三上学期暑期阶段测试化学试卷



