解题方法
1 . 亚硝酸钠(NaNO2)有毒、有咸味,外形与食盐相似,人若误食会引起中毒。某兴趣小组欲研究亚硝酸钠,查阅资料得到如表信息。试根据信息回答下列问题:
(1)已知NaNO2能发生如下反应:2NaNO2+4HI═2NO↑+I2+2NaI+2H2O,则该反应中氧化剂是 _______ ;若有0.75mol电子发生转移,则被氧化的还原剂的粒子数为 _______ (用NA表示阿伏加德罗常数的值)。
(2)人若误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列说法错误的是 _______(填序号)。
(3)下列方法中,可用来区分NaNO2和NaCl的是 _______ (填序号)。
A.焰色反应
B.滴加酸化的FeSO4溶液和KSCN溶液
C.在酸性条件下加入淀粉KI溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式_______ 。
| 药品 | NaNO2(亚硝酸钠) |
| 性质 | 在酸性溶液中有较强氧化性,能将Fe2+氧化成Fe3+。 |
(2)人若误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列说法错误的是 _______(填序号)。
| A.NaNO2被还原 |
| B.维生素C具有还原性 |
| C.还原性:维生素C>Fe2+ |
| D.NaNO2是还原剂 |
A.焰色反应
B.滴加酸化的FeSO4溶液和KSCN溶液
C.在酸性条件下加入淀粉KI溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式
您最近半年使用:0次
名校
解题方法
2 . 工业上用铝土矿(主要成份是 ,还含有
,还含有 、
、 )提取氧化铝做冶炼铝的原料(纯净的
)提取氧化铝做冶炼铝的原料(纯净的 ),某研究性学习小组设计了如图提取流程:
),某研究性学习小组设计了如图提取流程:
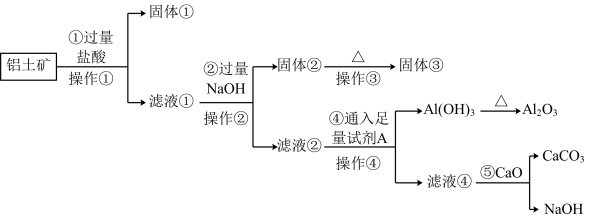
请回答下列问题:
(1)操作①的名称是_______ ,操作③用到的仪器有酒精灯、三脚架、泥三角、_______ 。
(2)写出加入过量 溶液发生反应的主要离子方程式:
溶液发生反应的主要离子方程式:________ 。
(3)流程中的 最好选用
最好选用________ ,发生反应的离子方程式为________ 。
(4)写出反应⑤的化学反应方程式______ ,上述流程中可以循环利用的物质为____ (填化学式)。
(5)有一种含铁、硅等元素的矿石,其主要成分的化学式为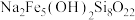 ,该物质中+2价铁与+3价铁的物质的量之比为
,该物质中+2价铁与+3价铁的物质的量之比为______ 。将 该矿石用足量
该矿石用足量______ (填盐酸或硫酸)溶解后,加入过量铜粉使溶液中的铁元素全部变为 ,过滤后滤液用
,过滤后滤液用 的
的 酸性溶液与
酸性溶液与 反应,用去
反应,用去 溶液。该矿石中铁元素的质量分数为
溶液。该矿石中铁元素的质量分数为_______ (用含 、
、 、
、 的代数式表示)。
的代数式表示)。
 ,还含有
,还含有 、
、 )提取氧化铝做冶炼铝的原料(纯净的
)提取氧化铝做冶炼铝的原料(纯净的 ),某研究性学习小组设计了如图提取流程:
),某研究性学习小组设计了如图提取流程:
请回答下列问题:
(1)操作①的名称是
(2)写出加入过量
 溶液发生反应的主要离子方程式:
溶液发生反应的主要离子方程式:(3)流程中的
 最好选用
最好选用(4)写出反应⑤的化学反应方程式
(5)有一种含铁、硅等元素的矿石,其主要成分的化学式为
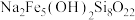 ,该物质中+2价铁与+3价铁的物质的量之比为
,该物质中+2价铁与+3价铁的物质的量之比为 该矿石用足量
该矿石用足量 ,过滤后滤液用
,过滤后滤液用 的
的 酸性溶液与
酸性溶液与 反应,用去
反应,用去 溶液。该矿石中铁元素的质量分数为
溶液。该矿石中铁元素的质量分数为 、
、 、
、 的代数式表示)。
的代数式表示)。
您最近半年使用:0次
2024-03-03更新
|
195次组卷
|
3卷引用:湖南省株洲市第一中学2021-2022学年高三上学期期中测试化学试题
名校
解题方法
3 . 下列有关反应涉及的离子方程式不正确的是
A.酸性碘化钾溶液中滴加适量双氧水: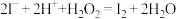 |
B.加入 将污水中的 将污水中的 氧化成 氧化成 : :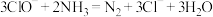 |
C.实验室用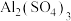 和氨水制取氢氧化铝: 和氨水制取氢氧化铝: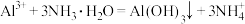 |
D. 溶液与足量 溶液与足量 溶液混合: 溶液混合: |
您最近半年使用:0次
名校
解题方法
4 . 高纯活性氧化锌可用于光催化、光电极、彩色显影等领域。以工业级氧化锌(含 等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:
等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下: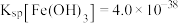 。
。
回答下列问题:
(1)浸出时,为了提高浸出效率可采取的措施有(写两种):___________ 。
(2)氧化时,加入 溶液是为了将浸出液中的
溶液是为了将浸出液中的 和
和 均转化为沉淀而除去,(溶液中
均转化为沉淀而除去,(溶液中 元素全部转化为
元素全部转化为 ),请分别写出
),请分别写出 除去
除去 和
和 的离子方程式
的离子方程式___________ ,___________ 。
(3)加入锌粉的目的是___________ 。
(4)已知 浸出液中,
浸出液中, 、
、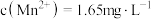 。
。
①若要除尽 上述浸出液中的
上述浸出液中的 和
和 ,需加入
,需加入___________ 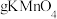 。
。
②加入 溶液反应一段时间后,溶液中
溶液反应一段时间后,溶液中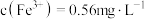 ,若溶液
,若溶液 ,则此时
,则此时
___________ (填“能”或“不能”)生成沉淀。
 等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:
等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下: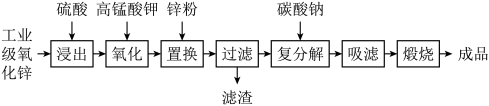
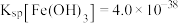 。
。回答下列问题:
(1)浸出时,为了提高浸出效率可采取的措施有(写两种):
(2)氧化时,加入
 溶液是为了将浸出液中的
溶液是为了将浸出液中的 和
和 均转化为沉淀而除去,(溶液中
均转化为沉淀而除去,(溶液中 元素全部转化为
元素全部转化为 ),请分别写出
),请分别写出 除去
除去 和
和 的离子方程式
的离子方程式(3)加入锌粉的目的是
(4)已知
 浸出液中,
浸出液中, 、
、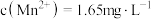 。
。①若要除尽
 上述浸出液中的
上述浸出液中的 和
和 ,需加入
,需加入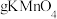 。
。②加入
 溶液反应一段时间后,溶液中
溶液反应一段时间后,溶液中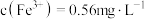 ,若溶液
,若溶液 ,则此时
,则此时
您最近半年使用:0次
2024-02-20更新
|
185次组卷
|
3卷引用:黑龙江省哈尔滨市第三中学校2020-2021学年高三上学期期末考试理科综合试卷-高中化学
黑龙江省哈尔滨市第三中学校2020-2021学年高三上学期期末考试理科综合试卷-高中化学(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)江西省南昌十九中2023-2024学年高三下学期第一次模拟考试化学试卷
名校
解题方法
5 . 某小组利用如图所示装置制备并收集TiCl4(夹持装置略去),并测定由TiCl4制备的纳米xTiO2•yH2O的组成。
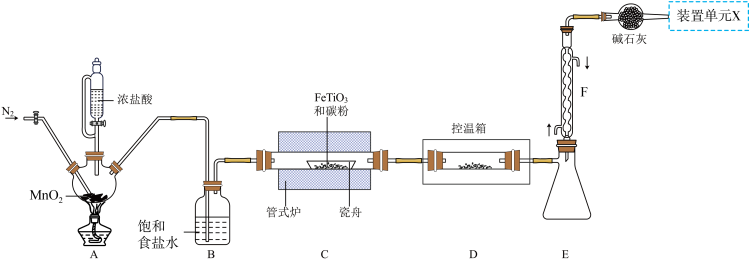
已知:
I. TiCl4高温时能与O2反应,极易水解,能溶于CCl4;
Ⅱ.瓷舟中主反应生成TiCl4、FeCl3(容易二聚成Fe2Cl6)和一种氧化物(有毒气体),还有少量副产物CCL4;
Ⅲ.相关物质的熔沸点如表:
(1)TiCl4摩尔质量大于FeCl3,但沸点却低于FeCl3的原因是_______ 。
(2)写出A中反应的化学方程式_______ ;上述装置存在一处缺陷,会导致TiCl4产率降低,改进的方法是_______ 。
(3)将管式炉加热至900℃时,瓷舟中主要反应的化学方程式为_______ 。
(4)装置E、F的作用为_______ 。
(5)设计实验测定纳米xTiO2•yH2O组成。
已知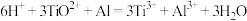 ,
,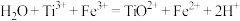
(可选试剂:水、稀硫酸、稀硝酸、氢氧化钠溶液、Al粉、0.1000 的NH4Fe(SO4)2标准溶液、硫氰化钾溶液、铁氰化钾溶液)
的NH4Fe(SO4)2标准溶液、硫氰化钾溶液、铁氰化钾溶液)
①取样称重:称取4.675g样品。②酸溶:用足量稀硫酸溶解。
③还原:加入过量Al粉还原至Al粉不再溶解,过滤取滤液定容。定容为500mL,取20.00mL。
④滴定:用0.1000 的NH4Fe(SO4)2标准溶液滴定,标准溶液装在
的NH4Fe(SO4)2标准溶液滴定,标准溶液装在_______ 滴定管(填“酸式”、“碱式”),用_______ 做指示剂,平均消耗标准溶液20.00mL,则xTiO2•yH2O的化学式为_______ 。

已知:
I. TiCl4高温时能与O2反应,极易水解,能溶于CCl4;
Ⅱ.瓷舟中主反应生成TiCl4、FeCl3(容易二聚成Fe2Cl6)和一种氧化物(有毒气体),还有少量副产物CCL4;
Ⅲ.相关物质的熔沸点如表:
TiCl4 | FeCl3 | CCl4 | |
熔点/℃ |
| 306 |
|
沸点/℃ | 136.4 | 315 | 76.8 |
(1)TiCl4摩尔质量大于FeCl3,但沸点却低于FeCl3的原因是
(2)写出A中反应的化学方程式
(3)将管式炉加热至900℃时,瓷舟中主要反应的化学方程式为
(4)装置E、F的作用为
(5)设计实验测定纳米xTiO2•yH2O组成。
已知
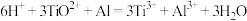 ,
,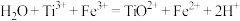
(可选试剂:水、稀硫酸、稀硝酸、氢氧化钠溶液、Al粉、0.1000
 的NH4Fe(SO4)2标准溶液、硫氰化钾溶液、铁氰化钾溶液)
的NH4Fe(SO4)2标准溶液、硫氰化钾溶液、铁氰化钾溶液)①取样称重:称取4.675g样品。②酸溶:用足量稀硫酸溶解。
③还原:加入过量Al粉还原至Al粉不再溶解,过滤取滤液定容。定容为500mL,取20.00mL。
④滴定:用0.1000
 的NH4Fe(SO4)2标准溶液滴定,标准溶液装在
的NH4Fe(SO4)2标准溶液滴定,标准溶液装在
您最近半年使用:0次
2024-02-19更新
|
846次组卷
|
3卷引用:湖南省株洲市第一中学2021届高三下学期第二次模拟检测化学试题
名校
解题方法
6 . 按要求填空:
(1)以下为中学化学中常见的几种物质:①二氧化碳 ②熔融 KCl ③NaHSO4固体④铜 ⑤稀硫酸 ⑥澄清石灰水,其中属于电解质的有_______ (填编号,下同),属于非电解质的 有_______ ,能导电的有_______ 。
(2)高铁酸钠(Na2FeO4)是一种新型的净水剂,可以通过下述反应制取:2Fe(OH)3+4NaOH+3NaClO=2Na2FeO4+3NaCl+5H2O;该反应中氧化剂是_______ (用化学式表示,下同) ,_______ 元素被氧化,还原产物与氧化产物之比为_______ 。
(3)已知次磷酸(H3PO2)是一元弱酸,其与氢氧化钠溶液反应的离子方程式为_______ 。
(1)以下为中学化学中常见的几种物质:①二氧化碳 ②熔融 KCl ③NaHSO4固体④铜 ⑤稀硫酸 ⑥澄清石灰水,其中属于电解质的有
(2)高铁酸钠(Na2FeO4)是一种新型的净水剂,可以通过下述反应制取:2Fe(OH)3+4NaOH+3NaClO=2Na2FeO4+3NaCl+5H2O;该反应中氧化剂是
(3)已知次磷酸(H3PO2)是一元弱酸,其与氢氧化钠溶液反应的离子方程式为
您最近半年使用:0次
7 . 氯化二硫 是广泛用于橡胶工业的硫化剂,其分子结构如下图所示。常温下
是广泛用于橡胶工业的硫化剂,其分子结构如下图所示。常温下 是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法错误的是
是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法错误的是
 是广泛用于橡胶工业的硫化剂,其分子结构如下图所示。常温下
是广泛用于橡胶工业的硫化剂,其分子结构如下图所示。常温下 是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法错误的是
是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体。下列说法错误的是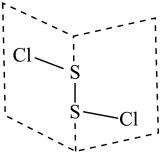
A. 的结构式为 的结构式为 |
B. 为含有极性键和非极性键的极性分子 为含有极性键和非极性键的极性分子 |
C.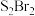 与 与 结构相似,分子间作用力: 结构相似,分子间作用力: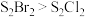 |
D. 与 与 反应的化学方程式可能为: 反应的化学方程式可能为: |
您最近半年使用:0次
2024-01-06更新
|
76次组卷
|
2卷引用:内蒙古赤峰第四中学2020-2021学年高二下学期第一次月考化学试题
名校
8 . 氧化钻(Co2O3)粉体材料在工业、电子、电讯等领域都有着广阔的应用前景。
某铜钻矿石主要含有CoO(OH)、CoCO3、Cu(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。由该矿石制备Co2O3的部分工艺过程如下:
Ⅰ、将粉碎的矿石用过量的稀H2SO4和Na2SO4溶液浸泡。
Ⅱ、浸出液除去含铜的化合物后,向溶液中先加入NaClO3溶液,再加入一定浓度的Na2CO3溶液,过滤,分离除去沉淀a[主要成分是Na2Fe6(SO4)4(OH)12]。
Ⅲ、向上述滤液中加入足量NaF溶液,过滤,分离除去沉淀b.
Ⅳ、Ⅲ中滤液加入浓Na2CO3溶液,获得CoCO3沉淀。
V、将CoCO3溶解在盐酸中,再加入(NH4)2C2O4溶液,产生CoC2O4·2H2O沉淀。分离出沉淀,将其在400℃~600℃煅烧,即得Co2O3
请回答:
(1)I中,稀硫酸溶解CoCO3的化学方程式是_____ 。
(2)根据图1、图2分析:
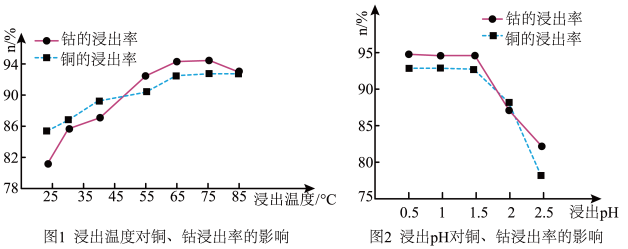
矿石粉末浸泡的适宜条件应是_____ 。
(3)Ⅱ中,漫出液中的金属离子与NaClO3反应的离子方程式:_____ 。
ClO +_____+_____ =Cl-+_____+_____
+_____+_____ =Cl-+_____+_____
(4)Ⅱ中,检验铁元素完全除去的试剂是_____ 。实验现象是 _____ 。
(5)Ⅱ、Ⅳ中,加Na2CO3的作用分别是_____ 、_____ 。
(6)V中,分离出纯净的CoC2O4⋅2H2O的操作是_____ 。
某铜钻矿石主要含有CoO(OH)、CoCO3、Cu(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。由该矿石制备Co2O3的部分工艺过程如下:
Ⅰ、将粉碎的矿石用过量的稀H2SO4和Na2SO4溶液浸泡。
Ⅱ、浸出液除去含铜的化合物后,向溶液中先加入NaClO3溶液,再加入一定浓度的Na2CO3溶液,过滤,分离除去沉淀a[主要成分是Na2Fe6(SO4)4(OH)12]。
Ⅲ、向上述滤液中加入足量NaF溶液,过滤,分离除去沉淀b.
Ⅳ、Ⅲ中滤液加入浓Na2CO3溶液,获得CoCO3沉淀。
V、将CoCO3溶解在盐酸中,再加入(NH4)2C2O4溶液,产生CoC2O4·2H2O沉淀。分离出沉淀,将其在400℃~600℃煅烧,即得Co2O3
请回答:
(1)I中,稀硫酸溶解CoCO3的化学方程式是
(2)根据图1、图2分析:

矿石粉末浸泡的适宜条件应是
(3)Ⅱ中,漫出液中的金属离子与NaClO3反应的离子方程式:
ClO
 +_____+_____ =Cl-+_____+_____
+_____+_____ =Cl-+_____+_____(4)Ⅱ中,检验铁元素完全除去的试剂是
(5)Ⅱ、Ⅳ中,加Na2CO3的作用分别是
(6)V中,分离出纯净的CoC2O4⋅2H2O的操作是
您最近半年使用:0次
名校
解题方法
9 . 工业制硝酸的尾气中含N2O、NO和NO2等氧化物是空气污染物,含有氢氧化物的尾气需处理后才能排放。
Ⅰ、工业制硝酸:
(1)氨催化氧化法是工业制硝酸的基础反应,写出氨催化氧化的化学方程式为_____ 。
Ⅱ、含氮氧化物的尾气处理:
(2)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂使N2O分解,N2O分解的化学方程式为_____ 。
(3)用NaClO溶液吸收尾气。用NaClO溶液代替NaOH溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为NO3-的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。

①在酸性NaClO溶液中,HClO氧化NO生成NO3-时发生反应的离子方程式为_____ 。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是_____ 。
Ⅰ、工业制硝酸:
(1)氨催化氧化法是工业制硝酸的基础反应,写出氨催化氧化的化学方程式为
Ⅱ、含氮氧化物的尾气处理:
(2)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂使N2O分解,N2O分解的化学方程式为
(3)用NaClO溶液吸收尾气。用NaClO溶液代替NaOH溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为NO3-的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。

①在酸性NaClO溶液中,HClO氧化NO生成NO3-时发生反应的离子方程式为
②NaClO溶液的初始pH越小,NO转化率越高。其原因是
您最近半年使用:0次
名校
解题方法
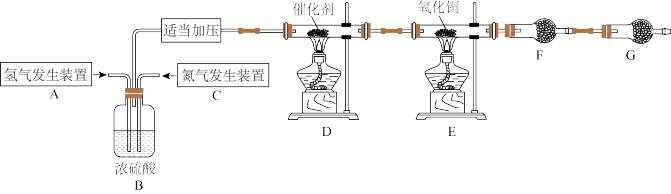
10 . 某学习小组根据氨气还原氧化铜的反应,设计实验测定铜元素相对原子质量Ar(Cu)(近似值)。甲同学模拟工业合成氨制备氨气,反应前先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H₂O),由此计算 Ar(Cu)。装置图如下:
已知:实验室用亚硝酸盐、铵盐的混合浓溶液共热制备N₂,化学反应方程式为
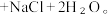 请回答下列问题:
请回答下列问题:
(1)C装置应选用___________ (填“Ⅰ”“Ⅱ”或“Ⅲ”)。

(2)装置B的作用是:①干燥氢气和氮气:②使气体混合均匀;③___________ 。
(3)氨气还原炽热氧化铜的化学方程式为___________ 。
(4)干燥管F中盛放的干燥剂为___________(填字母)。
(5)乙同学经过思考认为上述装置操作麻烦,并对原装置进行了改进,装置如图所示。实验前将石英玻璃管(带两端开关K₁和K₂)(设为装置C)称重,记为 m₁g。将氧化铜装入石英玻璃管中,再次将装置c 称重,记为m₂g。按下图连接好装置进行实验。
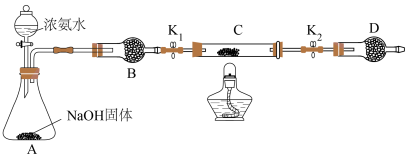
①将下列实验操作步骤正确排序:j、d、g、a、b、___________ (填字母代号);重复上述操作步骤,直至C 恒重, 记为 m₃g。
a. 点燃酒精灯,加热
b. 熄灭酒精灯
c. 关闭 K₁和 K₂
d. 打开 K₁和 K₂
e. 称量装置C的质量
f. 冷却至室温
g.打开分液漏斗活塞,使装置中充满 NH₃
h. 关闭分液漏斗活塞
j. 检验装置气密性
②根据实验记录,计算铜元素相对原子质量Ar(Cu)=___________ (列式表示)。

已知:实验室用亚硝酸盐、铵盐的混合浓溶液共热制备N₂,化学反应方程式为

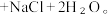 请回答下列问题:
请回答下列问题:(1)C装置应选用

(2)装置B的作用是:①干燥氢气和氮气:②使气体混合均匀;③
(3)氨气还原炽热氧化铜的化学方程式为
(4)干燥管F中盛放的干燥剂为___________(填字母)。
| A.碱石灰 | B.无水 CuSO₄ | C.五氧化二磷 | D.无水 CaCl₂ |
(5)乙同学经过思考认为上述装置操作麻烦,并对原装置进行了改进,装置如图所示。实验前将石英玻璃管(带两端开关K₁和K₂)(设为装置C)称重,记为 m₁g。将氧化铜装入石英玻璃管中,再次将装置c 称重,记为m₂g。按下图连接好装置进行实验。

①将下列实验操作步骤正确排序:j、d、g、a、b、
a. 点燃酒精灯,加热
b. 熄灭酒精灯
c. 关闭 K₁和 K₂
d. 打开 K₁和 K₂
e. 称量装置C的质量
f. 冷却至室温
g.打开分液漏斗活塞,使装置中充满 NH₃
h. 关闭分液漏斗活塞
j. 检验装置气密性
②根据实验记录,计算铜元素相对原子质量Ar(Cu)=
您最近半年使用:0次

 23.2
23.2

