1 . 已知: 易溶于水,
易溶于水, 微溶于水。以含锂的电解铝废渣(主要含
微溶于水。以含锂的电解铝废渣(主要含 、
、 、
、 、
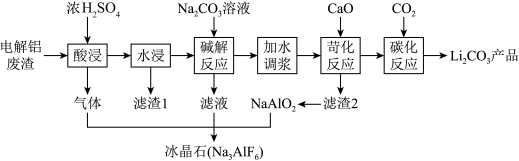
、 )和浓硫酸为原料,制备电池级碳酸锂,同时得到副产品冰晶石的工艺流程如图,下列有关说法不正确的是
)和浓硫酸为原料,制备电池级碳酸锂,同时得到副产品冰晶石的工艺流程如图,下列有关说法不正确的是
 易溶于水,
易溶于水, 微溶于水。以含锂的电解铝废渣(主要含
微溶于水。以含锂的电解铝废渣(主要含 、
、 、
、 、
、 )和浓硫酸为原料,制备电池级碳酸锂,同时得到副产品冰晶石的工艺流程如图,下列有关说法不正确的是
)和浓硫酸为原料,制备电池级碳酸锂,同时得到副产品冰晶石的工艺流程如图,下列有关说法不正确的是
A.第一步酸浸时产生气体的化学式为 |
B.滤渣1的成分为 |
C.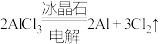 |
D.碳化反应后的溶液得到 的具体实验操作是蒸发浓缩,冷却结晶,过滤,洗涤,干燥 的具体实验操作是蒸发浓缩,冷却结晶,过滤,洗涤,干燥 |
您最近一年使用:0次
名校
2 . 海洋资源丰富,海水水资源的利用和海水化学资源(主要为 NaCl 和 MgSO4等物质及K、Br 等元素)的利用具有非常广阔的前景。
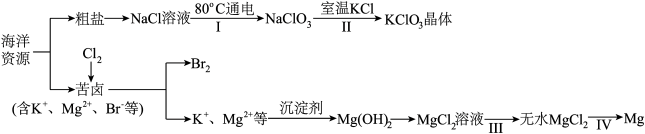
回答下列问题:
(1)Br 元素价电子排布式___________
(2)下列状态的镁中,电离最外层一个电子所需能量最大的是___________(填标号)。
(3)步骤Ⅰ利用电解法制备,写出阳极发生的反应方程式:___________ ,步骤Ⅱ中能析出 KClO3晶体而无其他晶体析出的原因是___________ 。
(4)氯碱工业中产生的氯气有很多用途,将氯气 Cl2和H2O(g)通过灼热的炭层,生成 HCl 和CO2,当有 1 mol Cl2参与反应时释放出 145.0 kJ 热量,写出该反应的热化学方程式___________ 。
(5)利用氯气制出的三氯化硼(BCl3)是一种重要的化工原料,BCl3的空间构型为___________ 。
(6)工业上还可以用 NaClO 在碱性条件下把 Ni(OH)2转化为 Ni2O3,其离子方程式为___________ 。
(7)写出在含有 amolFeBr2的溶液中,通入 amolCl2的离子方程式___________ 。

回答下列问题:
(1)Br 元素价电子排布式
(2)下列状态的镁中,电离最外层一个电子所需能量最大的是___________(填标号)。
A.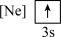 | B.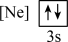 |
C.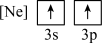 | D.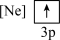 |
(4)氯碱工业中产生的氯气有很多用途,将氯气 Cl2和H2O(g)通过灼热的炭层,生成 HCl 和CO2,当有 1 mol Cl2参与反应时释放出 145.0 kJ 热量,写出该反应的热化学方程式
(5)利用氯气制出的三氯化硼(BCl3)是一种重要的化工原料,BCl3的空间构型为
(6)工业上还可以用 NaClO 在碱性条件下把 Ni(OH)2转化为 Ni2O3,其离子方程式为
(7)写出在含有 amolFeBr2的溶液中,通入 amolCl2的离子方程式
您最近一年使用:0次
名校
解题方法
3 . 六聚偏磷酸钠[(NaPO3)6]是偏磷酸钠(NaPO3)的一种聚合体,其主要用于水处理、造纸、食品行业。工业上由Ca3(PO4)2、焦炭、石英砂为原料制备六偏磷酸钠的方法如下:
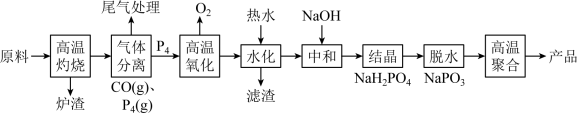
回答下列问题:
(1)六聚偏磷酸钠[(NaPO3)6]中的磷元素的化合价是_______ 。
(2)“高温灼烧”发生反应的化学方程式是_______ 。
(3)因白磷(P4)易自燃,故通常保存在冷水中。在“气体分离”环节中得到白磷固体比较合理的操作是_______ 。
(4)经分析,所得到的白磷中含有相对较多的Pb和含量相对少量的As元素。在“高温氧化”时As、Pb会被氧化成As2O5、PbO,随后在“水化”(产物是H3PO4)过程中转化为两种难溶性盐被除去,则两种滤渣的主要成分是_______ 、_______ (填化学式)。
(5)已知室温下H3PO4的Ka1=7.5×10-3、Ka2=6.4×10-8、Ka3=4.4×10-13,且lg3.2=0.5。
①若直接将白磷与足量NaOH溶液直接混合加热,则得到的是次磷酸钠(NaH2PO2),但同时会得到一种剧毒气体(PH3)。写出该化学方程式_______ 。
②欲得到室温下0.5mol/LNaH2PO4溶液,则“中和”时需加适量NaOH固体调溶液pH约为_______ (结果保留两位小数)。
(6)将白磷的氧化产物(P4O10)与纯碱混合加热是工业上制备偏磷酸钠的另一种方法,该方法的化学方程式是_______ 。

回答下列问题:
(1)六聚偏磷酸钠[(NaPO3)6]中的磷元素的化合价是
(2)“高温灼烧”发生反应的化学方程式是
(3)因白磷(P4)易自燃,故通常保存在冷水中。在“气体分离”环节中得到白磷固体比较合理的操作是
(4)经分析,所得到的白磷中含有相对较多的Pb和含量相对少量的As元素。在“高温氧化”时As、Pb会被氧化成As2O5、PbO,随后在“水化”(产物是H3PO4)过程中转化为两种难溶性盐被除去,则两种滤渣的主要成分是
(5)已知室温下H3PO4的Ka1=7.5×10-3、Ka2=6.4×10-8、Ka3=4.4×10-13,且lg3.2=0.5。
①若直接将白磷与足量NaOH溶液直接混合加热,则得到的是次磷酸钠(NaH2PO2),但同时会得到一种剧毒气体(PH3)。写出该化学方程式
②欲得到室温下0.5mol/LNaH2PO4溶液,则“中和”时需加适量NaOH固体调溶液pH约为
(6)将白磷的氧化产物(P4O10)与纯碱混合加热是工业上制备偏磷酸钠的另一种方法,该方法的化学方程式是
您最近一年使用:0次
名校
4 . 人类农业生产离不开氮肥,科学合理使用氮肥,不仅能提高化肥的使用且能够更好地保护环境,请回答下列问题:
(1)工业合成氨为氮肥的生产作出了巨大贡献。 和
和 在催化剂表面合成氨的微观历程及能量变化的示意图如下,用
在催化剂表面合成氨的微观历程及能量变化的示意图如下,用 、
、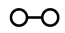 、
、 分别
分别 、
、 、
、 。
。
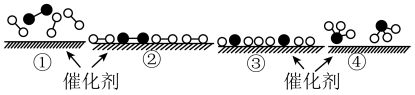
已知工业合成氨: 是一个放热反应。
是一个放热反应。
下列说法正确的是___________。
(2)以下是 (
( 和
和 的起始物质的量之比为1∶3)在不同条件下达到平衡状态时
的起始物质的量之比为1∶3)在不同条件下达到平衡状态时 的转化率,由表中数据可知:
的转化率,由表中数据可知:
①提高该化学反应限度的途径是___________ 。
② 含量达到98.8%的条件是
含量达到98.8%的条件是___________ ,而实际工业生产通常选择温度400~500℃,原因是___________ ,压强选择10MPa~30MPa,原因是___________ 。
(3)过渡施用氮肥将导致大气中 含量增高,加剧雾霾的形成。
含量增高,加剧雾霾的形成。 是雾霾的成分之一,其形成过程如下图所示(转化所需试剂及条件已略去)
是雾霾的成分之一,其形成过程如下图所示(转化所需试剂及条件已略去)
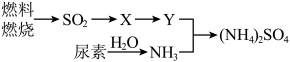
①X可能是 或
或___________ ,Y是___________
②尿素 是一种常用(有机氮肥,缓慢与
是一种常用(有机氮肥,缓慢与 发生非氧化还原反应释放出
发生非氧化还原反应释放出 和另外一种气体,该反应的化学方程式为
和另外一种气体,该反应的化学方程式为___________ 。
(1)工业合成氨为氮肥的生产作出了巨大贡献。
 和
和 在催化剂表面合成氨的微观历程及能量变化的示意图如下,用
在催化剂表面合成氨的微观历程及能量变化的示意图如下,用 、
、 、
、 分别
分别 、
、 、
、 。
。
已知工业合成氨:
 是一个放热反应。
是一个放热反应。下列说法正确的是___________。
| A.使用催化剂,可以加快合成氨的反应速率 |
| B.②→③过程,是吸热过程且只有H-H键断裂 |
C.③→④过程,N原子和H原子形成了含有极性键的 |
| D.合成氨反应中,反应物断键吸收能量大于生成物形成新键释放的能量 |
 (
( 和
和 的起始物质的量之比为1∶3)在不同条件下达到平衡状态时
的起始物质的量之比为1∶3)在不同条件下达到平衡状态时 的转化率,由表中数据可知:
的转化率,由表中数据可知:压强/MPa
温度/℃ | 0.1 | 10 | 20 | 30 | 60 | 100 |
| 200 | 15.3 | 81.5 | 86.4 | 89.9 | 95.4 | 98.8 |
| 300 | 2.2 | 52.0 | 64.2 | 71.0 | 84.2 | 92.6 |
| 400 | 0.4 | 25.1 | 38.2 | 47.0 | 65.2 | 79.8 |
| 500 | 0.1 | 10.6 | 19.1 | 26.4 | 42.2 | 57.5 |
| 600 | 0.05 | 4.5 | 9.1 | 13.8 | 23.1 | 31.4 |
②
 含量达到98.8%的条件是
含量达到98.8%的条件是(3)过渡施用氮肥将导致大气中
 含量增高,加剧雾霾的形成。
含量增高,加剧雾霾的形成。 是雾霾的成分之一,其形成过程如下图所示(转化所需试剂及条件已略去)
是雾霾的成分之一,其形成过程如下图所示(转化所需试剂及条件已略去)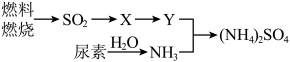
①X可能是
 或
或②尿素
 是一种常用(有机氮肥,缓慢与
是一种常用(有机氮肥,缓慢与 发生非氧化还原反应释放出
发生非氧化还原反应释放出 和另外一种气体,该反应的化学方程式为
和另外一种气体,该反应的化学方程式为
您最近一年使用:0次
名校
解题方法
5 . 钼是电子工业的重要材料,制备它的原料之一是钼铅矿(主要成分是PbMoO4,模拟部分工艺流如图:

已知:Mo有多种化合价,常见化合价有+2、+3、+4、+6;
(1)浸渣的主要成分是________ (填化学式)。
(2)写出流程中用热还原法制单质钼的化学方程式________ 。
(3)铵化时,加HNO3的作用是________ 。
(4)检验(NH4)2MoO4晶体洗净的方法是________ 。
(5)可循环利用的物质有________ (填化学式)。
(6)钼基硫化合物Cu2Mo6S8常用作锂离子电池正极材料,具有较高的功率密度和能量密度,该电池放电时的总反应为xLi+Cu2Mo6S8=LixCu2Mo6S8,写出该电池充电时阳极的电极反应式:________ 。

已知:Mo有多种化合价,常见化合价有+2、+3、+4、+6;
(1)浸渣的主要成分是
(2)写出流程中用热还原法制单质钼的化学方程式
(3)铵化时,加HNO3的作用是
(4)检验(NH4)2MoO4晶体洗净的方法是
(5)可循环利用的物质有
(6)钼基硫化合物Cu2Mo6S8常用作锂离子电池正极材料,具有较高的功率密度和能量密度,该电池放电时的总反应为xLi+Cu2Mo6S8=LixCu2Mo6S8,写出该电池充电时阳极的电极反应式:
您最近一年使用:0次
名校
解题方法
6 . 工业上用黄铁矿 为原料制备硫酸的流程如下:
为原料制备硫酸的流程如下:
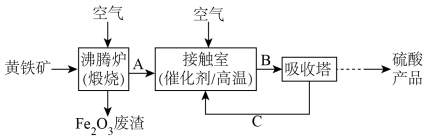
回答下列问题:
(1)在接触室中发生的反应是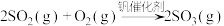 ,该反应属于
,该反应属于_______ (填字母)。
a.氧化还原反应 b.离子反应 c.化合反应 d.可逆反应
(2)沸腾炉中发生反应的化学方程式为_______ 。
(3)利用 废渣(俗称“红砂”)制备废水除砷剂的第一步是将“红砂”与硫酸混合,该步反应的离子方程式为
废渣(俗称“红砂”)制备废水除砷剂的第一步是将“红砂”与硫酸混合,该步反应的离子方程式为_______ 。
(4)我国 排放标准限值为
排放标准限值为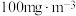 。硫酸工业废气(假设含硫化合物均为
。硫酸工业废气(假设含硫化合物均为 )可采用雾化的氨水与废气直接接触以吸收
)可采用雾化的氨水与废气直接接触以吸收 (反应生成
(反应生成 ),若烟气
),若烟气 含量为
含量为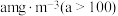 ,试计算每立方米烟气至少需要浓度为
,试计算每立方米烟气至少需要浓度为 氨水
氨水_______ L(用含a、b的代数式表示),才能使该烟气 排放值为
排放值为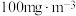 。
。
(5) 可用于杀菌、消毒。葡萄酒里含有微量
可用于杀菌、消毒。葡萄酒里含有微量 ,起保鲜、杀菌和抗氧化作用。氯水和
,起保鲜、杀菌和抗氧化作用。氯水和 都有漂白性,有人为增强漂白效果,将
都有漂白性,有人为增强漂白效果,将 和
和 混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因:
混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因:_______ 。
(6)大气中的水蒸气在紫外线作用下会转化为活泼的 (羟基自由基,“·”表示1个电子)。
(羟基自由基,“·”表示1个电子)。 可看作催化剂,将
可看作催化剂,将 转化为
转化为 ,过程如下:
,过程如下: 。按题目给出的信息,在第二步
。按题目给出的信息,在第二步 与
与 按物质的量之比1:1反应,请写出第二步反应(基元反应)的方程式
按物质的量之比1:1反应,请写出第二步反应(基元反应)的方程式_______ 。
 为原料制备硫酸的流程如下:
为原料制备硫酸的流程如下:
回答下列问题:
(1)在接触室中发生的反应是
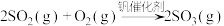 ,该反应属于
,该反应属于a.氧化还原反应 b.离子反应 c.化合反应 d.可逆反应
(2)沸腾炉中发生反应的化学方程式为
(3)利用
 废渣(俗称“红砂”)制备废水除砷剂的第一步是将“红砂”与硫酸混合,该步反应的离子方程式为
废渣(俗称“红砂”)制备废水除砷剂的第一步是将“红砂”与硫酸混合,该步反应的离子方程式为(4)我国
 排放标准限值为
排放标准限值为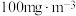 。硫酸工业废气(假设含硫化合物均为
。硫酸工业废气(假设含硫化合物均为 )可采用雾化的氨水与废气直接接触以吸收
)可采用雾化的氨水与废气直接接触以吸收 (反应生成
(反应生成 ),若烟气
),若烟气 含量为
含量为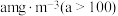 ,试计算每立方米烟气至少需要浓度为
,试计算每立方米烟气至少需要浓度为 氨水
氨水 排放值为
排放值为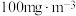 。
。(5)
 可用于杀菌、消毒。葡萄酒里含有微量
可用于杀菌、消毒。葡萄酒里含有微量 ,起保鲜、杀菌和抗氧化作用。氯水和
,起保鲜、杀菌和抗氧化作用。氯水和 都有漂白性,有人为增强漂白效果,将
都有漂白性,有人为增强漂白效果,将 和
和 混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因:
混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因:(6)大气中的水蒸气在紫外线作用下会转化为活泼的
 (羟基自由基,“·”表示1个电子)。
(羟基自由基,“·”表示1个电子)。 可看作催化剂,将
可看作催化剂,将 转化为
转化为 ,过程如下:
,过程如下: 。按题目给出的信息,在第二步
。按题目给出的信息,在第二步 与
与 按物质的量之比1:1反应,请写出第二步反应(基元反应)的方程式
按物质的量之比1:1反应,请写出第二步反应(基元反应)的方程式
您最近一年使用:0次
名校
7 . 根据要求回答问题:
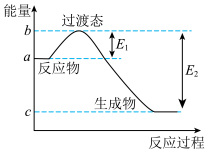
(1)如图是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,活化能E1的变化是_____ (填“增大”“减小”或“不变”,下同),ΔH的变化是_____ 。图中最稳定的是_____ (填“反应物”“过渡态”或“生成物”)。
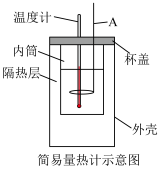
(2)50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应反应热(设溶液的密度均为1g•cm-3,反应后溶液的比热容c=4.18J•g-1•℃-1)。回答下列问题:
从实验装置上看,图中仪器A的名称是_____ ,隔热层的作用是_____ 。根据表中数据,结合题干信息,请写出生成1molH2O的热化学方程式_____ (保留3位有效数字)。
(3)生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的1.2~2.0万倍,在大气中的寿命可长达740年之久,表中是几种化学键的键能:
写出N2(g)与F2(g)反应合成NF3(g)的热化学方程式_____ 。
(4)在微生物作用的条件下,NH 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。这两步反应的能量变化如图:
。这两步反应的能量变化如图:
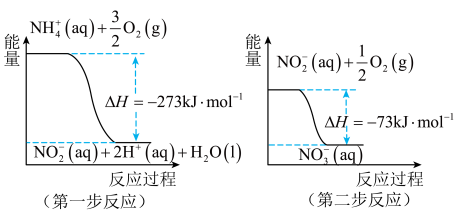
第二步反应是_____ (填“放热”或“吸热”)反应。1molNH (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的热化学方程式是
(aq)的热化学方程式是_____ 。
(1)如图是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,活化能E1的变化是

(2)50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应反应热(设溶液的密度均为1g•cm-3,反应后溶液的比热容c=4.18J•g-1•℃-1)。回答下列问题:
 | 实验次数 | 反应物的温度/℃ | 反应前体系的温度 | 反应后体系的温度 | 温度差 | |
| 盐酸 | NaOH溶液 | t1/℃ | t2/℃ | (t2-t1)/℃ | ||
| 1 | 25.0 | 25.2 | 25.1 | 28.5 | 3.4 | |
| 2 | 24.9 | 25.1 | 25.0 | 28.3 | 3.3 | |
| 3 | 25.6 | 25.4 | 25.5 | 29.0 | 3.5 | |
(3)生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的1.2~2.0万倍,在大气中的寿命可长达740年之久,表中是几种化学键的键能:
| 化学键 | N≡N | F-F | N-F |
| 键能/kJ•mol-1 | 941.7 | 154.8 | 283.0 |
(4)在微生物作用的条件下,NH
 经过两步反应被氧化成NO
经过两步反应被氧化成NO 。这两步反应的能量变化如图:
。这两步反应的能量变化如图:
第二步反应是
 (aq)全部氧化成NO
(aq)全部氧化成NO (aq)的热化学方程式是
(aq)的热化学方程式是
您最近一年使用:0次
名校
解题方法
8 . 化学让生活更美好,各类水处理剂能让水质得到提升达到饮用水的标准。生活中较常见的水处理剂有:氯气、次氯酸钠、漂白粉(主要成分为次氯酸钙)、二氧化氯、明矾、硫酸铁、高铁酸钠等等。
(1)氯气常用于自来水的消毒,请写出舍勒研究软锰矿时发现氯气的化学方程式:___________ 。
(2)氯气能用于制备易于保存、使用方便的漂白液,但若温度过高会发生副反应生成NaCl、NaClO3。请写出在加热时,当NaOH与Cl2反应生成的n(NaClO):n(NaClO3)=5:1时,NaOH与Cl2反应的化学方程式:___________ 。
(3)下列有关水资源及水质净化的说法,不正确的是___________(填序号)。
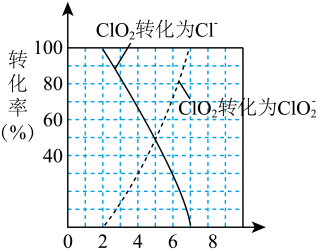
(4)近年来有科学家提出,氯气消毒时,会与水中的有机物发生反应,生成的有机氯化物可能对人体有害。因此,人们已开始研究并试用新的自来水消毒剂,如二氧化氯(ClO2)、臭氧等。ClO2被世界卫生组织(WHO)列为A级高效、安全灭菌消毒剂,将逐渐取代Cl2成为自来水的消毒剂。ClO2气体具有强氧化性,其还原产物ClO 、Cl﹣的转化率与pH关系如图所示。ClO2对污水中S2﹣、CN﹣等也有明显的去除效果,请写出pH≤2时,ClO2与S2﹣反应的离子方程式:
、Cl﹣的转化率与pH关系如图所示。ClO2对污水中S2﹣、CN﹣等也有明显的去除效果,请写出pH≤2时,ClO2与S2﹣反应的离子方程式:___________ 。某工厂污水中含CN﹣amg/L,现用ClO2将CN﹣氧化,生成了两种无毒无害的气体,处理50m3这种污水,至少需要ClO2___________ mol。
(5)高铁酸钠(Na2FeO4)在水中既能消毒杀菌,其产物Fe(OH)3胶体又能净水除去悬浮杂质,是一种理想的水处理剂。如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,Cl2、ClO2(pH≤2时)、Na2FeO4三种消毒杀菌剂的消毒效率由大到小的顺序是___________ 。
(1)氯气常用于自来水的消毒,请写出舍勒研究软锰矿时发现氯气的化学方程式:
(2)氯气能用于制备易于保存、使用方便的漂白液,但若温度过高会发生副反应生成NaCl、NaClO3。请写出在加热时,当NaOH与Cl2反应生成的n(NaClO):n(NaClO3)=5:1时,NaOH与Cl2反应的化学方程式:
(3)下列有关水资源及水质净化的说法,不正确的是___________(填序号)。
| A.将自来水煮沸烧开后再饮用更健康、因为能除去残留的Cl2及溶于其中的Cl﹣ |
| B.自来水用于洗涤后得到的含磷污水是很好的肥料,可灌溉庄稼,能直接排放到自然界水体中 |
| C.煤、石油的燃烧和汽车排放的尾气都会引起大气污染,且会出现酸雨等环境问题 |
| D.纳米铁粉可以高效地去除被污染水体中的Pb2+、Cu2+、Cd2+、Hg2+等重金属离子,其本质是纳米铁粉对重金属离子有较强的物理吸附 |
 、Cl﹣的转化率与pH关系如图所示。ClO2对污水中S2﹣、CN﹣等也有明显的去除效果,请写出pH≤2时,ClO2与S2﹣反应的离子方程式:
、Cl﹣的转化率与pH关系如图所示。ClO2对污水中S2﹣、CN﹣等也有明显的去除效果,请写出pH≤2时,ClO2与S2﹣反应的离子方程式:(5)高铁酸钠(Na2FeO4)在水中既能消毒杀菌,其产物Fe(OH)3胶体又能净水除去悬浮杂质,是一种理想的水处理剂。如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,Cl2、ClO2(pH≤2时)、Na2FeO4三种消毒杀菌剂的消毒效率由大到小的顺序是

您最近一年使用:0次
9 . 化学既能指导人们科学生活,也能指导人们治理环境污染等。
(1)没有擦干的铸铁锅易生锈,是因为发生了______________ (填“吸氧”或“析氢”)腐蚀。
(2)下列金属的防护方法中,正确的是_____________ (填字母)。
A.在铁制的下水道上焊上铜块
B.衣架和电线的外面包上一层塑料层
C.在自行车的钢圈上刷油漆,以防生锈
(3)汽车尾气中含有CO和NO等有毒气体,在催化剂的作用下,使CO和NO反应转化成 和一种无毒的单质气体,该反应的化学方程式是
和一种无毒的单质气体,该反应的化学方程式是__________________________ 。
(4)钢铁厂、电镀厂在生产过程中会产生酸性废水,一般用_____________(填字母)来进行中和处理。
(5)近几年冬季,雾霾天气有所减少.导致雾霾出现的主要原因是____________ (填字母)。
A. B.
B. C.PM2.5
C.PM2.5
(6)垃圾的再生利用是垃圾资源化的最佳途径,以下垃圾处理方法中正确的是_____________(填字母)。
(1)没有擦干的铸铁锅易生锈,是因为发生了
(2)下列金属的防护方法中,正确的是
A.在铁制的下水道上焊上铜块
B.衣架和电线的外面包上一层塑料层
C.在自行车的钢圈上刷油漆,以防生锈
(3)汽车尾气中含有CO和NO等有毒气体,在催化剂的作用下,使CO和NO反应转化成
 和一种无毒的单质气体,该反应的化学方程式是
和一种无毒的单质气体,该反应的化学方程式是(4)钢铁厂、电镀厂在生产过程中会产生酸性废水,一般用_____________(填字母)来进行中和处理。
A. | B. | C. | D. |
A.
 B.
B. C.PM2.5
C.PM2.5(6)垃圾的再生利用是垃圾资源化的最佳途径,以下垃圾处理方法中正确的是_____________(填字母)。
| A.废旧电池无须处理,集中深埋即可 | B.厨余垃圾直接倒入下水道 |
| C.废旧玻璃可回收熔炼,再生利用 | D.废旧纸张可直接露天焚烧 |
您最近一年使用:0次
21-22高一上·浙江·阶段练习
10 . 化学用语是学习化学的基本工具,是高中化学的重要内容,请根据要求用合适的化学用语填空:
(1)从分子结构上来看,氮与碳有很多对应的物质(如CH4和NH3对应),请找出下列含碳化合物对应的含氮物质(填写化学式):H2CO3_____ ;C2H2_____ 。
(2)已知Fe元素在化合物里通常显+2或+3价,因此Fe3O4可写成氧化物形式FeO·Fe2O3,或盐的形式Fe(FeO2)2,它属于偏铁酸盐。Pb在化合物里显+2价或+4价,那么Pb3O4也可以写成_____ 或_____ 。(填写化学式)
(3)在法庭医学分析上常用马氏砷法来证明受害者是否为砒霜(As2O3)中毒。用锌和盐酸与试样混合在一起,若试样中有砒霜,就会发生反应生成砷化氢(AsH3)、锌盐溶液。写出该反应的化学方程式_____ 。
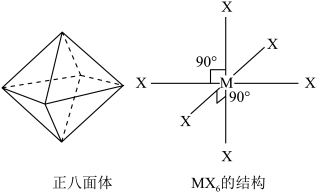
(4)某化合物MX6分子呈正八面体形式(如图所示)。由于六个X原子与M的连接完全对称,因此将任意一个X用Y原子替换均只能得到一种结构的MX5Y。按此思路,若将其中任意两个X原子用Y原子替换,请画出化学式为MX4Y2的各种结构_____ 。
(1)从分子结构上来看,氮与碳有很多对应的物质(如CH4和NH3对应),请找出下列含碳化合物对应的含氮物质(填写化学式):H2CO3
(2)已知Fe元素在化合物里通常显+2或+3价,因此Fe3O4可写成氧化物形式FeO·Fe2O3,或盐的形式Fe(FeO2)2,它属于偏铁酸盐。Pb在化合物里显+2价或+4价,那么Pb3O4也可以写成
(3)在法庭医学分析上常用马氏砷法来证明受害者是否为砒霜(As2O3)中毒。用锌和盐酸与试样混合在一起,若试样中有砒霜,就会发生反应生成砷化氢(AsH3)、锌盐溶液。写出该反应的化学方程式
(4)某化合物MX6分子呈正八面体形式(如图所示)。由于六个X原子与M的连接完全对称,因此将任意一个X用Y原子替换均只能得到一种结构的MX5Y。按此思路,若将其中任意两个X原子用Y原子替换,请画出化学式为MX4Y2的各种结构

您最近一年使用:0次



