解题方法
1 . 草酸(H2C2O4)又称为乙二酸,是一种二元中强酸,主要用作还原剂和漂白剂。将用硫酸酸化的0.2 mol/L KMnO4溶液与0.5 mol/L草酸溶液混合,发现开始一段时间反应速率较慢,溶液褪色不明显,半分钟后,反应速率加快,溶液快速褪色。
(1)已知酸性溶液中KMnO4的还原产物是Mn2+,H2C2O4的氧化产物是CO2。写出上述反应的化学方程式_______ ;
(2)某研究小组欲对产生上述实验现象的影响因素进行探究。
①提出合理假设。
假设1:草酸反应时先电离出C2O ,再与MnO
,再与MnO 反应,硫酸对草酸的电离起抑制作用;
反应,硫酸对草酸的电离起抑制作用;
假设2:_______ ;
假设3:_______ ;
②结合上述假设,设计实验方案进行探究。请在下表中写出对应的实验方案。限选试剂:浓硫酸、MnSO4溶液、石蕊试液、NaOH溶液、蒸馏水。
(3)已知20℃时H2C2O4·2H2O的溶解度是9.5g。该温度下用H2C2O4·2H2O_______ (填“能”或“不能”)配制1.0 mol/L草酸溶液(忽略溶解过程中溶液体积的变化)。
(1)已知酸性溶液中KMnO4的还原产物是Mn2+,H2C2O4的氧化产物是CO2。写出上述反应的化学方程式
(2)某研究小组欲对产生上述实验现象的影响因素进行探究。
①提出合理假设。
假设1:草酸反应时先电离出C2O
 ,再与MnO
,再与MnO 反应,硫酸对草酸的电离起抑制作用;
反应,硫酸对草酸的电离起抑制作用;假设2:
假设3:
②结合上述假设,设计实验方案进行探究。请在下表中写出对应的实验方案。限选试剂:浓硫酸、MnSO4溶液、石蕊试液、NaOH溶液、蒸馏水。
| 实验方案 | 预期现象与结论 |
| 方案1: | 若反应速率减慢,则假设1成立 |
| 方案2: | 若反应速率加快,则假设2成立 |
| 方案3: | 若反应速率加快,则假设3成立 |
您最近一年使用:0次
2 . 氯及其化合物在工业生产生活中有很重要的作用。图中为实验室通常制取氯气及性质验证的装置图:
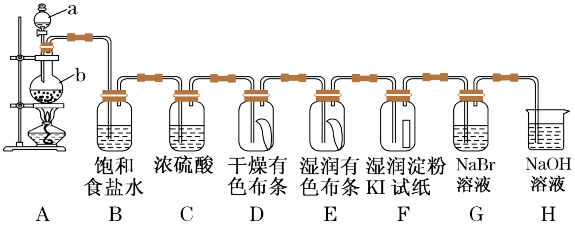
(1)H装置的作用____ ,写出发生的离子反应方程式____ 。
(2)在装置E中可观察到的现象是____ ,通过D、E中的现象说明什么结论____ 。
(3)装置G中发生的离子方程式____ 。
(4)可用KMnO4与浓盐酸快速制氯气,发生如下反应(未配平):KMnO4+HCl(浓)—KCl+Cl2↑+H2O+MnCl2。
写出配平的该反应的离子方程式_____ 。该反应中氧化剂与还原剂的物质的量之比为____ 。标况下反应生成11.2L的Cl2,则该反应转移的电子的数目为____ ;被氧化的HCl的物质的量为____ 。
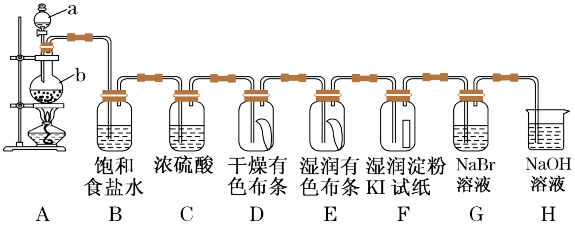
(1)H装置的作用
(2)在装置E中可观察到的现象是
(3)装置G中发生的离子方程式
(4)可用KMnO4与浓盐酸快速制氯气,发生如下反应(未配平):KMnO4+HCl(浓)—KCl+Cl2↑+H2O+MnCl2。
写出配平的该反应的离子方程式
您最近一年使用:0次
解题方法
3 . 绿矾(FeSO4﹒7H2O)是存在于自然界中的一种矿石。古籍有记载焙烧绿矾可以制备铁红(主要成分是Fe2O3,传统红色颜料的重要着色剂);同时焙烧绿矾也是一种生产硫酸的古老方法。
现利用下图所示装置对焙烧绿矾的反应进行探究。

(1)装置C的作用是__ 。
(2)向U形管中滴入石蕊试液,溶液呈红色,说明该溶液呈____ (填“酸性”或“碱性”);再向该溶液中滴加BaCl2溶液出现白色沉淀,说明其中含有___ (填离子化学式)。
(3)实验过程中,装置A玻管中发生的化学反应方程式为__ 。
现利用下图所示装置对焙烧绿矾的反应进行探究。

(1)装置C的作用是
(2)向U形管中滴入石蕊试液,溶液呈红色,说明该溶液呈
(3)实验过程中,装置A玻管中发生的化学反应方程式为
您最近一年使用:0次
名校
解题方法
4 . 某兴趣小组用铬铁矿[Fe(CrO2)2]制备K2Cr2O7晶体,流程如下:
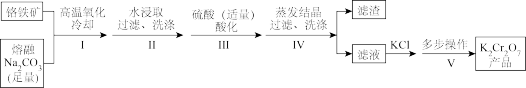
已知:NaFeO2遇水强烈水解;
回答以下问题:
(1)步骤I中铬铁矿转化为Na2CrO4和NaFeO2,化学反应方程式为_______ 。
(2)步骤III中加入硫酸不宜过多的原因是_______ 。
(3)步骤IV,所得滤渣的主要成分是_______ 。
(4)为了测定K2Cr2O7(摩尔质量为294g/mol)产品的纯度,可采用氧化还原滴定法:称取重铬酸钾试样2.500g配成500mL溶液,取出25.00mL于锥形瓶中,加10mL2mo/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入淀粉溶液做指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O =2I-+S4O
=2I-+S4O ),用去20.00mLNa2S2O3标准溶液,则该样品的纯度为
),用去20.00mLNa2S2O3标准溶液,则该样品的纯度为________ 。(写出计算过程)
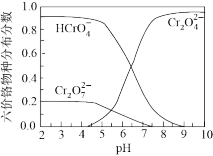
(5)PbCrO4是一种黄色颜料,难溶于水。请设计由K2Cr2O7溶液制备PbCrO4的实验方案:_______ ,静置,过滤,洗涤,干燥,得PbCrO4。[实验中须使用的试剂有:6mol·L-1的KOH溶液,0.5mol·L-1Pb(NO3)2溶液]。
已知:①Pb(OH)2开始沉淀时pH为7.2,完全沉淀时pH为8.7。
②PbCrO4可由沸腾的铬酸盐溶液与铅盐溶液反应制得,含PbCrO4晶种时更易生成。
③六价铬在溶液中物种分布分数与pH关系如图所示。
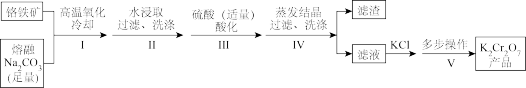
已知:NaFeO2遇水强烈水解;
回答以下问题:
(1)步骤I中铬铁矿转化为Na2CrO4和NaFeO2,化学反应方程式为
(2)步骤III中加入硫酸不宜过多的原因是
(3)步骤IV,所得滤渣的主要成分是
(4)为了测定K2Cr2O7(摩尔质量为294g/mol)产品的纯度,可采用氧化还原滴定法:称取重铬酸钾试样2.500g配成500mL溶液,取出25.00mL于锥形瓶中,加10mL2mo/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入淀粉溶液做指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O
 =2I-+S4O
=2I-+S4O ),用去20.00mLNa2S2O3标准溶液,则该样品的纯度为
),用去20.00mLNa2S2O3标准溶液,则该样品的纯度为(5)PbCrO4是一种黄色颜料,难溶于水。请设计由K2Cr2O7溶液制备PbCrO4的实验方案:
已知:①Pb(OH)2开始沉淀时pH为7.2,完全沉淀时pH为8.7。
②PbCrO4可由沸腾的铬酸盐溶液与铅盐溶液反应制得,含PbCrO4晶种时更易生成。
③六价铬在溶液中物种分布分数与pH关系如图所示。

您最近一年使用:0次
2022-09-02更新
|
317次组卷
|
3卷引用:江苏省南师附中、天一中学、海安中学、海门中学四校2021-2022学年高三12月联考化学试题
名校
解题方法
5 . 工业上,以钛白副产品硫酸亚铁制备的铁黄(FeOOH)代替硝酸铁等可溶性铁盐制备高铁酸钾,可降低生产工艺成本且产品质量好。工艺流程如图所示:

已知:①K2FeO4为暗紫色固体,可溶于水,微溶于KOH溶液。
②FeO 具有强氧化性,在酸性或者中性溶液中能产生O2,在碱性溶液中较稳定。
具有强氧化性,在酸性或者中性溶液中能产生O2,在碱性溶液中较稳定。
③铁黄在177℃开始分解。
(1)从电子排布的角度分析,Fe2+稳定性小于Fe3+的原因_______ 。
(2)制备铁黄的离子方程式为_______ 。
(3)实验测得反应液的温度、pH对铁黄产量的影响如图所示。
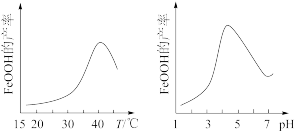
①反应液温度高于40 °C时,铁黄的产量下降的原因可能是_______ 。
②pH大于4.5时铁黄产量降低的主要原因可能是_______ 。
(4)粗产品K2FeO4提纯时采用重结晶、洗涤、低温烘干的方法,洗涤剂最好选用 _______(填序号)。
(5)用K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的S2-、CN-、NH3等,生成的Fe(OH)3胶体还能吸附水中的悬浮杂质。试写出K2FeO4处理含有CN- 的碱性污水时与CN-反应的离子方程式_______ 。

已知:①K2FeO4为暗紫色固体,可溶于水,微溶于KOH溶液。
②FeO
 具有强氧化性,在酸性或者中性溶液中能产生O2,在碱性溶液中较稳定。
具有强氧化性,在酸性或者中性溶液中能产生O2,在碱性溶液中较稳定。③铁黄在177℃开始分解。
(1)从电子排布的角度分析,Fe2+稳定性小于Fe3+的原因
(2)制备铁黄的离子方程式为
(3)实验测得反应液的温度、pH对铁黄产量的影响如图所示。
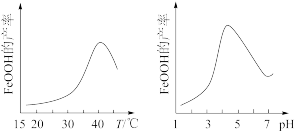
①反应液温度高于40 °C时,铁黄的产量下降的原因可能是
②pH大于4.5时铁黄产量降低的主要原因可能是
(4)粗产品K2FeO4提纯时采用重结晶、洗涤、低温烘干的方法,洗涤剂最好选用 _______(填序号)。
| A.冰水 | B.NaOH溶液 | C.稀硫酸 | D.Fe(NO3)3溶液 |
您最近一年使用:0次
2022-09-02更新
|
333次组卷
|
4卷引用:江苏省南师附中、天一中学、海安中学、海门中学四校2021-2022学年高三12月联考化学试题
解题方法
6 .  是危害环境的气体,生产中可用多种方法减少烟气中
是危害环境的气体,生产中可用多种方法减少烟气中 排放,并实现资源再利用。
排放,并实现资源再利用。
(1)软锰矿(主要成分 )可用于脱除烟气中的
)可用于脱除烟气中的 ,其主要化学反应原理是:
,其主要化学反应原理是:
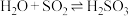

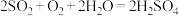
①脱除时需将软锰矿进行粉碎,配成软锰矿浆,其目的是_______ 。上述反应中,MnO2是_______ (填“氧化剂”、“还原剂”或“催化剂”)。
②吸收大量的 后,软锰矿浆的pH将
后,软锰矿浆的pH将_______ 。
A.增大 B.减小 C.不变 D.无法确定
③软锰矿浆吸收 时,温度常控制在室温。若温度过高,烟气脱硫效率将下降,其可能的原因是
时,温度常控制在室温。若温度过高,烟气脱硫效率将下降,其可能的原因是_______ 。
④实验室常用软锰矿制取氯气,写出发生的化学方程式:_______ 。
(2)工业上利用 尾气、硫黄、液氯为原料,在活性炭为催化剂、200~250℃条件下制备氯化亚砜(SOCl2),反应的化学方程式为
尾气、硫黄、液氯为原料,在活性炭为催化剂、200~250℃条件下制备氯化亚砜(SOCl2),反应的化学方程式为_______ 。
 是危害环境的气体,生产中可用多种方法减少烟气中
是危害环境的气体,生产中可用多种方法减少烟气中 排放,并实现资源再利用。
排放,并实现资源再利用。(1)软锰矿(主要成分
 )可用于脱除烟气中的
)可用于脱除烟气中的 ,其主要化学反应原理是:
,其主要化学反应原理是: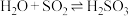

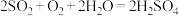
①脱除时需将软锰矿进行粉碎,配成软锰矿浆,其目的是
②吸收大量的
 后,软锰矿浆的pH将
后,软锰矿浆的pH将A.增大 B.减小 C.不变 D.无法确定
③软锰矿浆吸收
 时,温度常控制在室温。若温度过高,烟气脱硫效率将下降,其可能的原因是
时,温度常控制在室温。若温度过高,烟气脱硫效率将下降,其可能的原因是④实验室常用软锰矿制取氯气,写出发生的化学方程式:
(2)工业上利用
 尾气、硫黄、液氯为原料,在活性炭为催化剂、200~250℃条件下制备氯化亚砜(SOCl2),反应的化学方程式为
尾气、硫黄、液氯为原料,在活性炭为催化剂、200~250℃条件下制备氯化亚砜(SOCl2),反应的化学方程式为
您最近一年使用:0次
解题方法
7 . 将CO2转化为CO是利用CO2的重要途径,由CO出发可以制备多种液体燃料。
(1)我国在CO2催化加氢制取汽油方面取得突破性进展,转化过程如下所示。
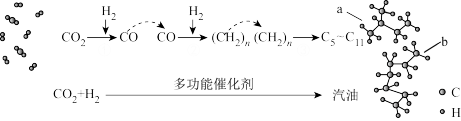
①图中a的名称是_______ 。
②CO2、a中碳原子的杂化轨道类型分别为_______ 。
(2)Cu、Cu2O可应用于CO2转化CO的研究。以CuSO4·5H2O、Na2SO3、Na2CO3为原料能制备Cu2O。
①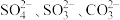 空间结构为平面三角形的是
空间结构为平面三角形的是_______ 。
②[Cu(H2O)4]2+离子中,配体是_______ 。
③除配位键外,CuSO4·5H2O中存在的化学键还有_______ 。
④将生成Cu2O的反应补充完整。______
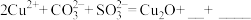
(3)在Cu催化剂作用下,反应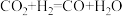 的可能机理如下。
的可能机理如下。
ⅰ.
ⅱ._______ 。(写出反应方程式)
(4)Cu的晶胞(图1)、Cu2O的晶胞(图2)如下所示。
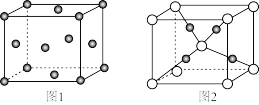
金属铜的一个晶胞中的铜原子数与Cu2O一个晶胞中的铜原子数之比为_______ 。
(1)我国在CO2催化加氢制取汽油方面取得突破性进展,转化过程如下所示。

①图中a的名称是
②CO2、a中碳原子的杂化轨道类型分别为
(2)Cu、Cu2O可应用于CO2转化CO的研究。以CuSO4·5H2O、Na2SO3、Na2CO3为原料能制备Cu2O。
①
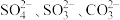 空间结构为平面三角形的是
空间结构为平面三角形的是②[Cu(H2O)4]2+离子中,配体是
③除配位键外,CuSO4·5H2O中存在的化学键还有
④将生成Cu2O的反应补充完整。
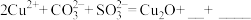
(3)在Cu催化剂作用下,反应
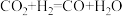 的可能机理如下。
的可能机理如下。ⅰ.

ⅱ.
(4)Cu的晶胞(图1)、Cu2O的晶胞(图2)如下所示。

金属铜的一个晶胞中的铜原子数与Cu2O一个晶胞中的铜原子数之比为
您最近一年使用:0次
解题方法
8 . 以黄铁矿为原料制硫酸产生的硫酸渣中含 、
、 、
、 、
、 等杂质。现以硫酸渣制备铁红(
等杂质。现以硫酸渣制备铁红( )的过程如下:
)的过程如下:
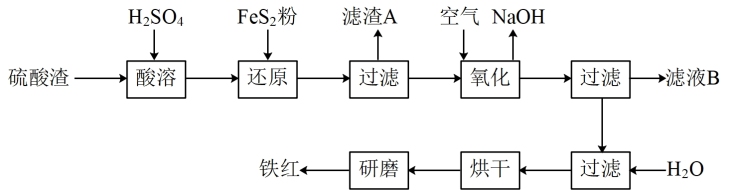
请回答下列问题:
(1) 中硫元素化合价为
中硫元素化合价为_______ ,滤渣A的名称为_______ 。
(2)酸溶时,粉碎硫酸渣的目的是____ ,酸溶过程中,溶解 的离子方程式是
的离子方程式是____ 。
(3)配平下列离子方程式:_______ 。
_______ _______
_______ _______
_______ _______
_______ _______
_______ _______
_______
(4)检验铁红中铁元素的实验方法是_______ 。
(5)现有黄铁矿烧渣500t,其中铁元素的质量分数为16.8%,经过一系列转化后,得到72t铁红,该产品的产率为_______ %。
 、
、 、
、 、
、 等杂质。现以硫酸渣制备铁红(
等杂质。现以硫酸渣制备铁红( )的过程如下:
)的过程如下:
请回答下列问题:
(1)
 中硫元素化合价为
中硫元素化合价为(2)酸溶时,粉碎硫酸渣的目的是
 的离子方程式是
的离子方程式是(3)配平下列离子方程式:
_______
 _______
_______ _______
_______ _______
_______ _______
_______ _______
_______
(4)检验铁红中铁元素的实验方法是
(5)现有黄铁矿烧渣500t,其中铁元素的质量分数为16.8%,经过一系列转化后,得到72t铁红,该产品的产率为
您最近一年使用:0次
2021高三·浙江·专题练习
解题方法
9 . 氟气跟氯化钠水溶液反应,一定有氟化氢和氧气生成。( )
您最近一年使用:0次
名校
解题方法
10 . 氨既是一种重要的化工产品,也是一种重要的化工原料。
(1)实验室利用如图所示装置及药品制取氨气。

①制取氨气的化学方程式是_______ 。
②下列装置中,可用于收集氨的是_______ (填字母)。
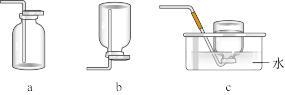
(2)氨是生产氮肥的原料,经过如下转化可以得到NH4NO3。NH3 NO
NO NO2
NO2 HNO3
HNO3 NH4NO3,写出反应①的方程式:
NH4NO3,写出反应①的方程式:_______ 。
(3)过量施用氮肥会造成水体污染。纳米零价铁——反硝化细菌复合体系可脱除水体中的硝酸盐( ),脱氮原理及对某酸性废水的脱氮效果如图。注:纳米零价铁对反硝化细菌具有抑制作用
),脱氮原理及对某酸性废水的脱氮效果如图。注:纳米零价铁对反硝化细菌具有抑制作用
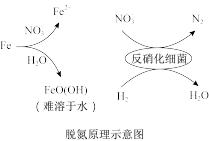
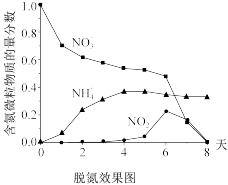
①0~2天,发生的主要反应为:_______ _______Fe+_______ +_______=_______Fe2++_______+_______
+_______=_______Fe2++_______+_______
②4~5天,检测到纳米零价铁有剩余,但 浓度无明显变化,结合方程式说明原因:
浓度无明显变化,结合方程式说明原因:_______ 。
③6~8天,结合离子方程式说明溶液中 浓度下降的原因是
浓度下降的原因是 _______ 。
(1)实验室利用如图所示装置及药品制取氨气。

①制取氨气的化学方程式是
②下列装置中,可用于收集氨的是

(2)氨是生产氮肥的原料,经过如下转化可以得到NH4NO3。NH3
 NO
NO NO2
NO2 HNO3
HNO3 NH4NO3,写出反应①的方程式:
NH4NO3,写出反应①的方程式:(3)过量施用氮肥会造成水体污染。纳米零价铁——反硝化细菌复合体系可脱除水体中的硝酸盐(
 ),脱氮原理及对某酸性废水的脱氮效果如图。注:纳米零价铁对反硝化细菌具有抑制作用
),脱氮原理及对某酸性废水的脱氮效果如图。注:纳米零价铁对反硝化细菌具有抑制作用

①0~2天,发生的主要反应为:
 +_______=_______Fe2++_______+_______
+_______=_______Fe2++_______+_______②4~5天,检测到纳米零价铁有剩余,但
 浓度无明显变化,结合方程式说明原因:
浓度无明显变化,结合方程式说明原因:③6~8天,结合离子方程式说明溶液中
 浓度下降的原因是
浓度下降的原因是
您最近一年使用:0次
2022-07-07更新
|
354次组卷
|
4卷引用:北京市朝阳区2020-2021学年高一下学期期末化学试题
北京市朝阳区2020-2021学年高一下学期期末化学试题福建省泉州市永春第一中学2022-2023学年高一下学期期末化学试题山东省济宁市邹城市第二中学2023-2024学年高一下学期3月月考化学试题(已下线)重难点04 硫和氮综合题-【好题汇编】备战2023-2024学年高一化学下学期期末真题分类汇编(北京专用)



