名校
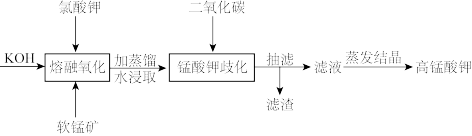
1 . 实验室模拟工业上以软锰矿(主要成分为 )为原料通过固体碱熔氧化法生产高锰酸钾,主要流程如图所示。下列说法正确的是
)为原料通过固体碱熔氧化法生产高锰酸钾,主要流程如图所示。下列说法正确的是
 )为原料通过固体碱熔氧化法生产高锰酸钾,主要流程如图所示。下列说法正确的是
)为原料通过固体碱熔氧化法生产高锰酸钾,主要流程如图所示。下列说法正确的是
| A.“熔融氧化”主要用到的仪器有酒精灯、瓷坩埚、三脚架、泥三角、玻璃棒、坩埚钳 |
B.“锰酸钾歧化”可以用HCl代替 |
C.该流程可循环利用的物质是 |
| D.“蒸发结晶”应蒸发至无液体剩余 |
您最近一年使用:0次
名校
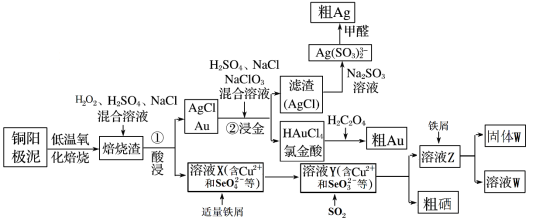
2 . 工业上从电解精炼铜的阳极泥中(主要含金、银、铜、硒等贵重金属)回收提取银、金、硒的流程图:
已知:①相同浓度下,SeO 氧化性强于Cu2+
氧化性强于Cu2+
②NaClO3在酸性条件下氧化性强
(1)“焙烧渣”在“①酸浸”时,为了更好酸浸,可采取的一种办法是_______ ,其中银元素发生反应的离子方程式为_______ ;
(2)向溶液X中加入铁屑的作用是_______ ;
(3)氯金酸(HAuCl4)中的Au的化合价为_______ ;
(4)“②浸金”反应中,H2SO4的作用为_______ ;
(5)氯金酸(HAuCl4)在pH为2~3的条件下被草酸还原为Au,同时放出二氧化碳气体,则该反应的化学方程式为_______
(6)由溶液W制取Fe(OH)3,需先将溶液W_______ ,然后再使溶液中的铁元素沉淀完全,所需溶液的pH最小为_______ 。(已知,常温下,Ksp[Fe(OH)3]=4.0×10-38,lg2=0.3)

已知:①相同浓度下,SeO
 氧化性强于Cu2+
氧化性强于Cu2+②NaClO3在酸性条件下氧化性强
(1)“焙烧渣”在“①酸浸”时,为了更好酸浸,可采取的一种办法是
(2)向溶液X中加入铁屑的作用是
(3)氯金酸(HAuCl4)中的Au的化合价为
(4)“②浸金”反应中,H2SO4的作用为
(5)氯金酸(HAuCl4)在pH为2~3的条件下被草酸还原为Au,同时放出二氧化碳气体,则该反应的化学方程式为
(6)由溶液W制取Fe(OH)3,需先将溶液W
您最近一年使用:0次
2022-03-16更新
|
115次组卷
|
2卷引用:吉林省长春市十一高中2021-2022学年高三上学期第二学程考试理综化学试题
名校
解题方法
3 . 硫化氢的回收、转化是环境保护和资源利用的重要研究课题。
(1)H2S溶于水分步电离出HS-、S2-。产生HS-的电离方程式是____ 。
(2)脱除H2S有多种方法。
①沉淀法。
将H2S气体通入ZnSO4溶液,只产生少量白色ZnS沉淀,即反应不完全。如果在ZnSO4溶液中事先加入CH3COONa,再通入H2S气体,则可得大量ZnS沉淀。
a.ZnSO4溶液吸收H2S的离子反应方程式是_____ 。
b.加入CH3COONa后得到大量ZnS沉淀的原因是____ 。
②沉淀氧化法。过程如图所示:
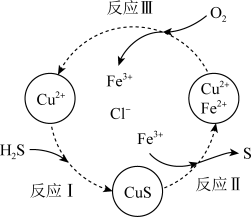
a.反应Ⅱ的离子方程式是____ 。
b.资料1:Cu2+在反应Ⅲ中起催化作用:
i.Cu2++Fe2+=Cu++Fe3+
ii._____ (将反应ii补充完整)
c.在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有____ 。
d.下面实验证实了资料1,Cu2+能提高反应Ⅲ的速率。
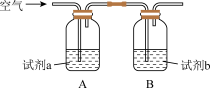
i.试剂a是___ ,试剂b是___ 。
ii.Cu2+提高反应Ⅲ速率的实验证据是____ 。
(1)H2S溶于水分步电离出HS-、S2-。产生HS-的电离方程式是
(2)脱除H2S有多种方法。
①沉淀法。
将H2S气体通入ZnSO4溶液,只产生少量白色ZnS沉淀,即反应不完全。如果在ZnSO4溶液中事先加入CH3COONa,再通入H2S气体,则可得大量ZnS沉淀。
a.ZnSO4溶液吸收H2S的离子反应方程式是
b.加入CH3COONa后得到大量ZnS沉淀的原因是
②沉淀氧化法。过程如图所示:

a.反应Ⅱ的离子方程式是
b.资料1:Cu2+在反应Ⅲ中起催化作用:
i.Cu2++Fe2+=Cu++Fe3+
ii.
c.在温度一定和不补加溶液的条件下,缓慢通入混合气体,并充分搅拌。欲使生成的硫单质中不含CuS,可采取的措施有
d.下面实验证实了资料1,Cu2+能提高反应Ⅲ的速率。

i.试剂a是
ii.Cu2+提高反应Ⅲ速率的实验证据是
您最近一年使用:0次
名校
4 . 实验室中用固体碱溶氧化法制取KMnO4,下图为该方法的实验操作流程。
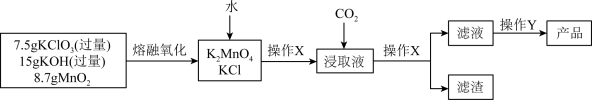
已知:
①锰酸钾(K2MnO4)在强碱性溶液中可稳定存在,碱性减弱或酸性溶液中易发生歧化反应。
②K2CO3和KHCO3的溶解度见下表:
请回答下列问题:
(1)实验室进行“熔融氧化”操作,需要用到的主要仪器包括铁坩埚、铁棒、酒精喷灯、_______ 、_______ 。不使用玻璃棒和瓷坩埚的原因(用化学方程式解释)_______ 。
(2)“熔融氧化”时反应的化学方程式为_______ 。
(3)浸取液中通入适量CO2时发生歧化,生成KMnO4、MnO2和K2CO3,反应的离子方程式为_______ 。实验室制取CO2的反应物是_______ 。
(4)操作Y为蒸发浓缩、冷却结晶、过滤、洗涤、低温干燥,采用低温干燥的原因为_______ 。
(5)与通入适量CO2产品中含有较少杂质相比,若浸取液中通入过量的CO2会导致产品中含有较多的KHCO3杂质,请解释原因为_______ 。

已知:
①锰酸钾(K2MnO4)在强碱性溶液中可稳定存在,碱性减弱或酸性溶液中易发生歧化反应。
②K2CO3和KHCO3的溶解度见下表:
| 0°C | 10°C | 20°C | 30°C | 40°C | |
| K2CO3 | 105 | 109 | 111 | 114 | 117 |
| KHCO3 | 22.5 | 27.4 | 33.7 | 39.9 | 47.5 |
请回答下列问题:
(1)实验室进行“熔融氧化”操作,需要用到的主要仪器包括铁坩埚、铁棒、酒精喷灯、
(2)“熔融氧化”时反应的化学方程式为
(3)浸取液中通入适量CO2时发生歧化,生成KMnO4、MnO2和K2CO3,反应的离子方程式为
(4)操作Y为蒸发浓缩、冷却结晶、过滤、洗涤、低温干燥,采用低温干燥的原因为
(5)与通入适量CO2产品中含有较少杂质相比,若浸取液中通入过量的CO2会导致产品中含有较多的KHCO3杂质,请解释原因为
您最近一年使用:0次
名校
解题方法
5 . 硫及其主要的化合物在化学研究及生产生活中都有重要的应用。研究性学习期小答同学带领化学兴趣小组的同学完成了一系列探究任务。
任务1——制备硫酸铜
甲、乙两位同学用铜和硫酸做原料,设计了两种制取硫酸铜的方案。
方案甲:铜与浓硫酸加热直接反应,即Cu→CuSO4
方案乙:由Cu→CuO→CuSO4
(1)方案甲中铜和浓硫酸反应的化学方程式是___________ ,该反应体现了浓硫酸的什么性质___________ 。
(2)请选择2个合适的角度(例如实验原理、实验操作、实验步骤、实验效果、绿色化学等方面),对甲乙两种方案进行评价___________ 。
任务2——认识硫化钠
工业污水中含有的重金属离子(例如Cu2+、Pb2+)可以形成硫化物沉淀而除去,这种方法叫硫化钠沉淀法。(提示:CuS是一种不溶于酸也不溶于水的黑色固体)
(3)利用Na2S处理污水中的铜离子,该反应过程的离子方程式为___________ 。
(4)从硫元素化合价的角度,Na2S具有什么性质___________ 。小荟同学预测硫化钠溶液可以与氯气发生氧化还原反应。他将不同浓度的硫化钠溶液分别注入两支盛有氯气的采集管中,振荡混合反应,发现其中一支试管中产生淡黄色沉淀物。据此写出发生反应的化学方程式___________ ,得出的结论是Cl-的还原性___________ S2-(填“强于”或弱于”)。另一支试管中无明显现象,小荟推测生成物可能为亚硫酸钠或硫酸钠。
(5)在Na2SO4和Na2SO3可能存在的体系中,如何检验 ?请用文字将检验过程描述完整,取少量反应后的混合溶液,
?请用文字将检验过程描述完整,取少量反应后的混合溶液,___________ 。
任务3——探究亚硫酸钠
化学课上并未系统学习过亚硫酸钠,所以小荟针对亚硫酸钠的性质展开了归纳和探究。
(6)从元素化合价角度思考,Na2SO3应具有氧化性和还原性。据此预测亚硫酸钠与酸性高锰酸钾
溶液反应的现象为___________ 。
(7)她还预测亚硫酸钠与硫化钠溶液混合,应产生淡黄色沉淀,做实验时却观察到并无明显现象,你能推测原因或提出解决办法吗?___________ 。
(8)取3.5g长期存放的Na2SO3粉末(可能部分氧化为Na2SO4),加入过量的100mL某浓度的盐酸中,加热使生成的气体全部逸出,测得该气体在标准状况下的体积为560mL,然后向溶液中渐渐加入0.5mol/L的Ba(OH)2溶液50mL,有沉淀生成,此时溶液呈中性。求:
①Na2SO3的纯度___________ ;
②盐酸的物质的量浓度___________ 。
任务1——制备硫酸铜
甲、乙两位同学用铜和硫酸做原料,设计了两种制取硫酸铜的方案。
方案甲:铜与浓硫酸加热直接反应,即Cu→CuSO4
方案乙:由Cu→CuO→CuSO4
(1)方案甲中铜和浓硫酸反应的化学方程式是
(2)请选择2个合适的角度(例如实验原理、实验操作、实验步骤、实验效果、绿色化学等方面),对甲乙两种方案进行评价
任务2——认识硫化钠
工业污水中含有的重金属离子(例如Cu2+、Pb2+)可以形成硫化物沉淀而除去,这种方法叫硫化钠沉淀法。(提示:CuS是一种不溶于酸也不溶于水的黑色固体)
(3)利用Na2S处理污水中的铜离子,该反应过程的离子方程式为
(4)从硫元素化合价的角度,Na2S具有什么性质
(5)在Na2SO4和Na2SO3可能存在的体系中,如何检验
 ?请用文字将检验过程描述完整,取少量反应后的混合溶液,
?请用文字将检验过程描述完整,取少量反应后的混合溶液,任务3——探究亚硫酸钠
化学课上并未系统学习过亚硫酸钠,所以小荟针对亚硫酸钠的性质展开了归纳和探究。
(6)从元素化合价角度思考,Na2SO3应具有氧化性和还原性。据此预测亚硫酸钠与酸性高锰酸钾
溶液反应的现象为
(7)她还预测亚硫酸钠与硫化钠溶液混合,应产生淡黄色沉淀,做实验时却观察到并无明显现象,你能推测原因或提出解决办法吗?
(8)取3.5g长期存放的Na2SO3粉末(可能部分氧化为Na2SO4),加入过量的100mL某浓度的盐酸中,加热使生成的气体全部逸出,测得该气体在标准状况下的体积为560mL,然后向溶液中渐渐加入0.5mol/L的Ba(OH)2溶液50mL,有沉淀生成,此时溶液呈中性。求:
①Na2SO3的纯度
②盐酸的物质的量浓度
您最近一年使用:0次
名校
解题方法
6 . 配平以下方程式并用单线桥法标出下列反应电子转移的方向和数目。(若系数为“1”,请标出)
(1)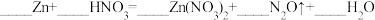
_______ 。
(2)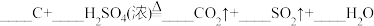
_______ 。
(3)
_______ 。
(4)
_______ 。
(5)
_______ 。
(6)
_______ 。
(1)
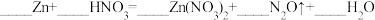
(2)
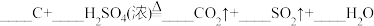
(3)

(4)

(5)

(6)

您最近一年使用:0次
名校
7 . 硫酸是当今世界上最重要的化工产品之一、
(1)《新修本草》中关于“青矾(FeSO4•7H2O)”的描述:“本来绿色,新出窟未见风者,正如琉璃,烧之赤色”。《物理小识》中说:“青矾厂气熏人,衣服当之易烂。栽木不茂”。
①赤色固体可能是___________ (填化学式)。
②为确认“青矾厂气”含有SO2和SO3,将其通入依次以下装置。
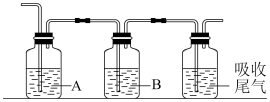
A、B中供选择的试剂有a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 c.浓硫酸
A中溶液为___________ (填标号),可观察到的现象为___________ 。
(2)工业制硫酸主要采用接触法,以黄铁矿(FeS2)为原料制备硫酸的主要设备和流程如图。
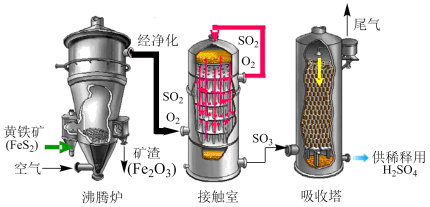
①“沸腾炉”中主要发生的反应为 。每反应消耗1molFeS2,转移的电子数为
。每反应消耗1molFeS2,转移的电子数为___________ 。
②“接触室”中生成SO3的化学方程式为___________ 。
③“吸收塔”中用于吸收SO3的试剂为___________ (填“水”或“浓硫酸”)。
④环保部门为了测定某硫酸厂周围空气中的SO2含量进行了如下实验。取标准状况下1.000L空气(含N2、O2、CO2、SO2),缓慢通过足量碘水。在所得溶液中加入稍过量的BaCl2溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为0.233g。则空气样品中SO2的体积分数为___________ 。
(1)《新修本草》中关于“青矾(FeSO4•7H2O)”的描述:“本来绿色,新出窟未见风者,正如琉璃,烧之赤色”。《物理小识》中说:“青矾厂气熏人,衣服当之易烂。栽木不茂”。
①赤色固体可能是
②为确认“青矾厂气”含有SO2和SO3,将其通入依次以下装置。

A、B中供选择的试剂有a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 c.浓硫酸
A中溶液为
(2)工业制硫酸主要采用接触法,以黄铁矿(FeS2)为原料制备硫酸的主要设备和流程如图。

①“沸腾炉”中主要发生的反应为
 。每反应消耗1molFeS2,转移的电子数为
。每反应消耗1molFeS2,转移的电子数为②“接触室”中生成SO3的化学方程式为
③“吸收塔”中用于吸收SO3的试剂为
④环保部门为了测定某硫酸厂周围空气中的SO2含量进行了如下实验。取标准状况下1.000L空气(含N2、O2、CO2、SO2),缓慢通过足量碘水。在所得溶液中加入稍过量的BaCl2溶液,产生白色沉淀,过滤后将沉淀洗涤、干燥,称得其质量为0.233g。则空气样品中SO2的体积分数为
您最近一年使用:0次
2022-02-28更新
|
411次组卷
|
2卷引用:福建省厦门双十中学2021-2022学年高一上学期第二次月考化学试题
名校
解题方法
8 . 某实验小组模拟工业上处理含重金属镉元素(Cr)和铬元素(Cd)的废水,回答下面的问题。
(1)以下是几种镉的难溶化合物的溶度积常数(25 ℃):
根据表中提供的信息判断,沉淀Cd2+效果最佳的试剂是_______ (填字母序号)。
a.Na2CO3 b.Na2S c.CaO
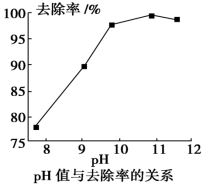
(2)如图是随污水的pH升高Cd2+去除率的变化图象,由图象可知,处理含Cd2+污水的最佳pH=_______ (取正整数),此时溶液中c(Cd2+)=_______ 。
(3)该实验小组采用Fe2+作还原剂模拟工业上处理含铬废水,将Cr2O 转化为Cr(OH)3沉淀除去,现用此法处理含0.01 mol Cr2O
转化为Cr(OH)3沉淀除去,现用此法处理含0.01 mol Cr2O 的工业废水。
的工业废水。
①Fe2+与酸性溶液中的Cr2O 反应的离子方程式是
反应的离子方程式是_______ ,
②向反应后溶液中加入足量碱液,得到沉淀的质量至少是_______ g。
已知该条件下:
(1)以下是几种镉的难溶化合物的溶度积常数(25 ℃):
| 含镉难溶物 | CdCO3 | CdS | Cd(OH)2 |
| 溶度积常数 | 5.2×10-12 | 3.6×10-29 | 2.0×10-16 |
a.Na2CO3 b.Na2S c.CaO
(2)如图是随污水的pH升高Cd2+去除率的变化图象,由图象可知,处理含Cd2+污水的最佳pH=

(3)该实验小组采用Fe2+作还原剂模拟工业上处理含铬废水,将Cr2O
 转化为Cr(OH)3沉淀除去,现用此法处理含0.01 mol Cr2O
转化为Cr(OH)3沉淀除去,现用此法处理含0.01 mol Cr2O 的工业废水。
的工业废水。①Fe2+与酸性溶液中的Cr2O
 反应的离子方程式是
反应的离子方程式是②向反应后溶液中加入足量碱液,得到沉淀的质量至少是
已知该条件下:
| 离子 | 氢氧化物开始 沉淀时的pH | 氢氧化物沉淀 完全时的pH |
| Fe2+ | 7.0 | 9.0 |
| Fe3+ | 1.9 | 3.2 |
| Cr3+ | 6.0 | 8.0 |
您最近一年使用:0次
9 . 小一水合硫酸锰(MnSO4·H2O)可用作微量分析试剂、媒染剂和油漆干燥剂,以软锰矿与硫酸工业的尾气(主要成分是SO2)联合制备一水合硫酸锰和硫酸钾的工艺流程如图:
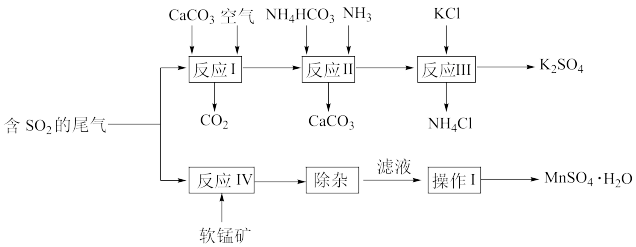
已知:软锰矿主要成分是MnO2,还含有少量SiO2等杂质。
(1)反应I的化学方程式为____ ,反应II的产物是CaCO3和____ (写出化学式)。
(2)反应II需控制温度在60~70℃,不能过低或过高,原因是____ 。
(3)反应IV中软锰矿预先粉碎并制成软锰矿浆的目的是____ ,主要反应的氧化剂与还原剂的物质的量之比为____ 。
(4)除杂后,滤液经过____ (写操作I的名称),可得到粉红色MnSO4·H2O晶体。
(5)灼烧MnSO4·H2O固体并称量,固体质量随温度变化曲线如图所示。850℃时,发生反应的化学方程式为____ ,q点时固体为____ (写出化学式)。


已知:软锰矿主要成分是MnO2,还含有少量SiO2等杂质。
(1)反应I的化学方程式为
(2)反应II需控制温度在60~70℃,不能过低或过高,原因是
(3)反应IV中软锰矿预先粉碎并制成软锰矿浆的目的是
(4)除杂后,滤液经过
(5)灼烧MnSO4·H2O固体并称量,固体质量随温度变化曲线如图所示。850℃时,发生反应的化学方程式为

您最近一年使用:0次
解题方法
10 . 过氧化锶(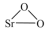 )广泛作为家庭及工业用漂白剂、洗涤剂、氧化剂。SrO2是一种白色粉末,加热条件下可与CO2、水蒸气反应,室温时在水中逐渐形成无色晶体SrO2·8H2O,与酸作用生成H2O2。
)广泛作为家庭及工业用漂白剂、洗涤剂、氧化剂。SrO2是一种白色粉末,加热条件下可与CO2、水蒸气反应,室温时在水中逐渐形成无色晶体SrO2·8H2O,与酸作用生成H2O2。
(1)实验室利用锶单质制备过氧化锶可能用到的仪器如图:

①按气流从左到右的流向,制备过氧化锶的导管接口顺序为a→____ (选择必要的仪器,可重复选择)。
②SrO2在空气中会变质生成碳酸盐,写出该反应的化学方程式____ 。
(2)通入氨气的条件下,在水溶液中可制备得到SrO2·8H2O,实验装置如图:
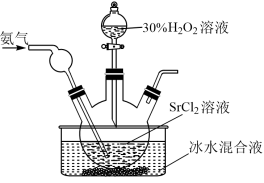
①盛装H2O2溶液的仪器名称为____ 。
②写出该方法制备SrO2·8H2O的离子方程式____ ,NH3的作用是___ 。
③冰水浴的原因是___ 。
(3)为测定SrO2·8H2O样品的纯度,可进行下列实验:准确称取3.0gSrO2·8H2O置于锥形瓶中,加入适量的盐酸充分溶解;加入过量KI溶液,摇匀后置于暗处;充分反应后加入少量淀粉溶液,用1.000mol·L-1Na2S2O3标准溶液滴定至____ (写出实验现象),记下此时消耗标准溶液的体积,重复实验3~4次,得如表数据:
SrO2·8H2O样品的纯度为____ (已知:I2+2S2O =2I-+S4O
=2I-+S4O )
)
 )广泛作为家庭及工业用漂白剂、洗涤剂、氧化剂。SrO2是一种白色粉末,加热条件下可与CO2、水蒸气反应,室温时在水中逐渐形成无色晶体SrO2·8H2O,与酸作用生成H2O2。
)广泛作为家庭及工业用漂白剂、洗涤剂、氧化剂。SrO2是一种白色粉末,加热条件下可与CO2、水蒸气反应,室温时在水中逐渐形成无色晶体SrO2·8H2O,与酸作用生成H2O2。(1)实验室利用锶单质制备过氧化锶可能用到的仪器如图:

①按气流从左到右的流向,制备过氧化锶的导管接口顺序为a→
②SrO2在空气中会变质生成碳酸盐,写出该反应的化学方程式
(2)通入氨气的条件下,在水溶液中可制备得到SrO2·8H2O,实验装置如图:

①盛装H2O2溶液的仪器名称为
②写出该方法制备SrO2·8H2O的离子方程式
③冰水浴的原因是
(3)为测定SrO2·8H2O样品的纯度,可进行下列实验:准确称取3.0gSrO2·8H2O置于锥形瓶中,加入适量的盐酸充分溶解;加入过量KI溶液,摇匀后置于暗处;充分反应后加入少量淀粉溶液,用1.000mol·L-1Na2S2O3标准溶液滴定至
| 平行实验 | 1 | 2 | 3 | 4 |
| 消耗标准溶液体积(mL) | 19.98 | 19.50 | 20.00 | 20.02 |
 =2I-+S4O
=2I-+S4O )
)
您最近一年使用:0次



