名校
解题方法
1 . 将CO2转化为CO是利用CO2的重要途径,由CO可以制备多种液体燃料。
(1)我国在CO2催化加氢制取汽油方面取得突破性进展,转化过程如下所示。

图中a的名称是_______ ,a中碳原子的杂化轨道类型为_______ 。
(2)Cu、Cu2O可应用于CO2转化CO的研究。以CuSO4·5H2O、Na2SO3、Na2CO3为原料能制备Cu2O。
①SO 、SO
、SO 、CO
、CO 空间结构为平面三角形的是
空间结构为平面三角形的是_______ 。
②除配位键外,CuSO4·5H2O中存在的化学键还有_______ 。
③将生成Cu2O的反应补充完整_______ 。
_______Cu2++_______CO +_______SO
+_______SO =_______Cu2O+_______□+_______
=_______Cu2O+_______□+_______
(3)在Cu催化剂作用下,反应CO2+H2=CO+H2O的可能机理如下。
i.CO2+2Cu=CO+Cu2O
ii._______ (写出反应方程式)。
(1)我国在CO2催化加氢制取汽油方面取得突破性进展,转化过程如下所示。

图中a的名称是
(2)Cu、Cu2O可应用于CO2转化CO的研究。以CuSO4·5H2O、Na2SO3、Na2CO3为原料能制备Cu2O。
①SO
 、SO
、SO 、CO
、CO 空间结构为平面三角形的是
空间结构为平面三角形的是②除配位键外,CuSO4·5H2O中存在的化学键还有
③将生成Cu2O的反应补充完整
_______Cu2++_______CO
 +_______SO
+_______SO =_______Cu2O+_______□+_______
=_______Cu2O+_______□+_______(3)在Cu催化剂作用下,反应CO2+H2=CO+H2O的可能机理如下。
i.CO2+2Cu=CO+Cu2O
ii.
您最近一年使用:0次
名校
2 . 新型纳米材料 ,可用于除去工业废气中的某些氧化物。
,可用于除去工业废气中的某些氧化物。
I.铁酸锌难溶于水,其晶胞由A、B结构按照1∶1交替累积而成,如图1所示。

(1)B结构的化学式为________ 。
Ⅱ.含铁锌精矿(主要含有 和
和 )焙烧可以得到
)焙烧可以得到 。废渣通常作为锌渣处理,一种回收利用锌渣制取
。废渣通常作为锌渣处理,一种回收利用锌渣制取 溶液和
溶液和 的流程如图1所示。
的流程如图1所示。

(2)写出由含铁锌精矿焙烧得到 的化学方程式:
的化学方程式:________ 。
(3)锌渣浸出时发生如下反应:
反应1:
反应2:
反应3: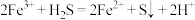
已知 ,则反应2的平衡常数
,则反应2的平衡常数
________ 。
(4)浸出过程中,溶液中 、总
、总 的浓度随时间的变化关系如图3所示。
的浓度随时间的变化关系如图3所示。
 时间内,溶液中
时间内,溶液中 的浓度随时间延长而逐渐增大的原因是
的浓度随时间延长而逐渐增大的原因是________ 。
Ⅲ.纳米 用于除去废气时转化关系为:
用于除去废气时转化关系为:

(5) 时,上述转化反应中消耗的
时,上述转化反应中消耗的
________ .
(6) 除去
除去 的化学方程式为:
的化学方程式为:________ 。
 ,可用于除去工业废气中的某些氧化物。
,可用于除去工业废气中的某些氧化物。I.铁酸锌难溶于水,其晶胞由A、B结构按照1∶1交替累积而成,如图1所示。

(1)B结构的化学式为
Ⅱ.含铁锌精矿(主要含有
 和
和 )焙烧可以得到
)焙烧可以得到 。废渣通常作为锌渣处理,一种回收利用锌渣制取
。废渣通常作为锌渣处理,一种回收利用锌渣制取 溶液和
溶液和 的流程如图1所示。
的流程如图1所示。
(2)写出由含铁锌精矿焙烧得到
 的化学方程式:
的化学方程式:(3)锌渣浸出时发生如下反应:
反应1:

反应2:

反应3:
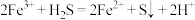
已知
 ,则反应2的平衡常数
,则反应2的平衡常数
(4)浸出过程中,溶液中
 、总
、总 的浓度随时间的变化关系如图3所示。
的浓度随时间的变化关系如图3所示。 时间内,溶液中
时间内,溶液中 的浓度随时间延长而逐渐增大的原因是
的浓度随时间延长而逐渐增大的原因是Ⅲ.纳米
 用于除去废气时转化关系为:
用于除去废气时转化关系为:
(5)
 时,上述转化反应中消耗的
时,上述转化反应中消耗的
(6)
 除去
除去 的化学方程式为:
的化学方程式为:
您最近一年使用:0次
名校
解题方法
3 . 钒具有广泛用途,利用含钒废催化剂(主要含有V2O5、VOSO4和不溶性硅酸盐)制备V2O5的新工艺流程如图:

已知:滤液1和滤液2中钒以VO2+的形式存在。回答下列问题:
(1)写出V基态原子核外电子排布式_______ 。
(2)在实验室中操作Ⅰ用到的玻璃仪器有_______ 。
(3)在滤渣1中加入Na2SO3和过量稀H2SO4溶液发生氧化还原反应,氧化剂和还原剂的物质的量之比为_______ 。
(4)混合溶液中加入KClO3,发生反应的离子方程式是_______ 。
(5)钒最后以NH4VO3的形式沉淀出来。沉钒率(NH4VO3沉淀中V的质量和废催化剂中V的质量之比)表示该工艺钒的回收率。图中是沉钒率随温度变化的关系曲线,“沉钒”时,温度超过80℃以后,沉钒率下降的可能原因是_______ (写一条即可)。

(6)称取w g所得产品,先用硫酸溶解,得到(VO2)2SO4溶液,再加入 的(NH4)2Fe(SO4)2溶液,最后用
的(NH4)2Fe(SO4)2溶液,最后用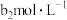 酸性KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗溶液KMnO4的体积为
酸性KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗溶液KMnO4的体积为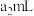 。假设杂质不参与反应,锰元素被还原为Mn2+。求产品中V2O5的质量分数为
。假设杂质不参与反应,锰元素被还原为Mn2+。求产品中V2O5的质量分数为_______ (写出计算过程)[已知(VO2)2SO4和(NH4)2Fe(SO4)2溶液反应的离子方程式为VO +2H++Fe2+=VO2++Fe3++H2O]
+2H++Fe2+=VO2++Fe3++H2O]

已知:滤液1和滤液2中钒以VO2+的形式存在。回答下列问题:
(1)写出V基态原子核外电子排布式
(2)在实验室中操作Ⅰ用到的玻璃仪器有
(3)在滤渣1中加入Na2SO3和过量稀H2SO4溶液发生氧化还原反应,氧化剂和还原剂的物质的量之比为
(4)混合溶液中加入KClO3,发生反应的离子方程式是
(5)钒最后以NH4VO3的形式沉淀出来。沉钒率(NH4VO3沉淀中V的质量和废催化剂中V的质量之比)表示该工艺钒的回收率。图中是沉钒率随温度变化的关系曲线,“沉钒”时,温度超过80℃以后,沉钒率下降的可能原因是

(6)称取w g所得产品,先用硫酸溶解,得到(VO2)2SO4溶液,再加入
 的(NH4)2Fe(SO4)2溶液,最后用
的(NH4)2Fe(SO4)2溶液,最后用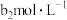 酸性KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗溶液KMnO4的体积为
酸性KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗溶液KMnO4的体积为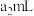 。假设杂质不参与反应,锰元素被还原为Mn2+。求产品中V2O5的质量分数为
。假设杂质不参与反应,锰元素被还原为Mn2+。求产品中V2O5的质量分数为 +2H++Fe2+=VO2++Fe3++H2O]
+2H++Fe2+=VO2++Fe3++H2O]
您最近一年使用:0次
2022-06-24更新
|
333次组卷
|
2卷引用:江苏省南京市六校联合体2021-2022学年高二下学期期末联考化学试题
4 .  常应用于电池、催化剂、染料等方面。含钴废水会污染环境,须经处理后才能排放。
常应用于电池、催化剂、染料等方面。含钴废水会污染环境,须经处理后才能排放。
(1) 中钴离子的基态核外电子排布式为
中钴离子的基态核外电子排布式为_______ 。
(2)以废旧锂离子电池的正极材料(主要含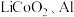 )为原料可以制备
)为原料可以制备 。
。
主要步骤如下:
①碱浸:将正极材料浸没于 溶液中,充分反应后过滤洗涤,取滤渣(LiCoO2)。写出该步反应的离子方程式
溶液中,充分反应后过滤洗涤,取滤渣(LiCoO2)。写出该步反应的离子方程式_______ 。
②还原:将滤渣浸入稀 与
与 的混合溶液中,该反应的化学方程式为
的混合溶液中,该反应的化学方程式为_______ ,酸化用 不用盐酸其主要原因:I.盐酸挥发利用率低;II.
不用盐酸其主要原因:I.盐酸挥发利用率低;II._______ 。
③沉钴:向步骤②反应后的溶液中,滴加 溶液,可得
溶液,可得 。
。
(3)氧化石墨烯/硅基杂化膜是一种主要基于“阴阳离子之间的静电吸附”处理含重金属离子废水的常用材料。利用氧化石墨烯/硅基杂化膜处理某含钴(Co2+)废水,在不同 的条件下,对钴离子的吸附效果如图所示,A点吸附率比B点低原因是
的条件下,对钴离子的吸附效果如图所示,A点吸附率比B点低原因是_______ ,C点吸附率比B点低的原因是_______ 。[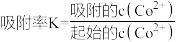 ]
]

 常应用于电池、催化剂、染料等方面。含钴废水会污染环境,须经处理后才能排放。
常应用于电池、催化剂、染料等方面。含钴废水会污染环境,须经处理后才能排放。(1)
 中钴离子的基态核外电子排布式为
中钴离子的基态核外电子排布式为(2)以废旧锂离子电池的正极材料(主要含
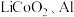 )为原料可以制备
)为原料可以制备 。
。主要步骤如下:
①碱浸:将正极材料浸没于
 溶液中,充分反应后过滤洗涤,取滤渣(LiCoO2)。写出该步反应的离子方程式
溶液中,充分反应后过滤洗涤,取滤渣(LiCoO2)。写出该步反应的离子方程式②还原:将滤渣浸入稀
 与
与 的混合溶液中,该反应的化学方程式为
的混合溶液中,该反应的化学方程式为 不用盐酸其主要原因:I.盐酸挥发利用率低;II.
不用盐酸其主要原因:I.盐酸挥发利用率低;II.③沉钴:向步骤②反应后的溶液中,滴加
 溶液,可得
溶液,可得 。
。(3)氧化石墨烯/硅基杂化膜是一种主要基于“阴阳离子之间的静电吸附”处理含重金属离子废水的常用材料。利用氧化石墨烯/硅基杂化膜处理某含钴(Co2+)废水,在不同
 的条件下,对钴离子的吸附效果如图所示,A点吸附率比B点低原因是
的条件下,对钴离子的吸附效果如图所示,A点吸附率比B点低原因是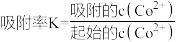 ]
]
您最近一年使用:0次
5 . Goodenough等人因在锂离子电池及磷酸铁锂等正极材料研究方面的卓越贡献而获得2019年诺贝尔化学奖。回答下列问题:
(1)LiFePO4是一种潜在的锂离子电池正极材料,它可以通过(NH4)2Fe(SO4)2、H3PO4与LiOH溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而值得。
①共沉淀反应投料时,不将(NH4)2Fe(SO4)2和LiOH溶液直接混合的原因是___ ,共沉淀反应的化学方程式为___ 。
②参与反应的H3PO4能与水以任意比互溶的原因是___ 。
③高温成型前,常向LiFePO4中加入少量活性炭黑,其作用除了可以改善成型后的LiFePO4的导电性能外,还能___ 。
(2)LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。
①每个晶胞中含有LiFePO4的单元数有___ 个。
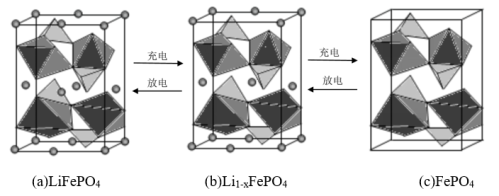
②电池充电时,LiFePO4脱出部分Li+,形成Li1-xFePO4,结构示意图如(b)所示,则x=___ ,n(Fe2+)∶n(Fe3+)=___ 。
(1)LiFePO4是一种潜在的锂离子电池正极材料,它可以通过(NH4)2Fe(SO4)2、H3PO4与LiOH溶液发生共沉淀反应,所得沉淀经80℃真空干燥、高温成型而值得。
①共沉淀反应投料时,不将(NH4)2Fe(SO4)2和LiOH溶液直接混合的原因是
②参与反应的H3PO4能与水以任意比互溶的原因是
③高温成型前,常向LiFePO4中加入少量活性炭黑,其作用除了可以改善成型后的LiFePO4的导电性能外,还能
(2)LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构。
①每个晶胞中含有LiFePO4的单元数有

②电池充电时,LiFePO4脱出部分Li+,形成Li1-xFePO4,结构示意图如(b)所示,则x=
您最近一年使用:0次



