名校
1 . 研究 、
、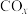 的消除和再利用对改善生态环境、促进低碳社会的构建和环境保护,构建生态文明具有重要的意义。
的消除和再利用对改善生态环境、促进低碳社会的构建和环境保护,构建生态文明具有重要的意义。
(1)采用 作还原剂催化还原
作还原剂催化还原 可以消除氮氧化物的污染。烟气以一定的流速通过催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物的转化率),反应原理为:
可以消除氮氧化物的污染。烟气以一定的流速通过催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物的转化率),反应原理为: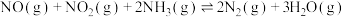 。以下说法正确的是______。
。以下说法正确的是______。
(2)CO与NO在Rh催化剂上的氧化还原反应是控制汽车尾气对空气污染的关键反应用Rh做催化剂时该反应的过程示意图如图所示:__________ 。(填“极性键”、“非极性键”或“极性键和非极性键”)。过程Ⅱ为__________ 过程(填“吸热”或“放热”)。
②已知过程Ⅰ的焓变为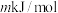 ,过程Ⅱ的焓变为
,过程Ⅱ的焓变为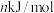 ,则该反应的热化学方程式为:
,则该反应的热化学方程式为:__________ 。
(3) 催化还原NO的物质转化如图所示。若参与反应的
催化还原NO的物质转化如图所示。若参与反应的 和
和 的物质的量之比为4∶1,则转化时
的物质的量之比为4∶1,则转化时 和NO物质的量之比为:
和NO物质的量之比为:__________ 。其中__________ 是催化剂(填化学符号)。______ (填选项)。(A.化学能转化为电能 B.电能转化为化学能),石墨Ⅰ是该电化学装置的______ (填选项)(A.正极 B.负极)石墨Ⅰ电极上发生的电极反应为__________ (提醒:介质为熔融 )。相同条件下,放电过程中消耗的
)。相同条件下,放电过程中消耗的 和
和 的体积比为
的体积比为__________ 。
 、
、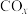 的消除和再利用对改善生态环境、促进低碳社会的构建和环境保护,构建生态文明具有重要的意义。
的消除和再利用对改善生态环境、促进低碳社会的构建和环境保护,构建生态文明具有重要的意义。(1)采用
 作还原剂催化还原
作还原剂催化还原 可以消除氮氧化物的污染。烟气以一定的流速通过催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物的转化率),反应原理为:
可以消除氮氧化物的污染。烟气以一定的流速通过催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物的转化率),反应原理为: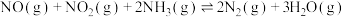 。以下说法正确的是______。
。以下说法正确的是______。A.使用催化剂更有利于提高 的平衡转化率 的平衡转化率 |
| B.及时吹脱水蒸气,可以提高脱氮率 |
| C.其他条件不变的条件下,改变压强对脱氮率没有影响 |
| D.烟气通过催化剂的流速越快,脱氮效果会越好 |
(2)CO与NO在Rh催化剂上的氧化还原反应是控制汽车尾气对空气污染的关键反应用Rh做催化剂时该反应的过程示意图如图所示:

②已知过程Ⅰ的焓变为
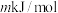 ,过程Ⅱ的焓变为
,过程Ⅱ的焓变为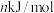 ,则该反应的热化学方程式为:
,则该反应的热化学方程式为:(3)
 催化还原NO的物质转化如图所示。若参与反应的
催化还原NO的物质转化如图所示。若参与反应的 和
和 的物质的量之比为4∶1,则转化时
的物质的量之比为4∶1,则转化时 和NO物质的量之比为:
和NO物质的量之比为: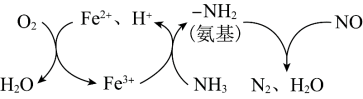
 )。相同条件下,放电过程中消耗的
)。相同条件下,放电过程中消耗的 和
和 的体积比为
的体积比为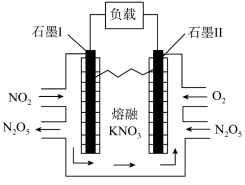
您最近一年使用:0次
2 . 锂电池的研发、使用及废电池的回收具有重要意义。
(1)比能量是指电池单位质量(或体积)输出的电能。锂金属电池放电时总反应为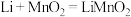 。下列关于锂金属电池说法正确的是
。下列关于锂金属电池说法正确的是___________ (填序号)。
A放电时Li作负极 B.比能量高于锌锰干电池 C.可用稀 作电解质
作电解质
(2)钴酸锂( )、磷酸铁锂(
)、磷酸铁锂( )等锂离子二次电池应用普遍。
)等锂离子二次电池应用普遍。
①钴酸锂电池放电时示意图如图1所示。放电时, 由
由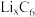 中脱嵌。写出放电至完全时
中脱嵌。写出放电至完全时 电极的电极反应式:
电极的电极反应式:___________ 。 脱嵌形成
脱嵌形成 。
。 晶胞中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构(如图2所示)。x=
晶胞中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构(如图2所示)。x=___________ 。 和NaCl溶液中使电池充分放电是电池回收工艺的首要步骤。电池在不同溶液中放电的残余电压随时间的变化如图3所示。对浸泡液中沉淀物热处理后,得到XRD示意图谱如图4所示。
和NaCl溶液中使电池充分放电是电池回收工艺的首要步骤。电池在不同溶液中放电的残余电压随时间的变化如图3所示。对浸泡液中沉淀物热处理后,得到XRD示意图谱如图4所示。___________ 。
②与 溶液相比,NaCl溶液的质量分数由5%增大至10%时,电池残余电压降低速率更快。依据图4XRD图谱,分析其主要原因:
溶液相比,NaCl溶液的质量分数由5%增大至10%时,电池残余电压降低速率更快。依据图4XRD图谱,分析其主要原因:___________ 。
(4)将放电完全的钴酸锂电池正极材料粉碎后进行酸浸处理。实验测得,在相同条件下,使用盐酸作浸取剂可使钴转化为 ,转化率达到99%,但工业生产使用
,转化率达到99%,但工业生产使用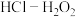 混合物作浸取剂。
混合物作浸取剂。
①写出盐酸作浸取剂发生酸浸反应的化学反应方程式:___________ 。
②工业生产时在盐酸中加入 ,
, 的作用是
的作用是___________ 。
(1)比能量是指电池单位质量(或体积)输出的电能。锂金属电池放电时总反应为
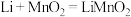 。下列关于锂金属电池说法正确的是
。下列关于锂金属电池说法正确的是A放电时Li作负极 B.比能量高于锌锰干电池 C.可用稀
 作电解质
作电解质(2)钴酸锂(
 )、磷酸铁锂(
)、磷酸铁锂( )等锂离子二次电池应用普遍。
)等锂离子二次电池应用普遍。①钴酸锂电池放电时示意图如图1所示。放电时,
 由
由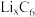 中脱嵌。写出放电至完全时
中脱嵌。写出放电至完全时 电极的电极反应式:
电极的电极反应式: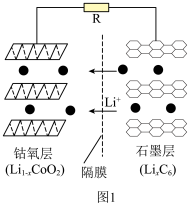
 脱嵌形成
脱嵌形成 。
。 晶胞中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构(如图2所示)。x=
晶胞中O围绕Fe和P分别形成正八面体和正四面体,它们通过共顶点、共棱形成空间链结构(如图2所示)。x=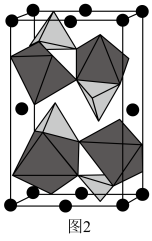
 和NaCl溶液中使电池充分放电是电池回收工艺的首要步骤。电池在不同溶液中放电的残余电压随时间的变化如图3所示。对浸泡液中沉淀物热处理后,得到XRD示意图谱如图4所示。
和NaCl溶液中使电池充分放电是电池回收工艺的首要步骤。电池在不同溶液中放电的残余电压随时间的变化如图3所示。对浸泡液中沉淀物热处理后,得到XRD示意图谱如图4所示。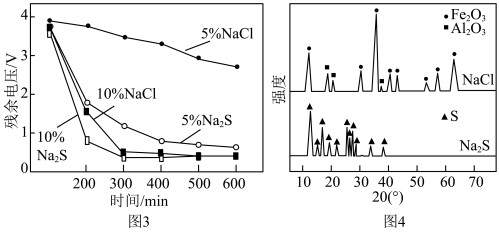
②与
 溶液相比,NaCl溶液的质量分数由5%增大至10%时,电池残余电压降低速率更快。依据图4XRD图谱,分析其主要原因:
溶液相比,NaCl溶液的质量分数由5%增大至10%时,电池残余电压降低速率更快。依据图4XRD图谱,分析其主要原因:(4)将放电完全的钴酸锂电池正极材料粉碎后进行酸浸处理。实验测得,在相同条件下,使用盐酸作浸取剂可使钴转化为
 ,转化率达到99%,但工业生产使用
,转化率达到99%,但工业生产使用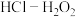 混合物作浸取剂。
混合物作浸取剂。①写出盐酸作浸取剂发生酸浸反应的化学反应方程式:
②工业生产时在盐酸中加入
 ,
, 的作用是
的作用是
您最近一年使用:0次
名校
3 . 研究氨的制备、应用及氨氮的去除有重要意义。
(1)在固定体积的密闭容器中,进行如下化学反应: ,其平衡常数K与温度T的关系如下表。
,其平衡常数K与温度T的关系如下表。
①试判断
_______  (填写“>”“=”或“<”)
(填写“>”“=”或“<”)
②一定温度下,在 密闭容器中充入
密闭容器中充入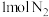 和
和 并发生反应。若容器容积恒定,
并发生反应。若容器容积恒定, 达到平衡时,气体的总物质的量为原来的
达到平衡时,气体的总物质的量为原来的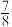 ,则
,则 的转化率
的转化率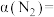
_______ ,以 表示该过程的反应速率
表示该过程的反应速率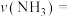
_______ 。
(2)氨的应用。以 和
和 为原料在一定温度和压强下合成尿素的反应分两步:
为原料在一定温度和压强下合成尿素的反应分两步:
I. 和
和 生成
生成 ;
;
Ⅱ. 分解生成
分解生成 。
。
反应过程中能量变化如图所示。 和
和 合成尿素反应的热化学方程式为
合成尿素反应的热化学方程式为_______ 。
②结合反应过程中能量变化示意图,下列说法正确的是_______ (填序号)。
a.活化能:反应I<反应Ⅱ
b.I为放热反应,Ⅱ为吸热反应
c.对总反应速率影响较大的是反应I
(3)氨氮的去除。下面是两种电化学除氨氮的方法。
方法一:电化学氧化法
有研究表明,当以碳材料为阴极, 可在阴极生成
可在阴极生成 ,并进一步生成氧化性更强的
,并进一步生成氧化性更强的 ,
, 可以将水中氨氮氧化为
可以将水中氨氮氧化为 。
。
①写出 去除氨气的化学反应方程式
去除氨气的化学反应方程式_______ 。
②阴极区加入 可进一步提高氨氮的去除率,结合如下图,用化学方程式、电极反应式和文字解释
可进一步提高氨氮的去除率,结合如下图,用化学方程式、电极反应式和文字解释 的作用
的作用_______ 。
用 溶液模拟氨氮废水,以镁作阳极、不锈钢作阴极进行电解,可将废水中的
溶液模拟氨氮废水,以镁作阳极、不锈钢作阴极进行电解,可将废水中的 转化为
转化为 沉淀而除去。调节溶液初始
沉淀而除去。调节溶液初始 ,氨氮去除率和溶液
,氨氮去除率和溶液 随时间的变化情况如图所示。
随时间的变化情况如图所示。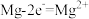 ,
, 。写出废水中生成
。写出废水中生成 沉淀的离子方程式:
沉淀的离子方程式:_______ 。
④反应1h以后,氨氮去除率随时间的延长反而下降的原因是_______ 。
(1)在固定体积的密闭容器中,进行如下化学反应:
 ,其平衡常数K与温度T的关系如下表。
,其平衡常数K与温度T的关系如下表。| T/K | 298 | 398 | 498 |
| 平衡常数K | 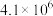 |  |  |

 (填写“>”“=”或“<”)
(填写“>”“=”或“<”)②一定温度下,在
 密闭容器中充入
密闭容器中充入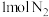 和
和 并发生反应。若容器容积恒定,
并发生反应。若容器容积恒定, 达到平衡时,气体的总物质的量为原来的
达到平衡时,气体的总物质的量为原来的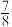 ,则
,则 的转化率
的转化率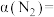
 表示该过程的反应速率
表示该过程的反应速率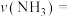
(2)氨的应用。以
 和
和 为原料在一定温度和压强下合成尿素的反应分两步:
为原料在一定温度和压强下合成尿素的反应分两步:I.
 和
和 生成
生成 ;
;Ⅱ.
 分解生成
分解生成 。
。反应过程中能量变化如图所示。

 和
和 合成尿素反应的热化学方程式为
合成尿素反应的热化学方程式为②结合反应过程中能量变化示意图,下列说法正确的是
a.活化能:反应I<反应Ⅱ
b.I为放热反应,Ⅱ为吸热反应
c.对总反应速率影响较大的是反应I
(3)氨氮的去除。下面是两种电化学除氨氮的方法。
方法一:电化学氧化法
有研究表明,当以碳材料为阴极,
 可在阴极生成
可在阴极生成 ,并进一步生成氧化性更强的
,并进一步生成氧化性更强的 ,
, 可以将水中氨氮氧化为
可以将水中氨氮氧化为 。
。①写出
 去除氨气的化学反应方程式
去除氨气的化学反应方程式②阴极区加入
 可进一步提高氨氮的去除率,结合如下图,用化学方程式、电极反应式和文字解释
可进一步提高氨氮的去除率,结合如下图,用化学方程式、电极反应式和文字解释 的作用
的作用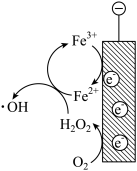
用
 溶液模拟氨氮废水,以镁作阳极、不锈钢作阴极进行电解,可将废水中的
溶液模拟氨氮废水,以镁作阳极、不锈钢作阴极进行电解,可将废水中的 转化为
转化为 沉淀而除去。调节溶液初始
沉淀而除去。调节溶液初始 ,氨氮去除率和溶液
,氨氮去除率和溶液 随时间的变化情况如图所示。
随时间的变化情况如图所示。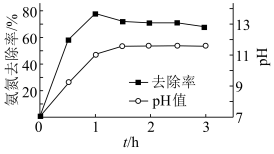
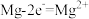 ,
, 。写出废水中生成
。写出废水中生成 沉淀的离子方程式:
沉淀的离子方程式:④反应1h以后,氨氮去除率随时间的延长反而下降的原因是
您最近一年使用:0次
4 . 不同催化剂作用下NH3还原NOx的机理与效果是研究烟气(含NOx、O2、N2等)脱硝的热点。
(1)NH3还原NO的主反应为4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g)。
已知:N2(g)+O2(g)=2NO(g)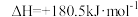 ;4NH3(g)+3O2(g)=2N2(g)+6H2O(g)
;4NH3(g)+3O2(g)=2N2(g)+6H2O(g) 
上述主反应的
____ 。
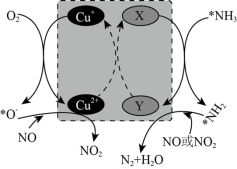
(2)在某钒催化剂中添加一定量Cu2O可加快NO的脱除效率,其可能机理如图所示(*表示物种吸附在催化剂表面,部分物种未画出)。____ 。
②烟气中若含有SO2,会生成NH4HSO4堵塞催化剂孔道。生成NH4HSO4的化学方程式为____ 。
(3)将模拟烟气(一定比例NOx、NH3、O2和N2)以一定流速通过装有Fe/Zr催化剂的反应管,测得NOx转化率随温度变化的曲线如图所示。_____ 。
②温度高于450℃时,NOx转化率已降低为负值,其可能原因是____ 。
(1)NH3还原NO的主反应为4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g)。
已知:N2(g)+O2(g)=2NO(g)
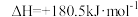 ;4NH3(g)+3O2(g)=2N2(g)+6H2O(g)
;4NH3(g)+3O2(g)=2N2(g)+6H2O(g) 
上述主反应的

(2)在某钒催化剂中添加一定量Cu2O可加快NO的脱除效率,其可能机理如图所示(*表示物种吸附在催化剂表面,部分物种未画出)。
②烟气中若含有SO2,会生成NH4HSO4堵塞催化剂孔道。生成NH4HSO4的化学方程式为
(3)将模拟烟气(一定比例NOx、NH3、O2和N2)以一定流速通过装有Fe/Zr催化剂的反应管,测得NOx转化率随温度变化的曲线如图所示。
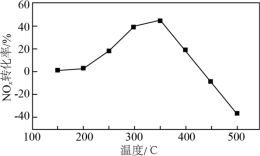
②温度高于450℃时,NOx转化率已降低为负值,其可能原因是
您最近一年使用:0次
名校
5 . 高砷煤中含有砷硫铁(FeAsS)等物质。燃煤产生的烟气中含NO、 、粉尘等,经过SCR脱硝除去NO,粉尘经沉降得到粉煤灰。
、粉尘等,经过SCR脱硝除去NO,粉尘经沉降得到粉煤灰。
(1)燃煤固硫
①燃烧高砷煤时加入生石灰将大部分硫元素转化为___________ (填化学式)留在煤渣中。
②高砷煤燃烧过程中,砷硫铁在高温下被氧化成 释放到烟气中,该反应的化学方程式为
释放到烟气中,该反应的化学方程式为___________ 。
(2)SCR脱硝(脱除烟气中的NO)
在烟气中加入适量氨气,用钒氧化物作催化剂将 、NO、
、NO、 转化为
转化为 。
。
①在SCR脱硝的反应中还原剂为___________ (填化学式)。
②若 与NO的物质的量之比为1∶1,写出SCR脱硝法的反应原理
与NO的物质的量之比为1∶1,写出SCR脱硝法的反应原理___________ (用化学方程式表示)。
(3)粉煤灰成分研究
粉煤灰可用于水泥工业,粉煤灰中的氨含量( 或铵盐)会影响水泥的性能。取50.00g粉煤灰加入NaOH蒸出
或铵盐)会影响水泥的性能。取50.00g粉煤灰加入NaOH蒸出 ,用20mL 0.1000
,用20mL 0.1000 的
的 溶液吸收
溶液吸收 ,用0.200
,用0.200 NaOH溶液滴定过量的
NaOH溶液滴定过量的 至终点,平行滴定3次,平均消耗NaOH溶液10.00mL,计算粉煤灰中的以
至终点,平行滴定3次,平均消耗NaOH溶液10.00mL,计算粉煤灰中的以 计的氨含量
计的氨含量___________ (用 表示,写出计算过程)。
表示,写出计算过程)。
 、粉尘等,经过SCR脱硝除去NO,粉尘经沉降得到粉煤灰。
、粉尘等,经过SCR脱硝除去NO,粉尘经沉降得到粉煤灰。(1)燃煤固硫
①燃烧高砷煤时加入生石灰将大部分硫元素转化为
②高砷煤燃烧过程中,砷硫铁在高温下被氧化成
 释放到烟气中,该反应的化学方程式为
释放到烟气中,该反应的化学方程式为(2)SCR脱硝(脱除烟气中的NO)
在烟气中加入适量氨气,用钒氧化物作催化剂将
 、NO、
、NO、 转化为
转化为 。
。①在SCR脱硝的反应中还原剂为
②若
 与NO的物质的量之比为1∶1,写出SCR脱硝法的反应原理
与NO的物质的量之比为1∶1,写出SCR脱硝法的反应原理(3)粉煤灰成分研究
粉煤灰可用于水泥工业,粉煤灰中的氨含量(
 或铵盐)会影响水泥的性能。取50.00g粉煤灰加入NaOH蒸出
或铵盐)会影响水泥的性能。取50.00g粉煤灰加入NaOH蒸出 ,用20mL 0.1000
,用20mL 0.1000 的
的 溶液吸收
溶液吸收 ,用0.200
,用0.200 NaOH溶液滴定过量的
NaOH溶液滴定过量的 至终点,平行滴定3次,平均消耗NaOH溶液10.00mL,计算粉煤灰中的以
至终点,平行滴定3次,平均消耗NaOH溶液10.00mL,计算粉煤灰中的以 计的氨含量
计的氨含量 表示,写出计算过程)。
表示,写出计算过程)。
您最近一年使用:0次
6 . 研究和采取措施去除氮氧化物尾气和水中硝酸盐造成的氮污染备受关注。
Ⅰ氧化吸收法 酸性条件下,NaClO溶液氧化 、NO和
、NO和 等生成
等生成 和
和 。
。
(1)其他条件一定, 转化为
转化为 的转化率随水体溶液初始pH的变化如图1所示。
的转化率随水体溶液初始pH的变化如图1所示。 、NO和
、NO和 三种气体中,相同条件下最易被NaClO氧化的是
三种气体中,相同条件下最易被NaClO氧化的是________ 。
②在酸性水体中,加入NaClO溶液吸收 的离子方程式为
的离子方程式为________ 。
③水体溶液初始pH越小, 转化率越高。其原因是
转化率越高。其原因是________ 。
(2)NaClO吸收液还可以同时脱除烟气中NO和 。研究发现NaClO吸收液在不同初始pH条件下,对流动烟气的脱硫效率都接近100%,而对NO的脱除率如图2所示:
。研究发现NaClO吸收液在不同初始pH条件下,对流动烟气的脱硫效率都接近100%,而对NO的脱除率如图2所示:
①酸性条件下, 的脱除率高于NO,其原因除
的脱除率高于NO,其原因除 的还原性比NO强外,还可能是
的还原性比NO强外,还可能是________ 。
②若用盐酸调节NaClO吸收液pH,不仅不利于NO的吸收,还会在反应过程中生成一种有毒气体,其化学式为________ 。
Ⅱ催化还原法
(3)在 的催化条件下,使用
的催化条件下,使用 作为还原剂,可将水中的
作为还原剂,可将水中的 转化为
转化为 。该反应机理分为三步,如题17图3所示:第一步:
。该反应机理分为三步,如题17图3所示:第一步:________ (补充完整该步反应机理);第二步: 从Cu表面迁移至W的表面;第三步:
从Cu表面迁移至W的表面;第三步: 在W表面吸附并解离为活性氢原子(W-H),W-H将
在W表面吸附并解离为活性氢原子(W-H),W-H将 还原为
还原为 ,同时W-H将CuO还原为Cu,自身转化为W,实现Cu和W的催化循环。
,同时W-H将CuO还原为Cu,自身转化为W,实现Cu和W的催化循环。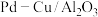 作为还原硝酸盐过程的催化剂,其催化机理与
作为还原硝酸盐过程的催化剂,其催化机理与 相似。但还原过程中检测到三种含氮化合物微粒,其浓度变化如图4所示,在1.5小时以后,
相似。但还原过程中检测到三种含氮化合物微粒,其浓度变化如图4所示,在1.5小时以后, 的百分含量不断减少,
的百分含量不断减少, 的百分含量不断增多的可能原因是
的百分含量不断增多的可能原因是________ 。
Ⅰ氧化吸收法 酸性条件下,NaClO溶液氧化
 、NO和
、NO和 等生成
等生成 和
和 。
。(1)其他条件一定,
 转化为
转化为 的转化率随水体溶液初始pH的变化如图1所示。
的转化率随水体溶液初始pH的变化如图1所示。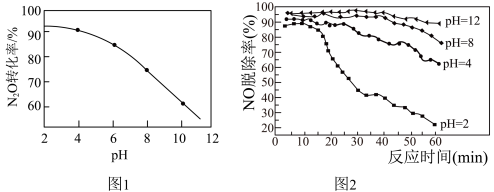
 、NO和
、NO和 三种气体中,相同条件下最易被NaClO氧化的是
三种气体中,相同条件下最易被NaClO氧化的是②在酸性水体中,加入NaClO溶液吸收
 的离子方程式为
的离子方程式为③水体溶液初始pH越小,
 转化率越高。其原因是
转化率越高。其原因是(2)NaClO吸收液还可以同时脱除烟气中NO和
 。研究发现NaClO吸收液在不同初始pH条件下,对流动烟气的脱硫效率都接近100%,而对NO的脱除率如图2所示:
。研究发现NaClO吸收液在不同初始pH条件下,对流动烟气的脱硫效率都接近100%,而对NO的脱除率如图2所示:①酸性条件下,
 的脱除率高于NO,其原因除
的脱除率高于NO,其原因除 的还原性比NO强外,还可能是
的还原性比NO强外,还可能是②若用盐酸调节NaClO吸收液pH,不仅不利于NO的吸收,还会在反应过程中生成一种有毒气体,其化学式为
Ⅱ催化还原法
(3)在
 的催化条件下,使用
的催化条件下,使用 作为还原剂,可将水中的
作为还原剂,可将水中的 转化为
转化为 。该反应机理分为三步,如题17图3所示:第一步:
。该反应机理分为三步,如题17图3所示:第一步: 从Cu表面迁移至W的表面;第三步:
从Cu表面迁移至W的表面;第三步: 在W表面吸附并解离为活性氢原子(W-H),W-H将
在W表面吸附并解离为活性氢原子(W-H),W-H将 还原为
还原为 ,同时W-H将CuO还原为Cu,自身转化为W,实现Cu和W的催化循环。
,同时W-H将CuO还原为Cu,自身转化为W,实现Cu和W的催化循环。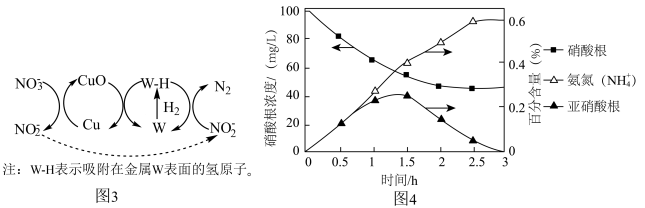
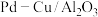 作为还原硝酸盐过程的催化剂,其催化机理与
作为还原硝酸盐过程的催化剂,其催化机理与 相似。但还原过程中检测到三种含氮化合物微粒,其浓度变化如图4所示,在1.5小时以后,
相似。但还原过程中检测到三种含氮化合物微粒,其浓度变化如图4所示,在1.5小时以后, 的百分含量不断减少,
的百分含量不断减少, 的百分含量不断增多的可能原因是
的百分含量不断增多的可能原因是
您最近一年使用:0次
2024·江苏·模拟预测
7 . 氮氧化物会严重污染空气,汽车尾气及一些工业生产的烟气中都含有氮氧化物,工业上常用催化转化法、氨还原法、氧化剂氧化法进行处理。回答下列问题:
(1)汽车排放的尾气中有NO和CO,在催化剂的作用下可转化为两种无污染的气体。已知:
N2(g)+O2(g) 2NO(g) △H1=+180.0kJ·mol-1 ①
2NO(g) △H1=+180.0kJ·mol-1 ①
CO(g)+ O2(g)
O2(g)  CO2(g) △H2=-283.5kJ·mol-1 ②
CO2(g) △H2=-283.5kJ·mol-1 ②
则反应2CO(g)+2NO(g) N2(g)+2CO2(g) △H=
N2(g)+2CO2(g) △H=_______ 。
(2)在2L的密闭容器中充入1molNO2和2molCO,发生下述反应:4CO(g)+2NO2(g) N2(g)+4CO2(g) △H<0,下图为平衡时CO2的体积分数与温度和压强的关系。在D点时,升高反应体系的温度,同时扩大容器的体积减小体系的压强,重新达到的平衡状态可能是图中A~G点中的
N2(g)+4CO2(g) △H<0,下图为平衡时CO2的体积分数与温度和压强的关系。在D点时,升高反应体系的温度,同时扩大容器的体积减小体系的压强,重新达到的平衡状态可能是图中A~G点中的_______ 点。_______ ,历程图中总反应的化学方程式为_______ 。 ,并放出热量。
,并放出热量。
①该反应的离子方程式为_______ 。
②向NaClO2溶液中加入Fe3+,会发生反应:Fe3++ =Fe2++ClO2↑。控制其他条件相同,分别以NaClO2溶液和含少量Fe3+的NaClO2溶液为吸收剂,测得相同时间内,NO的氧化率随起始NaClO2溶液浓度的变化如图1所示。起始NaClO2溶液浓度相同时,含Fe3+的NaClO2溶液作为吸收剂,NO的氧化率更高,原因是
=Fe2++ClO2↑。控制其他条件相同,分别以NaClO2溶液和含少量Fe3+的NaClO2溶液为吸收剂,测得相同时间内,NO的氧化率随起始NaClO2溶液浓度的变化如图1所示。起始NaClO2溶液浓度相同时,含Fe3+的NaClO2溶液作为吸收剂,NO的氧化率更高,原因是_______ ;以NaClO2溶液为吸收剂,NO的氧化率随温度的变化情况,如图2所示,温度超过60℃后,NO氧化率下降,试解释其原因:_______ 。
(1)汽车排放的尾气中有NO和CO,在催化剂的作用下可转化为两种无污染的气体。已知:
N2(g)+O2(g)
 2NO(g) △H1=+180.0kJ·mol-1 ①
2NO(g) △H1=+180.0kJ·mol-1 ①CO(g)+
 O2(g)
O2(g)  CO2(g) △H2=-283.5kJ·mol-1 ②
CO2(g) △H2=-283.5kJ·mol-1 ②则反应2CO(g)+2NO(g)
 N2(g)+2CO2(g) △H=
N2(g)+2CO2(g) △H=(2)在2L的密闭容器中充入1molNO2和2molCO,发生下述反应:4CO(g)+2NO2(g)
 N2(g)+4CO2(g) △H<0,下图为平衡时CO2的体积分数与温度和压强的关系。在D点时,升高反应体系的温度,同时扩大容器的体积减小体系的压强,重新达到的平衡状态可能是图中A~G点中的
N2(g)+4CO2(g) △H<0,下图为平衡时CO2的体积分数与温度和压强的关系。在D点时,升高反应体系的温度,同时扩大容器的体积减小体系的压强,重新达到的平衡状态可能是图中A~G点中的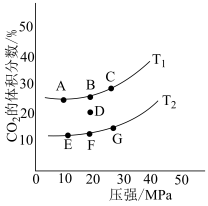

 ,并放出热量。
,并放出热量。①该反应的离子方程式为
②向NaClO2溶液中加入Fe3+,会发生反应:Fe3++
 =Fe2++ClO2↑。控制其他条件相同,分别以NaClO2溶液和含少量Fe3+的NaClO2溶液为吸收剂,测得相同时间内,NO的氧化率随起始NaClO2溶液浓度的变化如图1所示。起始NaClO2溶液浓度相同时,含Fe3+的NaClO2溶液作为吸收剂,NO的氧化率更高,原因是
=Fe2++ClO2↑。控制其他条件相同,分别以NaClO2溶液和含少量Fe3+的NaClO2溶液为吸收剂,测得相同时间内,NO的氧化率随起始NaClO2溶液浓度的变化如图1所示。起始NaClO2溶液浓度相同时,含Fe3+的NaClO2溶液作为吸收剂,NO的氧化率更高,原因是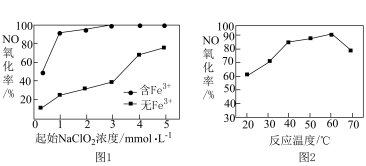
您最近一年使用:0次
名校
解题方法
8 . 有效去除大气中的NOx和水体中的氮,并且转化为可利用的资源是重要课题。
(1)在微生物作用的条件下, 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下: (aq)+2O2(g)=
(aq)+2O2(g)= (aq)+2H+(aq)+H2O(l) ΔH=
(aq)+2H+(aq)+H2O(l) ΔH=_______ kJ·mol-1
(2)近年来,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中的c(OH-)制备纳米Cu2O备受关注,其模拟装置如图甲、乙。_______ (请填“C”或“D”)极相连。
②该电解池的阳极反应式为_______ 。
③该电解池(图乙)中离子交换膜为_______ (请填“阴”或“阳”)离子交换膜。
④理论上,每生产144g纳米Cu2O,需要消耗肼(N2H4)_______ mol。
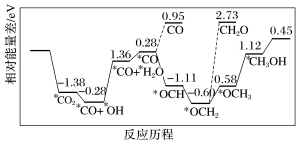
(3)纳米颗粒在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。_______ 。
②上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中_______ (填字母)的活化能。
A.*CO+*OH→*CO+*H2O
B.*CO→*OCH
C.*OCH2→*OCH3
D.*OCH3→*CH3OH
(4)磷酸铵镁(MgNH4PO4)沉淀法可去除水体中的氨氮( 和NH3)。实验室中模拟氨氮处理:1 L的模拟氨氮废水(主要含
和NH3)。实验室中模拟氨氮处理:1 L的模拟氨氮废水(主要含 ),置于搅拌器上,设定反应温度为25 ℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30 min后,取液面下2 cm处清液测定氨氮质量浓度。已知:常温下,磷酸铵镁(MgNH4PO4)微溶于水;H3PO4的Ka1=6.9×10-3, Ka2=6.2×10-8 ,Ka3=4.8×10-13。
),置于搅拌器上,设定反应温度为25 ℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30 min后,取液面下2 cm处清液测定氨氮质量浓度。已知:常温下,磷酸铵镁(MgNH4PO4)微溶于水;H3PO4的Ka1=6.9×10-3, Ka2=6.2×10-8 ,Ka3=4.8×10-13。_______ 。
②当反应pH为9.0时,该沉淀法对氨氮的去除率达到最高,当pH继续增至10.0时,氨氮的去除率下降,原因是_______ 。
(1)在微生物作用的条件下,
 经过两步反应被氧化成
经过两步反应被氧化成 。两步反应的能量变化示意图如下:
。两步反应的能量变化示意图如下: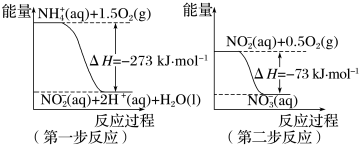
 (aq)+2O2(g)=
(aq)+2O2(g)= (aq)+2H+(aq)+H2O(l) ΔH=
(aq)+2H+(aq)+H2O(l) ΔH=(2)近年来,采用肼(N2H4)燃料电池为电源,用离子交换膜控制电解液中的c(OH-)制备纳米Cu2O备受关注,其模拟装置如图甲、乙。
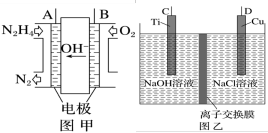
②该电解池的阳极反应式为
③该电解池(图乙)中离子交换膜为
④理论上,每生产144g纳米Cu2O,需要消耗肼(N2H4)
(3)纳米颗粒在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。
②上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中
A.*CO+*OH→*CO+*H2O
B.*CO→*OCH
C.*OCH2→*OCH3
D.*OCH3→*CH3OH
(4)磷酸铵镁(MgNH4PO4)沉淀法可去除水体中的氨氮(
 和NH3)。实验室中模拟氨氮处理:1 L的模拟氨氮废水(主要含
和NH3)。实验室中模拟氨氮处理:1 L的模拟氨氮废水(主要含 ),置于搅拌器上,设定反应温度为25 ℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30 min后,取液面下2 cm处清液测定氨氮质量浓度。已知:常温下,磷酸铵镁(MgNH4PO4)微溶于水;H3PO4的Ka1=6.9×10-3, Ka2=6.2×10-8 ,Ka3=4.8×10-13。
),置于搅拌器上,设定反应温度为25 ℃。先后加入MgCl2和Na2HPO4溶液,用NaOH调节反应pH,投加絮凝剂;开始搅拌,反应30 min后,取液面下2 cm处清液测定氨氮质量浓度。已知:常温下,磷酸铵镁(MgNH4PO4)微溶于水;H3PO4的Ka1=6.9×10-3, Ka2=6.2×10-8 ,Ka3=4.8×10-13。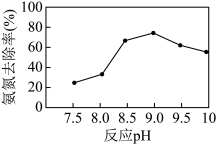
②当反应pH为9.0时,该沉淀法对氨氮的去除率达到最高,当pH继续增至10.0时,氨氮的去除率下降,原因是
您最近一年使用:0次
名校
9 . 氰化氢(HCN,一元弱酸,易挥发)主要应用于电镀、采矿、药物合成等工业生产。HCN,CN-能抑制人体组织细胞内酶的活性,不能直接排放到环境中。
(1)Na2S2O3在临床上常用于氰化物的解毒剂。解毒的原理是 将CN-转化为SCN-和
将CN-转化为SCN-和 。验证该转化过程中生成SCN-的实验方法是:向NaCN溶液中加入过量的Na2S2O3的溶液,充分反应后,取少量反应后的溶液于试管中,加入足量稀盐酸酸化,
。验证该转化过程中生成SCN-的实验方法是:向NaCN溶液中加入过量的Na2S2O3的溶液,充分反应后,取少量反应后的溶液于试管中,加入足量稀盐酸酸化,___________ 。
(2)Cu2+可催化过氧化氢氧化废水中的CN-。
①反应不能在酸性条件下进行,原因是___________ 。
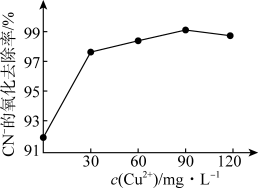
②在含氰废水总景、过氧化氢用量和溶液pH一定的情况下,反应相同时间,测得CN-的氧化去除率随c(Cu2+)的变化与如图所示。c(Cu2+)超过90mg·L-1时,CN-的氧化去除率有所下降,原因是___________ 。 ,其反应的离子方程式为
,其反应的离子方程式为___________ 。
(4)在铜镍为催化剂(Cu、CuO为活性组分,Cu的催化活性效果更好)的条件下,可利用反应:HCN(g)+H2O(g) NH3(g)+CO(g) △H>0
NH3(g)+CO(g) △H>0
除去废气中的HCN。将含相同比例的HCN(g)、H2O(g)、CO(g)[或N2(g)]混合气体分别通过催化剂,反应相同的时间,测得HCN(g)的去除率随温度变化如图所示。200℃时含CO的混合气体中HCN(g)的去除率较高,而400℃时含CO的混合气体中HCN(g)的去除率较低。其原因是___________ 。
(1)Na2S2O3在临床上常用于氰化物的解毒剂。解毒的原理是
 将CN-转化为SCN-和
将CN-转化为SCN-和 。验证该转化过程中生成SCN-的实验方法是:向NaCN溶液中加入过量的Na2S2O3的溶液,充分反应后,取少量反应后的溶液于试管中,加入足量稀盐酸酸化,
。验证该转化过程中生成SCN-的实验方法是:向NaCN溶液中加入过量的Na2S2O3的溶液,充分反应后,取少量反应后的溶液于试管中,加入足量稀盐酸酸化,(2)Cu2+可催化过氧化氢氧化废水中的CN-。
①反应不能在酸性条件下进行,原因是
②在含氰废水总景、过氧化氢用量和溶液pH一定的情况下,反应相同时间,测得CN-的氧化去除率随c(Cu2+)的变化与如图所示。c(Cu2+)超过90mg·L-1时,CN-的氧化去除率有所下降,原因是
 ,其反应的离子方程式为
,其反应的离子方程式为(4)在铜镍为催化剂(Cu、CuO为活性组分,Cu的催化活性效果更好)的条件下,可利用反应:HCN(g)+H2O(g)
 NH3(g)+CO(g) △H>0
NH3(g)+CO(g) △H>0除去废气中的HCN。将含相同比例的HCN(g)、H2O(g)、CO(g)[或N2(g)]混合气体分别通过催化剂,反应相同的时间,测得HCN(g)的去除率随温度变化如图所示。200℃时含CO的混合气体中HCN(g)的去除率较高,而400℃时含CO的混合气体中HCN(g)的去除率较低。其原因是

您最近一年使用:0次
名校
解题方法
10 . 汽车尾气主要含有一氧化碳、二氧化硫、一氧化氮等物质,是造成城市空气污染的主要因素之一、请回答下列问题:
(1)在催化转化器中,汽车尾气中的CO和NO可发生反应2CO(g)+2NO(g)⇌2CO2(g)+N2(g),一定温度下,在容积为10L的恒容密闭容器中进行该反应,起始时充入0.4molCO、0.3molNO,1min达平衡,测得CO的物质的量为0.16mol,则
①从开始到平衡时的反应速率v(CO)=_______ mol·L-1·min-1。
②NO的平衡转化率为_______ 。
(2)研究在相同时间内不同温度下经酸化处理的Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的可能原因是_______ 。_______ 反应。(填“氧化”或“还原”)
②外电路中,电子流动方向是_______ (填A或B)。
A.从 电极流向
电极流向 电极 B.从
电极 B.从 电极流向
电极流向 电极
电极
③ 电极上的电极反应式为
电极上的电极反应式为_______ 。
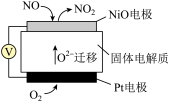
(4)SCR和NSR技术可有效降低柴油发动机在空气过量条件下的 排放,SCR(选择性催化还原)工作原理如图b所示,NSR(
排放,SCR(选择性催化还原)工作原理如图b所示,NSR( 储存还原)工作原理如图c所示。
储存还原)工作原理如图c所示。 )的水溶液热分解为
)的水溶液热分解为 和
和 ,该反应的化学方程式为
,该反应的化学方程式为_______ 。
②SCR催化过程中,当燃油中含硫量较高时,尾气中 在
在 作用下会形成
作用下会形成 ,使催化剂中毒,用化学方程式表示
,使催化剂中毒,用化学方程式表示 的形成:
的形成:_______ 。
③NSR转换中,通过 和
和 的相互转化实现
的相互转化实现 的储存和还原,图中NO的去除机理可描述为
的储存和还原,图中NO的去除机理可描述为_______ 。
(1)在催化转化器中,汽车尾气中的CO和NO可发生反应2CO(g)+2NO(g)⇌2CO2(g)+N2(g),一定温度下,在容积为10L的恒容密闭容器中进行该反应,起始时充入0.4molCO、0.3molNO,1min达平衡,测得CO的物质的量为0.16mol,则
①从开始到平衡时的反应速率v(CO)=
②NO的平衡转化率为
(2)研究在相同时间内不同温度下经酸化处理的Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的可能原因是

②外电路中,电子流动方向是
A.从
 电极流向
电极流向 电极 B.从
电极 B.从 电极流向
电极流向 电极
电极③
 电极上的电极反应式为
电极上的电极反应式为(4)SCR和NSR技术可有效降低柴油发动机在空气过量条件下的
 排放,SCR(选择性催化还原)工作原理如图b所示,NSR(
排放,SCR(选择性催化还原)工作原理如图b所示,NSR( 储存还原)工作原理如图c所示。
储存还原)工作原理如图c所示。
 )的水溶液热分解为
)的水溶液热分解为 和
和 ,该反应的化学方程式为
,该反应的化学方程式为②SCR催化过程中,当燃油中含硫量较高时,尾气中
 在
在 作用下会形成
作用下会形成 ,使催化剂中毒,用化学方程式表示
,使催化剂中毒,用化学方程式表示 的形成:
的形成:③NSR转换中,通过
 和
和 的相互转化实现
的相互转化实现 的储存和还原,图中NO的去除机理可描述为
的储存和还原,图中NO的去除机理可描述为
您最近一年使用:0次



