1 . 甲醇是一种基本的有机化工原料,用途十分广泛。应用CO2催化加氢规模化生产甲醇是综合利用CO2,实现“碳达峰”的有效措施之一、我国科学家研究发现二氧化碳电催化还原制甲醇的反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g) △H,需通过以下两步实现:
I.CO2(g)+H2(g)⇌CO(g)+H2O(g) △H1
Ⅱ.CO(g)+2H2(g)⇌CH3OH(g) △H2
反应过程中各物质的相对能量变化情况如图所示。
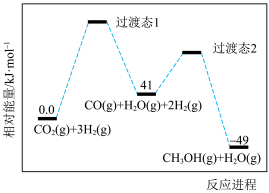
(1)
_______ ,稳定性:过渡态1_______ 过渡态2(填“大于”“小于”或“等于”)。
(2)基于催化剂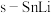 的CO2电催化制备甲酸盐同时释放电能的装置如图所示,该电池充电时,阳极的电极反应式为
的CO2电催化制备甲酸盐同时释放电能的装置如图所示,该电池充电时,阳极的电极反应式为_______ ,若电池工作t min,Zn电极的质量变化为 ,则理论上消耗CO2的物质的量为
,则理论上消耗CO2的物质的量为_______ 。
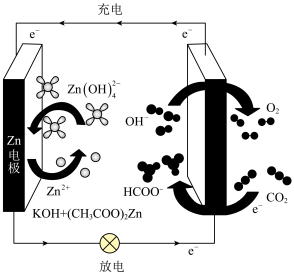
(3)+6价铬的化合物毒性较大,用甲醇酸性燃料电池电解处理酸性含铬废水(主要含有 )的原理示意图如下图所示。
)的原理示意图如下图所示。

①M极的电极反应式为_______ ,N极附近的pH_______ (填“变大”或“变小”或“不变”)。
②写出电解池中 转化为Cr3+的离子方程式
转化为Cr3+的离子方程式_______ 。
I.CO2(g)+H2(g)⇌CO(g)+H2O(g) △H1
Ⅱ.CO(g)+2H2(g)⇌CH3OH(g) △H2
反应过程中各物质的相对能量变化情况如图所示。

(1)

(2)基于催化剂
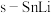 的CO2电催化制备甲酸盐同时释放电能的装置如图所示,该电池充电时,阳极的电极反应式为
的CO2电催化制备甲酸盐同时释放电能的装置如图所示,该电池充电时,阳极的电极反应式为 ,则理论上消耗CO2的物质的量为
,则理论上消耗CO2的物质的量为
(3)+6价铬的化合物毒性较大,用甲醇酸性燃料电池电解处理酸性含铬废水(主要含有
 )的原理示意图如下图所示。
)的原理示意图如下图所示。
①M极的电极反应式为
②写出电解池中
 转化为Cr3+的离子方程式
转化为Cr3+的离子方程式
您最近一年使用:0次
名校
解题方法
2 . 氯碱工业是化工产业的重要基础,其装置示意图如下图。生产过程中产生的氯酸盐副产物需要处理。
已知:当 升高时,
升高时, 易歧化为
易歧化为 和
和 。
。
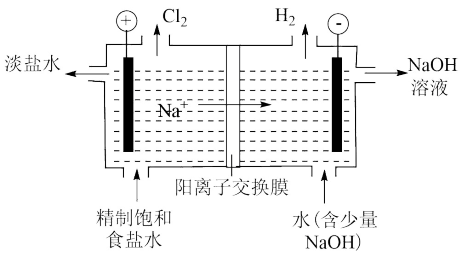
(1)电解饱和食盐水的阴极反应式为_____ 。
(2)下列关于 产生的说法中,合理的是
产生的说法中,合理的是_____ (填序号)。
a. 主要在阴极室产生
主要在阴极室产生
b. 在电极上放电,可能产生
在电极上放电,可能产生
c.阳离子交换膜破损导致 向阳极室迁移,可能产生
向阳极室迁移,可能产生
(3)测定副产物 含量的方法如下图。
含量的方法如下图。
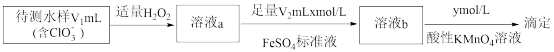
①加入 的目的是消耗水样中残留的
的目的是消耗水样中残留的 和
和 。若测定中未加入
。若测定中未加入 ,则水样中
,则水样中 的浓度将
的浓度将_____ (填“偏大”“偏小”或“不受影响”)。
②滴定测 含量消耗
含量消耗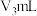 酸性
酸性 溶液,水样中
溶液,水样中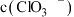 的计算式为
的计算式为_____ 。
(4)可用盐酸处理淡盐水中的 并回收
并回收
①反应的离子方程式为_____ 。
②处理 时,
时, 可能的作用是:
可能的作用是:
ⅰ.增大 ,使
,使 氧化性增强或
氧化性增强或 还原性增强;
还原性增强;
ⅱ.增大 ,
,_____ 。
③用如图装置验证ⅰ,请补全操作和现象:
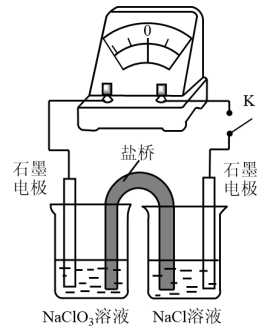
闭合 ,至指针读数稳定后
,至指针读数稳定后_____ 。
已知:当
 升高时,
升高时, 易歧化为
易歧化为 和
和 。
。
(1)电解饱和食盐水的阴极反应式为
(2)下列关于
 产生的说法中,合理的是
产生的说法中,合理的是a.
 主要在阴极室产生
主要在阴极室产生b.
 在电极上放电,可能产生
在电极上放电,可能产生
c.阳离子交换膜破损导致
 向阳极室迁移,可能产生
向阳极室迁移,可能产生
(3)测定副产物
 含量的方法如下图。
含量的方法如下图。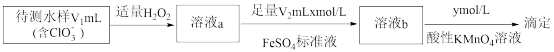
①加入
 的目的是消耗水样中残留的
的目的是消耗水样中残留的 和
和 。若测定中未加入
。若测定中未加入 ,则水样中
,则水样中 的浓度将
的浓度将②滴定测
 含量消耗
含量消耗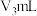 酸性
酸性 溶液,水样中
溶液,水样中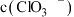 的计算式为
的计算式为(4)可用盐酸处理淡盐水中的
 并回收
并回收
①反应的离子方程式为
②处理
 时,
时, 可能的作用是:
可能的作用是:ⅰ.增大
 ,使
,使 氧化性增强或
氧化性增强或 还原性增强;
还原性增强;ⅱ.增大
 ,
,③用如图装置验证ⅰ,请补全操作和现象:

闭合
 ,至指针读数稳定后
,至指针读数稳定后
您最近一年使用:0次
名校
解题方法
3 . 石油天然气开采和炼制过程中会产生大量含硫废水(其中S元素的主要化合价是-2价),对设备、环境等造成严重危害。
已知: 有剧毒;常温下溶解度为
有剧毒;常温下溶解度为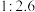 (体积)。
(体积)。
(1) 、
、 、
、 在水溶液中的物质的量分数随pH的分布曲线如图。
在水溶液中的物质的量分数随pH的分布曲线如图。

①当 时,含硫废水中最主要的含硫(-2价)微粒是
时,含硫废水中最主要的含硫(-2价)微粒是_________ 。
②通过图中数据可估算得 的
的______ (填“ ”或“
”或“ ”)。
”)。
(2)沉淀法处理含硫废水:
向 的含硫废水中加入适量
的含硫废水中加入适量 的溶液,产生黑色沉淀且溶液的pH降低。用化学平衡移动的原理解释溶液的pH降低的原因:
的溶液,产生黑色沉淀且溶液的pH降低。用化学平衡移动的原理解释溶液的pH降低的原因:_______ 。
(3)氧化还原法处理含硫废水:
向 的含硫废水中加入一定浓度的
的含硫废水中加入一定浓度的 溶液,加酸将溶液调为
溶液,加酸将溶液调为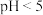 ,产生淡黄色沉淀。
,产生淡黄色沉淀。
①反应的离子方程式是________ 。
②不同pH时,硫化物去除率随时间的变化曲线如图。本工艺选择控制体系的 ,不选择
,不选择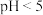 ,从环境保护的角度分析其主要原因:
,从环境保护的角度分析其主要原因:________ 。

(4)电浮选絮凝法处理含硫废水:
铝作阳极、石墨作阴极,以直流电电解含一定浓度 的
的 的含硫废水。阳极产生微小气泡,随后溶液中产生淡黄色浑浊,阳极附近生成的胶体吸附淡黄色浑浊。
的含硫废水。阳极产生微小气泡,随后溶液中产生淡黄色浑浊,阳极附近生成的胶体吸附淡黄色浑浊。
①用离子方程式表述产生淡黄色浑浊的可能原因:________ 。
②阴极产生的气泡把污水中的悬浮物(含阳极扩散的胶体)带到水面形成浮渣层,胶体的化学式:______ ,结合电极反应式解释浮渣层的形成过程:_______ 。
已知:
 有剧毒;常温下溶解度为
有剧毒;常温下溶解度为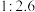 (体积)。
(体积)。(1)
 、
、 、
、 在水溶液中的物质的量分数随pH的分布曲线如图。
在水溶液中的物质的量分数随pH的分布曲线如图。
①当
 时,含硫废水中最主要的含硫(-2价)微粒是
时,含硫废水中最主要的含硫(-2价)微粒是②通过图中数据可估算得
 的
的 ”或“
”或“ ”)。
”)。(2)沉淀法处理含硫废水:
向
 的含硫废水中加入适量
的含硫废水中加入适量 的溶液,产生黑色沉淀且溶液的pH降低。用化学平衡移动的原理解释溶液的pH降低的原因:
的溶液,产生黑色沉淀且溶液的pH降低。用化学平衡移动的原理解释溶液的pH降低的原因:(3)氧化还原法处理含硫废水:
向
 的含硫废水中加入一定浓度的
的含硫废水中加入一定浓度的 溶液,加酸将溶液调为
溶液,加酸将溶液调为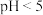 ,产生淡黄色沉淀。
,产生淡黄色沉淀。①反应的离子方程式是
②不同pH时,硫化物去除率随时间的变化曲线如图。本工艺选择控制体系的
 ,不选择
,不选择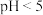 ,从环境保护的角度分析其主要原因:
,从环境保护的角度分析其主要原因:
(4)电浮选絮凝法处理含硫废水:
铝作阳极、石墨作阴极,以直流电电解含一定浓度
 的
的 的含硫废水。阳极产生微小气泡,随后溶液中产生淡黄色浑浊,阳极附近生成的胶体吸附淡黄色浑浊。
的含硫废水。阳极产生微小气泡,随后溶液中产生淡黄色浑浊,阳极附近生成的胶体吸附淡黄色浑浊。①用离子方程式表述产生淡黄色浑浊的可能原因:
②阴极产生的气泡把污水中的悬浮物(含阳极扩散的胶体)带到水面形成浮渣层,胶体的化学式:
您最近一年使用:0次
名校
解题方法
4 . 2019年诺贝尔化学奖颁给了日本吉野彰等三人,以表彰他们对锂离子电池研发的卓越贡献。工业中利用锂辉石(主要成分为 ,还含有
,还含有 、
、 、
、 等)制备钴酸锂(
等)制备钴酸锂( )的流程如图:
)的流程如图:

已知: ,
, ,
, 。
。
回答下列问题:
(1)锂辉石的主要成分为 ,其氧化物的形式为
,其氧化物的形式为___________ 。
(2)为提高“酸化焙烧”效率,常采取的措施是___________ 。
(3)向“浸出液”中加入 ,其目的是除去“酸化焙烧”中过量的硫酸,控制
,其目的是除去“酸化焙烧”中过量的硫酸,控制 使
使 完全沉淀,则
完全沉淀,则 至少为
至少为___________ (保留1位小数,已知:完全沉淀后离子浓度低于 )
)
(4)“滤渣II”的主要化学成分为___________ 。
(5)“沉锂”过程中加入的沉淀剂为饱和的___________ 溶液(填化学式);该过程所获得的“母液”中仍含有大量的 ,可将其加入到“
,可将其加入到“___________ ”步骤中。
(6) 与
与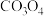 在敞口容器中高温下焙烧生成钴酸锂的化学方程式为
在敞口容器中高温下焙烧生成钴酸锂的化学方程式为___________ 。
 ,还含有
,还含有 、
、 、
、 等)制备钴酸锂(
等)制备钴酸锂( )的流程如图:
)的流程如图:
已知:
 ,
, ,
, 。
。回答下列问题:
(1)锂辉石的主要成分为
 ,其氧化物的形式为
,其氧化物的形式为(2)为提高“酸化焙烧”效率,常采取的措施是
(3)向“浸出液”中加入
 ,其目的是除去“酸化焙烧”中过量的硫酸,控制
,其目的是除去“酸化焙烧”中过量的硫酸,控制 使
使 完全沉淀,则
完全沉淀,则 至少为
至少为 )
)(4)“滤渣II”的主要化学成分为
(5)“沉锂”过程中加入的沉淀剂为饱和的
 ,可将其加入到“
,可将其加入到“(6)
 与
与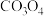 在敞口容器中高温下焙烧生成钴酸锂的化学方程式为
在敞口容器中高温下焙烧生成钴酸锂的化学方程式为
您最近一年使用:0次
2024-01-16更新
|
89次组卷
|
2卷引用:湖北省武汉市武钢三中2023-2024学年高二上学期12月月考化学试题
解题方法
5 . 钛是一种性能非常优越的金属,有着广泛的应用,有人说“21世纪将是钛的世纪”黄冈市有着储量可观的金红石(TiO2)矿,可作为钛冶炼的原料,但因选矿等原因,目前未大规模开发利用,故金红石矿的高效综合利用是黄冈市亟待攻克的重点课题。
Ⅰ.浮选是金红石选矿中常用的方法,油酸是浮选中良好的捕获剂和发泡剂。其原理为:金红石表面解离的Ti4+在水溶液中水解形成羟基化合物[Ti(OH)2]2+和[Ti(OH)3]+,络合在金红石表面成为浮选的活性点,再被油酸电离的C17H33COO-捕获,从而使金红石疏水上浮。
(1)油酸可由高级脂肪酸甘油酯制得,试写出三油酸甘油酯发生皂化反应的方程式_______ 。
(2)浮选时需控制pH在6~8之间,试分析其原因,pH过低时_______ ,pH过高时_______ 。
Ⅱ.经浮选后的金红石精矿粉(主要成分为TiO2,含有少量Al2O3、SiO2、FeO、Fe2O3等杂质)制备金属钛的工艺如下:
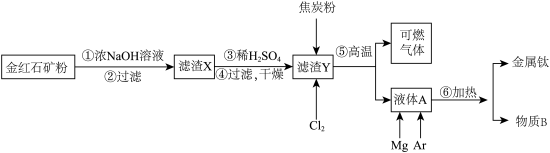
(3)操作①②的作用是_______ ,操作③④的作用是_______ 。
(4)过程⑤称为“碳氯化”,将钛由氧化物转化为氯化物,试写出该反应的化学方程式_______ 。
(5)物质B可以通过_______ (填工艺名称),实现物质循环利用。
(6)保持100 kPa下,将TiO2、C、Cl2以物质的量比1:2.2:2进行“碳氯化”反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
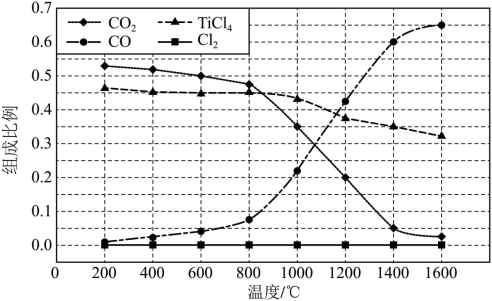
①反应C(s)+CO2(g) 2CO(g)的平衡常数Kp(1400℃)=
2CO(g)的平衡常数Kp(1400℃)=_______ 。
②图中显示,在200℃平衡时TiO2几乎完全转化为TiCl4,但实际生产中反应温度却远高于此温度,其原因_______ 。
Ⅰ.浮选是金红石选矿中常用的方法,油酸是浮选中良好的捕获剂和发泡剂。其原理为:金红石表面解离的Ti4+在水溶液中水解形成羟基化合物[Ti(OH)2]2+和[Ti(OH)3]+,络合在金红石表面成为浮选的活性点,再被油酸电离的C17H33COO-捕获,从而使金红石疏水上浮。
(1)油酸可由高级脂肪酸甘油酯制得,试写出三油酸甘油酯发生皂化反应的方程式
(2)浮选时需控制pH在6~8之间,试分析其原因,pH过低时
Ⅱ.经浮选后的金红石精矿粉(主要成分为TiO2,含有少量Al2O3、SiO2、FeO、Fe2O3等杂质)制备金属钛的工艺如下:

(3)操作①②的作用是
(4)过程⑤称为“碳氯化”,将钛由氧化物转化为氯化物,试写出该反应的化学方程式
(5)物质B可以通过
(6)保持100 kPa下,将TiO2、C、Cl2以物质的量比1:2.2:2进行“碳氯化”反应。体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。

①反应C(s)+CO2(g)
 2CO(g)的平衡常数Kp(1400℃)=
2CO(g)的平衡常数Kp(1400℃)=②图中显示,在200℃平衡时TiO2几乎完全转化为TiCl4,但实际生产中反应温度却远高于此温度,其原因
您最近一年使用:0次
名校
解题方法
6 . 过氧化氢(H2O2)是常用的绿色氧化剂。某化学兴趣小组查阅了H2O2的相关信息,并针对它的某些性质进行了探究,具体如下:H2O2可以通过H2和O2在某催化剂表面直接反应合成,具体原理如下图所示:

(1)采用同位素示踪法研究催化剂中H+的作用:将H2用D2(2H2)代替再进行实验。催化剂中氢离子参与反应的证据是生成的产物中有H2O2或_______ 粒子(填化学式)。
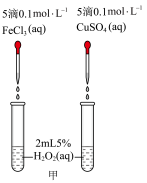
II.H2O2不稳定,在Fe3+、Cu2+等粒子的催化下会很快分解并放出热量。为了比较Fe3+和Cu2+对H2O2分解的催化效果,设计了如下实验。
(2)定性分析:通过观察甲装置两支试管中_______ 的现象,得出关于FeCl3和CuSO4催化效果的结论。某同学认为此方案还需要进一步控制变量,提出可将试剂CuSO4更换为_______ (填化学式)。
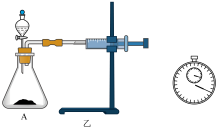
(3)定量测定:用乙装置进行定量实验。实验时组装好装置乙,关闭分液漏斗的活塞,将注射器活塞向外拉出一段距离后松开,观察活塞是否回到原来的位置。该操作的实验目的是_______ 。若反应30s后注射器中收集到气体的体积为VmL(标准状况),则锥形瓶A中实际产生气体的体积_______ VmL(填“>”、“<”或“=”)。
III.H2O2既有氧化性,又有还原性。
(4)H2O2可以氧化废水中的CN—,Cu2+可催化该反应。已知H2O2与CN—反应会生成参与大气循环的无毒气体。氰化氢(HCN)是一种易挥发的弱酸,有剧毒,对环境危害很大。
①H2O2与CN-的反应不能在酸性溶液中进行,原因是_______ ,反应生成气体的化学式为_______ 。
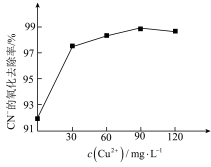
②一定条件下,测得CN-的氧化去除率随溶液中c(Cu2+)的变化如下图所示。c(Cu2+)过多时,CN-的氧化去除率有所下降,原因是_______ 。
(5)取少量84消毒液(有效成分为NaClO)于试管中,滴加H2O2溶液,产生大量无色气体。写出发生反应的化学方程式_______ 。

(1)采用同位素示踪法研究催化剂中H+的作用:将H2用D2(2H2)代替再进行实验。催化剂中氢离子参与反应的证据是生成的产物中有H2O2或
II.H2O2不稳定,在Fe3+、Cu2+等粒子的催化下会很快分解并放出热量。为了比较Fe3+和Cu2+对H2O2分解的催化效果,设计了如下实验。
(2)定性分析:通过观察甲装置两支试管中

(3)定量测定:用乙装置进行定量实验。实验时组装好装置乙,关闭分液漏斗的活塞,将注射器活塞向外拉出一段距离后松开,观察活塞是否回到原来的位置。该操作的实验目的是

III.H2O2既有氧化性,又有还原性。
(4)H2O2可以氧化废水中的CN—,Cu2+可催化该反应。已知H2O2与CN—反应会生成参与大气循环的无毒气体。氰化氢(HCN)是一种易挥发的弱酸,有剧毒,对环境危害很大。
①H2O2与CN-的反应不能在酸性溶液中进行,原因是
②一定条件下,测得CN-的氧化去除率随溶液中c(Cu2+)的变化如下图所示。c(Cu2+)过多时,CN-的氧化去除率有所下降,原因是

(5)取少量84消毒液(有效成分为NaClO)于试管中,滴加H2O2溶液,产生大量无色气体。写出发生反应的化学方程式
您最近一年使用:0次
7 . 烟气中的主要污染物是 、NO,工业上有多种烟气脱硫、脱硝的方法,具体如下:
、NO,工业上有多种烟气脱硫、脱硝的方法,具体如下:
Ⅰ.烟气经 预处理后用
预处理后用 水悬浮液吸收,可减少烟气中
水悬浮液吸收,可减少烟气中 、NO的含量。
、NO的含量。
 氧化烟气中
氧化烟气中 、
、 ,的主要反应的热化学方程式为:
,的主要反应的热化学方程式为:
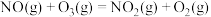
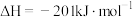
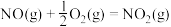
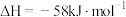
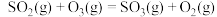
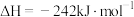
(1)反应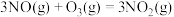 的
的
___________  。
。
(2)室温下,固定进入反应器的NO、 的物质的量,改变加入
的物质的量,改变加入 的物质的量,反应一段时间后体系中n(NO)、n(
的物质的量,反应一段时间后体系中n(NO)、n( )和n(
)和n( )随反应前n(
)随反应前n( ):n(NO)的变化见图:
):n(NO)的变化见图:
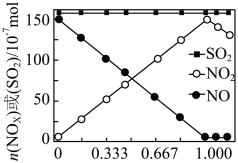
当n( ):n(NO)
):n(NO) 时,反应后
时,反应后 的物质的量减少,其原因是
的物质的量减少,其原因是___________ ;增加n( ),
), 氧化
氧化 的反应几乎不受影响,其可能原因是
的反应几乎不受影响,其可能原因是___________ 。
(3)当用 水悬浮液吸收经
水悬浮液吸收经 预处理的烟气时,清液(pH约为8)中
预处理的烟气时,清液(pH约为8)中 将
将 转化为
转化为 ,其离子方程式为
,其离子方程式为___________ 。
Ⅱ.NaClO溶液在不同温度下也可对烟气中的硫、硝脱除,一定时间内,其脱除率如下图所示。
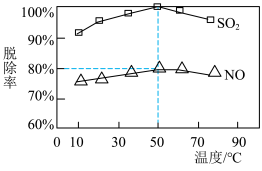
(4)烟气中 和NO体积比为2:1,烟气于50℃时的吸收液转化生成的n(
和NO体积比为2:1,烟气于50℃时的吸收液转化生成的n( ):n(
):n( )
)
___________ 。
Ⅲ.可利用CO为还原剂在催化剂作用下将NO脱除并转化为 和
和 。在一定温度下,向体积为1L的刚性容器中加入1.28 mol CO和1mol NO,发生的反应方程式如下:
。在一定温度下,向体积为1L的刚性容器中加入1.28 mol CO和1mol NO,发生的反应方程式如下:
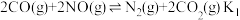

(5)下述情况能说明反应体系已达到平衡的是___________ 。
a.CO与NO转化率之比不再改变 b.混合气体的密度不再变化
c.混合气体的平均相对分子质量不变 d.v(CO):v( )
)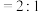
(6)若达到平衡时NO的转化率为80%, 的选择性为60%,则
的选择性为60%,则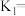
___________ 。( 的选择性
的选择性 )
)
 、NO,工业上有多种烟气脱硫、脱硝的方法,具体如下:
、NO,工业上有多种烟气脱硫、脱硝的方法,具体如下:Ⅰ.烟气经
 预处理后用
预处理后用 水悬浮液吸收,可减少烟气中
水悬浮液吸收,可减少烟气中 、NO的含量。
、NO的含量。 氧化烟气中
氧化烟气中 、
、 ,的主要反应的热化学方程式为:
,的主要反应的热化学方程式为: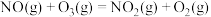
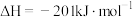
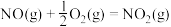
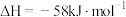
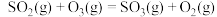
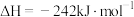
(1)反应
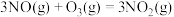 的
的
 。
。(2)室温下,固定进入反应器的NO、
 的物质的量,改变加入
的物质的量,改变加入 的物质的量,反应一段时间后体系中n(NO)、n(
的物质的量,反应一段时间后体系中n(NO)、n( )和n(
)和n( )随反应前n(
)随反应前n( ):n(NO)的变化见图:
):n(NO)的变化见图:
当n(
 ):n(NO)
):n(NO)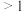 时,反应后
时,反应后 的物质的量减少,其原因是
的物质的量减少,其原因是 ),
), 氧化
氧化 的反应几乎不受影响,其可能原因是
的反应几乎不受影响,其可能原因是(3)当用
 水悬浮液吸收经
水悬浮液吸收经 预处理的烟气时,清液(pH约为8)中
预处理的烟气时,清液(pH约为8)中 将
将 转化为
转化为 ,其离子方程式为
,其离子方程式为Ⅱ.NaClO溶液在不同温度下也可对烟气中的硫、硝脱除,一定时间内,其脱除率如下图所示。

(4)烟气中
 和NO体积比为2:1,烟气于50℃时的吸收液转化生成的n(
和NO体积比为2:1,烟气于50℃时的吸收液转化生成的n( ):n(
):n( )
)
Ⅲ.可利用CO为还原剂在催化剂作用下将NO脱除并转化为
 和
和 。在一定温度下,向体积为1L的刚性容器中加入1.28 mol CO和1mol NO,发生的反应方程式如下:
。在一定温度下,向体积为1L的刚性容器中加入1.28 mol CO和1mol NO,发生的反应方程式如下: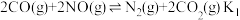

(5)下述情况能说明反应体系已达到平衡的是
a.CO与NO转化率之比不再改变 b.混合气体的密度不再变化
c.混合气体的平均相对分子质量不变 d.v(CO):v(
 )
)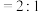
(6)若达到平衡时NO的转化率为80%,
 的选择性为60%,则
的选择性为60%,则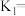
 的选择性
的选择性 )
)
您最近一年使用:0次
名校
8 . Ⅰ.常见元素A、B、M组成的四种物质发生反应:甲+乙=丙+丁,其中甲由A和M组成,乙由B和M组成,丙中只含有M。
(1)若甲为淡黄色固体,乙和丙均为常量下的无色无味气体。则甲的电子式为_______ ;丁溶于水时发生反应离子方程式为_______ 。
(2)若丁为能使品红褪色的无色气体,丙为常见红色金属,化合物甲、乙中原子个数比均为1:2(M均显+1价),原子序数B大于A。
①写出生成丙的化学方程式_______ 。
②向MCl2溶液中通入气体丁有白色沉淀(MCl)产生,该反应的离子方程式为_______ 。
Ⅱ.A、B、C、D均为中学化学中的常见物质,请根据题中信息回答下列问题:
(3)若它们存在如下反应转化关系:A+B→C+D+H2O(未配平,反应条件略去)。
①该转化关系中所涉及的反应为氧化还原反应。若C、D两种气体均能使澄清石灰水变浑浊,鉴别C、D两种气体不能选用下列试剂中的_______ (填写字母编号)。
A.Ba(OH)2溶液 B.酸性KMnO4溶液 C.紫色石蕊试液
D.H2O2与BaCl2混合液 E.酸化的Ba(NO3)2溶液
②该转化关系中所涉及的反应为非氧化还原反应。若A是造成温室效应的主要气体之一,C、D均为钠盐,D与B反应能转化为C.当参加反应的A、B物质的量之比为3:4时,则反应所得溶液中各种离子的浓度由大到小的顺序为_______ 。
③若该反应为氧化还原反应,A是一种气体,B、D溶液显碱性,且D溶液具有强氧化性,则在绿矾溶液中加入少量D溶液伴有红褐色沉淀,发生反应的离子方程式为_______ 。
(1)若甲为淡黄色固体,乙和丙均为常量下的无色无味气体。则甲的电子式为
(2)若丁为能使品红褪色的无色气体,丙为常见红色金属,化合物甲、乙中原子个数比均为1:2(M均显+1价),原子序数B大于A。
①写出生成丙的化学方程式
②向MCl2溶液中通入气体丁有白色沉淀(MCl)产生,该反应的离子方程式为
Ⅱ.A、B、C、D均为中学化学中的常见物质,请根据题中信息回答下列问题:
(3)若它们存在如下反应转化关系:A+B→C+D+H2O(未配平,反应条件略去)。
①该转化关系中所涉及的反应为氧化还原反应。若C、D两种气体均能使澄清石灰水变浑浊,鉴别C、D两种气体不能选用下列试剂中的
A.Ba(OH)2溶液 B.酸性KMnO4溶液 C.紫色石蕊试液
D.H2O2与BaCl2混合液 E.酸化的Ba(NO3)2溶液
②该转化关系中所涉及的反应为非氧化还原反应。若A是造成温室效应的主要气体之一,C、D均为钠盐,D与B反应能转化为C.当参加反应的A、B物质的量之比为3:4时,则反应所得溶液中各种离子的浓度由大到小的顺序为
③若该反应为氧化还原反应,A是一种气体,B、D溶液显碱性,且D溶液具有强氧化性,则在绿矾溶液中加入少量D溶液伴有红褐色沉淀,发生反应的离子方程式为
您最近一年使用:0次
名校
9 . 为消除燃煤烟气中含有的 、
、 ,研究者提出若干烟气“脱硫”“脱硝”的方法。
,研究者提出若干烟气“脱硫”“脱硝”的方法。
【方法一】以NaClO作为吸收剂进行一体化“脱硫”“脱硝”,将烟气中的 、NO转化为
、NO转化为 、
、 。
。
(1)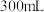

 溶液理论上最多能吸收标准状况下NO的体积为
溶液理论上最多能吸收标准状况下NO的体积为_______ L。
(2)实验室利用模拟烟气(模拟烟气中 和NO的物质的量之比为
和NO的物质的量之比为 )探究该方法“脱硫”“脱硝”的效果,一定时间内,温度对硫、硝脱除率的影响曲线如图所示。
)探究该方法“脱硫”“脱硝”的效果,一定时间内,温度对硫、硝脱除率的影响曲线如图所示。

①此方法“脱硫”“脱硝”探究实验的最佳温度为_______ ; 的脱除率高于
的脱除率高于 ,其原因除
,其原因除 的还原性比
的还原性比 强外,还可能是
强外,还可能是_______ 。
② 时,吸收液中烟气转化生成的
时,吸收液中烟气转化生成的 和
和 的物质的量之比为
的物质的量之比为_______ 。
【方法二】 技术(选择性催化还原氮氧化物)
技术(选择性催化还原氮氧化物)
研究表明,铁基催化剂在260~300℃范围内实现 技术的过程如图所示。
技术的过程如图所示。
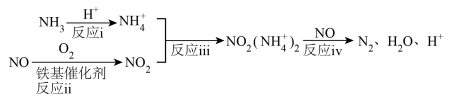
(3)根据上述机理, 在反应过程中的作用为
在反应过程中的作用为_______ ;等物质的量的 、
、 在有氧条件下转化为
在有氧条件下转化为 的总反应化学方程式为
的总反应化学方程式为_______ ;
(4)若使用锰基催化剂(活性物质为 )代替铁基催化剂,烟气中含有的
)代替铁基催化剂,烟气中含有的 会使催化剂失效而降低
会使催化剂失效而降低 脱除率,用化学方程式表示催化剂失效的原因:
脱除率,用化学方程式表示催化剂失效的原因:_______ 。
(5)向反应体系中添加 可显著提高
可显著提高 脱除率,原因是
脱除率,原因是 与
与 反应生成
反应生成 和阴离子M;阴离子M再与
和阴离子M;阴离子M再与 发生反应转化为
发生反应转化为 ,则阴离子M为
,则阴离子M为_______ 。
 、
、 ,研究者提出若干烟气“脱硫”“脱硝”的方法。
,研究者提出若干烟气“脱硫”“脱硝”的方法。【方法一】以NaClO作为吸收剂进行一体化“脱硫”“脱硝”,将烟气中的
 、NO转化为
、NO转化为 、
、 。
。(1)
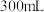

 溶液理论上最多能吸收标准状况下NO的体积为
溶液理论上最多能吸收标准状况下NO的体积为(2)实验室利用模拟烟气(模拟烟气中
 和NO的物质的量之比为
和NO的物质的量之比为 )探究该方法“脱硫”“脱硝”的效果,一定时间内,温度对硫、硝脱除率的影响曲线如图所示。
)探究该方法“脱硫”“脱硝”的效果,一定时间内,温度对硫、硝脱除率的影响曲线如图所示。
①此方法“脱硫”“脱硝”探究实验的最佳温度为
 的脱除率高于
的脱除率高于 ,其原因除
,其原因除 的还原性比
的还原性比 强外,还可能是
强外,还可能是②
 时,吸收液中烟气转化生成的
时,吸收液中烟气转化生成的 和
和 的物质的量之比为
的物质的量之比为【方法二】
 技术(选择性催化还原氮氧化物)
技术(选择性催化还原氮氧化物)研究表明,铁基催化剂在260~300℃范围内实现
 技术的过程如图所示。
技术的过程如图所示。
(3)根据上述机理,
 在反应过程中的作用为
在反应过程中的作用为 、
、 在有氧条件下转化为
在有氧条件下转化为 的总反应化学方程式为
的总反应化学方程式为(4)若使用锰基催化剂(活性物质为
 )代替铁基催化剂,烟气中含有的
)代替铁基催化剂,烟气中含有的 会使催化剂失效而降低
会使催化剂失效而降低 脱除率,用化学方程式表示催化剂失效的原因:
脱除率,用化学方程式表示催化剂失效的原因:(5)向反应体系中添加
 可显著提高
可显著提高 脱除率,原因是
脱除率,原因是 与
与 反应生成
反应生成 和阴离子M;阴离子M再与
和阴离子M;阴离子M再与 发生反应转化为
发生反应转化为 ,则阴离子M为
,则阴离子M为
您最近一年使用:0次
2022-11-19更新
|
208次组卷
|
2卷引用:湖北省部分学校2022-2023学年高三上学期11月月考化学试题
解题方法
10 . 近几年,我国汽车工业得到了飞速发展,新能源汽车走在世界前列。回答下列问题:
(1)庚烷是汽车燃料(汽油)的主要成分之一,1mol气态正庚烷(以 表示)完全燃烧生成二氧化碳和水蒸气放出4817kJ热量,该反应的热化学议程式为
表示)完全燃烧生成二氧化碳和水蒸气放出4817kJ热量,该反应的热化学议程式为_______ 。
(2)三种汽车燃料燃烧时的能量变化如下图所示。

根据图示,你认为_______ 作为汽车燃料最好,简述理由_______ (至少回答两点)
(3)在汽车排气管里安装三元催化剂,可有效降低汽车尾气中的CO和NO等污染气体的含量,写出汽车尾气中NO和CO反应的化学方程式:_______ 。
(4)汽车发生剧烈碰撞时,会引发汽车安全气囊中的物质迅速发生反应: ,气囊中产生大量的气体,从而保护驾车人员的安全。
,气囊中产生大量的气体,从而保护驾车人员的安全。
①反应中,每生成16molN2,转移的电子数为_______ 。
②反应中,氧化产物与还原产物的物质的量之比为_______ 。
(5)不使用汽油或柴油作为能源的汽车统称新能源汽车,一种新能源汽车使用的锂电池工作原理如下图,电池反应为: 。
。

①充电时,电解质溶液中的锂离子向电极_______ (填写“M”“N”)方向移动
②若放电时外电路有2NA电子转移,则理论上电极M的质量_______ (填序号)。
A.增重14g B.不变 C.减重14g D.无法确定
(1)庚烷是汽车燃料(汽油)的主要成分之一,1mol气态正庚烷(以
 表示)完全燃烧生成二氧化碳和水蒸气放出4817kJ热量,该反应的热化学议程式为
表示)完全燃烧生成二氧化碳和水蒸气放出4817kJ热量,该反应的热化学议程式为(2)三种汽车燃料燃烧时的能量变化如下图所示。

根据图示,你认为
(3)在汽车排气管里安装三元催化剂,可有效降低汽车尾气中的CO和NO等污染气体的含量,写出汽车尾气中NO和CO反应的化学方程式:
(4)汽车发生剧烈碰撞时,会引发汽车安全气囊中的物质迅速发生反应:
 ,气囊中产生大量的气体,从而保护驾车人员的安全。
,气囊中产生大量的气体,从而保护驾车人员的安全。①反应中,每生成16molN2,转移的电子数为
②反应中,氧化产物与还原产物的物质的量之比为
(5)不使用汽油或柴油作为能源的汽车统称新能源汽车,一种新能源汽车使用的锂电池工作原理如下图,电池反应为:
 。
。
①充电时,电解质溶液中的锂离子向电极
②若放电时外电路有2NA电子转移,则理论上电极M的质量
A.增重14g B.不变 C.减重14g D.无法确定
您最近一年使用:0次



