1 . 实验室模拟某含有机酸 工业废水的处理过程。
工业废水的处理过程。
 .利用
.利用 先与金属阳离子络合再被紫外光催化降解的方法去除
先与金属阳离子络合再被紫外光催化降解的方法去除 ,其机理如下:
,其机理如下:
(1) 和
和 发生络合反应生成有色物质:
发生络合反应生成有色物质:


①基态 的价电子排布式为
的价电子排布式为___________ 。
②下列有关上述络合反应的说法中,正确的有___________ (填标号)。
A.反应达平衡时,溶液的颜色不再变化
B.增大 浓度,逆反应速率减小
浓度,逆反应速率减小
C. 过低不利于
过低不利于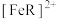 的生成
的生成
D.升高温度,该平衡正向移动
(2)紫外光催化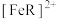 降解:
降解:
若有机酸为 ,则光催化降解反应的离子方程式为:
,则光催化降解反应的离子方程式为:___________ 。
 ___________
___________ ___________
___________ ___________
___________ ___________
___________
 .利用有机溶剂从废水中萃取
.利用有机溶剂从废水中萃取 的方法去除
的方法去除 。该过程涉及以下反应:
。该过程涉及以下反应:
(i)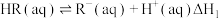
(ii)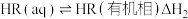
(iii)
(3)根据盖斯定律,反应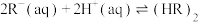 (有机相)的
(有机相)的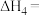
___________ 。
(4)水相的 以及体系温度
以及体系温度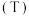 对
对 的平衡分配比
的平衡分配比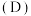 有影响。
有影响。
已知: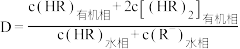 。
。
①常温下,配制体积相同、 不同、含
不同、含 粒子总浓度相同的系列溶液,分别加入等量有机溶剂萃取。测算并得到
粒子总浓度相同的系列溶液,分别加入等量有机溶剂萃取。测算并得到 随
随 变化的曲线如图所示。分析
变化的曲线如图所示。分析 随
随 升高而降低的原因
升高而降低的原因___________ 。 溶液
溶液 时,
时,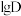 随
随 的变化曲线如图所示。
的变化曲线如图所示。 萃取宜在
萃取宜在___________ 温度下进行(填“较高”或“较低”)。
 经测定,在图中
经测定,在图中 点对应温度下,反应(ii)平衡常数
点对应温度下,反应(ii)平衡常数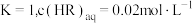 ,忽略水相中
,忽略水相中 的电离,则有机相中
的电离,则有机相中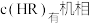
___________ 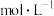 ;计算该温度下,反应(iii)的平衡常数
;计算该温度下,反应(iii)的平衡常数
___________ (写出计算过程)。
 工业废水的处理过程。
工业废水的处理过程。 .利用
.利用 先与金属阳离子络合再被紫外光催化降解的方法去除
先与金属阳离子络合再被紫外光催化降解的方法去除 ,其机理如下:
,其机理如下:(1)
 和
和 发生络合反应生成有色物质:
发生络合反应生成有色物质:

①基态
 的价电子排布式为
的价电子排布式为②下列有关上述络合反应的说法中,正确的有
A.反应达平衡时,溶液的颜色不再变化
B.增大
 浓度,逆反应速率减小
浓度,逆反应速率减小C.
 过低不利于
过低不利于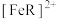 的生成
的生成 D.升高温度,该平衡正向移动
(2)紫外光催化
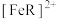 降解:
降解:若有机酸为
 ,则光催化降解反应的离子方程式为:
,则光催化降解反应的离子方程式为: ___________
___________ ___________
___________ ___________
___________ ___________
___________
 .利用有机溶剂从废水中萃取
.利用有机溶剂从废水中萃取 的方法去除
的方法去除 。该过程涉及以下反应:
。该过程涉及以下反应:(i)
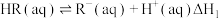
(ii)
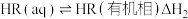
(iii)

(3)根据盖斯定律,反应
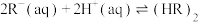 (有机相)的
(有机相)的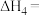
(4)水相的
 以及体系温度
以及体系温度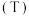 对
对 的平衡分配比
的平衡分配比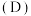 有影响。
有影响。已知:
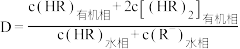 。
。①常温下,配制体积相同、
 不同、含
不同、含 粒子总浓度相同的系列溶液,分别加入等量有机溶剂萃取。测算并得到
粒子总浓度相同的系列溶液,分别加入等量有机溶剂萃取。测算并得到 随
随 变化的曲线如图所示。分析
变化的曲线如图所示。分析 随
随 升高而降低的原因
升高而降低的原因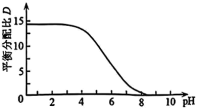
 溶液
溶液 时,
时,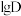 随
随 的变化曲线如图所示。
的变化曲线如图所示。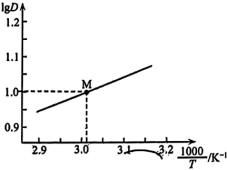
 萃取宜在
萃取宜在 经测定,在图中
经测定,在图中 点对应温度下,反应(ii)平衡常数
点对应温度下,反应(ii)平衡常数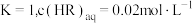 ,忽略水相中
,忽略水相中 的电离,则有机相中
的电离,则有机相中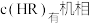
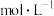 ;计算该温度下,反应(iii)的平衡常数
;计算该温度下,反应(iii)的平衡常数
您最近一年使用:0次
名校
解题方法
2 . 铬及其化合物在催化、金属防腐等方面具有重要应用。
(1)催化剂Cr2O3可由(NH4)2Cr2O7加热分解制备,反应同时生成无污染气体。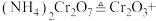
_______ +_______ 。
②Cr2O3催化丙烷脱氢过程中,部分反应历程如图, 过程的焓变为
过程的焓变为___________ (列式表示)。
③Cr2O3可用于NH3的催化氧化。设计从NH3出发经过3步反应制备HNO3的路线__________________ (用“→”表示含氮物质间的转化);其中一个有颜色变化的反应的化学方程式为____________ 。
(2) 溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
(ⅰ)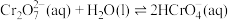
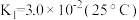
(ⅱ)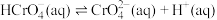

 溶液的说法正确的有
溶液的说法正确的有_______ 。
A.加入少量硫酸,溶液的pH不变
B.加入少量水稀释,溶液中离子总数增加
C.加入少量NaOH溶液,反应(ⅰ)的平衡逆向移动
D.加入少量K2Cr2O7固体,平衡时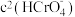 与
与 的比值保持不变
的比值保持不变
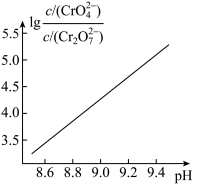
②25℃时,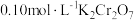 溶液中
溶液中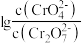 随pH的变化关系如图。当
随pH的变化关系如图。当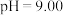 时,设
时,设 、
、 与
与 的平衡浓度分别为x、y、z mol/L,则x、y、z之间的关系式为
的平衡浓度分别为x、y、z mol/L,则x、y、z之间的关系式为____________  ;计算溶液中
;计算溶液中 的平衡浓度
的平衡浓度__________ (写出计算过程,结果保留两位有效数字)。
(1)催化剂Cr2O3可由(NH4)2Cr2O7加热分解制备,反应同时生成无污染气体。
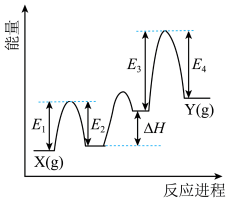
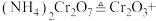
②Cr2O3催化丙烷脱氢过程中,部分反应历程如图,
 过程的焓变为
过程的焓变为③Cr2O3可用于NH3的催化氧化。设计从NH3出发经过3步反应制备HNO3的路线
(2)
 溶液中存在多个平衡。本题条件下仅需考虑如下平衡:
溶液中存在多个平衡。本题条件下仅需考虑如下平衡:(ⅰ)
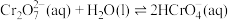
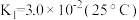
(ⅱ)
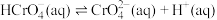

 溶液的说法正确的有
溶液的说法正确的有A.加入少量硫酸,溶液的pH不变
B.加入少量水稀释,溶液中离子总数增加
C.加入少量NaOH溶液,反应(ⅰ)的平衡逆向移动
D.加入少量K2Cr2O7固体,平衡时
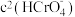 与
与 的比值保持不变
的比值保持不变②25℃时,
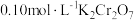 溶液中
溶液中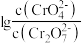 随pH的变化关系如图。当
随pH的变化关系如图。当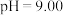 时,设
时,设 、
、 与
与 的平衡浓度分别为x、y、z mol/L,则x、y、z之间的关系式为
的平衡浓度分别为x、y、z mol/L,则x、y、z之间的关系式为 ;计算溶液中
;计算溶液中 的平衡浓度
的平衡浓度
您最近一年使用:0次
名校
解题方法
3 . 过氧化氢是重要的化工产品,广泛应用于绿色化学合成,医疗消毒等领域。
(1) 的
的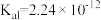 ,
, 的酸性
的酸性___________  (填“>”、“<”或“=”;研究表明,过氧化氢溶液中
(填“>”、“<”或“=”;研究表明,过氧化氢溶液中 的浓度越大,
的浓度越大, 的分解速率越快。常温下,一定浓度的
的分解速率越快。常温下,一定浓度的 ,若
,若 增大,则
增大,则 分解速率增大,原因是
分解速率增大,原因是___________ 。
(2)早期制备方法:
①II为可逆反应,促进该反应正向进行的措施是___________ 。(写一条)
②Ⅲ中生成 ,反应的化学方程式是
,反应的化学方程式是___________ 。
(3) 可对烟气中
可对烟气中 、
、 进行协同脱除。
进行协同脱除。
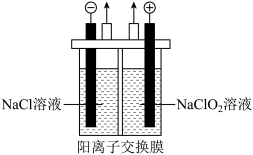
①电解 溶液制备
溶液制备 气体的装置如图所示。
气体的装置如图所示。 通过阳离子交换膜向阴极室迁移,电解时阴极的电极反应为
通过阳离子交换膜向阴极室迁移,电解时阴极的电极反应为___________ 。
②保持其他条件不变,调节烟气中 初始浓度,将烟气按一定流速通入反应器与
初始浓度,将烟气按一定流速通入反应器与 反应,测得
反应,测得 、
、 氧化率随
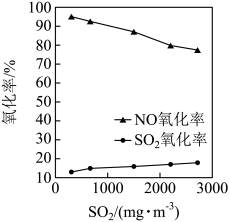
氧化率随 初始浓度的变化如图所示。
初始浓度的变化如图所示。 氧化率始终低于NO氧化率的原因可能是
氧化率始终低于NO氧化率的原因可能是________ 。
(4)甲醇( )是重要的化工原料及能源物质,如图是甲醇燃料电池工作原理示意图。
)是重要的化工原料及能源物质,如图是甲醇燃料电池工作原理示意图。
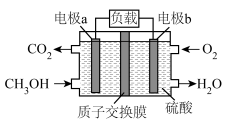
①a电极是电池的___________ (填“正”或“负”)极。
②b电极的电极反应式为___________ 。
(5)现有25℃时等浓度的5种溶液:A. ;B.
;B. ;C.
;C. ;D.
;D.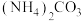 ;E.
;E. ,这5种溶液中
,这5种溶液中 浓度由大到小的顺序排列是:
浓度由大到小的顺序排列是:___________ (填字母)。
(1)
 的
的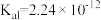 ,
, 的酸性
的酸性 (填“>”、“<”或“=”;研究表明,过氧化氢溶液中
(填“>”、“<”或“=”;研究表明,过氧化氢溶液中 的浓度越大,
的浓度越大, 的分解速率越快。常温下,一定浓度的
的分解速率越快。常温下,一定浓度的 ,若
,若 增大,则
增大,则 分解速率增大,原因是
分解速率增大,原因是(2)早期制备方法:

①II为可逆反应,促进该反应正向进行的措施是
②Ⅲ中生成
 ,反应的化学方程式是
,反应的化学方程式是(3)
 可对烟气中
可对烟气中 、
、 进行协同脱除。
进行协同脱除。①电解
 溶液制备
溶液制备 气体的装置如图所示。
气体的装置如图所示。 通过阳离子交换膜向阴极室迁移,电解时阴极的电极反应为
通过阳离子交换膜向阴极室迁移,电解时阴极的电极反应为
②保持其他条件不变,调节烟气中
 初始浓度,将烟气按一定流速通入反应器与
初始浓度,将烟气按一定流速通入反应器与 反应,测得
反应,测得 、
、 氧化率随
氧化率随 初始浓度的变化如图所示。
初始浓度的变化如图所示。 氧化率始终低于NO氧化率的原因可能是
氧化率始终低于NO氧化率的原因可能是
(4)甲醇(
 )是重要的化工原料及能源物质,如图是甲醇燃料电池工作原理示意图。
)是重要的化工原料及能源物质,如图是甲醇燃料电池工作原理示意图。
①a电极是电池的
②b电极的电极反应式为
(5)现有25℃时等浓度的5种溶液:A.
 ;B.
;B. ;C.
;C. ;D.
;D.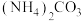 ;E.
;E. ,这5种溶液中
,这5种溶液中 浓度由大到小的顺序排列是:
浓度由大到小的顺序排列是:
您最近一年使用:0次
名校
解题方法
4 . 回答下列问题
(1)工业制胆矾时,将粗制 粉末(含
粉末(含 、
、 杂质)慢慢加入适量的稀
杂质)慢慢加入适量的稀 中完全溶解,除去杂质离子后,再经过一系列操作可得纯净的胆矾晶体。
中完全溶解,除去杂质离子后,再经过一系列操作可得纯净的胆矾晶体。
已知: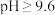 时,
时, 以
以 的形式完全沉淀:
的形式完全沉淀: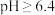 时,
时, 以
以 的形式完全沉淀:
的形式完全沉淀: 接近4时,
接近4时, 以
以 的形式完全沉淀.回答下列问题:
的形式完全沉淀.回答下列问题:
①为除去 ,可先加入
,可先加入________ ,(填编号)将 氧化为
氧化为 ,反应的离子方程式为
,反应的离子方程式为________________ ,后加入适当的________ (填编号)调节溶液的 使
使 沉淀。
沉淀。
A. B.
B. C.
C. D.
D.
②甲同学怀疑调整溶液 接近4是否能达到除去
接近4是否能达到除去 而不损失
而不损失 的目的,已知,常温下
的目的,已知,常温下 的溶度积
的溶度积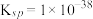 ,
, 的溶度积
的溶度积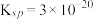 ,设溶液中
,设溶液中 的浓度为
的浓度为 ,则
,则 开始沉淀时溶液的
开始沉淀时溶液的 为
为________ , 完全沉淀时溶液的的
完全沉淀时溶液的的 为
为________ ,通过计算确定上述方案________ (填“可行”或“不可行”).
③ ,
, 溶液中由水电离出的
溶液中由水电离出的 是
是________ 。
(2)SOCl2是一种液态化合物,将其滴入水中,反应剧烈,液面上有白雾形成,并有带刺激性气味气体逸出,该气体可使品红溶液褪色。
①根据实验现象,写出SOCl2和H2O反应的化学方程式:________________ 。
②利用SOCl2和AlCl3•6H2O混合共热可制备无水AlCl3,试解释原因________________ 。
(1)工业制胆矾时,将粗制
 粉末(含
粉末(含 、
、 杂质)慢慢加入适量的稀
杂质)慢慢加入适量的稀 中完全溶解,除去杂质离子后,再经过一系列操作可得纯净的胆矾晶体。
中完全溶解,除去杂质离子后,再经过一系列操作可得纯净的胆矾晶体。已知:
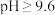 时,
时, 以
以 的形式完全沉淀:
的形式完全沉淀: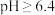 时,
时, 以
以 的形式完全沉淀:
的形式完全沉淀: 接近4时,
接近4时, 以
以 的形式完全沉淀.回答下列问题:
的形式完全沉淀.回答下列问题:①为除去
 ,可先加入
,可先加入 氧化为
氧化为 ,反应的离子方程式为
,反应的离子方程式为 使
使 沉淀。
沉淀。A.
 B.
B. C.
C. D.
D.
②甲同学怀疑调整溶液
 接近4是否能达到除去
接近4是否能达到除去 而不损失
而不损失 的目的,已知,常温下
的目的,已知,常温下 的溶度积
的溶度积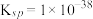 ,
, 的溶度积
的溶度积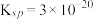 ,设溶液中
,设溶液中 的浓度为
的浓度为 ,则
,则 开始沉淀时溶液的
开始沉淀时溶液的 为
为 完全沉淀时溶液的的
完全沉淀时溶液的的 为
为③
 ,
, 溶液中由水电离出的
溶液中由水电离出的 是
是(2)SOCl2是一种液态化合物,将其滴入水中,反应剧烈,液面上有白雾形成,并有带刺激性气味气体逸出,该气体可使品红溶液褪色。
①根据实验现象,写出SOCl2和H2O反应的化学方程式:
②利用SOCl2和AlCl3•6H2O混合共热可制备无水AlCl3,试解释原因
您最近一年使用:0次
名校
5 . R是一种亲氯有机物,属于非电解质,易溶于水,在含 的溶液中能发生反应:
的溶液中能发生反应:
反应Ⅰ: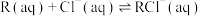
反应Ⅱ: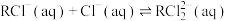
已知氯的氧化物对应水化物中,只有 和
和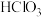 是强酸,回答下列问题:
是强酸,回答下列问题:
(1) 的还原性比
的还原性比 强,能被酸性氯酸钾氧化,完成反应的离子方程式:
强,能被酸性氯酸钾氧化,完成反应的离子方程式:
______ 
(2)向R溶液中加入适量NaCl,充分反应后:写出反应I平衡常数的表达式KⅠ=______ 。常温下,稀释该溶液,稀释过程中平衡常数KⅠ的值______ (填“变大”、“变小”或“不变”)。下列情况能说明反应Ⅰ和反应Ⅱ均已达到平衡状态的是______ (填正确答案的编号)
A.溶液中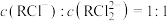
B.容器中生成一个R分子的同时生成一个
C.溶液中 不再发生变化
不再发生变化
D.反应Ⅰ生成 的速率与反应Ⅱ消耗
的速率与反应Ⅱ消耗 的速率相等
的速率相等
(3)常温下,向NaCl溶液中加入R,15s后测得 ,
,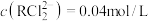 。
。
①有同学发现达到平衡前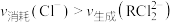 ,原因是
,原因是______ 。
②计算0~15s内, 的平均消耗速率
的平均消耗速率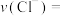
______ (在答题卷方框内写出计算过程)
(4)室温下,向 初始浓度
初始浓度 的NaCl溶液中加入不同量的R,用数据传感器测得平衡时各物种
的NaCl溶液中加入不同量的R,用数据传感器测得平衡时各物种 随
随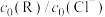 的数据记录如下表(b和d代表数字,忽略溶液体积变化):
的数据记录如下表(b和d代表数字,忽略溶液体积变化):
①根据表中数据分析d=______ 。
② 时,R的转化率为
时,R的转化率为______ 。
 的溶液中能发生反应:
的溶液中能发生反应:反应Ⅰ:
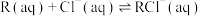
反应Ⅱ:
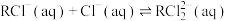
已知氯的氧化物对应水化物中,只有
 和
和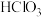 是强酸,回答下列问题:
是强酸,回答下列问题:(1)
 的还原性比
的还原性比 强,能被酸性氯酸钾氧化,完成反应的离子方程式:
强,能被酸性氯酸钾氧化,完成反应的离子方程式:

(2)向R溶液中加入适量NaCl,充分反应后:写出反应I平衡常数的表达式KⅠ=
A.溶液中
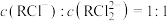
B.容器中生成一个R分子的同时生成一个

C.溶液中
 不再发生变化
不再发生变化D.反应Ⅰ生成
 的速率与反应Ⅱ消耗
的速率与反应Ⅱ消耗 的速率相等
的速率相等(3)常温下,向NaCl溶液中加入R,15s后测得
 ,
, 。
。①有同学发现达到平衡前
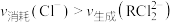 ,原因是
,原因是②计算0~15s内,
 的平均消耗速率
的平均消耗速率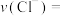
(4)室温下,向
 初始浓度
初始浓度 的NaCl溶液中加入不同量的R,用数据传感器测得平衡时各物种
的NaCl溶液中加入不同量的R,用数据传感器测得平衡时各物种 随
随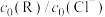 的数据记录如下表(b和d代表数字,忽略溶液体积变化):
的数据记录如下表(b和d代表数字,忽略溶液体积变化):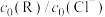 | 0 | 0.25 | 0.50 | 0.75 | 1.00 | |
 |  | 1.00 | 0.80 | 0.64 | 0.54 | 0.46 |
 | 0 | 0.08 | 0.16 | 0.22 | 0.28 | |
 | 0 | 0.06 | b | d | 0.13 | |
②
 时,R的转化率为
时,R的转化率为
您最近一年使用:0次
名校
解题方法
6 . 硫酸锰(MnSO4•H2O)是一种粉色晶体,易溶于水,不溶于乙醇,是重要的微量元素肥料之一,工业上由天然二氧化锰与硫化锰矿(还含Fe、Al、Mg、Si等元素的氧化物)制备硫酸锰的工艺如图所示。回答下列问题:
②相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如表:
(1)“溶浸”前需将矿石研成粉末,其目的是_______ 。“滤渣1”中含有S和_______ ;“溶浸”时两种含锰化合物与H2SO4反应的化学方程式为_______ 。
(2)“氧化”时添加适量的MnO2的作用是_______ (用离子方程式表示),若省略“氧化”步骤,造成的后果是_______ 。
(3)加入MnF2的目的是_______ 。
(4)滤液经过_______ (写操作A的名称),可得到粉红色MnSO4•H2O晶体。
(5)构想某锂电池的负极材料晶体是锂原子嵌入石墨烯层间,晶体结构如图。_______ 。
②如图晶体的化学式为_______ ;该晶体中最近的两个碳原子核间距离为142pm,石墨烯层间距离为335pm,则该晶体的密度为_______ g•cm-3(用NA表示阿伏加德罗常数,列式即可)。
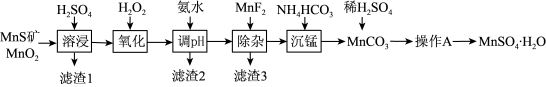
②相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如表:
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ |
| 开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 |
| 沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 |
(1)“溶浸”前需将矿石研成粉末,其目的是
(2)“氧化”时添加适量的MnO2的作用是
(3)加入MnF2的目的是
(4)滤液经过
(5)构想某锂电池的负极材料晶体是锂原子嵌入石墨烯层间,晶体结构如图。
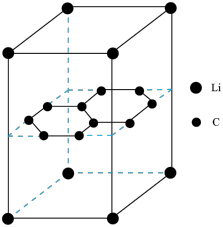
②如图晶体的化学式为
您最近一年使用:0次
7 . 阅读下面一段材料并回答问题。
(1) 中铁元素的化合价为
中铁元素的化合价为___________ 。
(2)制备 需要在
需要在___________ (填“酸性”、“碱性”或“中性”)环境中进行。
(3)下列关于 的说法中,不正确的是
的说法中,不正确的是___________ 。
a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(4)高铁酸钠 是一种新型的净水剂,可以通过氢氧化铁、氢氧化钠与次氯酸钠反应制得。
是一种新型的净水剂,可以通过氢氧化铁、氢氧化钠与次氯酸钠反应制得。
①请写出制取 的化学方程式
的化学方程式___________ 。
②该反应中氧化剂是___________ (用化学式表示,下同),___________ 元素被氧化,还原产物为___________ 。
(5)请将 与水反应的化学方程式补充完整:
与水反应的化学方程式补充完整:___________ 。

| 高铁酸钾使用说明书 【化学式】  【性状】暗紫色具有金属光泽的粉末,无臭无味 【产品特点】干燥品在室温下稳定,在强碱溶液中稳定,随着pH减小,稳定性下降,与水反应放出氧气  通过强烈的氧化作用可迅速杀灭细菌有消毒作用,同时不会产生有害物质。 通过强烈的氧化作用可迅速杀灭细菌有消毒作用,同时不会产生有害物质。 与水反应还能产生具有强吸附性的 与水反应还能产生具有强吸附性的 胶体,可除去水中细微的悬浮物,有净水作用 胶体,可除去水中细微的悬浮物,有净水作用【用途】主要用于饮用水消毒净化、城市生活污水和工业污水处理 【用量】消毒净化1L水投放: 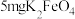 ,即可达到卫生标准 ,即可达到卫生标准 |
 中铁元素的化合价为
中铁元素的化合价为(2)制备
 需要在
需要在(3)下列关于
 的说法中,不正确的是
的说法中,不正确的是a.是强氧化性的盐 b.固体保存需要防潮
c.其消毒和净化水的原理相同 d.其净水优点有:作用快、安全性好、无异味
(4)高铁酸钠
 是一种新型的净水剂,可以通过氢氧化铁、氢氧化钠与次氯酸钠反应制得。
是一种新型的净水剂,可以通过氢氧化铁、氢氧化钠与次氯酸钠反应制得。①请写出制取
 的化学方程式
的化学方程式②该反应中氧化剂是
(5)请将
 与水反应的化学方程式补充完整:
与水反应的化学方程式补充完整:
您最近一年使用:0次
名校
8 . 回答下列问题:
(1)已知CuO具有氧化性,能够和氨气反应生成两种单质和一种生活中常见的化合物,请写出在加热条件下CuO和 反应的化学方程式:
反应的化学方程式:_______ 。
(2)在一定条件下, 和
和 可发生反应:
可发生反应: ,在上述过程中
,在上述过程中 被
被_______ (填“氧化”或“还原”), 中R的化合价是
中R的化合价是_______ 价。
(3)某一反应体系有反应物和生成物共五种物质: 、
、 、
、 、
、 、
、 已知该反应中
已知该反应中 只发生过程:
只发生过程: 。
。
①该反应中的氧化剂是_______ (填化学式,下同)
②该反应中,发生还原反应的过程是:_______ →_______ 。
(4) ,用双线桥表示反应电子转移方向和数目
,用双线桥表示反应电子转移方向和数目_______ 。
(1)已知CuO具有氧化性,能够和氨气反应生成两种单质和一种生活中常见的化合物,请写出在加热条件下CuO和
 反应的化学方程式:
反应的化学方程式:(2)在一定条件下,
 和
和 可发生反应:
可发生反应: ,在上述过程中
,在上述过程中 被
被 中R的化合价是
中R的化合价是(3)某一反应体系有反应物和生成物共五种物质:
 、
、 、
、 、
、 、
、 已知该反应中
已知该反应中 只发生过程:
只发生过程: 。
。①该反应中的氧化剂是
②该反应中,发生还原反应的过程是:
(4)
 ,用双线桥表示反应电子转移方向和数目
,用双线桥表示反应电子转移方向和数目
您最近一年使用:0次
名校
9 . 研究大气中含硫化合物(主要是 和
和 )的转化具有重要意义。
)的转化具有重要意义。
(1)工业上采用高温热分解 的方法制取
的方法制取 ,在膜反应器中分离
,在膜反应器中分离 ,发生的反应为
,发生的反应为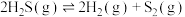

已知:①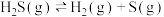
 ;②
;②

则
_____ (用含 、
、 的式子表示)。
的式子表示)。
(2)土壤中的微生物可将大气中的 经两步反应氧化成
经两步反应氧化成 ,两步反应的能量变化示意图如下:
,两步反应的能量变化示意图如下:
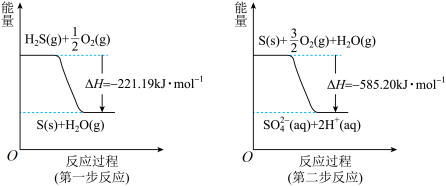
则

_____ 。1mol 全部被氧化为
全部被氧化为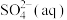 的热化学方程式为
的热化学方程式为_____ 。
(3)将 和空气的混合气体通入
和空气的混合气体通入 、
、 、
、 的混合溶液中反应回收S,其物质转化如图所示。
的混合溶液中反应回收S,其物质转化如图所示。
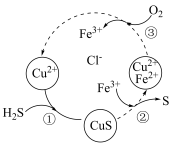
①该循环过程中 的作用是
的作用是_____ ,图示总反应的化学方程式为_____ 。
②已知反应③生成1mol 时放出akJ热量,则反应③中转移
时放出akJ热量,则反应③中转移 个电子时,放出
个电子时,放出_____ kJ热量。(用含a的式子表示)
 和
和 )的转化具有重要意义。
)的转化具有重要意义。(1)工业上采用高温热分解
 的方法制取
的方法制取 ,在膜反应器中分离
,在膜反应器中分离 ,发生的反应为
,发生的反应为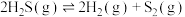

已知:①
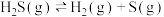
 ;②
;②

则

 、
、 的式子表示)。
的式子表示)。(2)土壤中的微生物可将大气中的
 经两步反应氧化成
经两步反应氧化成 ,两步反应的能量变化示意图如下:
,两步反应的能量变化示意图如下:
则


 全部被氧化为
全部被氧化为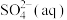 的热化学方程式为
的热化学方程式为(3)将
 和空气的混合气体通入
和空气的混合气体通入 、
、 、
、 的混合溶液中反应回收S,其物质转化如图所示。
的混合溶液中反应回收S,其物质转化如图所示。
①该循环过程中
 的作用是
的作用是②已知反应③生成1mol
 时放出akJ热量,则反应③中转移
时放出akJ热量,则反应③中转移 个电子时,放出
个电子时,放出
您最近一年使用:0次
2023-11-23更新
|
104次组卷
|
2卷引用:广东省广州市六校联考2023-2024学年高二上学期11月期中化学试题
解题方法
10 . 铵态氮肥的过度使用会导致水体的富营养化。氨氮( 和
和 )废水处理方法有化学法、离子交换法、生物法。回答下列问题:
)废水处理方法有化学法、离子交换法、生物法。回答下列问题:
(1)化学法可以用NaClO处理氨氮废水,NaClO和水中溶解的 反应得到无毒无害的物质,反应的离子方程式为:
反应得到无毒无害的物质,反应的离子方程式为: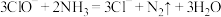 。该反应氧化剂与还原剂物质的量之比为
。该反应氧化剂与还原剂物质的量之比为___________ 。
(2)现探究化学法去除溶液中氨氮的最适宜条件。实验测定氨氮脱除率受溶液pH和 投料比例的影响。
投料比例的影响。
已知:
下表是不同pH下的氨氮脱除率:
下图是在最佳pH条件下, 投料比例不同的情况下的氨氮脱除率:
投料比例不同的情况下的氨氮脱除率:
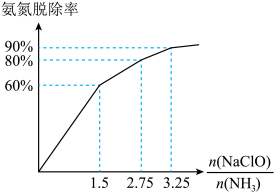
①由上述信息判断,反应的最佳pH范围是___________ ,最佳 投料比是
投料比是___________ 。
②实验测定在某酸性条件下, 投料比例3:2时,氨氮脱除率只有50%。从氧化还原反应的角度分析可能的原因
投料比例3:2时,氨氮脱除率只有50%。从氧化还原反应的角度分析可能的原因___________ 。
(3)离子交换法是利用 交换树脂,将氨氮废水中的
交换树脂,将氨氮废水中的 转化为
转化为 。用NaR表示
。用NaR表示 交换树脂。写出用离子交换树脂处理氨氮废水的离子方程式:
交换树脂。写出用离子交换树脂处理氨氮废水的离子方程式:___________ 。
(4)生物方法是利用硝化细菌,将土壤中的 转化为
转化为 后,土壤中的
后,土壤中的 进一步将
进一步将 氧化为
氧化为 。在氧气较少的环境下,
。在氧气较少的环境下, 又可以在反硝化细菌的作用下与
又可以在反硝化细菌的作用下与 反应,使氮以
反应,使氮以 形式放出。
形式放出。
①氧气与 反应时,反应物
反应时,反应物 与
与 的物质的量之比为
的物质的量之比为___________ 。
②写出 与
与 作用生成
作用生成 的离子方程式:
的离子方程式:___________ 。
 和
和 )废水处理方法有化学法、离子交换法、生物法。回答下列问题:
)废水处理方法有化学法、离子交换法、生物法。回答下列问题:(1)化学法可以用NaClO处理氨氮废水,NaClO和水中溶解的
 反应得到无毒无害的物质,反应的离子方程式为:
反应得到无毒无害的物质,反应的离子方程式为: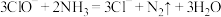 。该反应氧化剂与还原剂物质的量之比为
。该反应氧化剂与还原剂物质的量之比为(2)现探究化学法去除溶液中氨氮的最适宜条件。实验测定氨氮脱除率受溶液pH和
 投料比例的影响。
投料比例的影响。已知:

下表是不同pH下的氨氮脱除率:
| pH | 反应前氨元素质量 | 反应后氮元素质量 | 氨氮脱除率 |
| 5.8 | 49.3 | 24.11 | 51.1% |
| 6.9 | 49.3 | 19.08 | 61.3% |
| 7.7 | 49.3 | 16.86 | 65.8% |
| 8.8 | 49.3 | 18.88 | 61.7% |
| 9.3 | 49.3 | 25.29 | x |
 投料比例不同的情况下的氨氮脱除率:
投料比例不同的情况下的氨氮脱除率:
①由上述信息判断,反应的最佳pH范围是
 投料比是
投料比是②实验测定在某酸性条件下,
 投料比例3:2时,氨氮脱除率只有50%。从氧化还原反应的角度分析可能的原因
投料比例3:2时,氨氮脱除率只有50%。从氧化还原反应的角度分析可能的原因(3)离子交换法是利用
 交换树脂,将氨氮废水中的
交换树脂,将氨氮废水中的 转化为
转化为 。用NaR表示
。用NaR表示 交换树脂。写出用离子交换树脂处理氨氮废水的离子方程式:
交换树脂。写出用离子交换树脂处理氨氮废水的离子方程式:(4)生物方法是利用硝化细菌,将土壤中的
 转化为
转化为 后,土壤中的
后,土壤中的 进一步将
进一步将 氧化为
氧化为 。在氧气较少的环境下,
。在氧气较少的环境下, 又可以在反硝化细菌的作用下与
又可以在反硝化细菌的作用下与 反应,使氮以
反应,使氮以 形式放出。
形式放出。①氧气与
 反应时,反应物
反应时,反应物 与
与 的物质的量之比为
的物质的量之比为②写出
 与
与 作用生成
作用生成 的离子方程式:
的离子方程式:
您最近一年使用:0次



