研究 、
、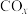 的消除和再利用对改善生态环境、促进低碳社会的构建和环境保护,构建生态文明具有重要的意义。
的消除和再利用对改善生态环境、促进低碳社会的构建和环境保护,构建生态文明具有重要的意义。
(1)采用 作还原剂催化还原
作还原剂催化还原 可以消除氮氧化物的污染。烟气以一定的流速通过催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物的转化率),反应原理为:
可以消除氮氧化物的污染。烟气以一定的流速通过催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物的转化率),反应原理为: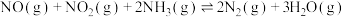 。以下说法正确的是______。
。以下说法正确的是______。
(2)CO与NO在Rh催化剂上的氧化还原反应是控制汽车尾气对空气污染的关键反应用Rh做催化剂时该反应的过程示意图如图所示:__________ 。(填“极性键”、“非极性键”或“极性键和非极性键”)。过程Ⅱ为__________ 过程(填“吸热”或“放热”)。
②已知过程Ⅰ的焓变为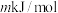 ,过程Ⅱ的焓变为
,过程Ⅱ的焓变为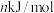 ,则该反应的热化学方程式为:
,则该反应的热化学方程式为:__________ 。
(3) 催化还原NO的物质转化如图所示。若参与反应的
催化还原NO的物质转化如图所示。若参与反应的 和
和 的物质的量之比为4∶1,则转化时
的物质的量之比为4∶1,则转化时 和NO物质的量之比为:
和NO物质的量之比为:__________ 。其中__________ 是催化剂(填化学符号)。______ (填选项)。(A.化学能转化为电能 B.电能转化为化学能),石墨Ⅰ是该电化学装置的______ (填选项)(A.正极 B.负极)石墨Ⅰ电极上发生的电极反应为__________ (提醒:介质为熔融 )。相同条件下,放电过程中消耗的
)。相同条件下,放电过程中消耗的 和
和 的体积比为
的体积比为__________ 。
 、
、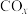 的消除和再利用对改善生态环境、促进低碳社会的构建和环境保护,构建生态文明具有重要的意义。
的消除和再利用对改善生态环境、促进低碳社会的构建和环境保护,构建生态文明具有重要的意义。(1)采用
 作还原剂催化还原
作还原剂催化还原 可以消除氮氧化物的污染。烟气以一定的流速通过催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物的转化率),反应原理为:
可以消除氮氧化物的污染。烟气以一定的流速通过催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物的转化率),反应原理为: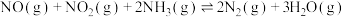 。以下说法正确的是______。
。以下说法正确的是______。A.使用催化剂更有利于提高 的平衡转化率 的平衡转化率 |
| B.及时吹脱水蒸气,可以提高脱氮率 |
| C.其他条件不变的条件下,改变压强对脱氮率没有影响 |
| D.烟气通过催化剂的流速越快,脱氮效果会越好 |
(2)CO与NO在Rh催化剂上的氧化还原反应是控制汽车尾气对空气污染的关键反应用Rh做催化剂时该反应的过程示意图如图所示:

②已知过程Ⅰ的焓变为
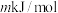 ,过程Ⅱ的焓变为
,过程Ⅱ的焓变为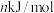 ,则该反应的热化学方程式为:
,则该反应的热化学方程式为:(3)
 催化还原NO的物质转化如图所示。若参与反应的
催化还原NO的物质转化如图所示。若参与反应的 和
和 的物质的量之比为4∶1,则转化时
的物质的量之比为4∶1,则转化时 和NO物质的量之比为:
和NO物质的量之比为: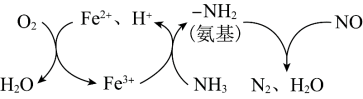
 )。相同条件下,放电过程中消耗的
)。相同条件下,放电过程中消耗的 和
和 的体积比为
的体积比为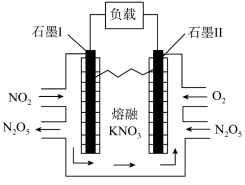
更新时间:2024/05/21 09:39:23
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐1】ClO2是一种优良的消毒剂,浓度过高时易发生分解,常将其制备成NaClO2或NaClO2·3H2O固体以便运输和贮存。过氧化氢法制备NaClO2的实验装置如图甲所示。
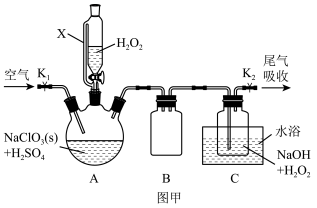
已知:①2NaClO3+H2O2+H2SO4 = 2ClO2↑+O2↑+Na2SO4+2H2O;
②ClO2的熔点为—59°C,沸点为11°C,H2O2 的沸点为150°C;
③当温度低于38°C时,NaClO2 饱和溶液中析出的晶体是NaClO2·3H2O。当温度在38-60°C时,析出NaClO2;温度高于60°C时,NaClO2分解。
(1)图甲所示装置组装完毕后,首先进行的操作是_______ 。
(2)Cl—对ClO2的生成有一定催化作用。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率会大大提高。该过程经两步反应完成,将其补充完整。
①2ClO +2Cl—+4H+=Cl2↑+2ClO2↑+2H2O;
+2Cl—+4H+=Cl2↑+2ClO2↑+2H2O;
②_______ (用离子方程式表示)。
(3)C装置中应使用_______ (填 “冰”或“热”)水浴;空气流速过快或过慢,均会降低NaClO2产率,其原因可能是_______ 。
(4)实验室利用装置乙分离C装置中的NaClO2,Y处应连接一个装置,目的是_______ 。水浴加热的温度最好控制在_______ °C左 右(填字母)。大量晶体析出后,过滤,洗涤,干燥。
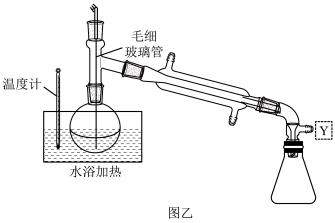
a.35 b.55 c. 70 d. 100
(5)图乙中起冷却作用的仪器名称是_______ 。
(6)产品纯度的测定:称取mg产品配成100 mL溶液,取25.00mL溶液,加入足量的KI和稀H2SO4充分反应后加入指示剂,用c mol·L-1 Na2S2O3标准溶液滴定至终点(I2+2S2O =2I-+S4O
=2I-+S4O ),平均消耗标准溶液的体积为V mL,则产品中NaClO2的质量分数是
),平均消耗标准溶液的体积为V mL,则产品中NaClO2的质量分数是_______ 。(用含m、c、V的式子表示)

已知:①2NaClO3+H2O2+H2SO4 = 2ClO2↑+O2↑+Na2SO4+2H2O;
②ClO2的熔点为—59°C,沸点为11°C,H2O2 的沸点为150°C;
③当温度低于38°C时,NaClO2 饱和溶液中析出的晶体是NaClO2·3H2O。当温度在38-60°C时,析出NaClO2;温度高于60°C时,NaClO2分解。
(1)图甲所示装置组装完毕后,首先进行的操作是
(2)Cl—对ClO2的生成有一定催化作用。反应开始时在三颈烧瓶中加入少量盐酸,ClO2的生成速率会大大提高。该过程经两步反应完成,将其补充完整。
①2ClO
 +2Cl—+4H+=Cl2↑+2ClO2↑+2H2O;
+2Cl—+4H+=Cl2↑+2ClO2↑+2H2O;②
(3)C装置中应使用
(4)实验室利用装置乙分离C装置中的NaClO2,Y处应连接一个装置,目的是

a.35 b.55 c. 70 d. 100
(5)图乙中起冷却作用的仪器名称是
(6)产品纯度的测定:称取mg产品配成100 mL溶液,取25.00mL溶液,加入足量的KI和稀H2SO4充分反应后加入指示剂,用c mol·L-1 Na2S2O3标准溶液滴定至终点(I2+2S2O
 =2I-+S4O
=2I-+S4O ),平均消耗标准溶液的体积为V mL,则产品中NaClO2的质量分数是
),平均消耗标准溶液的体积为V mL,则产品中NaClO2的质量分数是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】高砷煤中含有砷硫铁(FeAsS)等物质。燃煤产生的烟气中含NO、 、粉尘等,经过SCR脱硝除去NO,粉尘经沉降得到粉煤灰。
、粉尘等,经过SCR脱硝除去NO,粉尘经沉降得到粉煤灰。
(1)燃煤固硫
①燃烧高砷煤时加入生石灰将大部分硫元素转化为___________ (填化学式)留在煤渣中。
②高砷煤燃烧过程中,砷硫铁在高温下被氧化成 释放到烟气中,该反应的化学方程式为
释放到烟气中,该反应的化学方程式为___________ 。
(2)SCR脱硝(脱除烟气中的NO)
在烟气中加入适量氨气,用钒氧化物作催化剂将 、NO、
、NO、 转化为
转化为 。
。
①在SCR脱硝的反应中还原剂为___________ (填化学式)。
②若 与NO的物质的量之比为1∶1,写出SCR脱硝法的反应原理
与NO的物质的量之比为1∶1,写出SCR脱硝法的反应原理___________ (用化学方程式表示)。
(3)粉煤灰成分研究
粉煤灰可用于水泥工业,粉煤灰中的氨含量( 或铵盐)会影响水泥的性能。取50.00g粉煤灰加入NaOH蒸出
或铵盐)会影响水泥的性能。取50.00g粉煤灰加入NaOH蒸出 ,用20mL 0.1000
,用20mL 0.1000 的
的 溶液吸收
溶液吸收 ,用0.200
,用0.200 NaOH溶液滴定过量的
NaOH溶液滴定过量的 至终点,平行滴定3次,平均消耗NaOH溶液10.00mL,计算粉煤灰中的以
至终点,平行滴定3次,平均消耗NaOH溶液10.00mL,计算粉煤灰中的以 计的氨含量
计的氨含量___________ (用 表示,写出计算过程)。
表示,写出计算过程)。
 、粉尘等,经过SCR脱硝除去NO,粉尘经沉降得到粉煤灰。
、粉尘等,经过SCR脱硝除去NO,粉尘经沉降得到粉煤灰。(1)燃煤固硫
①燃烧高砷煤时加入生石灰将大部分硫元素转化为
②高砷煤燃烧过程中,砷硫铁在高温下被氧化成
 释放到烟气中,该反应的化学方程式为
释放到烟气中,该反应的化学方程式为(2)SCR脱硝(脱除烟气中的NO)
在烟气中加入适量氨气,用钒氧化物作催化剂将
 、NO、
、NO、 转化为
转化为 。
。①在SCR脱硝的反应中还原剂为
②若
 与NO的物质的量之比为1∶1,写出SCR脱硝法的反应原理
与NO的物质的量之比为1∶1,写出SCR脱硝法的反应原理(3)粉煤灰成分研究
粉煤灰可用于水泥工业,粉煤灰中的氨含量(
 或铵盐)会影响水泥的性能。取50.00g粉煤灰加入NaOH蒸出
或铵盐)会影响水泥的性能。取50.00g粉煤灰加入NaOH蒸出 ,用20mL 0.1000
,用20mL 0.1000 的
的 溶液吸收
溶液吸收 ,用0.200
,用0.200 NaOH溶液滴定过量的
NaOH溶液滴定过量的 至终点,平行滴定3次,平均消耗NaOH溶液10.00mL,计算粉煤灰中的以
至终点,平行滴定3次,平均消耗NaOH溶液10.00mL,计算粉煤灰中的以 计的氨含量
计的氨含量 表示,写出计算过程)。
表示,写出计算过程)。
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】红磷可用于制备半导体化合物,还可以用于制造火柴、烟火,以及三氯化磷等。
Ⅰ.研究小组以无水甲苯为溶剂, (易水解)和
(易水解)和 (叠氮化钠)为反应物制备红磷。
(叠氮化钠)为反应物制备红磷。
实验步骤如下:
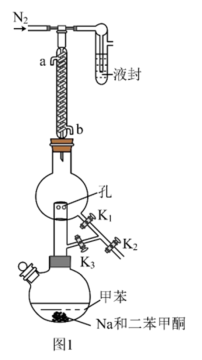
①甲苯的干燥和收集:装置如图1所示(夹持及加热装置略)
已知:二苯甲酮为指示剂,无水时体系呈蓝色,甲苯的沸点为110.6℃。 的作用是
的作用是___________ 。
(2)先小火加热控温100℃一段时间,打开活塞___________ ,达到除水的目的。再升温至120℃左右,打开活塞___________ ,达到分离收集甲苯的目的。
②红磷的制备:装置如图2所示(夹持、搅拌、加热装置已略)。___________ 。用氩气赶走空气的目的是___________ 。
(4)离心分离和洗涤得到产品,洗涤时先后使用乙醇和水,依次洗去的物质是___________ 。
Ⅱ.该实验所需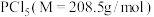 的纯度要求极高,对于
的纯度要求极高,对于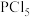 的纯度测定如下:
的纯度测定如下:
步骤Ⅰ:取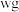 上述所用样品,置于盛有蒸馏水的水解瓶中摇动至完全水解,将水解液配成
上述所用样品,置于盛有蒸馏水的水解瓶中摇动至完全水解,将水解液配成 溶液;
溶液;
步骤Ⅱ:取 上述溶液于锥形瓶中,先加入足量稀硝酸,一段时间后再加入
上述溶液于锥形瓶中,先加入足量稀硝酸,一段时间后再加入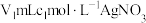 溶液(过量),使
溶液(过量),使 完全转化为
完全转化为 沉淀(
沉淀(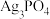 可溶于稀硝酸);
可溶于稀硝酸);
步骤Ⅲ:加入少量硝基苯,振荡,使沉淀表面被有机物覆盖。以硫酸铁溶液为指示剂,用 溶液滴定过量的
溶液滴定过量的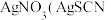 难溶于水),达到滴定终点时,共用去
难溶于水),达到滴定终点时,共用去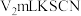 溶液。
溶液。
(5)产品中 的质量分数为
的质量分数为___________  ,若测定过程中没有加入硝基苯,则所测
,若测定过程中没有加入硝基苯,则所测 的含量会
的含量会___________ (填“偏大”“偏小”或“不变”)。
Ⅰ.研究小组以无水甲苯为溶剂,
 (易水解)和
(易水解)和 (叠氮化钠)为反应物制备红磷。
(叠氮化钠)为反应物制备红磷。实验步骤如下:
①甲苯的干燥和收集:装置如图1所示(夹持及加热装置略)
已知:二苯甲酮为指示剂,无水时体系呈蓝色,甲苯的沸点为110.6℃。
 的作用是
的作用是(2)先小火加热控温100℃一段时间,打开活塞
②红磷的制备:装置如图2所示(夹持、搅拌、加热装置已略)。
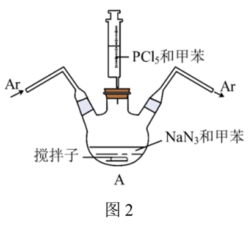
(4)离心分离和洗涤得到产品,洗涤时先后使用乙醇和水,依次洗去的物质是
Ⅱ.该实验所需
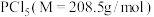 的纯度要求极高,对于
的纯度要求极高,对于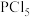 的纯度测定如下:
的纯度测定如下:步骤Ⅰ:取
 上述所用样品,置于盛有蒸馏水的水解瓶中摇动至完全水解,将水解液配成
上述所用样品,置于盛有蒸馏水的水解瓶中摇动至完全水解,将水解液配成 溶液;
溶液;步骤Ⅱ:取
 上述溶液于锥形瓶中,先加入足量稀硝酸,一段时间后再加入
上述溶液于锥形瓶中,先加入足量稀硝酸,一段时间后再加入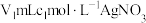 溶液(过量),使
溶液(过量),使 完全转化为
完全转化为 沉淀(
沉淀(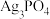 可溶于稀硝酸);
可溶于稀硝酸);步骤Ⅲ:加入少量硝基苯,振荡,使沉淀表面被有机物覆盖。以硫酸铁溶液为指示剂,用
 溶液滴定过量的
溶液滴定过量的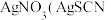 难溶于水),达到滴定终点时,共用去
难溶于水),达到滴定终点时,共用去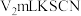 溶液。
溶液。(5)产品中
 的质量分数为
的质量分数为 ,若测定过程中没有加入硝基苯,则所测
,若测定过程中没有加入硝基苯,则所测 的含量会
的含量会
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】环境保护、绿色能源的使用是当今社会的热点问题
(1)对烟道气中的 进行回收再利用具有较高的社会价值和经济价值。CO还原法:一定条件下,由
进行回收再利用具有较高的社会价值和经济价值。CO还原法:一定条件下,由 和CO反应生成S和
和CO反应生成S和 的能量变化如图所示,每生成64g S(s),该反应
的能量变化如图所示,每生成64g S(s),该反应___________ (填“放出”或“吸收”)的热量为___________ kJ。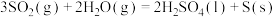
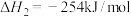
反应Ⅲ: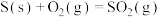
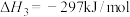
反应Ⅰ的热化学方程式为___________ 。
(3)为消除汽车尾气中含有NO、 、CO等气体,可采取:NO和CO在催化转换器中发生如下反应:
、CO等气体,可采取:NO和CO在催化转换器中发生如下反应:
 ;
;
已知: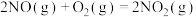
 ;CO的燃烧热为
;CO的燃烧热为 ;
;
 与CO发生反应的热化学方程式:
与CO发生反应的热化学方程式: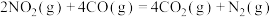

___________ (用 、
、 、
、 表示)。
表示)。
(4)工业上接触法生产硫酸的主要反应之一是:在一定的温度、压强和钒催化剂存在的条件下, 被空气中的
被空气中的 氧化为
氧化为 。
。 是钒催化剂的活性成分,
是钒催化剂的活性成分, 在对反应Ⅰ的催化循环过程中,经历了Ⅱ、Ⅲ两个反应阶段,反应Ⅱ为决速步,如下图所示:
在对反应Ⅰ的催化循环过程中,经历了Ⅱ、Ⅲ两个反应阶段,反应Ⅱ为决速步,如下图所示:
①根据气体分子中1mol化学键断裂时需要吸收的能量数据,计算反应Ⅰ的
___________ kJ/mol。
②反应Ⅰ、Ⅱ、Ⅲ中正反应活化能最小的是___________ 。
(1)对烟道气中的
 进行回收再利用具有较高的社会价值和经济价值。CO还原法:一定条件下,由
进行回收再利用具有较高的社会价值和经济价值。CO还原法:一定条件下,由 和CO反应生成S和
和CO反应生成S和 的能量变化如图所示,每生成64g S(s),该反应
的能量变化如图所示,每生成64g S(s),该反应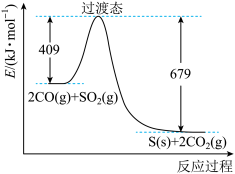

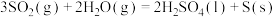
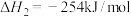
反应Ⅲ:
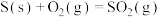
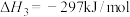
反应Ⅰ的热化学方程式为
(3)为消除汽车尾气中含有NO、
 、CO等气体,可采取:NO和CO在催化转换器中发生如下反应:
、CO等气体,可采取:NO和CO在催化转换器中发生如下反应:
 ;
;已知:
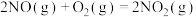
 ;CO的燃烧热为
;CO的燃烧热为 ;
; 与CO发生反应的热化学方程式:
与CO发生反应的热化学方程式: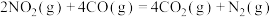

 、
、 、
、 表示)。
表示)。(4)工业上接触法生产硫酸的主要反应之一是:在一定的温度、压强和钒催化剂存在的条件下,
 被空气中的
被空气中的 氧化为
氧化为 。
。 是钒催化剂的活性成分,
是钒催化剂的活性成分, 在对反应Ⅰ的催化循环过程中,经历了Ⅱ、Ⅲ两个反应阶段,反应Ⅱ为决速步,如下图所示:
在对反应Ⅰ的催化循环过程中,经历了Ⅱ、Ⅲ两个反应阶段,反应Ⅱ为决速步,如下图所示: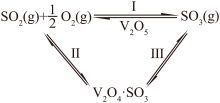
| 化学键 |  |  | 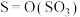 |
| 能量/kJ | a | b | c |

②反应Ⅰ、Ⅱ、Ⅲ中正反应活化能最小的是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】乙烯是石油化学工业重要的基本原料。乙烷在一定条件下可脱氢制得乙烯,在乙烷中引入 制备乙烯,可以降低反应温度并减少积碳,涉及如下反应:
制备乙烯,可以降低反应温度并减少积碳,涉及如下反应:
ⅰ.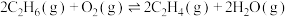
 ;
;
ⅱ.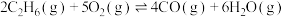
 ;
;
ⅲ.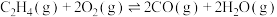
 。
。
涉及的物质与其相对能量如下图所示:
(1)
___________  。
。
(2)提高乙烷的平衡转化率的措施有___________ (写两条);氧气的引入可能导致过度氧化,为减少过度氧化,需要寻找催化剂降低反应___________ (填“ⅰ”“ⅱ”或“ⅲ”)的活化能。
(3)在密闭容器中充入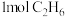 和
和 ,初始压强为
,初始压强为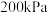 ,在催化剂作用下发生上述反应,平衡时
,在催化剂作用下发生上述反应,平衡时 在含碳产物中的物质的量分数及
在含碳产物中的物质的量分数及 的转化率随温度的变化如下图所示:
的转化率随温度的变化如下图所示:___________ ;585℃条件下,平衡时 的物质的量
的物质的量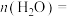
___________ mol,反应ⅰ的平衡常数
___________ kPa(列出计算式)。
(4)某学者研究了生成 的部分反应历程,如下图所示,该历程中存在的基元反应有
的部分反应历程,如下图所示,该历程中存在的基元反应有___________ 个,该历程的催化剂是___________ 。
 制备乙烯,可以降低反应温度并减少积碳,涉及如下反应:
制备乙烯,可以降低反应温度并减少积碳,涉及如下反应:ⅰ.
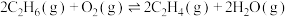
 ;
;ⅱ.
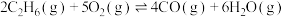
 ;
;ⅲ.
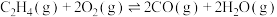
 。
。涉及的物质与其相对能量如下图所示:
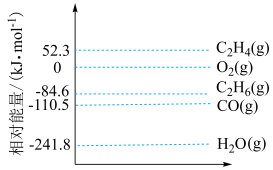
(1)

 。
。(2)提高乙烷的平衡转化率的措施有
(3)在密闭容器中充入
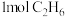 和
和 ,初始压强为
,初始压强为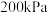 ,在催化剂作用下发生上述反应,平衡时
,在催化剂作用下发生上述反应,平衡时 在含碳产物中的物质的量分数及
在含碳产物中的物质的量分数及 的转化率随温度的变化如下图所示:
的转化率随温度的变化如下图所示: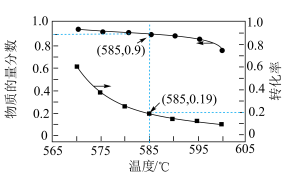
 的物质的量
的物质的量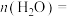

(4)某学者研究了生成
 的部分反应历程,如下图所示,该历程中存在的基元反应有
的部分反应历程,如下图所示,该历程中存在的基元反应有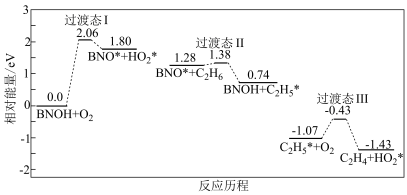
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐3】含氮物质、含硫物质的过量排放会污染大气或水体,研究氮、硫及其化合物的性质及转化,对降低含氮、含硫物质的污染有着重大的意义。
(1)在一定条件下,浓度为5%的尿素[CO(NH2)2]吸收液可以脱除烟气中的NOx。不同吸收反应温度下,测得NOx的脱除率变化如图所示。
已知信息:尿素的分解温度是160℃。尿素水解:CO(NH2)2+H2O=CO2↑+2NH3↑,在低温水解速度慢。
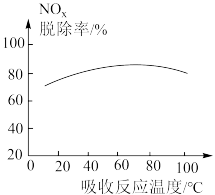
①当温度大于80℃时,NOx的脱除率随温度升高而降低的原因是______ 。
②写出在70~80℃条件下,尿素和烟气中NO2反应的化学方程式为______ 。
(2)ClO2可对烟气中NOx、SO2进行协同脱除,涉及的部分反应如下:
Ⅰ.ClO2+NO=NO2+ClO
Ⅱ.ClO+NO=Cl+NO2
Ⅲ.ClO2+SO2=ClO+SO3
Ⅳ.ClO+SO2=Cl+SO3
①反应Ⅳ的历程如图4所示。该历程中最大活化能E正=_____ kcal·mol-1。
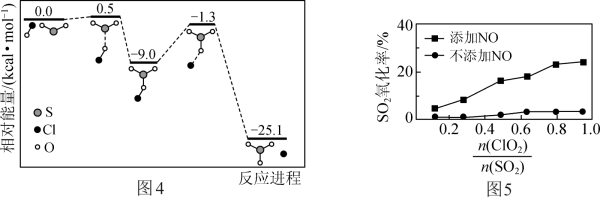
②保持其他条件不变,分别在不添加NO、添加NO两种情况下,控制模拟烟气中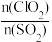 不同并反应相同时间,测得SO2氧化率随
不同并反应相同时间,测得SO2氧化率随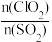 变化如图5所示。不添加NO时,SO2氧化率较低(不超过3%)的原因可能是
变化如图5所示。不添加NO时,SO2氧化率较低(不超过3%)的原因可能是______ 。添加NO时,SO2氧化率比不添加NO时高,其原因可能是______ 。
(1)在一定条件下,浓度为5%的尿素[CO(NH2)2]吸收液可以脱除烟气中的NOx。不同吸收反应温度下,测得NOx的脱除率变化如图所示。
已知信息:尿素的分解温度是160℃。尿素水解:CO(NH2)2+H2O=CO2↑+2NH3↑,在低温水解速度慢。

①当温度大于80℃时,NOx的脱除率随温度升高而降低的原因是
②写出在70~80℃条件下,尿素和烟气中NO2反应的化学方程式为
(2)ClO2可对烟气中NOx、SO2进行协同脱除,涉及的部分反应如下:
Ⅰ.ClO2+NO=NO2+ClO
Ⅱ.ClO+NO=Cl+NO2
Ⅲ.ClO2+SO2=ClO+SO3
Ⅳ.ClO+SO2=Cl+SO3
①反应Ⅳ的历程如图4所示。该历程中最大活化能E正=
②保持其他条件不变,分别在不添加NO、添加NO两种情况下,控制模拟烟气中
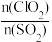 不同并反应相同时间,测得SO2氧化率随
不同并反应相同时间,测得SO2氧化率随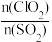 变化如图5所示。不添加NO时,SO2氧化率较低(不超过3%)的原因可能是
变化如图5所示。不添加NO时,SO2氧化率较低(不超过3%)的原因可能是
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐1】石油化工、煤化工等行业的废气中普遍含有硫化氢, 的回收利用有重要意义。以下是
的回收利用有重要意义。以下是 处理的一些方法。
处理的一些方法。
完成下列填空:
Ⅰ.用氢氧化钠溶液吸收。
(1)硫化氢被完全吸收后,溶液里含硫的微粒可能为_______ ,25℃时若溶液 ,则溶液中
,则溶液中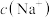
_______  (填“>”或“<”或“=”)。
(填“>”或“<”或“=”)。
Ⅱ.制取 ,其反应的能量示意如下图所示。
,其反应的能量示意如下图所示。_______
Ⅲ.高温分解: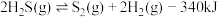
(3)能够判断上述反应到达平衡状态的是_______ 。(选填编号)
a. 的浓度保持不变b.气体的质量保持不变
的浓度保持不变b.气体的质量保持不变
c.恒容时,容器的压强保持不变d.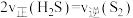
(4)在恒温恒压条件下,充入氩气,发现: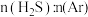 越小,
越小, 平衡转化率越大,请解释可能的原因。
平衡转化率越大,请解释可能的原因。_______
Ⅳ.将 燃烧,产生的
燃烧,产生的 与剩余
与剩余 混合后反应,生成单质硫回收。
混合后反应,生成单质硫回收。
①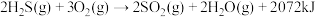
②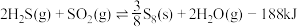
(5)②的平衡常数表达式为_______ ,某温度下,若只发生反应②,从反应开始到15s时,测得容器内的气体密度减小了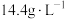 ,则
,则 内,
内, 平均反应速率
平均反应速率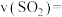
_______ 。
(6)在某温度下发生反应①和②,当②达到平衡,测得密闭系统中各组分浓度分别为: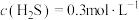 、
、 、
、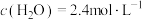 ,请计算开始时投料比
,请计算开始时投料比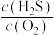
_______ 。
 的回收利用有重要意义。以下是
的回收利用有重要意义。以下是 处理的一些方法。
处理的一些方法。完成下列填空:
Ⅰ.用氢氧化钠溶液吸收。
(1)硫化氢被完全吸收后,溶液里含硫的微粒可能为
 ,则溶液中
,则溶液中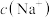
 (填“>”或“<”或“=”)。
(填“>”或“<”或“=”)。Ⅱ.制取
 ,其反应的能量示意如下图所示。
,其反应的能量示意如下图所示。
Ⅲ.高温分解:
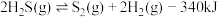
(3)能够判断上述反应到达平衡状态的是
a.
 的浓度保持不变b.气体的质量保持不变
的浓度保持不变b.气体的质量保持不变c.恒容时,容器的压强保持不变d.
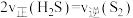
(4)在恒温恒压条件下,充入氩气,发现:
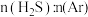 越小,
越小, 平衡转化率越大,请解释可能的原因。
平衡转化率越大,请解释可能的原因。Ⅳ.将
 燃烧,产生的
燃烧,产生的 与剩余
与剩余 混合后反应,生成单质硫回收。
混合后反应,生成单质硫回收。①
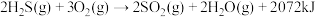
②
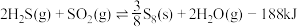
(5)②的平衡常数表达式为
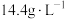 ,则
,则 内,
内, 平均反应速率
平均反应速率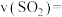
(6)在某温度下发生反应①和②,当②达到平衡,测得密闭系统中各组分浓度分别为:
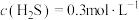 、
、 、
、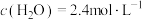 ,请计算开始时投料比
,请计算开始时投料比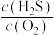
您最近一年使用:0次
【推荐2】乙醇水蒸气重整制氢是制备氢气的常用方法,体系中发生的主要反应有:
I.C2H5OH(g)+H2O(g)=2CO(g)+4H2(g) △H1
II.C2H5OH(g)+3H2O(g)=2CO2(g)+6H2(g) △H2=+173kJ·mol-1
III.CO(g)+H2O(g)=CO2(g)+H2(g) △H3=-41.2kJ·mol-1
IV.C2H5OH(g)+2H2(g)=2CH4(g)+H2O(g) △H4=-156.2kJ·mol-1
(1)△H1=____ kJ·mol-1。
(2)压强为100kPa的条件下,图1是平衡时体系中各产物的物质的量分数与温度的关系,图2是H2的平衡产率与温度及起始时 的关系。
的关系。
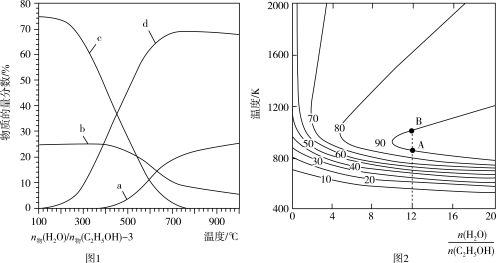
①图1中c线对应的产物为____ (填“CO2”、“H2”或“CH4”)。
②图2中B点H2的产率与A点相等的原因是___ 。
(3)反应温度T℃、0.1MPa的恒压密闭容器中,充入1mol乙醇和xmolH2O(g),若只发生反应CH3CH2OH(g)+3H2O(g) 2CO2(g)+6H2(g),平衡时,乙醇转化率为α,CO2的压强为
2CO2(g)+6H2(g),平衡时,乙醇转化率为α,CO2的压强为____ MPa,反应平衡常数Kp=____ (以分压表示,分压=总压×物质的量分数。列出计算式即可)
(4)CH3CH2OH(g)在催化剂Rh/CeO2上反应制取氢气的机理如图:
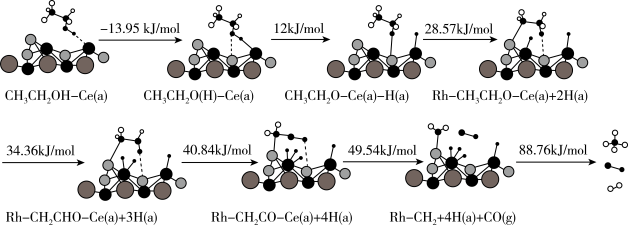
①出生成CO(g)步骤的化学方程式____ 。
②下列措施可以提高CH3CH2OH在催化剂表面吸附率的有____ (填标号)。
a..减小乙醇蒸气的分压 b.增大催化剂的比表面积
I.C2H5OH(g)+H2O(g)=2CO(g)+4H2(g) △H1
II.C2H5OH(g)+3H2O(g)=2CO2(g)+6H2(g) △H2=+173kJ·mol-1
III.CO(g)+H2O(g)=CO2(g)+H2(g) △H3=-41.2kJ·mol-1
IV.C2H5OH(g)+2H2(g)=2CH4(g)+H2O(g) △H4=-156.2kJ·mol-1
(1)△H1=
(2)压强为100kPa的条件下,图1是平衡时体系中各产物的物质的量分数与温度的关系,图2是H2的平衡产率与温度及起始时
 的关系。
的关系。
①图1中c线对应的产物为
②图2中B点H2的产率与A点相等的原因是
(3)反应温度T℃、0.1MPa的恒压密闭容器中,充入1mol乙醇和xmolH2O(g),若只发生反应CH3CH2OH(g)+3H2O(g)
 2CO2(g)+6H2(g),平衡时,乙醇转化率为α,CO2的压强为
2CO2(g)+6H2(g),平衡时,乙醇转化率为α,CO2的压强为(4)CH3CH2OH(g)在催化剂Rh/CeO2上反应制取氢气的机理如图:

①出生成CO(g)步骤的化学方程式
②下列措施可以提高CH3CH2OH在催化剂表面吸附率的有
a..减小乙醇蒸气的分压 b.增大催化剂的比表面积
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
【推荐3】近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。Deacon发明的直接氧化法为: 。
。
(1)根据表中物质生成焓及熵的数据,写出该反应的热化学方程式:___________ ;并分析该反应在常温下___________ (填“能”或“不能”)自发进行。
生成焓及熵数据
(2)刚性容器中,进料浓度比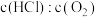 分别等于1:1、4:1、7:1时,
分别等于1:1、4:1、7:1时, 的平衡转化率随温度变化的关系如图甲:
的平衡转化率随温度变化的关系如图甲: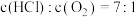 的是曲线
的是曲线___________ (填“a”、“b”或“c”);设 初始浓度为
初始浓度为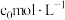 ,根据进料浓度比
,根据进料浓度比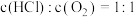 的数据计算
的数据计算
___________ (列出计算式)。按化学计量数之比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比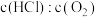 过低的不利影响是
过低的不利影响是___________ 。
(3)催化氧化法制备氯气的催化剂可以用 和
和 为主要活性成分,其他辅助物组分用量相同,且负载于已制备好的
为主要活性成分,其他辅助物组分用量相同,且负载于已制备好的 不同比表面积的载体上,反应
不同比表面积的载体上,反应 后测定
后测定 的转化率,结果如图乙。
的转化率,结果如图乙。___________ ;综合图分析,选择的催化剂是___________ (填“ ”或“
”或“ ”);反应条件:
”);反应条件:___________ (填“低比表面积”或“高比表面积”)。
 。
。(1)根据表中物质生成焓及熵的数据,写出该反应的热化学方程式:
生成焓及熵数据
| 物质 | 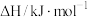 | 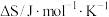 |
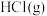 | 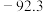 | 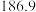 |
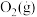 |  | 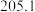 |
 |  | 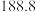 |
 | 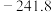 | 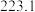 |
(2)刚性容器中,进料浓度比
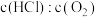 分别等于1:1、4:1、7:1时,
分别等于1:1、4:1、7:1时, 的平衡转化率随温度变化的关系如图甲:
的平衡转化率随温度变化的关系如图甲:
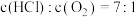 的是曲线
的是曲线 初始浓度为
初始浓度为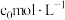 ,根据进料浓度比
,根据进料浓度比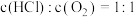 的数据计算
的数据计算
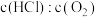 过低的不利影响是
过低的不利影响是(3)催化氧化法制备氯气的催化剂可以用
 和
和 为主要活性成分,其他辅助物组分用量相同,且负载于已制备好的
为主要活性成分,其他辅助物组分用量相同,且负载于已制备好的 不同比表面积的载体上,反应
不同比表面积的载体上,反应 后测定
后测定 的转化率,结果如图乙。
的转化率,结果如图乙。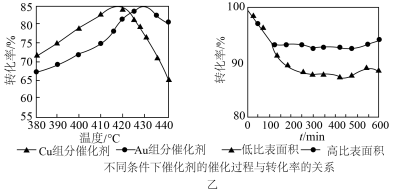
 ”或“
”或“ ”);反应条件:
”);反应条件:
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐1】A、B、C、D、E为原子序数依次增大的五种短周期元素,其中仅含有一种金属元素,A和D原子的最外层电子数相同;B、C和E在周期表中相邻,且C、E同主族。B、C原子的最外层电子数之和等于D原子的核外电子数,A和C可形成两种常见的液态化合物。请回答下列问题:
(1)C、D、E三种原子对应的离子半径由大到小的顺序是________________ (填离子符号),由A、B、C三种元素按原子个数比4∶2∶3组成的化合物所含的化学键类型有______________ (选填“离子键”、“极性键”、“非极性键”);
(2)地壳中含量最高的金属元素的单质与 D的最高价氧化物对应水化物的溶液反应,其离子方程式为:______________________________________________________ ;
(3)A、C两元素的单质与KOH溶液组成的燃料电池,其负极反应式为:______________________________ ;
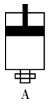
(4)可逆反应2EC2(g)+C2(g) 2EC3(g)在一密闭容器A中进行,A容器中有一个可上下移动的活塞 (如右图所示),若在A中充入1 mol C2和2 mol EC2,下列可以作为判断该反应达到平衡的标志的为
2EC3(g)在一密闭容器A中进行,A容器中有一个可上下移动的活塞 (如右图所示),若在A中充入1 mol C2和2 mol EC2,下列可以作为判断该反应达到平衡的标志的为__________ (选填序号)。
① 容器内混合气体的总压强不随时间变化
② 容器内混合气体的密度不随时间变化
③ 各组分浓度不再变化
④ 单位时间内消耗a mol C2同时生成2a mol EC3
(1)C、D、E三种原子对应的离子半径由大到小的顺序是
(2)地壳中含量最高的金属元素的单质与 D的最高价氧化物对应水化物的溶液反应,其离子方程式为:
(3)A、C两元素的单质与KOH溶液组成的燃料电池,其负极反应式为:
(4)可逆反应2EC2(g)+C2(g)
 2EC3(g)在一密闭容器A中进行,A容器中有一个可上下移动的活塞 (如右图所示),若在A中充入1 mol C2和2 mol EC2,下列可以作为判断该反应达到平衡的标志的为
2EC3(g)在一密闭容器A中进行,A容器中有一个可上下移动的活塞 (如右图所示),若在A中充入1 mol C2和2 mol EC2,下列可以作为判断该反应达到平衡的标志的为
① 容器内混合气体的总压强不随时间变化
② 容器内混合气体的密度不随时间变化
③ 各组分浓度不再变化
④ 单位时间内消耗a mol C2同时生成2a mol EC3
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
【推荐2】选择适当的催化剂在高温条件下可将汽车尾气中的 、
、 转化为无毒气体。已知反应原理为:
转化为无毒气体。已知反应原理为: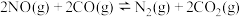 。
。
回答下列问题:
(1)已知断开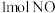 中的化学键要吸收
中的化学键要吸收 的能量,断开
的能量,断开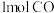 中的化学键要吸收
中的化学键要吸收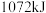 的能量,形成
的能量,形成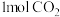 中的化学键要释放出
中的化学键要释放出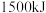 的能量,形成
的能量,形成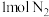 中的化学键要释放出
中的化学键要释放出 的能量,则该反应属于
的能量,则该反应属于___________ 反应(填“放热”或“吸热”)。
(2)已知在一定温度下,向 密闭容器中充入
密闭容器中充入 、
、 、
、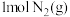 、
、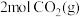 发生上述反应,反应过程中各物质的物质的量随时间变化的曲线如图所示:
发生上述反应,反应过程中各物质的物质的量随时间变化的曲线如图所示: 的物质的量随时间变化的曲线为
的物质的量随时间变化的曲线为___________ (填曲线字母)。
②反应开始至 ,
, 的平均反应速率为
的平均反应速率为___________ 。
③反应速率的大小:M点正反应的速率___________ N点逆反应的速率(填“>”“<”或“=”)。
④关于上述反应,下列叙述错误的是___________ (填选项字母)。
A.通过调控反应条件,可以提高该反应进行的程度
B.升高温度可增大正反应的速率,降低逆反应的速率
C.平衡时充入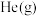 使反应容器的压强增大,生成
使反应容器的压强增大,生成 的反应速率不变
的反应速率不变
D. 与
与 的物质的量之比为
的物质的量之比为 ,说明反应达到化学平衡
,说明反应达到化学平衡
(3)可将上述反应设计成燃料电池,该电池的工作原理如图所示,电极a、b均为多孔性Pt电极。___________ 。
②该电池中电子的流动方向为___________ 。
A.由电极a经导线流向电极b
B.由电极a经 溶液流向电极b
溶液流向电极b
C.由电极b经导线流向电极a
D.由电极b经 溶液流向电极a
溶液流向电极a
③该电池中电极b上发生___________ 反应(填“氧化”或“还原”)。
 、
、 转化为无毒气体。已知反应原理为:
转化为无毒气体。已知反应原理为: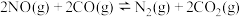 。
。回答下列问题:
(1)已知断开
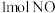 中的化学键要吸收
中的化学键要吸收 的能量,断开
的能量,断开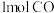 中的化学键要吸收
中的化学键要吸收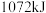 的能量,形成
的能量,形成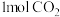 中的化学键要释放出
中的化学键要释放出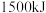 的能量,形成
的能量,形成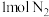 中的化学键要释放出
中的化学键要释放出 的能量,则该反应属于
的能量,则该反应属于(2)已知在一定温度下,向
 密闭容器中充入
密闭容器中充入 、
、 、
、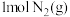 、
、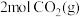 发生上述反应,反应过程中各物质的物质的量随时间变化的曲线如图所示:
发生上述反应,反应过程中各物质的物质的量随时间变化的曲线如图所示:
 的物质的量随时间变化的曲线为
的物质的量随时间变化的曲线为②反应开始至
 ,
, 的平均反应速率为
的平均反应速率为③反应速率的大小:M点正反应的速率
④关于上述反应,下列叙述错误的是
A.通过调控反应条件,可以提高该反应进行的程度
B.升高温度可增大正反应的速率,降低逆反应的速率
C.平衡时充入
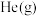 使反应容器的压强增大,生成
使反应容器的压强增大,生成 的反应速率不变
的反应速率不变D.
 与
与 的物质的量之比为
的物质的量之比为 ,说明反应达到化学平衡
,说明反应达到化学平衡(3)可将上述反应设计成燃料电池,该电池的工作原理如图所示,电极a、b均为多孔性Pt电极。

②该电池中电子的流动方向为
A.由电极a经导线流向电极b
B.由电极a经
 溶液流向电极b
溶液流向电极bC.由电极b经导线流向电极a
D.由电极b经
 溶液流向电极a
溶液流向电极a③该电池中电极b上发生
您最近一年使用:0次
【推荐3】氢能是一种重要的绿色能源,在实现“碳中和”与“碳达峰”目标中起到重要作用。乙醇与水催化重整制氢发生以下反应:
反应Ⅰ: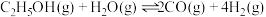
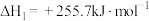
反应Ⅱ: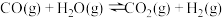
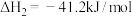
已知相关键能数据如下表:
(1)
_____  ,反应Ⅰ自发进行的条件是
,反应Ⅰ自发进行的条件是_____ (填序号)。
A.高压 B.低压 C.高温 D.低温
(2)向某恒容密闭容器中充入 和
和 ,起始压强为
,起始压强为 ,若仅发生上述反应,平衡时
,若仅发生上述反应,平衡时 和
和 的选择性、乙醇的转化率随温度的变化曲线如图所示[已知:
的选择性、乙醇的转化率随温度的变化曲线如图所示[已知: 的选择性
的选择性 ]。
]。 的选择性的是曲线
的选择性的是曲线_____ (填“a”或“b”或“c”)。
②反应Ⅱ的平衡常数:
_____  (填“>”“=”或“<”)。
(填“>”“=”或“<”)。
③下列能提高平衡时乙醇转化率的措施有_____ (填序号)。
A.适当减小压强 B.选用高效催化剂 C.增大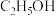 的投料 D.适当升高温度
的投料 D.适当升高温度
④设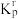 为相对压力平衡常数,即在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为
为相对压力平衡常数,即在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为 )除以
)除以 。
。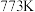 时,反应Ⅰ的相对压力平衡常数为
时,反应Ⅰ的相对压力平衡常数为
_____ (保留到小数点后一位)。
(3)研究发现,在酸性乙醇燃料电池中加入硝酸,可使电池持续大电流放电,其工作原理如图所示。_____ 。
②电池工作时正极区溶液的
_____ (填“增大”“减小”或“不变”,忽略溶液的体积变化)。
③外电路通过 电子,体系中水增多
电子,体系中水增多_____  。
。
反应Ⅰ:
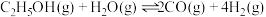
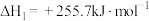
反应Ⅱ:
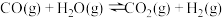
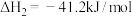
已知相关键能数据如下表:
| 化学键 |  |  |  |  |
键能/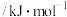 | 436 | 464.4 | a | 1072 |
(1)

 ,反应Ⅰ自发进行的条件是
,反应Ⅰ自发进行的条件是A.高压 B.低压 C.高温 D.低温
(2)向某恒容密闭容器中充入
 和
和 ,起始压强为
,起始压强为 ,若仅发生上述反应,平衡时
,若仅发生上述反应,平衡时 和
和 的选择性、乙醇的转化率随温度的变化曲线如图所示[已知:
的选择性、乙醇的转化率随温度的变化曲线如图所示[已知: 的选择性
的选择性 ]。
]。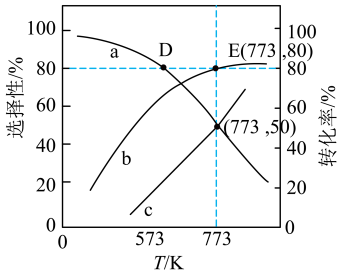
 的选择性的是曲线
的选择性的是曲线②反应Ⅱ的平衡常数:

 (填“>”“=”或“<”)。
(填“>”“=”或“<”)。③下列能提高平衡时乙醇转化率的措施有
A.适当减小压强 B.选用高效催化剂 C.增大
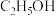 的投料 D.适当升高温度
的投料 D.适当升高温度④设
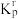 为相对压力平衡常数,即在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为
为相对压力平衡常数,即在浓度平衡常数表达式中,用相对分压代替浓度。气体的相对分压等于其分压(单位为 )除以
)除以 。
。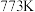 时,反应Ⅰ的相对压力平衡常数为
时,反应Ⅰ的相对压力平衡常数为
(3)研究发现,在酸性乙醇燃料电池中加入硝酸,可使电池持续大电流放电,其工作原理如图所示。

②电池工作时正极区溶液的

③外电路通过
 电子,体系中水增多
电子,体系中水增多 。
。
您最近一年使用:0次



