解题方法
1 . 高效氧化剂亚氯酸钠( )常用于烟气脱硝(
)常用于烟气脱硝( )和废水脱除氨氮。
)和废水脱除氨氮。
(1) 的制备。一种制备
的制备。一种制备 的过程可表示为
的过程可表示为_______ 。
②“反应1”的产物 经净化后常作为饮用水消毒剂替代传统的
经净化后常作为饮用水消毒剂替代传统的 ,从消毒后饮用水水质和消毒效率(单位质量消毒剂被还原时得电子数)的角度考虑,用
,从消毒后饮用水水质和消毒效率(单位质量消毒剂被还原时得电子数)的角度考虑,用 替代
替代 的原因是
的原因是_______ 。
(2) 溶液对烟气脱硝。
溶液对烟气脱硝。
①酸性条件下, 可催化溶液中的
可催化溶液中的 产生氧化性更强的
产生氧化性更强的 气体,总反应可表示为
气体,总反应可表示为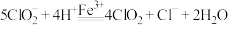 。请补充完整过程Ⅱ的离子方程式:
。请补充完整过程Ⅱ的离子方程式:
I.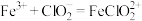 ;
;
Ⅱ._______ ;
Ⅲ.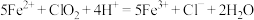 。
。
② 催化
催化 溶液脱硝。其他条件相同时,烟气中NO氧化率随
溶液脱硝。其他条件相同时,烟气中NO氧化率随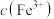 、反应温度的变化分别如图所示。
、反应温度的变化分别如图所示。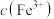 增大而增大的原因是
增大而增大的原因是_______ 。
ii.温度升高,NO氧化率先增大后减小的可能原因是_______ 。
(3) 溶液处理氨氮废水。向一定量酸性氨氮废水中加入一定体积已知浓度的
溶液处理氨氮废水。向一定量酸性氨氮废水中加入一定体积已知浓度的 溶液,用传感器测得溶液中
溶液,用传感器测得溶液中 与
与 含量随反应时间的变化如图所示。判断该实验中被氧化的
含量随反应时间的变化如图所示。判断该实验中被氧化的 是否全部转化为
是否全部转化为 的依据为
的依据为_______ 。
 )常用于烟气脱硝(
)常用于烟气脱硝( )和废水脱除氨氮。
)和废水脱除氨氮。(1)
 的制备。一种制备
的制备。一种制备 的过程可表示为
的过程可表示为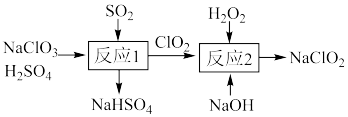
②“反应1”的产物
 经净化后常作为饮用水消毒剂替代传统的
经净化后常作为饮用水消毒剂替代传统的 ,从消毒后饮用水水质和消毒效率(单位质量消毒剂被还原时得电子数)的角度考虑,用
,从消毒后饮用水水质和消毒效率(单位质量消毒剂被还原时得电子数)的角度考虑,用 替代
替代 的原因是
的原因是(2)
 溶液对烟气脱硝。
溶液对烟气脱硝。①酸性条件下,
 可催化溶液中的
可催化溶液中的 产生氧化性更强的
产生氧化性更强的 气体,总反应可表示为
气体,总反应可表示为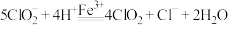 。请补充完整过程Ⅱ的离子方程式:
。请补充完整过程Ⅱ的离子方程式:I.
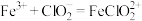 ;
;Ⅱ.
Ⅲ.
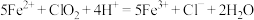 。
。②
 催化
催化 溶液脱硝。其他条件相同时,烟气中NO氧化率随
溶液脱硝。其他条件相同时,烟气中NO氧化率随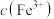 、反应温度的变化分别如图所示。
、反应温度的变化分别如图所示。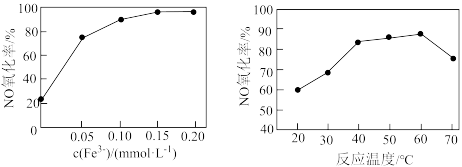
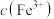 增大而增大的原因是
增大而增大的原因是ii.温度升高,NO氧化率先增大后减小的可能原因是
(3)
 溶液处理氨氮废水。向一定量酸性氨氮废水中加入一定体积已知浓度的
溶液处理氨氮废水。向一定量酸性氨氮废水中加入一定体积已知浓度的 溶液,用传感器测得溶液中
溶液,用传感器测得溶液中 与
与 含量随反应时间的变化如图所示。判断该实验中被氧化的
含量随反应时间的变化如图所示。判断该实验中被氧化的 是否全部转化为
是否全部转化为 的依据为
的依据为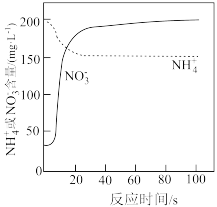
您最近半年使用:0次
昨日更新
|
170次组卷
|
2卷引用:江苏省南京市2024届高三下学期第二次模拟考试化学试题
解题方法
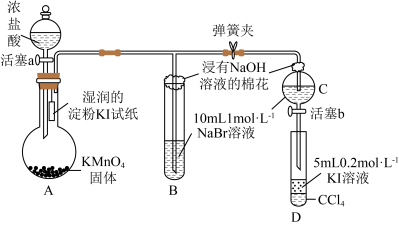
2 . 为证明卤族元素的非金属性强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检查)。
已知:①溴水呈黄色,而且颜色随浓度增大而加深。
② 容易从水中转移到
容易从水中转移到 中,导致下层(
中,导致下层( 层)因溶有
层)因溶有 显紫色。
显紫色。
实验过程:
①打开弹簧夹,打开活塞a,滴加浓盐酸。
②当B和C中的溶液都变为黄色时,夹紧弹簧夹。
③当B中溶液黄色加深时关闭活塞a。
④……
(1)NaOH的电子式为___________ 。
(2)A装置中制备氯气的离子方程式为___________ ,HCl的作用是做___________ 。
(3)B装置中主要反应的化学方程式为___________ 。
(4)为验证溴的氧化性强于碘,过程④的操作和现象分别是___________ 。
(5)过程③的实验目的是___________ 。
(6)结合元素周期表,从原子结构的角度解释氯、溴、碘单质的氧化性逐渐减弱的原因:___________ 。
(7)下列事实能说明元素Y的非金属性比硫元素强的是___________ 。
a.Y单质通入 溶液中,溶液出现淡黄色浑浊
溶液中,溶液出现淡黄色浑浊
b.与 反应时,1mol Y单质得到的电子比1mol S多
反应时,1mol Y单质得到的电子比1mol S多
c.Y和S的简单氢化物受热时,前者的分解温度较高
d.Y元素的氧化物对应水化物的酸性比S强
已知:①溴水呈黄色,而且颜色随浓度增大而加深。
②
 容易从水中转移到
容易从水中转移到 中,导致下层(
中,导致下层( 层)因溶有
层)因溶有 显紫色。
显紫色。实验过程:
①打开弹簧夹,打开活塞a,滴加浓盐酸。
②当B和C中的溶液都变为黄色时,夹紧弹簧夹。
③当B中溶液黄色加深时关闭活塞a。
④……
(1)NaOH的电子式为
(2)A装置中制备氯气的离子方程式为
(3)B装置中主要反应的化学方程式为
(4)为验证溴的氧化性强于碘,过程④的操作和现象分别是
(5)过程③的实验目的是
(6)结合元素周期表,从原子结构的角度解释氯、溴、碘单质的氧化性逐渐减弱的原因:
(7)下列事实能说明元素Y的非金属性比硫元素强的是
a.Y单质通入
 溶液中,溶液出现淡黄色浑浊
溶液中,溶液出现淡黄色浑浊b.与
 反应时,1mol Y单质得到的电子比1mol S多
反应时,1mol Y单质得到的电子比1mol S多c.Y和S的简单氢化物受热时,前者的分解温度较高
d.Y元素的氧化物对应水化物的酸性比S强
您最近半年使用:0次
名校
解题方法
3 . 海水是资源宝库,下图是对海水资源的综合利用的部分片段(其中某些操作或试剂已省略)。 、
、 、
、 等杂质离子,需加入NaOH、
等杂质离子,需加入NaOH、 和
和 试剂,其中加入
试剂,其中加入 的作用是
的作用是______ 。
据国家海洋信息中心提供的数据,每kg海水中各种离子的含量(已经折算成物质的量)如下表所示。
有同学认为在除杂试剂的选择上,可以用 代替
代替 和NaOH,这样可以起到一举两得的作用,你认为是否合理?
和NaOH,这样可以起到一举两得的作用,你认为是否合理?______ ,理由是______ 。
根据以上数据,至少可以判断海水中还存在没有列出的其它______ (填“阳离子”、“阴离子”)。
(2)步骤Ⅰ中已获得游离态的溴,步骤Ⅱ将之转变成化合态的溴,其目的是______ 。
实验室模拟上述反应过程,将 水逐滴加到
水逐滴加到 溶液中,
溶液中, 水褪色,直至
水褪色,直至 不再褪色,未见有气泡产生;请写出
不再褪色,未见有气泡产生;请写出 与
与 溶液反应的离子方程式
溶液反应的离子方程式______ 。
再仿照步骤Ⅲ,向上述试管里的溶液中加入硫酸酸化,溶液中有大量气体产生,同时溶液重新再现 水的橙黄色。此时产生的气体是
水的橙黄色。此时产生的气体是______ 。

 、
、 、
、 等杂质离子,需加入NaOH、
等杂质离子,需加入NaOH、 和
和 试剂,其中加入
试剂,其中加入 的作用是
的作用是据国家海洋信息中心提供的数据,每kg海水中各种离子的含量(已经折算成物质的量)如下表所示。
离子 | 物质的量含量(mol/kg) |
| 0.51 |
| 0.46 |
| 0.028 |
| 0.054 |
| 0.01 |
| -0.01 |
 代替
代替 和NaOH,这样可以起到一举两得的作用,你认为是否合理?
和NaOH,这样可以起到一举两得的作用,你认为是否合理?根据以上数据,至少可以判断海水中还存在没有列出的其它
(2)步骤Ⅰ中已获得游离态的溴,步骤Ⅱ将之转变成化合态的溴,其目的是
实验室模拟上述反应过程,将
 水逐滴加到
水逐滴加到 溶液中,
溶液中, 水褪色,直至
水褪色,直至 不再褪色,未见有气泡产生;请写出
不再褪色,未见有气泡产生;请写出 与
与 溶液反应的离子方程式
溶液反应的离子方程式再仿照步骤Ⅲ,向上述试管里的溶液中加入硫酸酸化,溶液中有大量气体产生,同时溶液重新再现
 水的橙黄色。此时产生的气体是
水的橙黄色。此时产生的气体是
您最近半年使用:0次
名校
4 . 研究氨的制备、应用及氨氮的去除有重要意义。
(1)在固定体积的密闭容器中,进行如下化学反应: ,其平衡常数K与温度T的关系如下表。
,其平衡常数K与温度T的关系如下表。
①试判断
_______  (填写“>”“=”或“<”)
(填写“>”“=”或“<”)
②一定温度下,在 密闭容器中充入
密闭容器中充入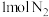 和
和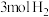 并发生反应。若容器容积恒定,
并发生反应。若容器容积恒定, 达到平衡时,气体的总物质的量为原来的
达到平衡时,气体的总物质的量为原来的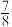 ,则
,则 的转化率
的转化率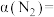
_______ ,以 表示该过程的反应速率
表示该过程的反应速率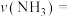
_______ 。
(2)氨的应用。以 和
和 为原料在一定温度和压强下合成尿素的反应分两步:
为原料在一定温度和压强下合成尿素的反应分两步:
I. 和
和 生成
生成 ;
;
Ⅱ. 分解生成
分解生成 。
。
反应过程中能量变化如图所示。 和
和 合成尿素反应的热化学方程式为
合成尿素反应的热化学方程式为_______ 。
②结合反应过程中能量变化示意图,下列说法正确的是_______ (填序号)。
a.活化能:反应I<反应Ⅱ
b.I为放热反应,Ⅱ为吸热反应
c.对总反应速率影响较大的是反应I
(3)氨氮的去除。下面是两种电化学除氨氮的方法。
方法一:电化学氧化法
有研究表明,当以碳材料为阴极, 可在阴极生成
可在阴极生成 ,并进一步生成氧化性更强的
,并进一步生成氧化性更强的 ,
, 可以将水中氨氮氧化为
可以将水中氨氮氧化为 。
。
①写出 去除氨气的化学反应方程式
去除氨气的化学反应方程式_______ 。
②阴极区加入 可进一步提高氨氮的去除率,结合如下图,用化学方程式、电极反应式和文字解释
可进一步提高氨氮的去除率,结合如下图,用化学方程式、电极反应式和文字解释 的作用
的作用_______ 。
用 溶液模拟氨氮废水,以镁作阳极、不锈钢作阴极进行电解,可将废水中的
溶液模拟氨氮废水,以镁作阳极、不锈钢作阴极进行电解,可将废水中的 转化为
转化为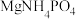 沉淀而除去。调节溶液初始
沉淀而除去。调节溶液初始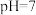 ,氨氮去除率和溶液
,氨氮去除率和溶液 随时间的变化情况如图所示。
随时间的变化情况如图所示。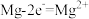 ,
, 。写出废水中生成
。写出废水中生成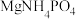 沉淀的离子方程式:
沉淀的离子方程式:_______ 。
④反应1h以后,氨氮去除率随时间的延长反而下降的原因是_______ 。
(1)在固定体积的密闭容器中,进行如下化学反应:
 ,其平衡常数K与温度T的关系如下表。
,其平衡常数K与温度T的关系如下表。| T/K | 298 | 398 | 498 |
| 平衡常数K | 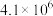 |  |  |

 (填写“>”“=”或“<”)
(填写“>”“=”或“<”)②一定温度下,在
 密闭容器中充入
密闭容器中充入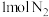 和
和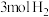 并发生反应。若容器容积恒定,
并发生反应。若容器容积恒定, 达到平衡时,气体的总物质的量为原来的
达到平衡时,气体的总物质的量为原来的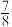 ,则
,则 的转化率
的转化率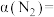
 表示该过程的反应速率
表示该过程的反应速率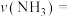
(2)氨的应用。以
 和
和 为原料在一定温度和压强下合成尿素的反应分两步:
为原料在一定温度和压强下合成尿素的反应分两步:I.
 和
和 生成
生成 ;
;Ⅱ.
 分解生成
分解生成 。
。反应过程中能量变化如图所示。

 和
和 合成尿素反应的热化学方程式为
合成尿素反应的热化学方程式为②结合反应过程中能量变化示意图,下列说法正确的是
a.活化能:反应I<反应Ⅱ
b.I为放热反应,Ⅱ为吸热反应
c.对总反应速率影响较大的是反应I
(3)氨氮的去除。下面是两种电化学除氨氮的方法。
方法一:电化学氧化法
有研究表明,当以碳材料为阴极,
 可在阴极生成
可在阴极生成 ,并进一步生成氧化性更强的
,并进一步生成氧化性更强的 ,
, 可以将水中氨氮氧化为
可以将水中氨氮氧化为 。
。①写出
 去除氨气的化学反应方程式
去除氨气的化学反应方程式②阴极区加入
 可进一步提高氨氮的去除率,结合如下图,用化学方程式、电极反应式和文字解释
可进一步提高氨氮的去除率,结合如下图,用化学方程式、电极反应式和文字解释 的作用
的作用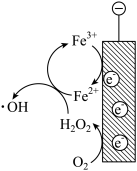
用
 溶液模拟氨氮废水,以镁作阳极、不锈钢作阴极进行电解,可将废水中的
溶液模拟氨氮废水,以镁作阳极、不锈钢作阴极进行电解,可将废水中的 转化为
转化为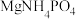 沉淀而除去。调节溶液初始
沉淀而除去。调节溶液初始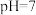 ,氨氮去除率和溶液
,氨氮去除率和溶液 随时间的变化情况如图所示。
随时间的变化情况如图所示。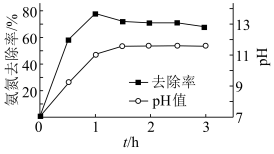
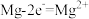 ,
, 。写出废水中生成
。写出废水中生成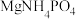 沉淀的离子方程式:
沉淀的离子方程式:④反应1h以后,氨氮去除率随时间的延长反而下降的原因是
您最近半年使用:0次
名校
5 . 利用元素的化合价物质类别的坐标系,可以对含某元素的各物质性质有整体的认识。如图是硫元素的常见化合价与部分物质类别的对应关系。______ ;检验其阴离子的方法是______ 。
(2)化石燃料的燃烧可产生 ,在上述图表中它是
,在上述图表中它是______ (图中的字母),为避免过多 进入大气造成酸雨,沿海的火电站可利用天然海水(显弱碱性的微粒主要是
进入大气造成酸雨,沿海的火电站可利用天然海水(显弱碱性的微粒主要是 )吸收该物质,成本低廉。其过程如下。
)吸收该物质,成本低廉。其过程如下。 时,发生的主要反应的离子方程式为
时,发生的主要反应的离子方程式为______ 。
②氧化的目的是将硫元素全部转化为 ,该过程中溶液pH
,该过程中溶液pH______ (填“升高”“不变”或“降低”)。
③排放海水与原海水相比,减少的 与增加的
与增加的 的物质的量之比的为
的物质的量之比的为______ 。
(3)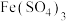 溶液脱除空气污染物X并再生的原理如图所示。反应I的离子方程式为
溶液脱除空气污染物X并再生的原理如图所示。反应I的离子方程式为______ ;每脱除170kg X,消耗标准状况下 的体积为
的体积为______ L。
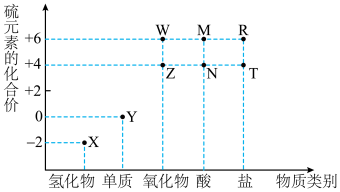
(2)化石燃料的燃烧可产生
 ,在上述图表中它是
,在上述图表中它是 进入大气造成酸雨,沿海的火电站可利用天然海水(显弱碱性的微粒主要是
进入大气造成酸雨,沿海的火电站可利用天然海水(显弱碱性的微粒主要是 )吸收该物质,成本低廉。其过程如下。
)吸收该物质,成本低廉。其过程如下。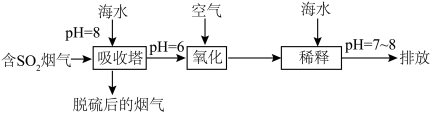
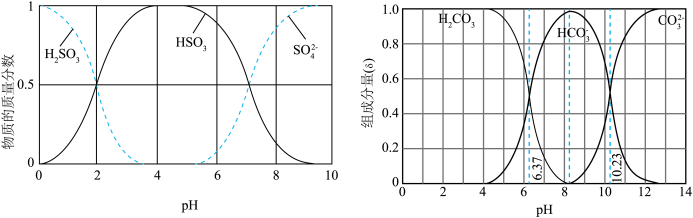
 时,发生的主要反应的离子方程式为
时,发生的主要反应的离子方程式为②氧化的目的是将硫元素全部转化为
 ,该过程中溶液pH
,该过程中溶液pH③排放海水与原海水相比,减少的
 与增加的
与增加的 的物质的量之比的为
的物质的量之比的为(3)
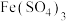 溶液脱除空气污染物X并再生的原理如图所示。反应I的离子方程式为
溶液脱除空气污染物X并再生的原理如图所示。反应I的离子方程式为 的体积为
的体积为
您最近半年使用:0次
6 . 在研究前18号元素时发现,随原子序数递增可以将它们排成如图所示的蜗牛形状。图中每个点代表一种元素,其中①代表氢元素。___________ 键(填“离子”或“共价”);
(2)写出由元素①、②、③形成的化合物的电子式___________ 。
(3)Li和元素③在同一族,现代航天工业中选择用 做供氧剂的原因是
做供氧剂的原因是___________ 。
(4)元素④在元素周期表中的位置是___________ 。
(5)自然界磷元素只存在一种稳定的核素 。约里奧-居里夫妇在核反应中用α粒子轰击
。约里奧-居里夫妇在核反应中用α粒子轰击 ,得到另一种核素
,得到另一种核素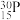 。
。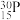 与
与 的关系是
的关系是___________ 。
(6)请设计实验验证元素④的非金属性弱于元素⑤的非金属性___________ (用离子方程式表示)。
(7)向由元素②、③、⑤按原子个数比1∶1∶1组成的化合物水溶液中滴入石蕊试液,溶液变成蓝色,一段时间后溶液颜色褪去,请解释原因___________ 。

(2)写出由元素①、②、③形成的化合物的电子式
(3)Li和元素③在同一族,现代航天工业中选择用
 做供氧剂的原因是
做供氧剂的原因是(4)元素④在元素周期表中的位置是
(5)自然界磷元素只存在一种稳定的核素
 。约里奧-居里夫妇在核反应中用α粒子轰击
。约里奧-居里夫妇在核反应中用α粒子轰击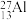 ,得到另一种核素
,得到另一种核素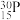 。
。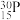 与
与 的关系是
的关系是(6)请设计实验验证元素④的非金属性弱于元素⑤的非金属性
(7)向由元素②、③、⑤按原子个数比1∶1∶1组成的化合物水溶液中滴入石蕊试液,溶液变成蓝色,一段时间后溶液颜色褪去,请解释原因
您最近半年使用:0次
7 . 实验室里可用如下图所示的装置制取氯酸钾、次氯酸钠,并验证氯水的性质。 的发生装置。
的发生装置。
(1)装置a中,为了使浓盐酸在反应中顺利滴入,应采取的措施是___________ 。
(2)比较制取氯酸钾和次氯酸钠的条件,你得出的结论是___________ 。
(3)将d中余气与f中产生的气体通入e中,产生的现象是___________ ,请用离子方程式表示产生此现象的原因:___________ 、___________ 。
(4)写出装置c中发生反应的化学方程式___________ 。
(5)工业上为了变废为宝,可用多种方式处理硫酸工业排出的尾气(主要含 ),其中之一便是用
),其中之一便是用 浆液吸收。溶液中
浆液吸收。溶液中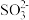 吸收
吸收 的离子方程式为
的离子方程式为___________ (已知20℃时 的溶解度为0.57g)。
的溶解度为0.57g)。
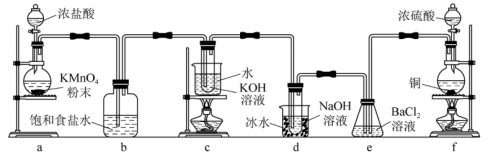
 的发生装置。
的发生装置。(1)装置a中,为了使浓盐酸在反应中顺利滴入,应采取的措施是
(2)比较制取氯酸钾和次氯酸钠的条件,你得出的结论是
(3)将d中余气与f中产生的气体通入e中,产生的现象是
(4)写出装置c中发生反应的化学方程式
(5)工业上为了变废为宝,可用多种方式处理硫酸工业排出的尾气(主要含
 ),其中之一便是用
),其中之一便是用 浆液吸收。溶液中
浆液吸收。溶液中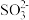 吸收
吸收 的离子方程式为
的离子方程式为 的溶解度为0.57g)。
的溶解度为0.57g)。
您最近半年使用:0次
解题方法
8 . 氯酸镁[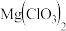 ]常用作催熟剂、除草剂等,实验室制备少量
]常用作催熟剂、除草剂等,实验室制备少量 的流程如下:
的流程如下: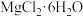 ,含有
,含有 、
、 等杂质。
等杂质。
②四种化合物的溶解度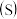 随温度
随温度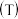 变化曲线如图2所示。
变化曲线如图2所示。
(1)加速卤块在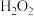 溶液中溶解的措施有:
溶液中溶解的措施有:_______ (任写一点)。
(2)加入 的作用是
的作用是_______ ,滤渣的成分_______ ,此时滤液中c(Fe3+) = ______ mol/L。(已知: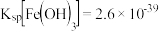 )
)
(3)加入 饱和溶液后发生反应的化学方程式为
饱和溶液后发生反应的化学方程式为________ (溶解度低的物质以沉淀形式析出),再进一步制 晶体的实验步骤依次为:
晶体的实验步骤依次为:
①加热蒸发;②_______ ;①______ ;④过滤洗涤。
产品中 含量的测定:
含量的测定:
步骤 :准确称量
:准确称量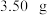 产品配成
产品配成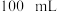 溶液。
溶液。
步骤 :取
:取 试液于锥形瓶中,加入
试液于锥形瓶中,加入 稀硫酸和
稀硫酸和 的
的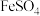 溶液,微热。
溶液,微热。
步骤 :冷却至室温,用
:冷却至室温,用 溶液滴定剩余的
溶液滴定剩余的 至终点。此过程中反应的离子方程式为:
至终点。此过程中反应的离子方程式为: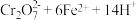 →
→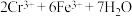 。
。
步骤 :将步骤
:将步骤 、
、 重复两次
重复两次
(4)①写出步骤 中发生反应的离子方程式:
中发生反应的离子方程式:________ 。
②步骤 中若滴定前不用标准液润洗滴定管,将会导致最终结果
中若滴定前不用标准液润洗滴定管,将会导致最终结果_____  填“偏大”、“偏小”或“不变”
填“偏大”、“偏小”或“不变” ;
;
(5)若平均消耗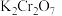 溶液
溶液 ,则产品中
,则产品中 的质量分数为
的质量分数为_______ 。(写出必要的计算过程)
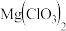 ]常用作催熟剂、除草剂等,实验室制备少量
]常用作催熟剂、除草剂等,实验室制备少量 的流程如下:
的流程如下: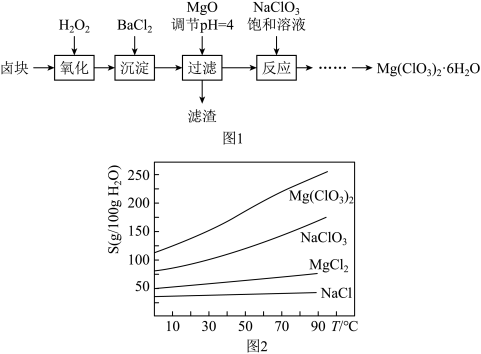
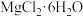 ,含有
,含有 、
、 等杂质。
等杂质。②四种化合物的溶解度
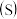 随温度
随温度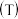 变化曲线如图2所示。
变化曲线如图2所示。(1)加速卤块在
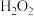 溶液中溶解的措施有:
溶液中溶解的措施有:(2)加入
 的作用是
的作用是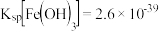 )
)(3)加入
 饱和溶液后发生反应的化学方程式为
饱和溶液后发生反应的化学方程式为 晶体的实验步骤依次为:
晶体的实验步骤依次为:①加热蒸发;②
产品中
 含量的测定:
含量的测定:步骤
 :准确称量
:准确称量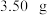 产品配成
产品配成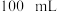 溶液。
溶液。步骤
 :取
:取 试液于锥形瓶中,加入
试液于锥形瓶中,加入 稀硫酸和
稀硫酸和 的
的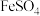 溶液,微热。
溶液,微热。步骤
 :冷却至室温,用
:冷却至室温,用 溶液滴定剩余的
溶液滴定剩余的 至终点。此过程中反应的离子方程式为:
至终点。此过程中反应的离子方程式为: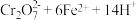 →
→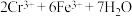 。
。步骤
 :将步骤
:将步骤 、
、 重复两次
重复两次(4)①写出步骤
 中发生反应的离子方程式:
中发生反应的离子方程式:②步骤
 中若滴定前不用标准液润洗滴定管,将会导致最终结果
中若滴定前不用标准液润洗滴定管,将会导致最终结果 填“偏大”、“偏小”或“不变”
填“偏大”、“偏小”或“不变” ;
;(5)若平均消耗
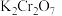 溶液
溶液 ,则产品中
,则产品中 的质量分数为
的质量分数为
您最近半年使用:0次
9 . 不同催化剂作用下NH3还原NOx的机理与效果是研究烟气(含NOx、O2、N2等)脱硝的热点。
(1)NH3还原NO的主反应为4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g)。
已知:N2(g)+O2(g)=2NO(g)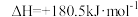 ;4NH3(g)+3O2(g)=2N2(g)+6H2O(g)
;4NH3(g)+3O2(g)=2N2(g)+6H2O(g) 
上述主反应的
____ 。
(2)在某钒催化剂中添加一定量Cu2O可加快NO的脱除效率,其可能机理如图所示(*表示物种吸附在催化剂表面,部分物种未画出)。____ 。
②烟气中若含有SO2,会生成NH4HSO4堵塞催化剂孔道。生成NH4HSO4的化学方程式为____ 。
(3)将模拟烟气(一定比例NOx、NH3、O2和N2)以一定流速通过装有Fe/Zr催化剂的反应管,测得NOx转化率随温度变化的曲线如图所示。_____ 。
②温度高于450℃时,NOx转化率已降低为负值,其可能原因是____ 。
(1)NH3还原NO的主反应为4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g)。
已知:N2(g)+O2(g)=2NO(g)
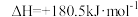 ;4NH3(g)+3O2(g)=2N2(g)+6H2O(g)
;4NH3(g)+3O2(g)=2N2(g)+6H2O(g) 
上述主反应的

(2)在某钒催化剂中添加一定量Cu2O可加快NO的脱除效率,其可能机理如图所示(*表示物种吸附在催化剂表面,部分物种未画出)。
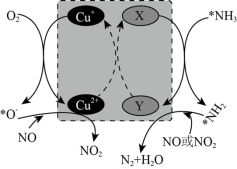
②烟气中若含有SO2,会生成NH4HSO4堵塞催化剂孔道。生成NH4HSO4的化学方程式为
(3)将模拟烟气(一定比例NOx、NH3、O2和N2)以一定流速通过装有Fe/Zr催化剂的反应管,测得NOx转化率随温度变化的曲线如图所示。
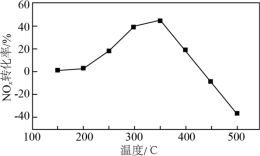
②温度高于450℃时,NOx转化率已降低为负值,其可能原因是
您最近半年使用:0次
解题方法
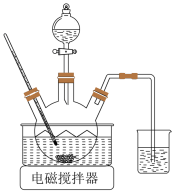
10 . 以软锰矿粉(含MnO2及少量Fe、Al、Si、Ca、Mg等的氧化物)为原料制备电池级MnO2。
(1)浸取。将一定量软锰矿粉与Na2SO3、H2SO4溶液中的一种配成悬浊液,加入三颈瓶中(如图)。70℃下通过分液漏斗缓慢滴加另一种溶液,充分反应,过滤。滴液漏斗中的溶液是_______ ;MnO2转化为Mn2+的离子方程式为_______ 。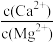 =
=_____ [Ksp(MgF2)=5×10-11,Ksp(CaF2)=5×10-9]
(3)写出基态Mn核外价层电子排布式___________ 。
(4)制备MnCO3。在搅拌下向100mL1mol/LMnSO4溶液中缓慢滴加1mol/LNH4HCO3溶液,过滤、洗涤、干燥,得到MnCO3固体。需加入NH4HCO3溶液的体积约为_______ 。
(1)浸取。将一定量软锰矿粉与Na2SO3、H2SO4溶液中的一种配成悬浊液,加入三颈瓶中(如图)。70℃下通过分液漏斗缓慢滴加另一种溶液,充分反应,过滤。滴液漏斗中的溶液是
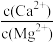 =
=(3)写出基态Mn核外价层电子排布式
(4)制备MnCO3。在搅拌下向100mL1mol/LMnSO4溶液中缓慢滴加1mol/LNH4HCO3溶液,过滤、洗涤、干燥,得到MnCO3固体。需加入NH4HCO3溶液的体积约为
您最近半年使用:0次








