2024·黑龙江哈尔滨·三模
名校
1 . 羟基氧化铁 为淡黄色固体,简称铁黄,可作颜料。制备铁黄的关键是先制备铁黄晶种,否则只能得到稀薄的、颜色暗淡的色浆,不具备颜料性能。实验室以硫酸亚铁铵为主要原料制备铁黄的实验步骤如下:
为淡黄色固体,简称铁黄,可作颜料。制备铁黄的关键是先制备铁黄晶种,否则只能得到稀薄的、颜色暗淡的色浆,不具备颜料性能。实验室以硫酸亚铁铵为主要原料制备铁黄的实验步骤如下:
 .产品制备及产率计算
.产品制备及产率计算
①制备晶种:称取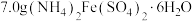 放入三颈烧瓶中,加入
放入三颈烧瓶中,加入 去离子水,恒温水浴加热至
去离子水,恒温水浴加热至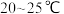 ,搅拌溶解,慢慢滴加
,搅拌溶解,慢慢滴加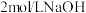 溶液,用
溶液,用 试纸检验至溶液
试纸检验至溶液 为
为 ,停止加碱,观察到出现沉淀并伴随沉淀颜色变化。
,停止加碱,观察到出现沉淀并伴随沉淀颜色变化。
②氧化过程:称取足量 ,加入上述溶液,于
,加入上述溶液,于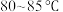 恒温水浴中进行氧化。氧化过程中,边搅拌边不断滴加
恒温水浴中进行氧化。氧化过程中,边搅拌边不断滴加 溶液至
溶液至 为
为 时,停止加热。
时,停止加热。
③洗涤、干燥:用去离子水洗涤生成的固体,抽滤,弃去母液,得到淡黄色固体。将其转入蒸发皿中,在水浴加热条件下烘干,称量,计算产率。
回答下列问题:
(1)用 试纸检验溶液
试纸检验溶液 的操作为
的操作为___________ 。
(2)①中观察到沉淀的颜色变为___________ 色时,证明已经成功制备晶种。
(3)②氧化过程中,发生反应的离子方程式为___________ 。
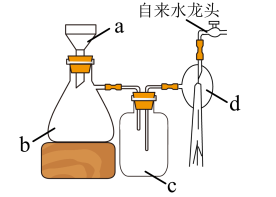
(4)抽滤装置如图,仪器c的作用为___________ ,和普通过滤相比,抽滤的优点有过滤速度更快和___________ 。 .产品纯度测定
.产品纯度测定
铁黄纯度可以通过产品的耗酸量确定。 ,
,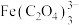 不与稀
不与稀 溶液反应。
溶液反应。
(5)铁黄溶于 标准液的离子方程式为
标准液的离子方程式为___________ 。
(6) 标准液和
标准液和 标准液浓度均为
标准液浓度均为 ,消耗两溶液的体积依次为
,消耗两溶液的体积依次为 ,计算铁黄的纯度为
,计算铁黄的纯度为___________ (列出计算式,不需化简)。
(7)若 溶液过量,会使测定结果
溶液过量,会使测定结果___________ (填“偏大”、“偏小”或“无影响”)。(已知草酸的电离平衡常数: )
)
 为淡黄色固体,简称铁黄,可作颜料。制备铁黄的关键是先制备铁黄晶种,否则只能得到稀薄的、颜色暗淡的色浆,不具备颜料性能。实验室以硫酸亚铁铵为主要原料制备铁黄的实验步骤如下:
为淡黄色固体,简称铁黄,可作颜料。制备铁黄的关键是先制备铁黄晶种,否则只能得到稀薄的、颜色暗淡的色浆,不具备颜料性能。实验室以硫酸亚铁铵为主要原料制备铁黄的实验步骤如下: .产品制备及产率计算
.产品制备及产率计算①制备晶种:称取
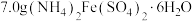 放入三颈烧瓶中,加入
放入三颈烧瓶中,加入 去离子水,恒温水浴加热至
去离子水,恒温水浴加热至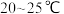 ,搅拌溶解,慢慢滴加
,搅拌溶解,慢慢滴加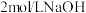 溶液,用
溶液,用 试纸检验至溶液
试纸检验至溶液 为
为 ,停止加碱,观察到出现沉淀并伴随沉淀颜色变化。
,停止加碱,观察到出现沉淀并伴随沉淀颜色变化。②氧化过程:称取足量
 ,加入上述溶液,于
,加入上述溶液,于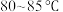 恒温水浴中进行氧化。氧化过程中,边搅拌边不断滴加
恒温水浴中进行氧化。氧化过程中,边搅拌边不断滴加 溶液至
溶液至 为
为 时,停止加热。
时,停止加热。③洗涤、干燥:用去离子水洗涤生成的固体,抽滤,弃去母液,得到淡黄色固体。将其转入蒸发皿中,在水浴加热条件下烘干,称量,计算产率。
回答下列问题:
(1)用
 试纸检验溶液
试纸检验溶液 的操作为
的操作为(2)①中观察到沉淀的颜色变为
(3)②氧化过程中,发生反应的离子方程式为
(4)抽滤装置如图,仪器c的作用为
 .产品纯度测定
.产品纯度测定铁黄纯度可以通过产品的耗酸量确定。

 ,
,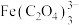 不与稀
不与稀 溶液反应。
溶液反应。(5)铁黄溶于
 标准液的离子方程式为
标准液的离子方程式为(6)
 标准液和
标准液和 标准液浓度均为
标准液浓度均为 ,消耗两溶液的体积依次为
,消耗两溶液的体积依次为 ,计算铁黄的纯度为
,计算铁黄的纯度为(7)若
 溶液过量,会使测定结果
溶液过量,会使测定结果 )
)
您最近一年使用:0次
7日内更新
|
374次组卷
|
3卷引用:江苏省南京外国语学校2024届高三下学期二模化学试题
2024·陕西榆林·三模
名校
2 .  (三氯化六氨合钴,
(三氯化六氨合钴,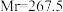 )是合成其他含钴配合物的重要原料,实验室中可由金属钴及其他原料制备
)是合成其他含钴配合物的重要原料,实验室中可由金属钴及其他原料制备 。
。
已知:①在 时,
时, 恰好完全沉淀为
恰好完全沉淀为 ;
;
②不同温度下 在水中的溶解度如图所示;
在水中的溶解度如图所示; 易潮解,Co(Ⅲ)的氧化性强于
易潮解,Co(Ⅲ)的氧化性强于 。
。
制备步骤如下:
Ⅰ. 的制备:用金属钴与氯气反应制备
的制备:用金属钴与氯气反应制备 ,实验中利用如图装置(连接处橡胶管省略)进行制备。
,实验中利用如图装置(连接处橡胶管省略)进行制备。 锥形瓶内加入
锥形瓶内加入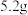 研细的
研细的 、
、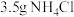 和
和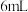 水,加热溶解后加入
水,加热溶解后加入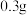 活性炭作催化剂。
活性炭作催化剂。
Ⅲ.冷却后,加入浓氨水混合均匀。控制温度在10℃以下并缓慢加入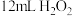 溶液。
溶液。
Ⅳ.在60℃下反应一段时间后,经过___________、过滤、洗涤、干燥等操作,得到橙黄色的 晶体
晶体 。
。
请回答下列问题:
(1)仪器a的名称为___________ 。
(2)用图中的装置组合制备 ,仪器的连接顺序为
,仪器的连接顺序为___________ 。装置B的作用是___________ 。
(3)制备三氯化六氨合钴的反应方程式为___________ 。
(4)在制备 时,加入浓氨水前,需在步骤Ⅱ中加入
时,加入浓氨水前,需在步骤Ⅱ中加入 ,请结合平衡移动原理解释原因
,请结合平衡移动原理解释原因___________ 。
(5)步骤Ⅲ中在加入 溶液时,控制温度在10℃以下缓慢加入的目的是
溶液时,控制温度在10℃以下缓慢加入的目的是___________ 。
(6)在步骤Ⅳ中过滤、洗涤、干燥之前的操作为___________ 、___________ 。
(7)制得 产品的产率为
产品的产率为___________ %(精确到0.1%)。
 (三氯化六氨合钴,
(三氯化六氨合钴,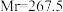 )是合成其他含钴配合物的重要原料,实验室中可由金属钴及其他原料制备
)是合成其他含钴配合物的重要原料,实验室中可由金属钴及其他原料制备 。
。已知:①在
 时,
时, 恰好完全沉淀为
恰好完全沉淀为 ;
;②不同温度下
 在水中的溶解度如图所示;
在水中的溶解度如图所示;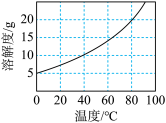
 易潮解,Co(Ⅲ)的氧化性强于
易潮解,Co(Ⅲ)的氧化性强于 。
。制备步骤如下:
Ⅰ.
 的制备:用金属钴与氯气反应制备
的制备:用金属钴与氯气反应制备 ,实验中利用如图装置(连接处橡胶管省略)进行制备。
,实验中利用如图装置(连接处橡胶管省略)进行制备。
 锥形瓶内加入
锥形瓶内加入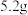 研细的
研细的 、
、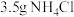 和
和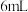 水,加热溶解后加入
水,加热溶解后加入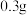 活性炭作催化剂。
活性炭作催化剂。Ⅲ.冷却后,加入浓氨水混合均匀。控制温度在10℃以下并缓慢加入
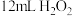 溶液。
溶液。Ⅳ.在60℃下反应一段时间后,经过___________、过滤、洗涤、干燥等操作,得到橙黄色的
 晶体
晶体 。
。请回答下列问题:
(1)仪器a的名称为
(2)用图中的装置组合制备
 ,仪器的连接顺序为
,仪器的连接顺序为(3)制备三氯化六氨合钴的反应方程式为
(4)在制备
 时,加入浓氨水前,需在步骤Ⅱ中加入
时,加入浓氨水前,需在步骤Ⅱ中加入 ,请结合平衡移动原理解释原因
,请结合平衡移动原理解释原因(5)步骤Ⅲ中在加入
 溶液时,控制温度在10℃以下缓慢加入的目的是
溶液时,控制温度在10℃以下缓慢加入的目的是(6)在步骤Ⅳ中过滤、洗涤、干燥之前的操作为
(7)制得
 产品的产率为
产品的产率为
您最近一年使用:0次
解题方法
3 . 高效氧化剂亚氯酸钠( )常用于烟气脱硝(
)常用于烟气脱硝( )和废水脱除氨氮。
)和废水脱除氨氮。
(1) 的制备。一种制备
的制备。一种制备 的过程可表示为
的过程可表示为_______ 。
②“反应1”的产物 经净化后常作为饮用水消毒剂替代传统的
经净化后常作为饮用水消毒剂替代传统的 ,从消毒后饮用水水质和消毒效率(单位质量消毒剂被还原时得电子数)的角度考虑,用
,从消毒后饮用水水质和消毒效率(单位质量消毒剂被还原时得电子数)的角度考虑,用 替代
替代 的原因是
的原因是_______ 。
(2) 溶液对烟气脱硝。
溶液对烟气脱硝。
①酸性条件下, 可催化溶液中的
可催化溶液中的 产生氧化性更强的
产生氧化性更强的 气体,总反应可表示为
气体,总反应可表示为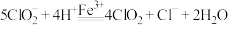 。请补充完整过程Ⅱ的离子方程式:
。请补充完整过程Ⅱ的离子方程式:
I.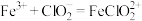 ;
;
Ⅱ._______ ;
Ⅲ.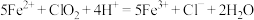 。
。
② 催化
催化 溶液脱硝。其他条件相同时,烟气中NO氧化率随
溶液脱硝。其他条件相同时,烟气中NO氧化率随 、反应温度的变化分别如图所示。
、反应温度的变化分别如图所示。 增大而增大的原因是
增大而增大的原因是_______ 。
ii.温度升高,NO氧化率先增大后减小的可能原因是_______ 。
(3) 溶液处理氨氮废水。向一定量酸性氨氮废水中加入一定体积已知浓度的
溶液处理氨氮废水。向一定量酸性氨氮废水中加入一定体积已知浓度的 溶液,用传感器测得溶液中
溶液,用传感器测得溶液中 与
与 含量随反应时间的变化如图所示。判断该实验中被氧化的
含量随反应时间的变化如图所示。判断该实验中被氧化的 是否全部转化为
是否全部转化为 的依据为
的依据为_______ 。
 )常用于烟气脱硝(
)常用于烟气脱硝( )和废水脱除氨氮。
)和废水脱除氨氮。(1)
 的制备。一种制备
的制备。一种制备 的过程可表示为
的过程可表示为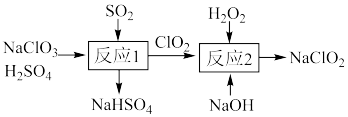
②“反应1”的产物
 经净化后常作为饮用水消毒剂替代传统的
经净化后常作为饮用水消毒剂替代传统的 ,从消毒后饮用水水质和消毒效率(单位质量消毒剂被还原时得电子数)的角度考虑,用
,从消毒后饮用水水质和消毒效率(单位质量消毒剂被还原时得电子数)的角度考虑,用 替代
替代 的原因是
的原因是(2)
 溶液对烟气脱硝。
溶液对烟气脱硝。①酸性条件下,
 可催化溶液中的
可催化溶液中的 产生氧化性更强的
产生氧化性更强的 气体,总反应可表示为
气体,总反应可表示为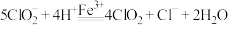 。请补充完整过程Ⅱ的离子方程式:
。请补充完整过程Ⅱ的离子方程式:I.
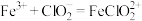 ;
;Ⅱ.
Ⅲ.
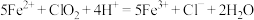 。
。②
 催化
催化 溶液脱硝。其他条件相同时,烟气中NO氧化率随
溶液脱硝。其他条件相同时,烟气中NO氧化率随 、反应温度的变化分别如图所示。
、反应温度的变化分别如图所示。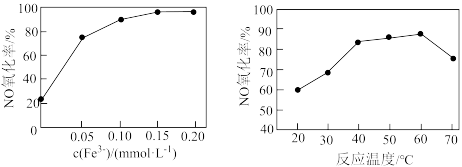
 增大而增大的原因是
增大而增大的原因是ii.温度升高,NO氧化率先增大后减小的可能原因是
(3)
 溶液处理氨氮废水。向一定量酸性氨氮废水中加入一定体积已知浓度的
溶液处理氨氮废水。向一定量酸性氨氮废水中加入一定体积已知浓度的 溶液,用传感器测得溶液中
溶液,用传感器测得溶液中 与
与 含量随反应时间的变化如图所示。判断该实验中被氧化的
含量随反应时间的变化如图所示。判断该实验中被氧化的 是否全部转化为
是否全部转化为 的依据为
的依据为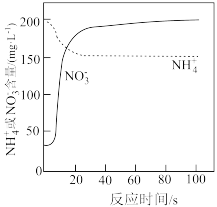
您最近一年使用:0次
名校
解题方法
4 . 海水是资源宝库,下图是对海水资源的综合利用的部分片段(其中某些操作或试剂已省略)。 、
、 、
、 等杂质离子,需加入NaOH、
等杂质离子,需加入NaOH、 和
和 试剂,其中加入
试剂,其中加入 的作用是
的作用是______ 。
据国家海洋信息中心提供的数据,每kg海水中各种离子的含量(已经折算成物质的量)如下表所示。
有同学认为在除杂试剂的选择上,可以用 代替
代替 和NaOH,这样可以起到一举两得的作用,你认为是否合理?
和NaOH,这样可以起到一举两得的作用,你认为是否合理?______ ,理由是______ 。
根据以上数据,至少可以判断海水中还存在没有列出的其它______ (填“阳离子”、“阴离子”)。
(2)步骤Ⅰ中已获得游离态的溴,步骤Ⅱ将之转变成化合态的溴,其目的是______ 。
实验室模拟上述反应过程,将 水逐滴加到
水逐滴加到 溶液中,
溶液中, 水褪色,直至
水褪色,直至 不再褪色,未见有气泡产生;请写出
不再褪色,未见有气泡产生;请写出 与
与 溶液反应的离子方程式
溶液反应的离子方程式______ 。
再仿照步骤Ⅲ,向上述试管里的溶液中加入硫酸酸化,溶液中有大量气体产生,同时溶液重新再现 水的橙黄色。此时产生的气体是
水的橙黄色。此时产生的气体是______ 。

 、
、 、
、 等杂质离子,需加入NaOH、
等杂质离子,需加入NaOH、 和
和 试剂,其中加入
试剂,其中加入 的作用是
的作用是据国家海洋信息中心提供的数据,每kg海水中各种离子的含量(已经折算成物质的量)如下表所示。
离子 | 物质的量含量(mol/kg) |
| 0.51 |
| 0.46 |
| 0.028 |
| 0.054 |
| 0.01 |
| -0.01 |
 代替
代替 和NaOH,这样可以起到一举两得的作用,你认为是否合理?
和NaOH,这样可以起到一举两得的作用,你认为是否合理?根据以上数据,至少可以判断海水中还存在没有列出的其它
(2)步骤Ⅰ中已获得游离态的溴,步骤Ⅱ将之转变成化合态的溴,其目的是
实验室模拟上述反应过程,将
 水逐滴加到
水逐滴加到 溶液中,
溶液中, 水褪色,直至
水褪色,直至 不再褪色,未见有气泡产生;请写出
不再褪色,未见有气泡产生;请写出 与
与 溶液反应的离子方程式
溶液反应的离子方程式再仿照步骤Ⅲ,向上述试管里的溶液中加入硫酸酸化,溶液中有大量气体产生,同时溶液重新再现
 水的橙黄色。此时产生的气体是
水的橙黄色。此时产生的气体是
您最近一年使用:0次
名校
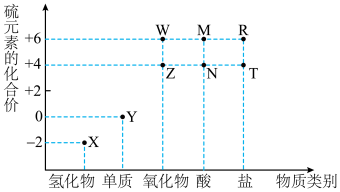
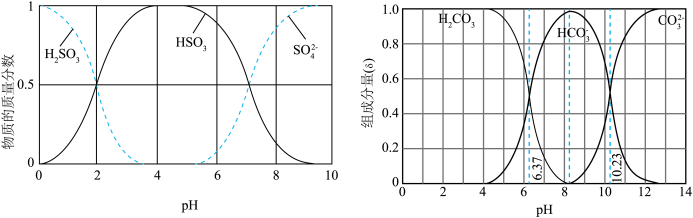
5 . 利用元素的化合价物质类别的坐标系,可以对含某元素的各物质性质有整体的认识。如图是硫元素的常见化合价与部分物质类别的对应关系。______ ;检验其阴离子的方法是______ 。
(2)化石燃料的燃烧可产生 ,在上述图表中它是
,在上述图表中它是______ (图中的字母),为避免过多 进入大气造成酸雨,沿海的火电站可利用天然海水(显弱碱性的微粒主要是
进入大气造成酸雨,沿海的火电站可利用天然海水(显弱碱性的微粒主要是 )吸收该物质,成本低廉。其过程如下。
)吸收该物质,成本低廉。其过程如下。 时,发生的主要反应的离子方程式为
时,发生的主要反应的离子方程式为______ 。
②氧化的目的是将硫元素全部转化为 ,该过程中溶液pH
,该过程中溶液pH______ (填“升高”“不变”或“降低”)。
③排放海水与原海水相比,减少的 与增加的
与增加的 的物质的量之比的为
的物质的量之比的为______ 。
(3)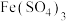 溶液脱除空气污染物X并再生的原理如图所示。反应I的离子方程式为
溶液脱除空气污染物X并再生的原理如图所示。反应I的离子方程式为______ ;每脱除170kg X,消耗标准状况下 的体积为
的体积为______ L。
(2)化石燃料的燃烧可产生
 ,在上述图表中它是
,在上述图表中它是 进入大气造成酸雨,沿海的火电站可利用天然海水(显弱碱性的微粒主要是
进入大气造成酸雨,沿海的火电站可利用天然海水(显弱碱性的微粒主要是 )吸收该物质,成本低廉。其过程如下。
)吸收该物质,成本低廉。其过程如下。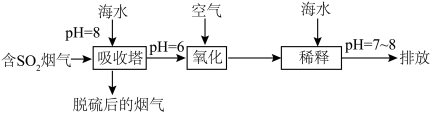
 时,发生的主要反应的离子方程式为
时,发生的主要反应的离子方程式为②氧化的目的是将硫元素全部转化为
 ,该过程中溶液pH
,该过程中溶液pH③排放海水与原海水相比,减少的
 与增加的
与增加的 的物质的量之比的为
的物质的量之比的为(3)
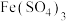 溶液脱除空气污染物X并再生的原理如图所示。反应I的离子方程式为
溶液脱除空气污染物X并再生的原理如图所示。反应I的离子方程式为 的体积为
的体积为
您最近一年使用:0次
6 . 不同催化剂作用下NH3还原NOx的机理与效果是研究烟气(含NOx、O2、N2等)脱硝的热点。
(1)NH3还原NO的主反应为4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g)。
已知:N2(g)+O2(g)=2NO(g)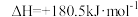 ;4NH3(g)+3O2(g)=2N2(g)+6H2O(g)
;4NH3(g)+3O2(g)=2N2(g)+6H2O(g) 
上述主反应的
____ 。
(2)在某钒催化剂中添加一定量Cu2O可加快NO的脱除效率,其可能机理如图所示(*表示物种吸附在催化剂表面,部分物种未画出)。____ 。
②烟气中若含有SO2,会生成NH4HSO4堵塞催化剂孔道。生成NH4HSO4的化学方程式为____ 。
(3)将模拟烟气(一定比例NOx、NH3、O2和N2)以一定流速通过装有Fe/Zr催化剂的反应管,测得NOx转化率随温度变化的曲线如图所示。_____ 。
②温度高于450℃时,NOx转化率已降低为负值,其可能原因是____ 。
(1)NH3还原NO的主反应为4NH3(g)+4NO(g)+O2(g)=4N2(g)+6H2O(g)。
已知:N2(g)+O2(g)=2NO(g)
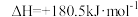 ;4NH3(g)+3O2(g)=2N2(g)+6H2O(g)
;4NH3(g)+3O2(g)=2N2(g)+6H2O(g) 
上述主反应的

(2)在某钒催化剂中添加一定量Cu2O可加快NO的脱除效率,其可能机理如图所示(*表示物种吸附在催化剂表面,部分物种未画出)。
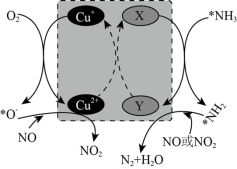
②烟气中若含有SO2,会生成NH4HSO4堵塞催化剂孔道。生成NH4HSO4的化学方程式为
(3)将模拟烟气(一定比例NOx、NH3、O2和N2)以一定流速通过装有Fe/Zr催化剂的反应管,测得NOx转化率随温度变化的曲线如图所示。
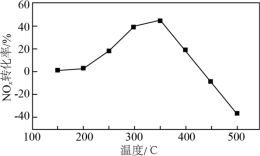
②温度高于450℃时,NOx转化率已降低为负值,其可能原因是
您最近一年使用:0次
解题方法
7 . 以软锰矿粉(含MnO2及少量Fe、Al、Si、Ca、Mg等的氧化物)为原料制备电池级MnO2。
(1)浸取。将一定量软锰矿粉与Na2SO3、H2SO4溶液中的一种配成悬浊液,加入三颈瓶中(如图)。70℃下通过分液漏斗缓慢滴加另一种溶液,充分反应,过滤。滴液漏斗中的溶液是_______ ;MnO2转化为Mn2+的离子方程式为_______ 。 =
=_____ [Ksp(MgF2)=5×10-11,Ksp(CaF2)=5×10-9]
(3)写出基态Mn核外价层电子排布式___________ 。
(4)制备MnCO3。在搅拌下向100mL1mol/LMnSO4溶液中缓慢滴加1mol/LNH4HCO3溶液,过滤、洗涤、干燥,得到MnCO3固体。需加入NH4HCO3溶液的体积约为_______ 。
(1)浸取。将一定量软锰矿粉与Na2SO3、H2SO4溶液中的一种配成悬浊液,加入三颈瓶中(如图)。70℃下通过分液漏斗缓慢滴加另一种溶液,充分反应,过滤。滴液漏斗中的溶液是
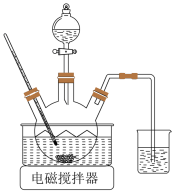
 =
=(3)写出基态Mn核外价层电子排布式
(4)制备MnCO3。在搅拌下向100mL1mol/LMnSO4溶液中缓慢滴加1mol/LNH4HCO3溶液,过滤、洗涤、干燥,得到MnCO3固体。需加入NH4HCO3溶液的体积约为
您最近一年使用:0次
名校
解题方法
8 . 实验室以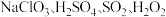 和
和 为原料,制备
为原料,制备 和无水
和无水 ,其主要流程如图所示:
,其主要流程如图所示:
②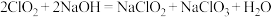
③ 在溶液中过饱和时,若溶液温度低于
在溶液中过饱和时,若溶液温度低于 ,析出
,析出 ;若溶液温度高于
;若溶液温度高于 ,则析出
,则析出 ;温度高于
;温度高于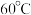 时,
时, 发生分解生成
发生分解生成 和
和 。
。
(1)反应1中 与
与 反应制得
反应制得 气体,该反应的化学方程式为
气体,该反应的化学方程式为___________ 。
(2)在图1所示装置中发生反应2生成 ,反应过程中放出大量的热。
,反应过程中放出大量的热。 与
与 的物质的量之比需要控制在0.8左右,原因可能是
的物质的量之比需要控制在0.8左右,原因可能是___________ 。
②装置Ⅱ的作用是___________ 。
(3)反应结束后,为从母液2中获得 晶体,需进行以下操作:
晶体,需进行以下操作:
①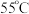 蒸发结晶;②趁热过滤;③用
蒸发结晶;②趁热过滤;③用___________  热水洗涤晶体:④低温干燥,得到成品。
热水洗涤晶体:④低温干燥,得到成品。
(4) 的溶解度曲线如图2所示。请补充完整由母液1制备无水
的溶解度曲线如图2所示。请补充完整由母液1制备无水 的实验方案:
的实验方案:___________ ,用无水乙醇洗涤,干燥得到产品。
(可选用的试剂: 溶液、氨水;除常用仪器外须使用的仪器:
溶液、氨水;除常用仪器外须使用的仪器: 计)
计)
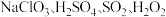 和
和 为原料,制备
为原料,制备 和无水
和无水 ,其主要流程如图所示:
,其主要流程如图所示: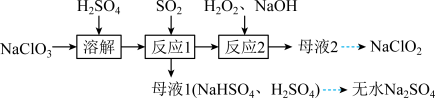

②
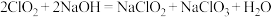
③
 在溶液中过饱和时,若溶液温度低于
在溶液中过饱和时,若溶液温度低于 ,析出
,析出 ;若溶液温度高于
;若溶液温度高于 ,则析出
,则析出 ;温度高于
;温度高于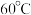 时,
时, 发生分解生成
发生分解生成 和
和 。
。(1)反应1中
 与
与 反应制得
反应制得 气体,该反应的化学方程式为
气体,该反应的化学方程式为(2)在图1所示装置中发生反应2生成
 ,反应过程中放出大量的热。
,反应过程中放出大量的热。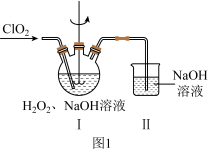
 与
与 的物质的量之比需要控制在0.8左右,原因可能是
的物质的量之比需要控制在0.8左右,原因可能是②装置Ⅱ的作用是
(3)反应结束后,为从母液2中获得
 晶体,需进行以下操作:
晶体,需进行以下操作:①
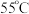 蒸发结晶;②趁热过滤;③用
蒸发结晶;②趁热过滤;③用 热水洗涤晶体:④低温干燥,得到成品。
热水洗涤晶体:④低温干燥,得到成品。(4)
 的溶解度曲线如图2所示。请补充完整由母液1制备无水
的溶解度曲线如图2所示。请补充完整由母液1制备无水 的实验方案:
的实验方案:(可选用的试剂:
 溶液、氨水;除常用仪器外须使用的仪器:
溶液、氨水;除常用仪器外须使用的仪器: 计)
计)
您最近一年使用:0次
名校
解题方法
9 . 实验室利用 和亚硫酰氯
和亚硫酰氯 制备无水
制备无水 的装置如图所示(加热及夹持装置略)。已知:
的装置如图所示(加热及夹持装置略)。已知: 沸点为
沸点为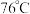 ,遇水极易反应生成两种酸性气体。
,遇水极易反应生成两种酸性气体。
(1)①实验开始先通 ,一段时间后,先加热装置
,一段时间后,先加热装置___________ (填“ ”或“
”或“ ”)。
”)。
装置 内发生反应的化学方程式为
内发生反应的化学方程式为___________ 。
装置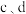 共同起到的作用是
共同起到的作用是___________ 。
②现有含少量杂质的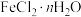 ,为测定
,为测定 值进行如下实验:
值进行如下实验:
实验Ⅰ:称取 样品,用足量稀硫酸溶解后,滴入
样品,用足量稀硫酸溶解后,滴入 标准溶液
标准溶液 与
与 恰好完全反应(反应过程中
恰好完全反应(反应过程中 化为
化为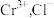 不反应)。
不反应)。
实验Ⅱ:另取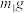 样品,利用上述装置与足量
样品,利用上述装置与足量 反应后,固体质量为
反应后,固体质量为 。
。
则
___________ ;下列情况会导致 测量值偏小的是
测量值偏小的是___________ (填标号)。
A.样品中含少量 杂质
杂质
B.样品与 反应时失水不充分
反应时失水不充分
 实验Ⅰ中,称重后样品发生了潮解
实验Ⅰ中,称重后样品发生了潮解
(2)①用上述装置,根据反应 制备
制备 (已知:
(已知: 与
与 互溶,遇水极易反应)。写出
互溶,遇水极易反应)。写出 的电子式
的电子式___________ ,选择合适仪器并组装蒸馏装置对 混合物进行蒸馏提纯(加热及夹持装置略),安装顺序为①⑨⑧
混合物进行蒸馏提纯(加热及夹持装置略),安装顺序为①⑨⑧___________ (填序号)。 在焦炭、
在焦炭、 作用下高温煅烧也可制备
作用下高温煅烧也可制备 ,在
,在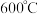 的沸腾炉中充分反应后,混合气体中各组分的体积分数如下表:
的沸腾炉中充分反应后,混合气体中各组分的体积分数如下表:
该温度下, 与
与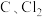 ,反应的总化学方程式为
,反应的总化学方程式为___________ ;
随着温度升高,尾气中 的含量升高,原因是
的含量升高,原因是___________ 。
 和亚硫酰氯
和亚硫酰氯 制备无水
制备无水 的装置如图所示(加热及夹持装置略)。已知:
的装置如图所示(加热及夹持装置略)。已知: 沸点为
沸点为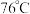 ,遇水极易反应生成两种酸性气体。
,遇水极易反应生成两种酸性气体。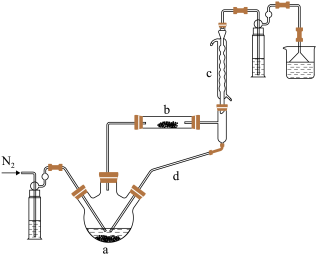
(1)①实验开始先通
 ,一段时间后,先加热装置
,一段时间后,先加热装置 ”或“
”或“ ”)。
”)。装置
 内发生反应的化学方程式为
内发生反应的化学方程式为装置
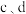 共同起到的作用是
共同起到的作用是②现有含少量杂质的
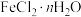 ,为测定
,为测定 值进行如下实验:
值进行如下实验:实验Ⅰ:称取
 样品,用足量稀硫酸溶解后,滴入
样品,用足量稀硫酸溶解后,滴入 标准溶液
标准溶液 与
与 恰好完全反应(反应过程中
恰好完全反应(反应过程中 化为
化为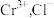 不反应)。
不反应)。实验Ⅱ:另取
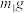 样品,利用上述装置与足量
样品,利用上述装置与足量 反应后,固体质量为
反应后,固体质量为 。
。则

 测量值偏小的是
测量值偏小的是A.样品中含少量
 杂质
杂质B.样品与
 反应时失水不充分
反应时失水不充分 实验Ⅰ中,称重后样品发生了潮解
实验Ⅰ中,称重后样品发生了潮解(2)①用上述装置,根据反应
 制备
制备 (已知:
(已知: 与
与 互溶,遇水极易反应)。写出
互溶,遇水极易反应)。写出 的电子式
的电子式 混合物进行蒸馏提纯(加热及夹持装置略),安装顺序为①⑨⑧
混合物进行蒸馏提纯(加热及夹持装置略),安装顺序为①⑨⑧
 在焦炭、
在焦炭、 作用下高温煅烧也可制备
作用下高温煅烧也可制备 ,在
,在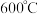 的沸腾炉中充分反应后,混合气体中各组分的体积分数如下表:
的沸腾炉中充分反应后,混合气体中各组分的体积分数如下表:| 物质 |  |  |  |  |
| 体积分数 |  | 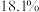 |  |  |
 与
与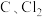 ,反应的总化学方程式为
,反应的总化学方程式为随着温度升高,尾气中
 的含量升高,原因是
的含量升高,原因是
您最近一年使用:0次
名校
解题方法
10 . 氮、磷、砷 、锑
、锑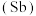 、铋
、铋 、镆
、镆 为元素周期表中原子序数依次增大的同主族元素。回答下列问题:
为元素周期表中原子序数依次增大的同主族元素。回答下列问题:
(1) 中
中 键和
键和 键的数目比例是
键的数目比例是___________ ,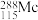 的中子数为
的中子数为___________ 。
(2)①已知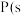 ,白磷)
,白磷) ,黑磷),该反应中
,黑磷),该反应中 的固态白磷转化为固态黑磷,放出
的固态白磷转化为固态黑磷,放出 的热量;
的热量;
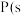 ,白磷)
,白磷) ,红磷),该反应中
,红磷),该反应中 的固态白磷转化为固态红磷,放出
的固态白磷转化为固态红磷,放出 的热量;
的热量;
由此推知,其中最稳定的磷单质是___________ 。
②比较氮和磷氢化物的热稳定性:
___________  (填“
(填“ ”“
”“ ”);写出
”);写出 结构式
结构式___________ 。
③ 与卤化氢的反应和
与卤化氢的反应和 与卤化氢的反应相似,产物的结构和性质也相似。
与卤化氢的反应相似,产物的结构和性质也相似。
下列对 与
与 反应产物的推断正确的是
反应产物的推断正确的是___________ (填序号)。
 不能与
不能与 反应
反应  含离子键、共价键
含离子键、共价键  受热易分解
受热易分解
(3)已知 溶于水后的电离方程式为
溶于水后的电离方程式为 ,若分别向上述混合体系中加入稀硫酸、
,若分别向上述混合体系中加入稀硫酸、 溶液,则生成的正盐的化学式分别为
溶液,则生成的正盐的化学式分别为___________ 、___________ 。
(4) 能与水以等物质的量之比发生较强烈的反应,生成难溶的
能与水以等物质的量之比发生较强烈的反应,生成难溶的 ,写出该反应的化学方程式
,写出该反应的化学方程式___________ 。
(5)某工厂采用辉铋矿(主要成分为 ,含有
,含有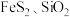 杂质)与软锰矿(主要成分为
杂质)与软锰矿(主要成分为 )联合焙烧法制备
)联合焙烧法制备 和
和 ,工艺流程如图所示:
,工艺流程如图所示: 分解为
分解为 转变为
转变为 ;
;
②金属活动性: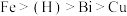 ;
;
③相关金属离子形成氢氧化物的 范围如下:
范围如下:
① 在元素周期表中的位置是
在元素周期表中的位置是___________ ,基态原子价层电子排布式为___________ 。
② 在空气中单独焙烧生成
在空气中单独焙烧生成 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
③滤渣的主要成分为___________ (填化学式)。
④生成气体 的离子方程式为
的离子方程式为___________ 。
⑤加入金属 的目的是
的目的是___________ 。
 、锑
、锑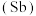 、铋
、铋 、镆
、镆 为元素周期表中原子序数依次增大的同主族元素。回答下列问题:
为元素周期表中原子序数依次增大的同主族元素。回答下列问题:(1)
 中
中 键和
键和 键的数目比例是
键的数目比例是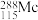 的中子数为
的中子数为(2)①已知
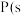 ,白磷)
,白磷) ,黑磷),该反应中
,黑磷),该反应中 的固态白磷转化为固态黑磷,放出
的固态白磷转化为固态黑磷,放出 的热量;
的热量;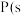 ,白磷)
,白磷) ,红磷),该反应中
,红磷),该反应中 的固态白磷转化为固态红磷,放出
的固态白磷转化为固态红磷,放出 的热量;
的热量;由此推知,其中最稳定的磷单质是
②比较氮和磷氢化物的热稳定性:

 (填“
(填“ ”“
”“ ”);写出
”);写出 结构式
结构式③
 与卤化氢的反应和
与卤化氢的反应和 与卤化氢的反应相似,产物的结构和性质也相似。
与卤化氢的反应相似,产物的结构和性质也相似。下列对
 与
与 反应产物的推断正确的是
反应产物的推断正确的是 不能与
不能与 反应
反应  含离子键、共价键
含离子键、共价键  受热易分解
受热易分解(3)已知
 溶于水后的电离方程式为
溶于水后的电离方程式为 ,若分别向上述混合体系中加入稀硫酸、
,若分别向上述混合体系中加入稀硫酸、 溶液,则生成的正盐的化学式分别为
溶液,则生成的正盐的化学式分别为(4)
 能与水以等物质的量之比发生较强烈的反应,生成难溶的
能与水以等物质的量之比发生较强烈的反应,生成难溶的 ,写出该反应的化学方程式
,写出该反应的化学方程式(5)某工厂采用辉铋矿(主要成分为
 ,含有
,含有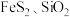 杂质)与软锰矿(主要成分为
杂质)与软锰矿(主要成分为 )联合焙烧法制备
)联合焙烧法制备 和
和 ,工艺流程如图所示:
,工艺流程如图所示:
 分解为
分解为 转变为
转变为 ;
;②金属活动性:
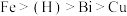 ;
;③相关金属离子形成氢氧化物的
 范围如下:
范围如下:开始沉淀 | 完全沉淀 | |
 | 6.5 | 8.3 |
 | 1.6 | 2.8 |
 | 8.1 | 10.1 |
 在元素周期表中的位置是
在元素周期表中的位置是②
 在空气中单独焙烧生成
在空气中单独焙烧生成 ,该反应的化学方程式为
,该反应的化学方程式为③滤渣的主要成分为
④生成气体
 的离子方程式为
的离子方程式为⑤加入金属
 的目的是
的目的是
您最近一年使用:0次








