名校
解题方法
1 . 回答下列问题
(1)图1记录了1940~2000的60年间 排放总量的变化,以及产生
排放总量的变化,以及产生 的主要因素,燃料燃烧和交通运输是空气中
的主要因素,燃料燃烧和交通运输是空气中 的两大主要来源,请用方程式解释为什么交通运输中会产生
的两大主要来源,请用方程式解释为什么交通运输中会产生 的原因
的原因______ 。 排放量迅速降低,其中原因主要有三:
排放量迅速降低,其中原因主要有三:
①工业生产中的 尾气主要通过集中处理而大幅减少,以碱吸收法和氨还原法为要。
尾气主要通过集中处理而大幅减少,以碱吸收法和氨还原法为要。
碱液吸收法中沙及到的主要反应为: ,
, 。
。
若碱液回收尾气以后,溶液中 和
和 的物质的量之比为1∶15,则尾气中NO和
的物质的量之比为1∶15,则尾气中NO和 的体积比为
的体积比为______ 。
氨还原法是在催化剂作用下,用 还原NO或
还原NO或 ,相应的化学反应方程式分别为
,相应的化学反应方程式分别为______ 、______ 。
若在相同条件下消耗的 和生成的
和生成的 的体积相等,则氮氧化物中的x为
的体积相等,则氮氧化物中的x为______ 。
②交通运输中汽车在尾气排放之前经过三元催化剂的处理,促使尾气中的CO和NO相互反应,转化为可以参与大气循环的气体,其反应方程式为______ 。
③结合社会生活中交通工具的变化,你认为 的排放总量的下降,还与哪些因素有关?
的排放总量的下降,还与哪些因素有关?______ (请至少例举一条)
(1)图1记录了1940~2000的60年间
 排放总量的变化,以及产生
排放总量的变化,以及产生 的主要因素,燃料燃烧和交通运输是空气中
的主要因素,燃料燃烧和交通运输是空气中 的两大主要来源,请用方程式解释为什么交通运输中会产生
的两大主要来源,请用方程式解释为什么交通运输中会产生 的原因
的原因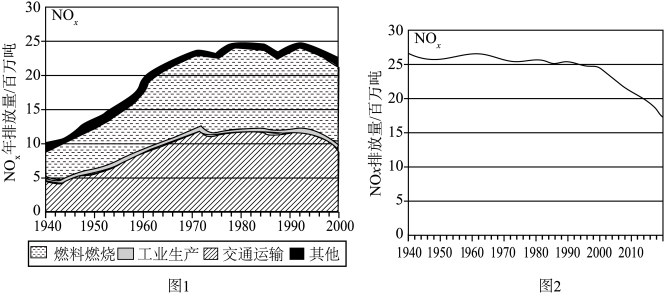
 排放量迅速降低,其中原因主要有三:
排放量迅速降低,其中原因主要有三:①工业生产中的
 尾气主要通过集中处理而大幅减少,以碱吸收法和氨还原法为要。
尾气主要通过集中处理而大幅减少,以碱吸收法和氨还原法为要。碱液吸收法中沙及到的主要反应为:
 ,
, 。
。若碱液回收尾气以后,溶液中
 和
和 的物质的量之比为1∶15,则尾气中NO和
的物质的量之比为1∶15,则尾气中NO和 的体积比为
的体积比为氨还原法是在催化剂作用下,用
 还原NO或
还原NO或 ,相应的化学反应方程式分别为
,相应的化学反应方程式分别为若在相同条件下消耗的
 和生成的
和生成的 的体积相等,则氮氧化物中的x为
的体积相等,则氮氧化物中的x为②交通运输中汽车在尾气排放之前经过三元催化剂的处理,促使尾气中的CO和NO相互反应,转化为可以参与大气循环的气体,其反应方程式为
③结合社会生活中交通工具的变化,你认为
 的排放总量的下降,还与哪些因素有关?
的排放总量的下降,还与哪些因素有关?
您最近一年使用:0次
名校
2 . N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与NO在加热和催化剂作用下生成N2O的化学方程式为___________ 。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为:
NO+NO2+2OH-=2 +H2O
+H2O
2NO2+2OH-= +
+ +H2O
+H2O
①下列措施能提高尾气中NO和NO2去除率的有___________ (填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是___________ (填化学式);吸收后排放的尾气中含量较高的氮氧化物是___________ (填化学式)。
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。 ,其离子方程式为
,其离子方程式为___________ 。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是___________ 。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与NO在加热和催化剂作用下生成N2O的化学方程式为
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为:
NO+NO2+2OH-=2
 +H2O
+H2O2NO2+2OH-=
 +
+ +H2O
+H2O①下列措施能提高尾气中NO和NO2去除率的有
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为
 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。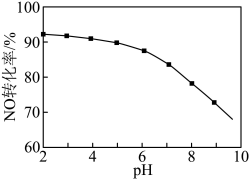
 ,其离子方程式为
,其离子方程式为②NaClO溶液的初始pH越小,NO转化率越高。其原因是
您最近一年使用:0次
名校
3 . 回答下列问题:
(1)一种新型的人工固氮原理如图a所示,该过程中属于氧化还原反应的是_________ (填反应编号)。_________ 。
(3)SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放,SCR(选择性催化还原)工作原理如图b所示,NSR(NOx储存还原)工作原理如图c所示。_________ 。
②SCR催化过程中,当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒,用化学方程式表示(NH4)2SO4的形成:_________ 。
③NSR转化中,通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原,其中储存NOx的物质是_________ 。
④用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图d表示该过程相关物质浓度随时间的变化关系,第一步反应中消耗的H2与Ba(NO3)2的物质的量之比是_________ 。
经过简单猜测,小组成员认为该氮肥的有效成分为铵盐,为了验证猜想,他们取了少量氮肥配制为溶液,后续应当进行的操作为_________ 。
(1)一种新型的人工固氮原理如图a所示,该过程中属于氧化还原反应的是

(3)SCR和NSR技术可有效降低柴油发动机在空气过量条件下的NOx排放,SCR(选择性催化还原)工作原理如图b所示,NSR(NOx储存还原)工作原理如图c所示。

②SCR催化过程中,当燃油中含硫量较高时,尾气中SO2在O2作用下会形成(NH4)2SO4,使催化剂中毒,用化学方程式表示(NH4)2SO4的形成:
③NSR转化中,通过BaO和Ba(NO3)2的相互转化实现NOx的储存和还原,其中储存NOx的物质是
④用H2模拟尾气中还原性气体研究了Ba(NO3)2的催化还原过程,该过程分两步进行,图d表示该过程相关物质浓度随时间的变化关系,第一步反应中消耗的H2与Ba(NO3)2的物质的量之比是

经过简单猜测,小组成员认为该氮肥的有效成分为铵盐,为了验证猜想,他们取了少量氮肥配制为溶液,后续应当进行的操作为
您最近一年使用:0次
2024-04-10更新
|
166次组卷
|
2卷引用:江苏省南京市金陵中学2023-2024学年高一下学期3月月考化学试题
4 . V2O5-WO3/TiO2催化剂可以催化NH3脱除烟气中的NO,反应为:4NO(g) + 4NH3(g) + O2(g)=4N2(g) + 6H2O(g)  =-1632.4kJ·mol-1,工业上以石煤(主要成分为V2O3,含有少量SiO2、P2O5等杂质)为原料制备V2O5,主要经过“焙烧、水浸、除杂、沉钒、煅烧”等过程。
=-1632.4kJ·mol-1,工业上以石煤(主要成分为V2O3,含有少量SiO2、P2O5等杂质)为原料制备V2O5,主要经过“焙烧、水浸、除杂、沉钒、煅烧”等过程。
已知:NaVO3溶于水,NH4VO3难溶于水。
回答下列问题:
(1)向石煤中加纯碱,在通入空气的条件下焙烧, 转化为
转化为 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
(2)“沉钒”时加入NH4Cl析出NH4VO3,沉钒温度需控制在50℃左右,温度不能过高的原因为___________ ;在水溶液中VO 水解为H3VO4沉淀的离子方程式为
水解为H3VO4沉淀的离子方程式为___________ 。
(3)还原V2O5可制得VO2,下图为VO2的晶胞,该晶胞中钒的配位数为___________ 。

(4)催化剂的应用。将模拟烟气(含NO、NH3、N2、O2)以一定流速通过装有V2O5-WO3/TiO2催化剂的反应管,反应相同时间,测得NO的转化率随温度的变化如图所示,反应温度高于350℃,NO转化率下降的原因可能是___________ 。

(5)为测定回收所得V2O5样品的纯度,进行如下实验:称取2.000g样品,用稀硫酸溶解、定容得100mL (VO2)2SO4溶液,量取20.00mL溶液放入锥形瓶中,加入10.00mL 0.5000mol·L-1(NH4)2Fe(SO4)2溶液,再用0.01000mol·L-1KMnO4标准溶液滴定至终点,消耗标准溶液24.00mL,滴定过程中发生如下反应:
VO +Fe2++2H+ = VO2++Fe3++H2O;MnO
+Fe2++2H+ = VO2++Fe3++H2O;MnO +5Fe2++ 8H+ = Mn2++5Fe3++4H2O。
+5Fe2++ 8H+ = Mn2++5Fe3++4H2O。
则V2O5样品的纯度为___________ 。(写出计算过程)
 =-1632.4kJ·mol-1,工业上以石煤(主要成分为V2O3,含有少量SiO2、P2O5等杂质)为原料制备V2O5,主要经过“焙烧、水浸、除杂、沉钒、煅烧”等过程。
=-1632.4kJ·mol-1,工业上以石煤(主要成分为V2O3,含有少量SiO2、P2O5等杂质)为原料制备V2O5,主要经过“焙烧、水浸、除杂、沉钒、煅烧”等过程。已知:NaVO3溶于水,NH4VO3难溶于水。
回答下列问题:
(1)向石煤中加纯碱,在通入空气的条件下焙烧,
 转化为
转化为 ,该反应的化学方程式为
,该反应的化学方程式为(2)“沉钒”时加入NH4Cl析出NH4VO3,沉钒温度需控制在50℃左右,温度不能过高的原因为
 水解为H3VO4沉淀的离子方程式为
水解为H3VO4沉淀的离子方程式为(3)还原V2O5可制得VO2,下图为VO2的晶胞,该晶胞中钒的配位数为

(4)催化剂的应用。将模拟烟气(含NO、NH3、N2、O2)以一定流速通过装有V2O5-WO3/TiO2催化剂的反应管,反应相同时间,测得NO的转化率随温度的变化如图所示,反应温度高于350℃,NO转化率下降的原因可能是

(5)为测定回收所得V2O5样品的纯度,进行如下实验:称取2.000g样品,用稀硫酸溶解、定容得100mL (VO2)2SO4溶液,量取20.00mL溶液放入锥形瓶中,加入10.00mL 0.5000mol·L-1(NH4)2Fe(SO4)2溶液,再用0.01000mol·L-1KMnO4标准溶液滴定至终点,消耗标准溶液24.00mL,滴定过程中发生如下反应:
VO
 +Fe2++2H+ = VO2++Fe3++H2O;MnO
+Fe2++2H+ = VO2++Fe3++H2O;MnO +5Fe2++ 8H+ = Mn2++5Fe3++4H2O。
+5Fe2++ 8H+ = Mn2++5Fe3++4H2O。则V2O5样品的纯度为
您最近一年使用:0次
名校
解题方法
5 . 人们在认识自然的过程中所形成的化学知识和观念,都始于对实验的观察、想象和思考.
(1)两支盛有等量KI-淀粉溶液的试管,分别同时加入等浓度的 溶液和
溶液和 溶液,实验中发现加入
溶液,实验中发现加入 水的试管中溶液迅速变为蓝色,而加入
水的试管中溶液迅速变为蓝色,而加入 溶液的试管却是在慢慢地、慢慢地变蓝,可以想象,当将KI溶液滴加到
溶液的试管却是在慢慢地、慢慢地变蓝,可以想象,当将KI溶液滴加到 和
和 的混合溶液中,首先发生的离子反应为
的混合溶液中,首先发生的离子反应为__________________________________ ,由此可以推知,将等物质的量的 与
与 在溶液中反应,发生反应的离子方程式为
在溶液中反应,发生反应的离子方程式为_________________ .
(2)①将5mL饱和 (滴有酚酞试液)溶液迅速滴加到充满
(滴有酚酞试液)溶液迅速滴加到充满 气体的矿泉水瓶中,瓶子变瘪,酚酞红色逐渐变浅,瓶中析出大量的白色晶体,产生晶体的离子方程式为
气体的矿泉水瓶中,瓶子变瘪,酚酞红色逐渐变浅,瓶中析出大量的白色晶体,产生晶体的离子方程式为_________________ .
②两支试管中分别放有 固体,现向两支试管中分别加入等体积(约10mL)的水和饱和
固体,现向两支试管中分别加入等体积(约10mL)的水和饱和 溶液振荡,两试管中
溶液振荡,两试管中 固体均完全溶解且有放热的现象,同时加入
固体均完全溶解且有放热的现象,同时加入 饱和溶液的试管的温度明显高于加水的试管,可见
饱和溶液的试管的温度明显高于加水的试管,可见 固体在碳酸氢钠溶液中除溶解释放热以外,还存在离子反应
固体在碳酸氢钠溶液中除溶解释放热以外,还存在离子反应_________________
(1)两支盛有等量KI-淀粉溶液的试管,分别同时加入等浓度的
 溶液和
溶液和 溶液,实验中发现加入
溶液,实验中发现加入 水的试管中溶液迅速变为蓝色,而加入
水的试管中溶液迅速变为蓝色,而加入 溶液的试管却是在慢慢地、慢慢地变蓝,可以想象,当将KI溶液滴加到
溶液的试管却是在慢慢地、慢慢地变蓝,可以想象,当将KI溶液滴加到 和
和 的混合溶液中,首先发生的离子反应为
的混合溶液中,首先发生的离子反应为 与
与 在溶液中反应,发生反应的离子方程式为
在溶液中反应,发生反应的离子方程式为(2)①将5mL饱和
 (滴有酚酞试液)溶液迅速滴加到充满
(滴有酚酞试液)溶液迅速滴加到充满 气体的矿泉水瓶中,瓶子变瘪,酚酞红色逐渐变浅,瓶中析出大量的白色晶体,产生晶体的离子方程式为
气体的矿泉水瓶中,瓶子变瘪,酚酞红色逐渐变浅,瓶中析出大量的白色晶体,产生晶体的离子方程式为②两支试管中分别放有
 固体,现向两支试管中分别加入等体积(约10mL)的水和饱和
固体,现向两支试管中分别加入等体积(约10mL)的水和饱和 溶液振荡,两试管中
溶液振荡,两试管中 固体均完全溶解且有放热的现象,同时加入
固体均完全溶解且有放热的现象,同时加入 饱和溶液的试管的温度明显高于加水的试管,可见
饱和溶液的试管的温度明显高于加水的试管,可见 固体在碳酸氢钠溶液中除溶解释放热以外,还存在离子反应
固体在碳酸氢钠溶液中除溶解释放热以外,还存在离子反应
您最近一年使用:0次
名校
解题方法
6 . 按要求完成下列题目
(1)下列物质中①CO2②乙醇③熔融NaCl④CuCl2溶液⑤固态Na2CO3其中属于电解质的是___________ (只填序号,下同),属于非电解质的是___________ 。所给状态下能导电的是___________ 。
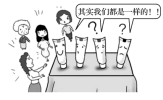
(2)牙膏是日常生活中常用的清洁用品,由粉状摩擦剂、湿润剂、表面活性剂、黏合剂、香料、甜味剂及其他特殊成分构成。下表列出了三种牙膏中的摩擦剂。
①将上述摩擦剂a、b所属物质的正确类别填入空格___________ 、___________
②你推测上述三种摩擦剂都___________ (填“溶于”或者“不溶于”)水。
③已知二氧化硅的化学式为SiO2,该物质能与NaOH溶液反应,反应方程式为2NaOH+SiO2=Na2SiO3+H2O,Na2SiO3属于___________ (填“酸”“碱”或“盐”)类。非金属氧化物SO2也具有类似的性质,请你写出SO2与NaOH溶液反应的化学方程式___________
(3)工业废水中含有重铬酸根离子(Cr2O72—)有毒,必须处理达标后才能排放。工业上常用绿矾(FeSO4·7H2O)做处理剂,反应的离子方程式如下: (未配平)
(未配平)
在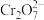 中Cr的化合价为
中Cr的化合价为___________ ;
②该反应中氧化剂和还原剂的个数之比为___________ 。
(1)下列物质中①CO2②乙醇③熔融NaCl④CuCl2溶液⑤固态Na2CO3其中属于电解质的是
(2)牙膏是日常生活中常用的清洁用品,由粉状摩擦剂、湿润剂、表面活性剂、黏合剂、香料、甜味剂及其他特殊成分构成。下表列出了三种牙膏中的摩擦剂。

| 牙膏 | X牙膏 | Y牙膏 | Z牙膏 |
| 摩擦剂 | 氢氧化铝 | 碳酸钙 | 二氧化硅 |
| 摩擦剂物质类别(指酸、碱、盐、氧化物) | a | b |
②你推测上述三种摩擦剂都
③已知二氧化硅的化学式为SiO2,该物质能与NaOH溶液反应,反应方程式为2NaOH+SiO2=Na2SiO3+H2O,Na2SiO3属于
(3)工业废水中含有重铬酸根离子(Cr2O72—)有毒,必须处理达标后才能排放。工业上常用绿矾(FeSO4·7H2O)做处理剂,反应的离子方程式如下:
 (未配平)
(未配平)在
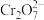 中Cr的化合价为
中Cr的化合价为②该反应中氧化剂和还原剂的个数之比为
您最近一年使用:0次
2024-01-05更新
|
93次组卷
|
2卷引用:江苏省南京市大厂,溧水二高,秦中,江浦文昌四校联考2023-2024学年高一上学期11月期中化学试题
名校
7 . 回答下列氧化还原反应相关问题
(1)完成下列反应方程式的配平:
①____ 
②____ 
③____ 
(2)一个完整的氧化还原反应方程式可以拆开,写成两个“半反应”,如
 可拆写为氧化反应:
可拆写为氧化反应:
 还原反应:
还原反应: ,据此,请将反应
,据此,请将反应 ,拆写成两个半反应。氧化反应:
,拆写成两个半反应。氧化反应:___________ ;还原反应:___________ 。
(3)PH3作为一种熏蒸剂,在贮粮中用于防治害虫,一种制备PH3的流程如图所示:

①白磷与浓 NaOH 溶液反应的化学方程式为___________ ;
②次磷酸的化学式为___________ , 属于
属于___________ (选填“正盐”或“酸式盐”);
③理论上,1mol白磷可生产___________ mol PH3。
(1)完成下列反应方程式的配平:
①

②

③

(2)一个完整的氧化还原反应方程式可以拆开,写成两个“半反应”,如

 可拆写为氧化反应:
可拆写为氧化反应:
 还原反应:
还原反应: ,据此,请将反应
,据此,请将反应 ,拆写成两个半反应。氧化反应:
,拆写成两个半反应。氧化反应:(3)PH3作为一种熏蒸剂,在贮粮中用于防治害虫,一种制备PH3的流程如图所示:

①白磷与浓 NaOH 溶液反应的化学方程式为
②次磷酸的化学式为
 属于
属于③理论上,1mol白磷可生产
您最近一年使用:0次
名校
解题方法
8 . 根据信息和要求书写相关反应的方程式
(1)用84消毒液对新冠病毒进行消杀。将 通入NaOH溶液制备84消毒液,写出反应的离子方程式
通入NaOH溶液制备84消毒液,写出反应的离子方程式___________ 。
(2) 与炭黑焙烧时所发生的物质转化如图所示,写出该反应的化学方程式:
与炭黑焙烧时所发生的物质转化如图所示,写出该反应的化学方程式:_____ 。

(3)以 为原料可在加热熔融条件下制取
为原料可在加热熔融条件下制取 。该反应中包含的所有物质有
。该反应中包含的所有物质有 、
、 、KCl、KOH、
、KCl、KOH、 、
、 ,写出该反应的化学方程式
,写出该反应的化学方程式___________ 。
(4)向 溶液中逐滴加入
溶液中逐滴加入 溶液至沉淀完全,写出发生反应的离子方程式:
溶液至沉淀完全,写出发生反应的离子方程式:___________ 。
(1)用84消毒液对新冠病毒进行消杀。将
 通入NaOH溶液制备84消毒液,写出反应的离子方程式
通入NaOH溶液制备84消毒液,写出反应的离子方程式(2)
 与炭黑焙烧时所发生的物质转化如图所示,写出该反应的化学方程式:
与炭黑焙烧时所发生的物质转化如图所示,写出该反应的化学方程式:
(3)以
 为原料可在加热熔融条件下制取
为原料可在加热熔融条件下制取 。该反应中包含的所有物质有
。该反应中包含的所有物质有 、
、 、KCl、KOH、
、KCl、KOH、 、
、 ,写出该反应的化学方程式
,写出该反应的化学方程式(4)向
 溶液中逐滴加入
溶液中逐滴加入 溶液至沉淀完全,写出发生反应的离子方程式:
溶液至沉淀完全,写出发生反应的离子方程式:
您最近一年使用:0次
名校
解题方法
9 . 纯过氧化氢(H2O2,俗称双氧水)是淡蓝色的粘稠液体,可任意比例与水混溶。双氧水在医疗以及生产、生活中有广泛的应用。请分析在下列反应中,H2O2的作用(填写“氧化剂”或“还原剂”),并用单线桥标出反应过程中电子转移方向和数目。
(1)双氧水在氧化剂的作用下,可定量地产生O2,这在分析化学中,具有重要的意义。
___________ 。反应中,H2O2在反应中的作用是___________ 。
(2)双氧水曾在文艺复兴时期的油画修复中发挥很大的作用。其中发生的反应是:
___________ 。反应中,H2O2在反应中的作用是___________ 。
(3)稀释以后的双氧水常用于医疗中的杀菌消毒,使用过程中可见有气体产生,涉及到的反应有:
___________ 。H2O2在反应中的作用是___________ 。
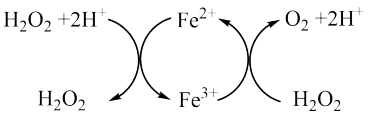
(4)将双氧水滴加到FeCl3溶液中,也会产生有趣的现象。
虽说H2O2可以将Fe2+氧化为Fe3+,可是反应中依然有气体生成。研究表明,在此主要涉及到Fe2+、Fe3+和H2O2发生的循环反应(如图)。请根据图示,写出两个相应反应的离子方程式。___________ 、___________
(1)双氧水在氧化剂的作用下,可定量地产生O2,这在分析化学中,具有重要的意义。

(2)双氧水曾在文艺复兴时期的油画修复中发挥很大的作用。其中发生的反应是:

(3)稀释以后的双氧水常用于医疗中的杀菌消毒,使用过程中可见有气体产生,涉及到的反应有:

(4)将双氧水滴加到FeCl3溶液中,也会产生有趣的现象。
虽说H2O2可以将Fe2+氧化为Fe3+,可是反应中依然有气体生成。研究表明,在此主要涉及到Fe2+、Fe3+和H2O2发生的循环反应(如图)。请根据图示,写出两个相应反应的离子方程式。

您最近一年使用:0次
名校
解题方法
10 . 回答下列问题:
(1)请完成并配平如下化学方程式,再用双线桥法表示该氧化还原反应电子转移的方向和数目:________
_____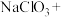 ________
________ ________
________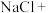 ________
________ ________
________
(2)NaH可在野外作生氢剂。反应原理为 ,该反应中氧化产物和还原产物的质量比为
,该反应中氧化产物和还原产物的质量比为________ 。
(3)工业废水中的 有毒,常在酸性条件下用
有毒,常在酸性条件下用 做处理剂,将
做处理剂,将 转化为
转化为 ,反应的离子方程式为
,反应的离子方程式为________ 。
(4)某一反应体系中有反应物和生成物共五种物质: 、
、 、
、 、
、 、
、 。已知该反应中
。已知该反应中 中发生的过程为
中发生的过程为 。
。
①该反应中,发生还原反应的过程是________ →________ 。
②写出该反应的化学方程或(配平)________ 。
(1)请完成并配平如下化学方程式,再用双线桥法表示该氧化还原反应电子转移的方向和数目:
_____
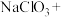 ________
________ ________
________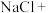 ________
________ ________
________
(2)NaH可在野外作生氢剂。反应原理为
 ,该反应中氧化产物和还原产物的质量比为
,该反应中氧化产物和还原产物的质量比为(3)工业废水中的
 有毒,常在酸性条件下用
有毒,常在酸性条件下用 做处理剂,将
做处理剂,将 转化为
转化为 ,反应的离子方程式为
,反应的离子方程式为(4)某一反应体系中有反应物和生成物共五种物质:
 、
、 、
、 、
、 、
、 。已知该反应中
。已知该反应中 中发生的过程为
中发生的过程为 。
。①该反应中,发生还原反应的过程是
②写出该反应的化学方程或(配平)
您最近一年使用:0次



