名校
1 . 有效去除大气和水体中的氮氧化物是环境保护的重要课题。
(1)某学者使用 作催化剂对燃煤烟气脱硝进行了研究。催化剂制备方法如下:在60~100℃下,向足量
作催化剂对燃煤烟气脱硝进行了研究。催化剂制备方法如下:在60~100℃下,向足量 溶液中通入一段时间
溶液中通入一段时间 ,再加入适量新制
,再加入适量新制 溶液,充分反应后制得白色沉淀;向该白色沉淀中加入
溶液,充分反应后制得白色沉淀;向该白色沉淀中加入 溶液,充分反应后经磁铁吸附、洗涤、真空干燥,制得
溶液,充分反应后经磁铁吸附、洗涤、真空干燥,制得 催化剂。
催化剂。
①通入 的目的是
的目的是________ 。
②若不通入 ,会看到红褐色沉淀,则生成的白色沉淀转变为红褐色沉淀的化学方程式是
,会看到红褐色沉淀,则生成的白色沉淀转变为红褐色沉淀的化学方程式是_____ 。
(2)含氯化合物可将废气中的 转化成
转化成 脱除。
脱除。
①提高废气中 脱除率的可行措施有
脱除率的可行措施有______ (填字母)。
A.加快通入废气的速率 B.吸收塔中喷淋的吸收液与气体逆向接触 C.适当提高吸收液浓度
②300mL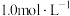
 溶液理论上最多能吸收标准状况下
溶液理论上最多能吸收标准状况下 的体积是
的体积是______ 。
③按一定流速将含 的废气通过
的废气通过 溶液,该反应的离子方程式是
溶液,该反应的离子方程式是______ 。
(3)有人研究了用纳米零价铁去除水体中 。控制其他条件不变,用纳米零价铁还原水体中的
。控制其他条件不变,用纳米零价铁还原水体中的 ,测得溶液中
,测得溶液中 、
、 、
、 浓度随时间变化如下图所示。与初始溶液中的总氮浓度相比,反应过程中溶液中的总氮(
浓度随时间变化如下图所示。与初始溶液中的总氮浓度相比,反应过程中溶液中的总氮( 、
、 、
、 )浓度减少,其可能原因是
)浓度减少,其可能原因是_______ 。

(1)某学者使用
 作催化剂对燃煤烟气脱硝进行了研究。催化剂制备方法如下:在60~100℃下,向足量
作催化剂对燃煤烟气脱硝进行了研究。催化剂制备方法如下:在60~100℃下,向足量 溶液中通入一段时间
溶液中通入一段时间 ,再加入适量新制
,再加入适量新制 溶液,充分反应后制得白色沉淀;向该白色沉淀中加入
溶液,充分反应后制得白色沉淀;向该白色沉淀中加入 溶液,充分反应后经磁铁吸附、洗涤、真空干燥,制得
溶液,充分反应后经磁铁吸附、洗涤、真空干燥,制得 催化剂。
催化剂。①通入
 的目的是
的目的是②若不通入
 ,会看到红褐色沉淀,则生成的白色沉淀转变为红褐色沉淀的化学方程式是
,会看到红褐色沉淀,则生成的白色沉淀转变为红褐色沉淀的化学方程式是(2)含氯化合物可将废气中的
 转化成
转化成 脱除。
脱除。①提高废气中
 脱除率的可行措施有
脱除率的可行措施有A.加快通入废气的速率 B.吸收塔中喷淋的吸收液与气体逆向接触 C.适当提高吸收液浓度
②300mL
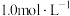
 溶液理论上最多能吸收标准状况下
溶液理论上最多能吸收标准状况下 的体积是
的体积是③按一定流速将含
 的废气通过
的废气通过 溶液,该反应的离子方程式是
溶液,该反应的离子方程式是(3)有人研究了用纳米零价铁去除水体中
 。控制其他条件不变,用纳米零价铁还原水体中的
。控制其他条件不变,用纳米零价铁还原水体中的 ,测得溶液中
,测得溶液中 、
、 、
、 浓度随时间变化如下图所示。与初始溶液中的总氮浓度相比,反应过程中溶液中的总氮(
浓度随时间变化如下图所示。与初始溶液中的总氮浓度相比,反应过程中溶液中的总氮( 、
、 、
、 )浓度减少,其可能原因是
)浓度减少,其可能原因是
您最近一年使用:0次
2024-02-16更新
|
133次组卷
|
2卷引用:江苏省泰州中学2023-2024学年高一上学期期末考试化学试题
2 . 运用化学反应原理研究硫单质及其化合物的反应,对生产、生活、环境保护等领域有着重要的意义。
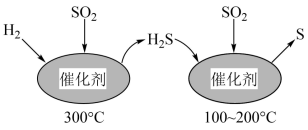
(1)工业上采用 催化还原
催化还原 ,不仅可以消除
,不仅可以消除 污染,还可得到单质S。反应分两步完成,如图所示,
污染,还可得到单质S。反应分两步完成,如图所示, 催化还原
催化还原 第一步反应的化学方程式为
第一步反应的化学方程式为___________ 。
(2)工业上常用 溶液对燃煤烟气进行脱硫、脱硝。
溶液对燃煤烟气进行脱硫、脱硝。
已知 溶液具有强氧化性,酸性条件下
溶液具有强氧化性,酸性条件下 发生歧化反应生成
发生歧化反应生成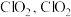 易溶于水,具有强氧化性,可氧化
易溶于水,具有强氧化性,可氧化 。
。
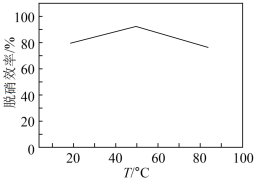
①实验室模拟脱硫过程:先加稀硫酸调节 吸收液的
吸收液的 为5,再向其中通入含
为5,再向其中通入含 的模拟烟气,测得脱硫效率(即
的模拟烟气,测得脱硫效率(即 的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于
的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于 时,随温度升高脱硫效率下降的原因是
时,随温度升高脱硫效率下降的原因是___________ 。
②煤燃烧排放的烟气含有 和
和 ,采用
,采用 溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有
溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有 和
和 的烟气通入盛有
的烟气通入盛有 溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如表(其他离子忽略不计):
溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如表(其他离子忽略不计):
表中y=_______ 。若该溶液为 (吸收前后溶液体积不变),该过程转移的电子数为
(吸收前后溶液体积不变),该过程转移的电子数为______ mol。(写出计算过程)。
(1)工业上采用
 催化还原
催化还原 ,不仅可以消除
,不仅可以消除 污染,还可得到单质S。反应分两步完成,如图所示,
污染,还可得到单质S。反应分两步完成,如图所示, 催化还原
催化还原 第一步反应的化学方程式为
第一步反应的化学方程式为
(2)工业上常用
 溶液对燃煤烟气进行脱硫、脱硝。
溶液对燃煤烟气进行脱硫、脱硝。已知
 溶液具有强氧化性,酸性条件下
溶液具有强氧化性,酸性条件下 发生歧化反应生成
发生歧化反应生成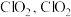 易溶于水,具有强氧化性,可氧化
易溶于水,具有强氧化性,可氧化 。
。①实验室模拟脱硫过程:先加稀硫酸调节
 吸收液的
吸收液的 为5,再向其中通入含
为5,再向其中通入含 的模拟烟气,测得脱硫效率(即
的模拟烟气,测得脱硫效率(即 的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于
的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于 时,随温度升高脱硫效率下降的原因是
时,随温度升高脱硫效率下降的原因是
②煤燃烧排放的烟气含有
 和
和 ,采用
,采用 溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有
溶液作为吸收剂可同时对烟气进行脱硫、脱硝。将含有 和
和 的烟气通入盛有
的烟气通入盛有 溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如表(其他离子忽略不计):
溶液的反应器中,反应一段时间后,测得溶液中离子浓度的有关数据如表(其他离子忽略不计):| 离子 |  |  |  |  |  |
浓度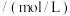 | 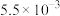 |  |  |  |  |
 (吸收前后溶液体积不变),该过程转移的电子数为
(吸收前后溶液体积不变),该过程转移的电子数为
您最近一年使用:0次
3 . 硫元素是动植物生长不可缺少的元素,图1是自然界中硫元素的存在示意图。图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。
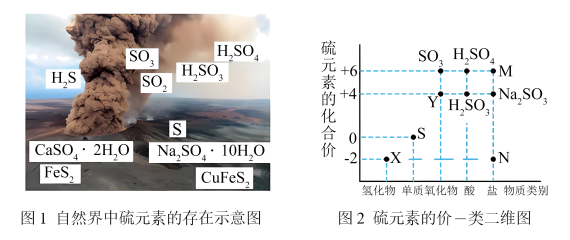
(1)图1中与图2中M、N对应的物质分别是
(2)X与Y反应中氧化剂与还原剂的物质的量之比为
(3)
 溶液易变质,实验室检验
溶液易变质,实验室检验 溶液是否变质的基本操作是
溶液是否变质的基本操作是(4)已知
 能被酸性
能被酸性 氧化为
氧化为 ,则
,则 的
的 溶液与
溶液与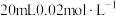 的
的 溶液恰好反应时,发生的离子方程式为:
溶液恰好反应时,发生的离子方程式为:(5)过二硫酸钠
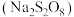 有强氧化性,在碱性条件下
有强氧化性,在碱性条件下 溶液能将
溶液能将 氧化成
氧化成 ,且反应后的溶液滴入
,且反应后的溶液滴入 溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为
溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为(6)雌黄
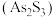 和雄黄
和雄黄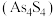 在自然界中共生且可以相互转化(两者的硫元素价态均为-2价)。
在自然界中共生且可以相互转化(两者的硫元素价态均为-2价)。① 和
和 在盐酸中恰好完全反应转化为
在盐酸中恰好完全反应转化为 和
和 并放出
并放出 气体。则参加反应的
气体。则参加反应的 和
和 的物质的量之比为
的物质的量之比为
② 和
和 可以相互转化,转化过程中存在如图所示的步骤。若
可以相互转化,转化过程中存在如图所示的步骤。若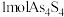 参加反应时,转移
参加反应时,转移 电子,则物质
电子,则物质 为
为
您最近一年使用:0次
名校
解题方法
4 . 工业革命以来人类对于防治大气中NOx(由NO与NO2组成的混合物,当x=1.5时,混合物中NO与NO2物质的量之比为1:1)污染的研究从未停歇。回答下列问题:
(1)NaOH溶液可以吸收NOx,反应方程式如下:
ⅰ. (未配平)
(未配平)
ⅱ.
①当x=1.25时,NOx中NO与NO2的物质的量之比为___________ 。
②配平并写出反应ⅰ的化学方程式:___________ ;反应ⅱ中,每吸收0.3mol NO2,转移电子为___________ mol。
③将一定体积的NOx通入足量NaOH溶液中,若NOx可以被完全吸收,x的取值范围为___________ 。
(2)利用NaClO吸收液可以同时脱除燃煤烟气中NO和SO2。研究发现NaClO吸收液在不同的初始pH条件下,对流动烟气的脱硫效率都接近100%,而对NO的脱除率如下图所示:

①pH=12时,脱除SO2的离子方程式为___________ 。
②酸性条件下,SO2的脱除率高于NO,其原因除SO2的还原性比NO强外,还可能是___________ 。
③若用盐酸调节NaClO吸收液的pH,不仅不利于NO的吸收,还会在反应过程中生成一种有毒气体,其化学式为___________ 。
(1)NaOH溶液可以吸收NOx,反应方程式如下:
ⅰ.
 (未配平)
(未配平)ⅱ.

①当x=1.25时,NOx中NO与NO2的物质的量之比为
②配平并写出反应ⅰ的化学方程式:
③将一定体积的NOx通入足量NaOH溶液中,若NOx可以被完全吸收,x的取值范围为
(2)利用NaClO吸收液可以同时脱除燃煤烟气中NO和SO2。研究发现NaClO吸收液在不同的初始pH条件下,对流动烟气的脱硫效率都接近100%,而对NO的脱除率如下图所示:

①pH=12时,脱除SO2的离子方程式为
②酸性条件下,SO2的脱除率高于NO,其原因除SO2的还原性比NO强外,还可能是
③若用盐酸调节NaClO吸收液的pH,不仅不利于NO的吸收,还会在反应过程中生成一种有毒气体,其化学式为
您最近一年使用:0次
2023-05-10更新
|
213次组卷
|
3卷引用:江苏省泰州市2023-2024学年高一上学期1月期末化学试题
名校
5 . 回答下列问题
(1)按如图所示操作,充分反应后:
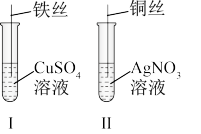
①Ⅰ中发生反应的离子方程式为_______ ;
②Ⅱ中铜丝上观察到的现象是_______ ;
③结合Ⅰ、Ⅱ实验现象可知 、
、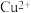 、
、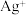 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为_______ 。
(2)某一反应体系中有反应物和生成物共5种物质:S、 、
、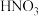 、NO、
、NO、 。该反应物中还原产物是
。该反应物中还原产物是_______ ;若反应方程式中转移了0.3mol电子,则氧化产物的质量是_______ 。
(3)医学上常用酸性高锰酸钾溶液与草酸溶液的反应来测定血钙的含量,配平以下离子方程式,并填上合适的微粒:_____
_______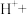 _______
_______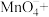 _______
_______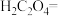 _______
_______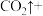 _______
_______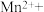 _______
_______
(1)按如图所示操作,充分反应后:

①Ⅰ中发生反应的离子方程式为
②Ⅱ中铜丝上观察到的现象是
③结合Ⅰ、Ⅱ实验现象可知
 、
、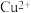 、
、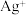 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为(2)某一反应体系中有反应物和生成物共5种物质:S、
 、
、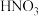 、NO、
、NO、 。该反应物中还原产物是
。该反应物中还原产物是(3)医学上常用酸性高锰酸钾溶液与草酸溶液的反应来测定血钙的含量,配平以下离子方程式,并填上合适的微粒:
_______
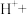 _______
_______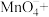 _______
_______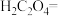 _______
_______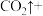 _______
_______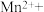 _______
_______
您最近一年使用:0次
2022-10-15更新
|
131次组卷
|
2卷引用:江苏省泰州中学2022-2023学年高一上学期第一次月考化学试题
名校
解题方法
6 . 化学的魅力在于认识和改造物质世界。
(1)合成氨在化学工业史上意义重大,推动了基础理论的进一步发展。德国化学家格哈德埃特尔曾提出合成氨反应的一种可能机理,如图所示。

①在铁表面很容易解离为原子的是_______ (填 或
或 ),原因是
),原因是_______ 。
②图中M的电子式为_______ 。
(2)配合物 可用作杀虫剂。其显深蓝色的微粒的结构可用示意图表示为
可用作杀虫剂。其显深蓝色的微粒的结构可用示意图表示为_______ 。请设计制备该杀虫剂的实验方案:_______ 。(可选用的试剂: 溶液、
溶液、 氨水、
氨水、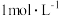 氨水、95%乙醇、蒸馏水)。
氨水、95%乙醇、蒸馏水)。
(3)废水中的氨氮(以 、
、 形式存在)可通过加入
形式存在)可通过加入 溶液氧化处理后达到国家规定的排放标准。
溶液氧化处理后达到国家规定的排放标准。
① 将废水中的氨氮转化为
将废水中的氨氮转化为 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。(写一个即可)
② (氨氮)对废水中氨氮去除率和总氮去除率的影响如图所示。当
(氨氮)对废水中氨氮去除率和总氮去除率的影响如图所示。当 (氨氮)
(氨氮) 后,总氮去除率下降的原因是
后,总氮去除率下降的原因是_______ 。

(1)合成氨在化学工业史上意义重大,推动了基础理论的进一步发展。德国化学家格哈德埃特尔曾提出合成氨反应的一种可能机理,如图所示。

①在铁表面很容易解离为原子的是
 或
或 ),原因是
),原因是②图中M的电子式为
(2)配合物
 可用作杀虫剂。其显深蓝色的微粒的结构可用示意图表示为
可用作杀虫剂。其显深蓝色的微粒的结构可用示意图表示为 溶液、
溶液、 氨水、
氨水、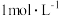 氨水、95%乙醇、蒸馏水)。
氨水、95%乙醇、蒸馏水)。(3)废水中的氨氮(以
 、
、 形式存在)可通过加入
形式存在)可通过加入 溶液氧化处理后达到国家规定的排放标准。
溶液氧化处理后达到国家规定的排放标准。①
 将废水中的氨氮转化为
将废水中的氨氮转化为 ,该反应的离子方程式为
,该反应的离子方程式为②
 (氨氮)对废水中氨氮去除率和总氮去除率的影响如图所示。当
(氨氮)对废水中氨氮去除率和总氮去除率的影响如图所示。当 (氨氮)
(氨氮) 后,总氮去除率下降的原因是
后,总氮去除率下降的原因是
您最近一年使用:0次
名校
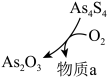
7 . 硒( )是动物和人体所必需的微量元素之一,也是一种重要的工业原料。硒在自然界中稀少而分散,常从精炼铜的阳极泥中提取而得。
)是动物和人体所必需的微量元素之一,也是一种重要的工业原料。硒在自然界中稀少而分散,常从精炼铜的阳极泥中提取而得。
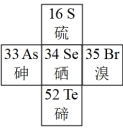
(1)硒在元素周期表中的位置如图所示:
① 在元素周期表中位置表示为
在元素周期表中位置表示为_______ ;
②用电子式表示 的形成过程:
的形成过程:_______ 。
(2)阳极泥中的硒主要以 和
和 的形式存在,工业上提取硒的流程如下:
的形式存在,工业上提取硒的流程如下:
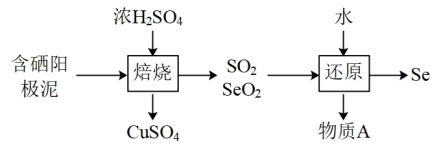
①请写出 与浓
与浓 反应的化学方程式:
反应的化学方程式:_______ 。
②写出“还原”步骤对应的化学方程式,并用单线桥标出电子转移情况:_______ 。
(3)下列说法正确的是_______。
 )是动物和人体所必需的微量元素之一,也是一种重要的工业原料。硒在自然界中稀少而分散,常从精炼铜的阳极泥中提取而得。
)是动物和人体所必需的微量元素之一,也是一种重要的工业原料。硒在自然界中稀少而分散,常从精炼铜的阳极泥中提取而得。
(1)硒在元素周期表中的位置如图所示:
①
 在元素周期表中位置表示为
在元素周期表中位置表示为②用电子式表示
 的形成过程:
的形成过程:(2)阳极泥中的硒主要以
 和
和 的形式存在,工业上提取硒的流程如下:
的形式存在,工业上提取硒的流程如下:
①请写出
 与浓
与浓 反应的化学方程式:
反应的化学方程式:②写出“还原”步骤对应的化学方程式,并用单线桥标出电子转移情况:
(3)下列说法正确的是_______。
A. 既有氧化性又有还原性 既有氧化性又有还原性 | B.原子半径由大到小顺序: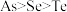 |
C.热稳定性: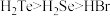 | D.酸性: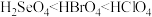 |
您最近一年使用:0次
2022-03-30更新
|
428次组卷
|
3卷引用:江苏省泰州中学2021-2022学年高一上学期期末考试化学试题
江苏省泰州中学2021-2022学年高一上学期期末考试化学试题四川省泸县第四中学2022-2023学年高一上学期第三次月考化学试题(已下线)专题09 原子结构 元素周期律和周期表-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(江苏专用)
名校
解题方法
8 . 氧化还原法、沉淀法等是常用于治理水体污染的重要化学方法。
(1)还原法处理含铬废水:铝粉可将废水中的Cr2O 还原为Cr3+。如图所示,废水的不同初始pH对Cr2O
还原为Cr3+。如图所示,废水的不同初始pH对Cr2O 去除效果有重要影响。
去除效果有重要影响。

①酸性条件下,铝粉去除Cr2O 反应的离子方程式为
反应的离子方程式为_______
②初始pH为3.0,反应180min后,废水中Cr2O 浓度仍较高的原因是
浓度仍较高的原因是_______ 。
③实验证明,若初始pH过低,Cr2O 的去除效果也不理想,其原因可能是
的去除效果也不理想,其原因可能是_______ 。
(2)沉淀法处理含氯废水:向模拟废水(NaCl溶液)中加入Ca(OH)2和NaAlO2粉末,氯离子可转化为Ca4Al2(OH)12Cl2沉淀。
①该反应的化学方程式为_______ 。
②保持投料比[n(Ca):n(Al):n(Cl)]和其他反应条件不变,溶液中氯离子去除率随溶液初始氯离子浓度的变化如图所示,当初始氯离子浓度高于5g·L-1时,氯离子去除率下降的原因可能是_______ 。

(1)还原法处理含铬废水:铝粉可将废水中的Cr2O
 还原为Cr3+。如图所示,废水的不同初始pH对Cr2O
还原为Cr3+。如图所示,废水的不同初始pH对Cr2O 去除效果有重要影响。
去除效果有重要影响。
①酸性条件下,铝粉去除Cr2O
 反应的离子方程式为
反应的离子方程式为②初始pH为3.0,反应180min后,废水中Cr2O
 浓度仍较高的原因是
浓度仍较高的原因是③实验证明,若初始pH过低,Cr2O
 的去除效果也不理想,其原因可能是
的去除效果也不理想,其原因可能是(2)沉淀法处理含氯废水:向模拟废水(NaCl溶液)中加入Ca(OH)2和NaAlO2粉末,氯离子可转化为Ca4Al2(OH)12Cl2沉淀。
①该反应的化学方程式为
②保持投料比[n(Ca):n(Al):n(Cl)]和其他反应条件不变,溶液中氯离子去除率随溶液初始氯离子浓度的变化如图所示,当初始氯离子浓度高于5g·L-1时,氯离子去除率下降的原因可能是

您最近一年使用:0次
2021-03-27更新
|
1228次组卷
|
4卷引用:江苏省泰州中学2022-2023学年高一下学期期中考试化学试题
江苏省泰州中学2022-2023学年高一下学期期中考试化学试题江苏省南京市盐城市2021届高三第二次模拟考试化学试题(已下线)第二章能力提升检测卷-2022年高考化学一轮复习讲练测(已下线)第二章 化学物质及其变化(测)-2023年高考化学一轮复习讲练测(全国通用)
解题方法
9 . (1)钒是人体必需的微量元素,对治疗糖尿病和癌症及保护心血管等具有潜在的药理学作用。工业上用含三价钒(V2O3)为主的某石煤(含有Al2O3、CaO等杂质)为原料,用钙化法焙烧制备V2O5,其流程如图:

已知:+5价钒在溶液中的主要存在形式与溶液pH的关系如表。
①焙烧:向石煤中加石灰石焙烧,将V2O3转化为Ca(VO3)2的化学方程式是:_______ 。酸浸:Ca(VO3)2难溶于水,可溶于盐酸。若焙砂酸浸时溶液的pH=4,Ca(VO3)2溶于盐酸的离子方程式是_______ 。
②基态钒原子的核外电子排布式为[Ar]_______ 。
(2)镓(Ga)、锗(Ge)、硅(Si)、硒(Se)的单质及某些化合物如砷化镓、磷化镓等都是常用的半导体材料,应用于航空航天测控、光纤通讯等领域。回答下列问题:
①硒常用作光敏材料,SeO3的空间构型是_______ 。
②根据元素周期律,原子半径Ga_______ As,第一电离能Ga_______ As。(填“大于”或“小于”)
③硅与氢结合能形成一系列的二元化合物SiH4、Si2H6等,与氯、溴结合能形成SiCl4、SiBr4,上述四种物质沸点由高到低顺序为_______ ,丁硅烯(Si4H8)中σ键与π键个数之比为_______ 。

已知:+5价钒在溶液中的主要存在形式与溶液pH的关系如表。
| pH | 4~6 | 6~8 | 8~10 | 10~12 |
| 主要离子 | VO | VO | VO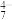 | VO |
①焙烧:向石煤中加石灰石焙烧,将V2O3转化为Ca(VO3)2的化学方程式是:
②基态钒原子的核外电子排布式为[Ar]
(2)镓(Ga)、锗(Ge)、硅(Si)、硒(Se)的单质及某些化合物如砷化镓、磷化镓等都是常用的半导体材料,应用于航空航天测控、光纤通讯等领域。回答下列问题:
①硒常用作光敏材料,SeO3的空间构型是
②根据元素周期律,原子半径Ga
③硅与氢结合能形成一系列的二元化合物SiH4、Si2H6等,与氯、溴结合能形成SiCl4、SiBr4,上述四种物质沸点由高到低顺序为
您最近一年使用:0次
名校
解题方法
10 . 烟气(主要污染物SO2、NOx)是大气主要污染物,有效去除大气中SO2、NOx的是环境保护的重要课题。
(1)氨水法脱硫就是用足量的氨水将烟气中的SO2吸收,生成的盐再进一步氧化成硫酸铵。写出上述处理过程中发生反应的化学方程式______ 、______ 。
(2)用亚硫酸钠吸收法可实现SO2的循环使用,步骤如下:第一步,用亚硫酸钠溶液吸收SO2;第二步,加热吸收液,使之重新生成亚硫酸钠。写出上述处理过程中发生反应的化学方程式______ 、______ 。
(3)可以氨气还原法处理NOx,生成无污染的N2。写出氨气与NO2发生反应的化学方程式______ 。
(4)环保部门为测定某硫酸厂周围空气中SO2的体积分数,做了如下实验:取标准状况下的空气2.000L(含N2、O2、CO2、SO2等),缓慢通过足量溴水,在所得溶液中加入过量的BaCl2溶液,产生白色沉淀,将沉淀洗涤、干燥,称得其质量为0.466g。试回答:
①加入过量BaCl2溶液的目的是______ 。
②该空气样品中SO2的体积分数为______ 。
(1)氨水法脱硫就是用足量的氨水将烟气中的SO2吸收,生成的盐再进一步氧化成硫酸铵。写出上述处理过程中发生反应的化学方程式
(2)用亚硫酸钠吸收法可实现SO2的循环使用,步骤如下:第一步,用亚硫酸钠溶液吸收SO2;第二步,加热吸收液,使之重新生成亚硫酸钠。写出上述处理过程中发生反应的化学方程式
(3)可以氨气还原法处理NOx,生成无污染的N2。写出氨气与NO2发生反应的化学方程式
(4)环保部门为测定某硫酸厂周围空气中SO2的体积分数,做了如下实验:取标准状况下的空气2.000L(含N2、O2、CO2、SO2等),缓慢通过足量溴水,在所得溶液中加入过量的BaCl2溶液,产生白色沉淀,将沉淀洗涤、干燥,称得其质量为0.466g。试回答:
①加入过量BaCl2溶液的目的是
②该空气样品中SO2的体积分数为
您最近一年使用:0次



