名校
1 . 回答下列问题:
(一)下列物质中:①漂白粉固体 ② 固体 ③
固体 ③ 固体 ④熔融
固体 ④熔融 ⑤食醋⑥
⑤食醋⑥ 片 ⑦
片 ⑦ ⑧盐酸 ⑨石墨 ⑩
⑧盐酸 ⑨石墨 ⑩ 葡萄糖(填序号)
葡萄糖(填序号)
(1)以上物质中属于强电解质且能导电的是___________________________ ;
(2)以上物质中属于非电解质的是___________________________ ;
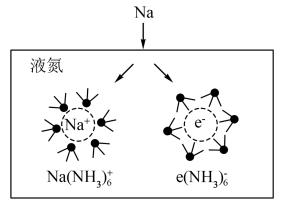
(二)氨基钠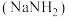 是有机合成中重要的还原剂.金属钠放入液氨中,沉入底部。一部分钠与液氨反应,并缓慢放出气泡;另一部分钠与液氨溶剂化,生成氨合钠离子
是有机合成中重要的还原剂.金属钠放入液氨中,沉入底部。一部分钠与液氨反应,并缓慢放出气泡;另一部分钠与液氨溶剂化,生成氨合钠离子 和蓝色的氨合电子
和蓝色的氨合电子 ,钠的溶剂化过程如图所示。
,钠的溶剂化过程如图所示。
(3)导电性:蓝色溶液____________ 液氨(填“>、<、=”)
(4)将 钠投入液氨中,得到
钠投入液氨中,得到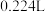 (标准状况下)
(标准状况下) ,与液氨反应产生
,与液氨反应产生 的钠和发生溶剂化作用的钠,两者物质的量之比为
的钠和发生溶剂化作用的钠,两者物质的量之比为______________ 。
(5)钠与液氨反应方程式为:________________________________________ 。
(一)下列物质中:①漂白粉固体 ②
 固体 ③
固体 ③ 固体 ④熔融
固体 ④熔融 ⑤食醋⑥
⑤食醋⑥ 片 ⑦
片 ⑦ ⑧盐酸 ⑨石墨 ⑩
⑧盐酸 ⑨石墨 ⑩ 葡萄糖(填序号)
葡萄糖(填序号)(1)以上物质中属于强电解质且能导电的是
(2)以上物质中属于非电解质的是
(二)氨基钠
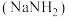 是有机合成中重要的还原剂.金属钠放入液氨中,沉入底部。一部分钠与液氨反应,并缓慢放出气泡;另一部分钠与液氨溶剂化,生成氨合钠离子
是有机合成中重要的还原剂.金属钠放入液氨中,沉入底部。一部分钠与液氨反应,并缓慢放出气泡;另一部分钠与液氨溶剂化,生成氨合钠离子 和蓝色的氨合电子
和蓝色的氨合电子 ,钠的溶剂化过程如图所示。
,钠的溶剂化过程如图所示。
(3)导电性:蓝色溶液
(4)将
 钠投入液氨中,得到
钠投入液氨中,得到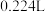 (标准状况下)
(标准状况下) ,与液氨反应产生
,与液氨反应产生 的钠和发生溶剂化作用的钠,两者物质的量之比为
的钠和发生溶剂化作用的钠,两者物质的量之比为(5)钠与液氨反应方程式为:
您最近一年使用:0次
2 . “2060年实现碳中和”的目标提出之后, 的排放和转化成为各行各业关注的重点。利用两种不同的金属催化剂,可在水溶液中将
的排放和转化成为各行各业关注的重点。利用两种不同的金属催化剂,可在水溶液中将 分别转化为CO和HCOOH,反应过程示意如图所示。
分别转化为CO和HCOOH,反应过程示意如图所示。

(1)HCOOH是有机物,分子中所含官能团的名称为___________ 。
(2)将 转化为CO的路径中,涉及到碳氧键的断裂,该过程需要
转化为CO的路径中,涉及到碳氧键的断裂,该过程需要___________ 能量(填“吸收”或“放出”)。
(3)一定条件下, 可与H2O以物质的量之比1∶1发生反应生成HCOOH,该反应的化学方程式为
可与H2O以物质的量之比1∶1发生反应生成HCOOH,该反应的化学方程式为___________ 。
 的排放和转化成为各行各业关注的重点。利用两种不同的金属催化剂,可在水溶液中将
的排放和转化成为各行各业关注的重点。利用两种不同的金属催化剂,可在水溶液中将 分别转化为CO和HCOOH,反应过程示意如图所示。
分别转化为CO和HCOOH,反应过程示意如图所示。
(1)HCOOH是有机物,分子中所含官能团的名称为
(2)将
 转化为CO的路径中,涉及到碳氧键的断裂,该过程需要
转化为CO的路径中,涉及到碳氧键的断裂,该过程需要(3)一定条件下,
 可与H2O以物质的量之比1∶1发生反应生成HCOOH,该反应的化学方程式为
可与H2O以物质的量之比1∶1发生反应生成HCOOH,该反应的化学方程式为
您最近一年使用:0次
2024-01-12更新
|
203次组卷
|
2卷引用:江苏省常州高级中学高中学业水平合格性考试化学模拟试题(二)(附答案)
解题方法
3 . 运用化学反应原理研究硫单质及其化合物的反应,对生产、生活、环境保护等领域有着重要的意义。
(1)一定条件下,将 通入
通入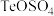 溶液中,反应一段时间后过滤、洗涤得到粗Te。
溶液中,反应一段时间后过滤、洗涤得到粗Te。
① 还原
还原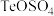 溶液得到Te的反应中,
溶液得到Te的反应中,
___________ 。
②检验沉淀是否洗涤干净的具体操作为___________ 。
③过程中须控制反应温度为80℃,适宜的加热方式为___________ ;采取该加热方式的优点为___________ 。
(2)工业上采用 催化还原
催化还原 ,不仅可以消除
,不仅可以消除 污染,还可得到有价值的单质S。反应分两步完成,如图所示,
污染,还可得到有价值的单质S。反应分两步完成,如图所示, 催化还原
催化还原 第一步反应的化学方程式为
第一步反应的化学方程式为___________ 。

(3)工业上常用 溶液对燃煤烟气进行脱硫。已知
溶液对燃煤烟气进行脱硫。已知 溶液具有强氧化性,酸性条件下
溶液具有强氧化性,酸性条件下 发生歧化反应生成
发生歧化反应生成 ,
, 易溶于水,具有强氧化性,可氧化
易溶于水,具有强氧化性,可氧化 。
。
①在实验室模拟脱硫过程:先加稀硫酸调节 吸收液的pH为5,再向其中通入含
吸收液的pH为5,再向其中通入含 的模拟烟气。测得脱硫反应后,溶液中的阴离子为
的模拟烟气。测得脱硫反应后,溶液中的阴离子为 和
和 ,则脱硫反应的离子方程式为
,则脱硫反应的离子方程式为___________ 。
②测得脱硫效率(即 的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于50℃时,随温度升高脱硫效率下降的原因是
的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于50℃时,随温度升高脱硫效率下降的原因是___________ 。

(4) 水悬浊液吸收
水悬浊液吸收 。已知:室温下,
。已知:室温下,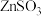 微溶于水,
微溶于水, 易溶于水;溶液中
易溶于水;溶液中 、
、 、
、 的物质的量分数随pH的分布如图1所示。向
的物质的量分数随pH的分布如图1所示。向 水悬浊液中匀速缓慢通入
水悬浊液中匀速缓慢通入 ,在开始吸收的
,在开始吸收的 内,
内, 吸收率、溶液pH均经历了从几乎不变到迅速降低的变化(见图2)。溶液pH几乎不变阶段,主要产物是
吸收率、溶液pH均经历了从几乎不变到迅速降低的变化(见图2)。溶液pH几乎不变阶段,主要产物是___________ (填化学式); 吸收率迅速降低阶段,主要反应的离子方程式为
吸收率迅速降低阶段,主要反应的离子方程式为___________ 。

(1)一定条件下,将
 通入
通入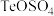 溶液中,反应一段时间后过滤、洗涤得到粗Te。
溶液中,反应一段时间后过滤、洗涤得到粗Te。①
 还原
还原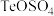 溶液得到Te的反应中,
溶液得到Te的反应中,
②检验沉淀是否洗涤干净的具体操作为
③过程中须控制反应温度为80℃,适宜的加热方式为
(2)工业上采用
 催化还原
催化还原 ,不仅可以消除
,不仅可以消除 污染,还可得到有价值的单质S。反应分两步完成,如图所示,
污染,还可得到有价值的单质S。反应分两步完成,如图所示, 催化还原
催化还原 第一步反应的化学方程式为
第一步反应的化学方程式为
(3)工业上常用
 溶液对燃煤烟气进行脱硫。已知
溶液对燃煤烟气进行脱硫。已知 溶液具有强氧化性,酸性条件下
溶液具有强氧化性,酸性条件下 发生歧化反应生成
发生歧化反应生成 ,
, 易溶于水,具有强氧化性,可氧化
易溶于水,具有强氧化性,可氧化 。
。①在实验室模拟脱硫过程:先加稀硫酸调节
 吸收液的pH为5,再向其中通入含
吸收液的pH为5,再向其中通入含 的模拟烟气。测得脱硫反应后,溶液中的阴离子为
的模拟烟气。测得脱硫反应后,溶液中的阴离子为 和
和 ,则脱硫反应的离子方程式为
,则脱硫反应的离子方程式为②测得脱硫效率(即
 的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于50℃时,随温度升高脱硫效率下降的原因是
的吸收率)随温度变化的曲线如图所示。结合已知信息分析,温度大于50℃时,随温度升高脱硫效率下降的原因是
(4)
 水悬浊液吸收
水悬浊液吸收 。已知:室温下,
。已知:室温下,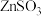 微溶于水,
微溶于水, 易溶于水;溶液中
易溶于水;溶液中 、
、 、
、 的物质的量分数随pH的分布如图1所示。向
的物质的量分数随pH的分布如图1所示。向 水悬浊液中匀速缓慢通入
水悬浊液中匀速缓慢通入 ,在开始吸收的
,在开始吸收的 内,
内, 吸收率、溶液pH均经历了从几乎不变到迅速降低的变化(见图2)。溶液pH几乎不变阶段,主要产物是
吸收率、溶液pH均经历了从几乎不变到迅速降低的变化(见图2)。溶液pH几乎不变阶段,主要产物是 吸收率迅速降低阶段,主要反应的离子方程式为
吸收率迅速降低阶段,主要反应的离子方程式为
您最近一年使用:0次
2023-12-13更新
|
256次组卷
|
2卷引用:江苏省常州市田家炳2高级中学023-2024学年高一上学期12月阶段性调研化学学科试卷
4 . 化学还原稳定法是当前 水体污染修复领域的主要技术。废水中
水体污染修复领域的主要技术。废水中 主要以
主要以 和
和 形式存在,化学还原稳定法去除水中
形式存在,化学还原稳定法去除水中 主要包括铬的还原和固定两个过程。常用的化学还原剂包括硫系还原剂和铁系还原剂。已知:
主要包括铬的还原和固定两个过程。常用的化学还原剂包括硫系还原剂和铁系还原剂。已知: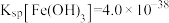 ,
,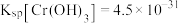 。
。
(1)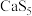 是常用的硫系还原剂,在处理
是常用的硫系还原剂,在处理 时自身转化为单质S。
时自身转化为单质S。
① 具有链状结构,其结构式可表示为
具有链状结构,其结构式可表示为_______ 。
②经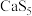 修复的水体pH明显
修复的水体pH明显_______ (填“增大”或“减小”),严重影响土壤及地下水的利用。
(2)铁系还原剂 的还原效率虽不及硫化物,但有利于Cr的固定。
的还原效率虽不及硫化物,但有利于Cr的固定。
①在酸性溶液中, 还原
还原 的离子方程式为
的离子方程式为_______ 。
②Cr的固定途径有两个:其一是难溶性铬铁共沉淀氢氧化物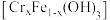 或
或 沉淀的生成;其二是
沉淀的生成;其二是_______ 。
(3)试剂联用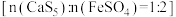 有望实现高效且稳定的修复效果。
有望实现高效且稳定的修复效果。
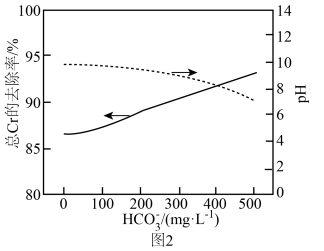
①待各体系充分反应后,静置2h。实验测得分别使用单一试剂和试剂联用时,溶液中总Cr的去除率随溶液初始pH的变化关系如图1所示。pH>9,随pH增大,试剂联用时溶液中总Cr的去除率上升的原因是_______ 。

②在 存在下,试剂联用处理溶液中
存在下,试剂联用处理溶液中 ,待体系充分反应,静置2h。测得
,待体系充分反应,静置2h。测得 浓度对溶液pH以及总Cr去除效果的影响关系如图2所示。随
浓度对溶液pH以及总Cr去除效果的影响关系如图2所示。随 浓度进一步增加,总Cr的去除率明显上升的原因是
浓度进一步增加,总Cr的去除率明显上升的原因是_______ 。
③研究表明,试剂联用效果优于单一试剂主要是由于反应过程中生成了起催化作用的FeS。FeS的生成过程可用化学方程式表示为_______ 。
 水体污染修复领域的主要技术。废水中
水体污染修复领域的主要技术。废水中 主要以
主要以 和
和 形式存在,化学还原稳定法去除水中
形式存在,化学还原稳定法去除水中 主要包括铬的还原和固定两个过程。常用的化学还原剂包括硫系还原剂和铁系还原剂。已知:
主要包括铬的还原和固定两个过程。常用的化学还原剂包括硫系还原剂和铁系还原剂。已知: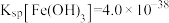 ,
,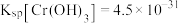 。
。(1)
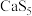 是常用的硫系还原剂,在处理
是常用的硫系还原剂,在处理 时自身转化为单质S。
时自身转化为单质S。①
 具有链状结构,其结构式可表示为
具有链状结构,其结构式可表示为②经
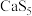 修复的水体pH明显
修复的水体pH明显(2)铁系还原剂
 的还原效率虽不及硫化物,但有利于Cr的固定。
的还原效率虽不及硫化物,但有利于Cr的固定。①在酸性溶液中,
 还原
还原 的离子方程式为
的离子方程式为②Cr的固定途径有两个:其一是难溶性铬铁共沉淀氢氧化物
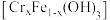 或
或 沉淀的生成;其二是
沉淀的生成;其二是(3)试剂联用
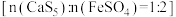 有望实现高效且稳定的修复效果。
有望实现高效且稳定的修复效果。①待各体系充分反应后,静置2h。实验测得分别使用单一试剂和试剂联用时,溶液中总Cr的去除率随溶液初始pH的变化关系如图1所示。pH>9,随pH增大,试剂联用时溶液中总Cr的去除率上升的原因是

②在
 存在下,试剂联用处理溶液中
存在下,试剂联用处理溶液中 ,待体系充分反应,静置2h。测得
,待体系充分反应,静置2h。测得 浓度对溶液pH以及总Cr去除效果的影响关系如图2所示。随
浓度对溶液pH以及总Cr去除效果的影响关系如图2所示。随 浓度进一步增加,总Cr的去除率明显上升的原因是
浓度进一步增加,总Cr的去除率明显上升的原因是
③研究表明,试剂联用效果优于单一试剂主要是由于反应过程中生成了起催化作用的FeS。FeS的生成过程可用化学方程式表示为
您最近一年使用:0次
名校
5 . 二硫化钼(MoS2,难溶于水)具有良好的光、电性能,可由钼精矿(主要含MoS2,还含NiS、CaMoO4等)为原料经过如下过程制得。
(1)“浸取”。向钼精矿中加入NaOH溶液,再加入NaClO溶液,充分反应后的溶液中含有Na2MoO4、Na2SO4、NiSO4、NaCl。
①写出浸取时MoS2发生反应的离子方程式:_______ 。
②浸取后的滤渣中含CaMoO4。若浸取时向溶液中加入Na2CO3溶液,可提高浸出液中Mo元素的含量,原因是_______ 。
③浸取时,Mo元素的浸出率与时间的变化如图1所示。已知生成物对反应无影响,则反应3~4min时,Mo元素的浸出率迅速上升的原因是_______ 。

(2)“制硫代钼酸铵[(NH4)2MoS4,摩尔质量260g•mol-1]”。向浸出液中加入NH4NO3和HNO3,析出(NH4)2Mo4O13,将(NH4)2Mo4O13溶于水,向其中加入(NH4)2S溶液,可得(NH4)2MoS4,写出生成(NH4)2MoS4反应的化学方程式:________ 。
(3)“制MoS2”。(NH4)2MoS4可通过如下两种方法制取MoS2:
方法一:将(NH4)2MoS4在一定条件下加热,可分解得到MoS2、NH3、H2S和硫单质。其中NH3、H2S和硫单质的物质的量之比为8:4:1。
方法二:将(NH4)2MoS4在空气中加热可得MoS2,加热时所得剩余固体的质量与原始固体质量的比值与温度的关系如图2所示。
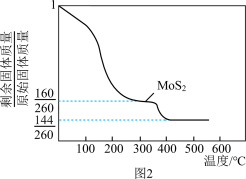
①方法一中,所得硫单质的分子式为_______ 。
②方法二中,500℃可得到Mo的一种氧化物,该氧化物的化学式为_______ 。
(1)“浸取”。向钼精矿中加入NaOH溶液,再加入NaClO溶液,充分反应后的溶液中含有Na2MoO4、Na2SO4、NiSO4、NaCl。
①写出浸取时MoS2发生反应的离子方程式:
②浸取后的滤渣中含CaMoO4。若浸取时向溶液中加入Na2CO3溶液,可提高浸出液中Mo元素的含量,原因是
③浸取时,Mo元素的浸出率与时间的变化如图1所示。已知生成物对反应无影响,则反应3~4min时,Mo元素的浸出率迅速上升的原因是

(2)“制硫代钼酸铵[(NH4)2MoS4,摩尔质量260g•mol-1]”。向浸出液中加入NH4NO3和HNO3,析出(NH4)2Mo4O13,将(NH4)2Mo4O13溶于水,向其中加入(NH4)2S溶液,可得(NH4)2MoS4,写出生成(NH4)2MoS4反应的化学方程式:
(3)“制MoS2”。(NH4)2MoS4可通过如下两种方法制取MoS2:
方法一:将(NH4)2MoS4在一定条件下加热,可分解得到MoS2、NH3、H2S和硫单质。其中NH3、H2S和硫单质的物质的量之比为8:4:1。
方法二:将(NH4)2MoS4在空气中加热可得MoS2,加热时所得剩余固体的质量与原始固体质量的比值与温度的关系如图2所示。

①方法一中,所得硫单质的分子式为
②方法二中,500℃可得到Mo的一种氧化物,该氧化物的化学式为
您最近一年使用:0次
2023-05-29更新
|
498次组卷
|
3卷引用:江苏省常州高级中学2023-2024学年高三上学期开学考试化学试题
解题方法
6 .  是一种常用消毒剂。
是一种常用消毒剂。 与酸性
与酸性 溶液发生反应的化学方程式为
溶液发生反应的化学方程式为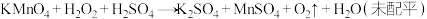 。回答下列问题:
。回答下列问题:
(1)该反应中氧化剂是_______ (填化学式), 发生
发生_______ 反应(填“氧化”或“还原”)。
(2)参加反应的氧化剂与还原剂的化学计量数之比为_______ 。
(3)用双线桥法表示该反应中电子转移的方向和数目:_______ 。
(4)该反应的离子方程式为_______ 。
 是一种常用消毒剂。
是一种常用消毒剂。 与酸性
与酸性 溶液发生反应的化学方程式为
溶液发生反应的化学方程式为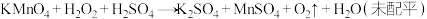 。回答下列问题:
。回答下列问题:(1)该反应中氧化剂是
 发生
发生(2)参加反应的氧化剂与还原剂的化学计量数之比为
(3)用双线桥法表示该反应中电子转移的方向和数目:
(4)该反应的离子方程式为
您最近一年使用:0次
2022-11-23更新
|
112次组卷
|
2卷引用:江苏省常州市田家炳2高级中学023-2024学年高一上学期12月阶段性调研化学学科试卷
解题方法
7 . 以含砷氧化铜矿[含CuO、 及重金属盐等]为原料,用氨浸法制取饲料级硫酸铜。
及重金属盐等]为原料,用氨浸法制取饲料级硫酸铜。
(1)氨浸:常温下,将一定比例的氨水和 溶液混合,配制成浸取液,可将矿物中的CuO转化为
溶液混合,配制成浸取液,可将矿物中的CuO转化为 溶液,此时砷元素以
溶液,此时砷元素以 形式进入溶液。
形式进入溶液。
已知25℃时,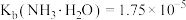 ,
,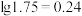 。
。
①为提高铜的浸出率,不仅要求浸取液中总氨(氨铵之和)适当过量,而且要求控制其pH约为9.24,此时浸取液中氨铵比 约为
约为_______ (填字母)。
A.1∶2 B.2∶3 C.1∶1 D.2∶1
②氨浸时溶液温度不宜过高,其原因是_______ 。
(2)除杂:在浸出液中先加入 溶液去除重金属离子,然后调节溶液呈弱酸性,再依次用
溶液去除重金属离子,然后调节溶液呈弱酸性,再依次用 溶液和
溶液和 溶液去除含砷微粒,除砷主要经过“吸附→反应→沉淀”的过程。
溶液去除含砷微粒,除砷主要经过“吸附→反应→沉淀”的过程。
①加入 溶液,同时鼓入空气,可加快吸附过程的发生。请简述产生吸附作用的原理:
溶液,同时鼓入空气,可加快吸附过程的发生。请简述产生吸附作用的原理:_______ 。
②加入 溶液,可将溶液中少量残留的
溶液,可将溶液中少量残留的 氧化为
氧化为 ,并进一步转化为难溶铁盐,脱离浸出液。写出
,并进一步转化为难溶铁盐,脱离浸出液。写出 发生氧化反应的离子方程式:
发生氧化反应的离子方程式:_______ 。
(3)蒸氨、酸溶:除杂后的溶液主要成分为 ,经蒸氨操作得到
,经蒸氨操作得到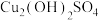 固体。过滤后将其加入硫酸溶解。蒸氨后过滤得到大量废液,为实现资源的充分利用,请结合上述工艺流程提出一条使用建议:
固体。过滤后将其加入硫酸溶解。蒸氨后过滤得到大量废液,为实现资源的充分利用,请结合上述工艺流程提出一条使用建议:_______ 。
(4)结晶、烘干:酸溶后的溶液结晶、过滤、洗涤,得到产品 。实验测得烘干过程中剩余固体的质量与起始样品的质量的比值随温度变化的曲线如图所示。
。实验测得烘干过程中剩余固体的质量与起始样品的质量的比值随温度变化的曲线如图所示。

为确保产品为饲料级 ,烘干温度应不超过
,烘干温度应不超过_______ (写出计算过程)
 及重金属盐等]为原料,用氨浸法制取饲料级硫酸铜。
及重金属盐等]为原料,用氨浸法制取饲料级硫酸铜。(1)氨浸:常温下,将一定比例的氨水和
 溶液混合,配制成浸取液,可将矿物中的CuO转化为
溶液混合,配制成浸取液,可将矿物中的CuO转化为 溶液,此时砷元素以
溶液,此时砷元素以 形式进入溶液。
形式进入溶液。已知25℃时,
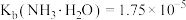 ,
,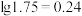 。
。①为提高铜的浸出率,不仅要求浸取液中总氨(氨铵之和)适当过量,而且要求控制其pH约为9.24,此时浸取液中氨铵比
 约为
约为A.1∶2 B.2∶3 C.1∶1 D.2∶1
②氨浸时溶液温度不宜过高,其原因是
(2)除杂:在浸出液中先加入
 溶液去除重金属离子,然后调节溶液呈弱酸性,再依次用
溶液去除重金属离子,然后调节溶液呈弱酸性,再依次用 溶液和
溶液和 溶液去除含砷微粒,除砷主要经过“吸附→反应→沉淀”的过程。
溶液去除含砷微粒,除砷主要经过“吸附→反应→沉淀”的过程。①加入
 溶液,同时鼓入空气,可加快吸附过程的发生。请简述产生吸附作用的原理:
溶液,同时鼓入空气,可加快吸附过程的发生。请简述产生吸附作用的原理:②加入
 溶液,可将溶液中少量残留的
溶液,可将溶液中少量残留的 氧化为
氧化为 ,并进一步转化为难溶铁盐,脱离浸出液。写出
,并进一步转化为难溶铁盐,脱离浸出液。写出 发生氧化反应的离子方程式:
发生氧化反应的离子方程式:(3)蒸氨、酸溶:除杂后的溶液主要成分为
 ,经蒸氨操作得到
,经蒸氨操作得到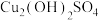 固体。过滤后将其加入硫酸溶解。蒸氨后过滤得到大量废液,为实现资源的充分利用,请结合上述工艺流程提出一条使用建议:
固体。过滤后将其加入硫酸溶解。蒸氨后过滤得到大量废液,为实现资源的充分利用,请结合上述工艺流程提出一条使用建议:(4)结晶、烘干:酸溶后的溶液结晶、过滤、洗涤,得到产品
 。实验测得烘干过程中剩余固体的质量与起始样品的质量的比值随温度变化的曲线如图所示。
。实验测得烘干过程中剩余固体的质量与起始样品的质量的比值随温度变化的曲线如图所示。
为确保产品为饲料级
 ,烘干温度应不超过
,烘干温度应不超过
您最近一年使用:0次
解题方法
8 . 回答下列问题:
(1)工业盐的主要成分是NaNO2,以前有许多起因误食NaNO2而中毒的事件,其原因是NaNO2把人体内的Fe2+转化为Fe3+而失去与O2结合的能力,这说明NaNO2具有_______ (填“氧化”或“还原”)性。工业盐中毒后,可服用维生素C来缓解中毒状况,这说明维生素C具有_______ (填“氧化”或“还原”)性。
(2)在Fe+4HNO3=Fe(NO3)3+NO↑+2H2O的反应中,每有0.6mol电子发生转移时,被还原的HNO3为_______ mol。
(3)某容器中发生一个化学反应,反应过程中存在Fe2+、NO 、Fe3+、NH
、Fe3+、NH 、H+和H2O六种粒子,在反应过程中测得Fe3+、NO
、H+和H2O六种粒子,在反应过程中测得Fe3+、NO 的物质的量随时间变化的曲线如图所示,该反应的离子方程式为
的物质的量随时间变化的曲线如图所示,该反应的离子方程式为_______

(1)工业盐的主要成分是NaNO2,以前有许多起因误食NaNO2而中毒的事件,其原因是NaNO2把人体内的Fe2+转化为Fe3+而失去与O2结合的能力,这说明NaNO2具有
(2)在Fe+4HNO3=Fe(NO3)3+NO↑+2H2O的反应中,每有0.6mol电子发生转移时,被还原的HNO3为
(3)某容器中发生一个化学反应,反应过程中存在Fe2+、NO
 、Fe3+、NH
、Fe3+、NH 、H+和H2O六种粒子,在反应过程中测得Fe3+、NO
、H+和H2O六种粒子,在反应过程中测得Fe3+、NO 的物质的量随时间变化的曲线如图所示,该反应的离子方程式为
的物质的量随时间变化的曲线如图所示,该反应的离子方程式为
您最近一年使用:0次
9 . (1)写出下列物质在水溶液中的电离方程式
①NaHCO3___________ ,
②NaHSO4___________ 。
(2)写出下列微粒的结构示意图
①最外层电子数为次外层电子数2倍的原子的结构示意图___________ ,
②第二层电子数为第一层、第三层电子数之和的原子形成的离子结构示意图:___________ 。
(3)配平并用双线桥表示电子转移的方向和数目:___________KI+___________HNO3——___________KNO3+___________NO↑+___________I2+___________H2O,___________ ,若反应中转移了0.9mol电子,则产生的气体在标准状况下的体积为___________ 。
(4)在一定温度下有分解反应A(s)=B(s)+C(g)+4D(g),若测得生成的气体的质量是同温同压下相同体积氢气的10倍,且当所生成的气体在标况下的体积为44.8L时,所得B的质量为60g,A的摩尔质量为___________ 。
①NaHCO3
②NaHSO4
(2)写出下列微粒的结构示意图
①最外层电子数为次外层电子数2倍的原子的结构示意图
②第二层电子数为第一层、第三层电子数之和的原子形成的离子结构示意图:
(3)配平并用双线桥表示电子转移的方向和数目:___________KI+___________HNO3——___________KNO3+___________NO↑+___________I2+___________H2O,
(4)在一定温度下有分解反应A(s)=B(s)+C(g)+4D(g),若测得生成的气体的质量是同温同压下相同体积氢气的10倍,且当所生成的气体在标况下的体积为44.8L时,所得B的质量为60g,A的摩尔质量为
您最近一年使用:0次
名校
10 . 铁及其化合物在处理工业废水、废气过程中发挥着重要作用。
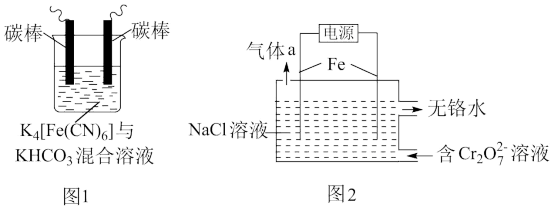
(1)用铁的化合物除硫化氢:2[Fe(CN)6]3-+ 2 +HS- =2[Fe(CN)6]4-+ 2
+HS- =2[Fe(CN)6]4-+ 2 +S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为
+S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为_______ ;电解过程中阴极区溶液的pH_______ (填“变大”、 “变小”或“不变")。
(2)以铁为电极电解除铬,如图2
已知: + H2O=2
+ H2O=2 +2H+
+2H+
氧化性: >
>
①电解过程中主要反应之一: +6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是
+6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是_______ 。
②电解过程中,不同pH时,通电时间与Cr元素的去除率关系如图3所示,pH=10相比pH=4,Cr元素的去除率偏低的原因可能是_______ 。
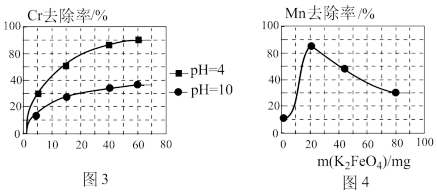
(3)高铁酸钾(K2FeO4)除锰
已知:K2FeO4具有强氧化性,极易溶于水
①在酸性条件下,能与废水中的Mn2+反应生成Fe(OH)3和MnO2沉淀来除锰,该反应的离子方程式_______ 。
②用K2FeO4处理1L 50 mg/L的含Mn2+废水,Mn元素的去除率与K2FeO4量的关系如图4所示,当K2FeO4超过20 mg时,Mn元素的去除率下降的原因可能是_______ 。

(1)用铁的化合物除硫化氢:2[Fe(CN)6]3-+ 2
 +HS- =2[Fe(CN)6]4-+ 2
+HS- =2[Fe(CN)6]4-+ 2 +S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为
+S↓,可通过图1使[Fe(CN)6]3-再生,电解时,阳极的电极反应式为(2)以铁为电极电解除铬,如图2
已知:
 + H2O=2
+ H2O=2 +2H+
+2H+氧化性:
 >
>
①电解过程中主要反应之一:
 +6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是
+6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是②电解过程中,不同pH时,通电时间与Cr元素的去除率关系如图3所示,pH=10相比pH=4,Cr元素的去除率偏低的原因可能是

(3)高铁酸钾(K2FeO4)除锰
已知:K2FeO4具有强氧化性,极易溶于水
①在酸性条件下,能与废水中的Mn2+反应生成Fe(OH)3和MnO2沉淀来除锰,该反应的离子方程式
②用K2FeO4处理1L 50 mg/L的含Mn2+废水,Mn元素的去除率与K2FeO4量的关系如图4所示,当K2FeO4超过20 mg时,Mn元素的去除率下降的原因可能是
您最近一年使用:0次
2021-03-25更新
|
449次组卷
|
5卷引用:江苏省常州市第一中学2023-2024学年高二上学期11月期中考试化学试题
江苏省常州市第一中学2023-2024学年高二上学期11月期中考试化学试题(已下线)【苏州新东方】化学试卷(已下线)2.3.1 浓度变化对化学平衡的影响-2021-2022学年高二化学课后培优练(苏教版2019选择性必修1)湖北省武汉市蔡甸区汉阳一中2021-2022学年高二上学期12月月考化学试题湖北省武汉市部分重点中学2021-2022学年高二上学期12月联考化学试题



