名校
1 . 利用含钴废料(主要成分为Co3O4,还含有少量SiO2、Fe2O3、Al2O3等杂质)制备LiCoO2的工艺如下。
回答下列问题:
(1)“酸浸”时_______ (填“可”或“不可”)用SO2代替H2O2。
(2)写出沉钴的离子反应方程式:_______ 。
(3)“调pH”的范围为4.5~7.8,滤液中残留的
_______ 。
(4)“高温焙烧"时的化学方程式:_______ 。

| 金属离子 | Fe2+ | Fe3+ | Al3+ | Co2+ |
| 开始沉淀的pH | 8.5 | 2.2 | 3.4 | 7.8 |
| 完全沉淀[c(金属离子)≤1×10-5mol/L]的pH | 10.0 | 3.0 | 4.5 | 9.4 |
(1)“酸浸”时
(2)写出沉钴的离子反应方程式:
(3)“调pH”的范围为4.5~7.8,滤液中残留的

(4)“高温焙烧"时的化学方程式:
您最近一年使用:0次
解题方法
2 . 已知海水中溴元素主要以 形式存在,工业上从海水中提取溴的流程如下:
形式存在,工业上从海水中提取溴的流程如下:
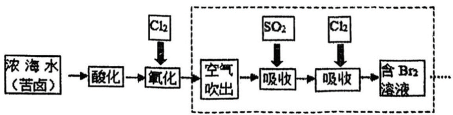
资料:溴单质容易挥发。
(1)写出“氧化”时的离子方程式____________ 。
(2)写出第1步“吸收”时的离子方程式____________________ ,该反应体现了 的
的____________ 性。
(3)得到的“含 溶液”通过以下不同操作,都可得到溴单质:
溶液”通过以下不同操作,都可得到溴单质:
①直接蒸馏得到溴单质,该操作利用的是溴的何种性质:________________ ;
②加入四氯化碳萃取,将得到的溴的四氯化碳溶液蒸馏得到溴单质。可以用四氯化碳对溴溶液进行萃取利用的是溴的何种性质:________________ 。
(4)工业可用 溶液代替二氧化硫的水溶液吸收
溶液代替二氧化硫的水溶液吸收 ,完成下列化学反应方程式:
,完成下列化学反应方程式:_____ 。
_________ _________
_________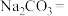 _________
_________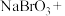 _________
_________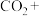 _________
_________
若有480g溴完全反应,转移电子的物质的量为_________  。
。
 形式存在,工业上从海水中提取溴的流程如下:
形式存在,工业上从海水中提取溴的流程如下:
资料:溴单质容易挥发。
(1)写出“氧化”时的离子方程式
(2)写出第1步“吸收”时的离子方程式
 的
的(3)得到的“含
 溶液”通过以下不同操作,都可得到溴单质:
溶液”通过以下不同操作,都可得到溴单质:①直接蒸馏得到溴单质,该操作利用的是溴的何种性质:
②加入四氯化碳萃取,将得到的溴的四氯化碳溶液蒸馏得到溴单质。可以用四氯化碳对溴溶液进行萃取利用的是溴的何种性质:
(4)工业可用
 溶液代替二氧化硫的水溶液吸收
溶液代替二氧化硫的水溶液吸收 ,完成下列化学反应方程式:
,完成下列化学反应方程式:_________
 _________
_________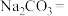 _________
_________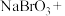 _________
_________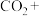 _________
_________若有480g溴完全反应,转移电子的物质的量为
 。
。
您最近一年使用:0次
解题方法
3 . 胆矾和绿矾( )都是重要的化工试剂,某工厂废金属屑的主要成分为
)都是重要的化工试剂,某工厂废金属屑的主要成分为 、
、 和Al(含有少量
和Al(含有少量 和
和 )。某化学兴趣小组模拟工业生产设计如下实验流程,用该工厂的废金属屑制取氯化铝、绿矾晶体(
)。某化学兴趣小组模拟工业生产设计如下实验流程,用该工厂的废金属屑制取氯化铝、绿矾晶体( )和胆矾晶体,已知偏铝酸盐溶液能与
)和胆矾晶体,已知偏铝酸盐溶液能与 反应生成氢氧化铝沉淀。
反应生成氢氧化铝沉淀。

回答下列问题:
(1)胆矾的化学式为
(2)请写出试剂X和Y的化学式:X
(3)若向溶液C滴加盐酸有
 生成,则溶液C中溶质的主要成分
生成,则溶液C中溶质的主要成分(4)写出C中主要溶质滴加盐酸发生反应的离子方程式
(5)某酸性工业废水中含有的重铬酸根离子(
 )有毒,必须处理达标后才能排放。工业上常用绿矾做处理剂,还原产物为
)有毒,必须处理达标后才能排放。工业上常用绿矾做处理剂,还原产物为 ,该反应的离子方程式为
,该反应的离子方程式为 的酸性重铬酸钾溶液,消耗该溶液80
的酸性重铬酸钾溶液,消耗该溶液80 ,则所制绿矾中铁元素的质量分数为
,则所制绿矾中铁元素的质量分数为
您最近一年使用:0次
名校
解题方法
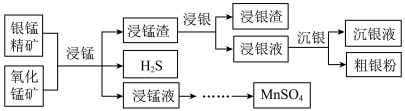
4 . 以银锰精矿(主要含Ag2S、MnS、FeS2,其他不反应的杂质不考虑)和氧化锰矿(主要含MnO2)为原料联合提取银和锰的一种流程示意图如下:
已知:1.酸性条件下,MnO2的氧化性强于Fe3+;
II.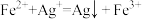 。
。
(1)“浸锰”过程是在H2SO4溶液中使矿石中的锰元素浸出,同时去除FeS2,有利于后续银的浸出,矿石中的银以Ag2S的形式残留于浸锰渣中。
①写出Mn元素基态原子的价层电子排布式:_________________ 。
②Ksp(MnS)______________ (填“>”或“<”)Ksp(Ag2S)。
③浸锰液中主要的金属阳离子有______________ 。
(2)“浸银”时,使用过量FeCl3、HCl和CaCl2的混合液作为浸出剂,将Ag2S中的银以[AgCl2]-形式浸出。
①写出“浸银”反应的离子方程式:______________ 。
②解释浸出剂中Cl-、H+的作用:______________ 。
(3)“沉银”过程中需要用铁粉作为还原剂。
①写出“沉银”过程的离子方程式:______________ 。
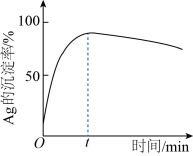
②一定温度下,Ag的沉淀率随反应时间的变化如图所示。解释1分钟后Ag的沉淀率逐渐减小的原因:______________ 。
(4)结合“浸锰”过程,从两种矿石中各物质利用的角度,分析这种联合提取银和锰方法的优势:______________ 。

已知:1.酸性条件下,MnO2的氧化性强于Fe3+;
II.
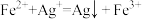 。
。(1)“浸锰”过程是在H2SO4溶液中使矿石中的锰元素浸出,同时去除FeS2,有利于后续银的浸出,矿石中的银以Ag2S的形式残留于浸锰渣中。
①写出Mn元素基态原子的价层电子排布式:
②Ksp(MnS)
③浸锰液中主要的金属阳离子有
(2)“浸银”时,使用过量FeCl3、HCl和CaCl2的混合液作为浸出剂,将Ag2S中的银以[AgCl2]-形式浸出。

①写出“浸银”反应的离子方程式:
②解释浸出剂中Cl-、H+的作用:
(3)“沉银”过程中需要用铁粉作为还原剂。
①写出“沉银”过程的离子方程式:
②一定温度下,Ag的沉淀率随反应时间的变化如图所示。解释1分钟后Ag的沉淀率逐渐减小的原因:
(4)结合“浸锰”过程,从两种矿石中各物质利用的角度,分析这种联合提取银和锰方法的优势:
您最近一年使用:0次
5 . 低碳经济已成为人们一种新的生活理念,二氧化碳的捕捉和利用是能源领域的一个重要研究方向。回答下列问题:
(1)工业上用 和
和 反应合成二甲醚。已知:
反应合成二甲醚。已知:
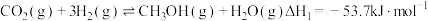
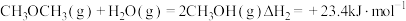
则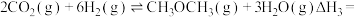
_______ kJ∙mol-1。
(2)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。科学家提出由 制取
制取 的太阳能工艺如图:
的太阳能工艺如图: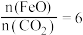 ,则
,则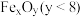 的化学式为
的化学式为_______ ,“热分解系统”中每转移 电子,需消耗
电子,需消耗
_______  。
。
(3)催化时还可以使用一种无机固体电解质作催化剂,其由正离子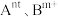 和负离子
和负离子 组成,该物质
组成,该物质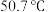 以上形成无序结构(高温相),
以上形成无序结构(高温相),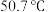 以下变为有序结构(低温相),二者晶体晶胞结构如图所示:
以下变为有序结构(低温相),二者晶体晶胞结构如图所示:_______ 。
ii.“高温相”具有良好的离子导电性,其主要原因是_______ 。
(4)铜基催化剂 (
( 为
为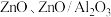 等)是
等)是 加氢制甲醇常用的催化剂,部分合成路线如图所示。
加氢制甲醇常用的催化剂,部分合成路线如图所示。 上发生反应的总化学方程式
上发生反应的总化学方程式_______ 。
(5)利用电解法在碱性或酸性条件下将 还原为
还原为 和
和 的原理如下图所示:
的原理如下图所示: 和法拉第效率(
和法拉第效率(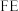 )的定义(X代表
)的定义(X代表 或
或 )如下:
)如下:
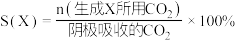

①实验测得,碱性条件生成 总的选择性小于酸性条件,原因是
总的选择性小于酸性条件,原因是_______ 。
②实验测得,酸性条件生成 总的法拉第效率小于碱性条件,原因是
总的法拉第效率小于碱性条件,原因是_______ 。
(1)工业上用
 和
和 反应合成二甲醚。已知:
反应合成二甲醚。已知: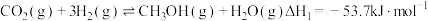
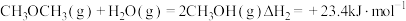
则
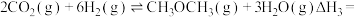
(2)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。科学家提出由
 制取
制取 的太阳能工艺如图:
的太阳能工艺如图: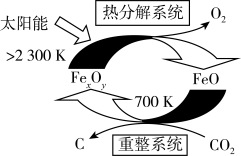
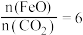 ,则
,则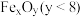 的化学式为
的化学式为 电子,需消耗
电子,需消耗
 。
。(3)催化时还可以使用一种无机固体电解质作催化剂,其由正离子
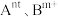 和负离子
和负离子 组成,该物质
组成,该物质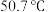 以上形成无序结构(高温相),
以上形成无序结构(高温相),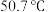 以下变为有序结构(低温相),二者晶体晶胞结构如图所示:
以下变为有序结构(低温相),二者晶体晶胞结构如图所示: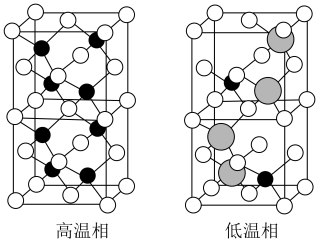
说明:图中,○球为负离子;高温相中的●深色球为正离子或空位;低温相中的 球为
球为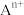 离子,●球为
离子,●球为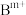 离子。
离子。
ii.“高温相”具有良好的离子导电性,其主要原因是
(4)铜基催化剂
 (
( 为
为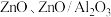 等)是
等)是 加氢制甲醇常用的催化剂,部分合成路线如图所示。
加氢制甲醇常用的催化剂,部分合成路线如图所示。 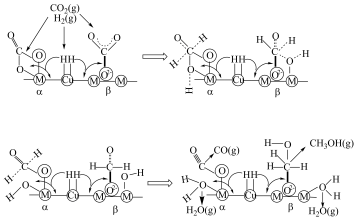
 上发生反应的总化学方程式
上发生反应的总化学方程式(5)利用电解法在碱性或酸性条件下将
 还原为
还原为 和
和 的原理如下图所示:
的原理如下图所示: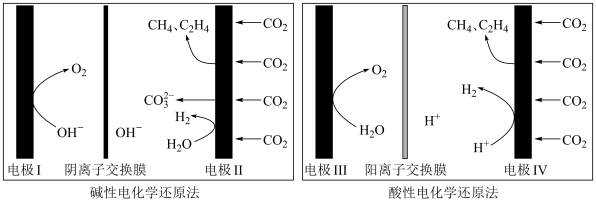
 和法拉第效率(
和法拉第效率(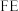 )的定义(X代表
)的定义(X代表 或
或 )如下:
)如下: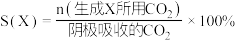

①实验测得,碱性条件生成
 总的选择性小于酸性条件,原因是
总的选择性小于酸性条件,原因是②实验测得,酸性条件生成
 总的法拉第效率小于碱性条件,原因是
总的法拉第效率小于碱性条件,原因是
您最近一年使用:0次
名校
解题方法
6 .  在环境保护等领域有广泛应用。
在环境保护等领域有广泛应用。
(1)在 下,向
下,向 溶液中边搅拌边分批加入
溶液中边搅拌边分批加入 固体,同时滴加
固体,同时滴加 溶液,使溶液
溶液,使溶液 控制在4~4.5之间。一段时间后,过滤、洗涤得
控制在4~4.5之间。一段时间后,过滤、洗涤得 固体。
固体。
①制备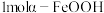 理论上需要
理论上需要 的物质的量为
的物质的量为___________  ;实际生产过程中所加
;实际生产过程中所加 低于理论用量的原因是
低于理论用量的原因是___________ 。
②为检验 已被完全氧化,某同学向过滤所得滤液中滴加酸性
已被完全氧化,某同学向过滤所得滤液中滴加酸性 溶液,该设计方案不合理的理由是
溶液,该设计方案不合理的理由是___________ 。
(2) 的结构中,每个
的结构中,每个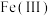 与羟基氧和非羟基氧构成了
与羟基氧和非羟基氧构成了 八面体,相同环境的氧原子之间构成正三角形。补充完整该八面体的结构
八面体,相同环境的氧原子之间构成正三角形。补充完整该八面体的结构___________ 。 可用于脱除烟气中的
可用于脱除烟气中的 。脱硫、再生过程中可能的物种变化如图1所示。生成的
。脱硫、再生过程中可能的物种变化如图1所示。生成的 (结构如图2所示)覆盖在
(结构如图2所示)覆盖在 的表面。
的表面。___________ 。
②工业可使用四氯乙烯 溶解
溶解 并实现与
并实现与 分离。四氯乙烯能溶解
分离。四氯乙烯能溶解 的原因是
的原因是___________ 。
③部分环状分子(如苯)中由于存在大 键,增强了分子的稳定性。
键,增强了分子的稳定性。 分子中不能形成大
分子中不能形成大 键的原因是
键的原因是___________ 。
 在环境保护等领域有广泛应用。
在环境保护等领域有广泛应用。(1)在
 下,向
下,向 溶液中边搅拌边分批加入
溶液中边搅拌边分批加入 固体,同时滴加
固体,同时滴加 溶液,使溶液
溶液,使溶液 控制在4~4.5之间。一段时间后,过滤、洗涤得
控制在4~4.5之间。一段时间后,过滤、洗涤得 固体。
固体。①制备
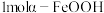 理论上需要
理论上需要 的物质的量为
的物质的量为 ;实际生产过程中所加
;实际生产过程中所加 低于理论用量的原因是
低于理论用量的原因是②为检验
 已被完全氧化,某同学向过滤所得滤液中滴加酸性
已被完全氧化,某同学向过滤所得滤液中滴加酸性 溶液,该设计方案不合理的理由是
溶液,该设计方案不合理的理由是(2)
 的结构中,每个
的结构中,每个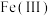 与羟基氧和非羟基氧构成了
与羟基氧和非羟基氧构成了 八面体,相同环境的氧原子之间构成正三角形。补充完整该八面体的结构
八面体,相同环境的氧原子之间构成正三角形。补充完整该八面体的结构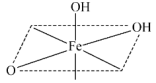
 可用于脱除烟气中的
可用于脱除烟气中的 。脱硫、再生过程中可能的物种变化如图1所示。生成的
。脱硫、再生过程中可能的物种变化如图1所示。生成的 (结构如图2所示)覆盖在
(结构如图2所示)覆盖在 的表面。
的表面。
②工业可使用四氯乙烯
 溶解
溶解 并实现与
并实现与 分离。四氯乙烯能溶解
分离。四氯乙烯能溶解 的原因是
的原因是③部分环状分子(如苯)中由于存在大
 键,增强了分子的稳定性。
键,增强了分子的稳定性。 分子中不能形成大
分子中不能形成大 键的原因是
键的原因是
您最近一年使用:0次
2024-02-13更新
|
708次组卷
|
4卷引用:江苏省常州市联盟校2023-2024学年高二下学期3月阶段调研化学试题
名校
解题方法
7 . 将不同类型的矿物协同浸出可以节约原料。
(1)方铅矿(主要成分为PbS,含少量FeS2等)与软锰矿(主要成分为MnO2,含有少量SiO2、Al2O3等)可协同浸出Pb、Mn。协同浸取的过程为:将一定质量比的方铅矿和软锰矿投入足量稀盐酸和NaCl的混合溶液中,控制反应的温度为70℃,并不断搅拌,酸浸后浸出液中含Mn2+、Fe3+、Al3+、 、Cl-,沉淀中含S、难溶矿渣及少量PbCl2。
、Cl-,沉淀中含S、难溶矿渣及少量PbCl2。
已知:i.PbCl2难溶于冷水,可发生反应: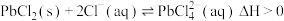 ;
;
ii.室温时Ksp(PbCl2)=1.6×10-5,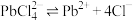 的平衡常数K=3.2×10-2。
的平衡常数K=3.2×10-2。
①写出浸取时生成PbCl2的反应离子方程式:___________ 。
②室温时反应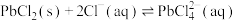 的平衡常数K=
的平衡常数K=________ 。
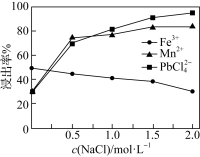
③其他条件一定,改变起始NaCl的浓度,反应相同时间,测得浸出液中Fe、Mn、Pb的浸出率与起始NaCl的浓度的关系如图所示。NaCl浓度越大,Fe的浸出率越低的原因是________ 。
(2)上述软锰矿与闪锌矿(主要成分为ZnS)可协同浸出Zn、Mn。协同浸取的过程为:将一定质量比的软锰矿和闪锌矿投入足量稀硫酸中,控制反应的温度为80℃,并不断搅拌,酸浸后浸出液中含Mn2+、Zn2+、Al3+、 ,沉淀中含S、难溶矿渣。浸出过程中发现若加入少量FeSO4晶体,可以加快Zn、Mn浸出速率。
,沉淀中含S、难溶矿渣。浸出过程中发现若加入少量FeSO4晶体,可以加快Zn、Mn浸出速率。
①研究表明,FeSO4参与了Zn、Mn的浸出反应,该反应的过程可描述为___________ 。
②加入少量FeSO4可以加快浸出速率的原因是___________ 。
(1)方铅矿(主要成分为PbS,含少量FeS2等)与软锰矿(主要成分为MnO2,含有少量SiO2、Al2O3等)可协同浸出Pb、Mn。协同浸取的过程为:将一定质量比的方铅矿和软锰矿投入足量稀盐酸和NaCl的混合溶液中,控制反应的温度为70℃,并不断搅拌,酸浸后浸出液中含Mn2+、Fe3+、Al3+、
 、Cl-,沉淀中含S、难溶矿渣及少量PbCl2。
、Cl-,沉淀中含S、难溶矿渣及少量PbCl2。已知:i.PbCl2难溶于冷水,可发生反应:
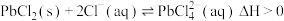 ;
; ii.室温时Ksp(PbCl2)=1.6×10-5,
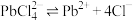 的平衡常数K=3.2×10-2。
的平衡常数K=3.2×10-2。①写出浸取时生成PbCl2的反应离子方程式:
②室温时反应
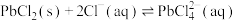 的平衡常数K=
的平衡常数K=③其他条件一定,改变起始NaCl的浓度,反应相同时间,测得浸出液中Fe、Mn、Pb的浸出率与起始NaCl的浓度的关系如图所示。NaCl浓度越大,Fe的浸出率越低的原因是

(2)上述软锰矿与闪锌矿(主要成分为ZnS)可协同浸出Zn、Mn。协同浸取的过程为:将一定质量比的软锰矿和闪锌矿投入足量稀硫酸中,控制反应的温度为80℃,并不断搅拌,酸浸后浸出液中含Mn2+、Zn2+、Al3+、
 ,沉淀中含S、难溶矿渣。浸出过程中发现若加入少量FeSO4晶体,可以加快Zn、Mn浸出速率。
,沉淀中含S、难溶矿渣。浸出过程中发现若加入少量FeSO4晶体,可以加快Zn、Mn浸出速率。①研究表明,FeSO4参与了Zn、Mn的浸出反应,该反应的过程可描述为
②加入少量FeSO4可以加快浸出速率的原因是
您最近一年使用:0次
8 . 金属钛被广泛应用于飞机、火箭和人造卫星等领域,可通过如图所示的转化制取:

(1)“反应1”生成TiCl4,化学反应方程式为:___________ ,若有0.2molCl2参与反应,反应生成TiCl4的物质的量是___________ 。
(2)“反应2”须在无氧和非水性溶剂中进行,原因是___________ 。用双线桥法表示该反应电子转移的方向和数目:
______________ 。
(3)工业制备金属钠时,发生反应的化学方程式是___________ 。

(1)“反应1”生成TiCl4,化学反应方程式为:
(2)“反应2”须在无氧和非水性溶剂中进行,原因是

(3)工业制备金属钠时,发生反应的化学方程式是
您最近一年使用:0次
名校
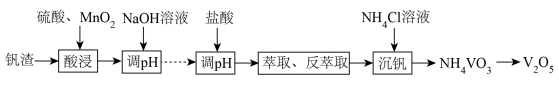
9 . 五氧化二钒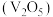 是广泛用于冶金、化工等行业的催化剂。由富钒废渣制备
是广泛用于冶金、化工等行业的催化剂。由富钒废渣制备 的一种流程如下:
的一种流程如下:
已知:i. 溶于水,
溶于水, 难溶于水。
难溶于水。
ii.部分含钒(五价)物质在水溶液中的主要存在形式如下表:
(1)“酸浸”时, 将
将 转化为
转化为 方的离子反应方程式为
方的离子反应方程式为___________ 。
(2)通过“调 、萃取、反萃取”等过程,可制得
、萃取、反萃取”等过程,可制得 溶液。已知
溶液。已知 能被有机萃取剂(简称
能被有机萃取剂(简称 )萃取,其萃取原理可表示为
)萃取,其萃取原理可表示为 (水层)
(水层) (有机层)
(有机层)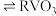 (有机层)
(有机层)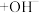 (水层)。
(水层)。
①萃取前,加盐酸调节溶液的 为7的目的是
为7的目的是___________ 。
②反萃取中, 反萃取率随着
反萃取率随着 的升高呈现先增大后减小的趋势的原因是
的升高呈现先增大后减小的趋势的原因是___________ 。
(3)“沉矾”时,向 为8的
为8的 溶液中加入
溶液中加入 溶液,析出
溶液,析出 沉淀。沉钒温度需控制在70℃左右,温度不能过高的原因是
沉淀。沉钒温度需控制在70℃左右,温度不能过高的原因是___________ 。
(4)用活化后的 作催化剂,
作催化剂, 将
将 还原为
还原为 的一种反应历程如图所示。
的一种反应历程如图所示。 与
与 形成能提供质子的酸性位,
形成能提供质子的酸性位, 以“氢键”形式吸附在酸性位上生成“中间体X”,
以“氢键”形式吸附在酸性位上生成“中间体X”, 与X反应生成不稳定的“过渡态”物质,随后分解生成
与X反应生成不稳定的“过渡态”物质,随后分解生成 和
和 。“中间体X”的结构式可表示为
。“中间体X”的结构式可表示为___________ , 将
将 还原为
还原为 的总反应方程式为
的总反应方程式为___________ 。

 是广泛用于冶金、化工等行业的催化剂。由富钒废渣制备
是广泛用于冶金、化工等行业的催化剂。由富钒废渣制备 的一种流程如下:
的一种流程如下:
已知:i.
 溶于水,
溶于水, 难溶于水。
难溶于水。ii.部分含钒(五价)物质在水溶液中的主要存在形式如下表:
| pH | 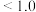 |  | 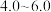 |  | 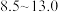 | 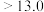 |
| 主要存在形式 |  |  | 多矾酸根 |  | 多矾酸根 |  |
| 备注 | 多矾酸盐在水中溶解度较小 | |||||
(1)“酸浸”时,
 将
将 转化为
转化为 方的离子反应方程式为
方的离子反应方程式为(2)通过“调
 、萃取、反萃取”等过程,可制得
、萃取、反萃取”等过程,可制得 溶液。已知
溶液。已知 能被有机萃取剂(简称
能被有机萃取剂(简称 )萃取,其萃取原理可表示为
)萃取,其萃取原理可表示为 (水层)
(水层) (有机层)
(有机层)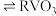 (有机层)
(有机层)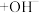 (水层)。
(水层)。①萃取前,加盐酸调节溶液的
 为7的目的是
为7的目的是②反萃取中,
 反萃取率随着
反萃取率随着 的升高呈现先增大后减小的趋势的原因是
的升高呈现先增大后减小的趋势的原因是(3)“沉矾”时,向
 为8的
为8的 溶液中加入
溶液中加入 溶液,析出
溶液,析出 沉淀。沉钒温度需控制在70℃左右,温度不能过高的原因是
沉淀。沉钒温度需控制在70℃左右,温度不能过高的原因是(4)用活化后的
 作催化剂,
作催化剂, 将
将 还原为
还原为 的一种反应历程如图所示。
的一种反应历程如图所示。 与
与 形成能提供质子的酸性位,
形成能提供质子的酸性位, 以“氢键”形式吸附在酸性位上生成“中间体X”,
以“氢键”形式吸附在酸性位上生成“中间体X”, 与X反应生成不稳定的“过渡态”物质,随后分解生成
与X反应生成不稳定的“过渡态”物质,随后分解生成 和
和 。“中间体X”的结构式可表示为
。“中间体X”的结构式可表示为 将
将 还原为
还原为 的总反应方程式为
的总反应方程式为
您最近一年使用:0次
名校
10 . 完成下列问题。
(1)已知:反应I: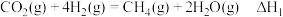
反应II: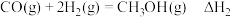
反应III:
若某反应的平衡常数表达式为 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式:______ 。(焓变用含 的代数式表示)
的代数式表示)
(2)铁粉可用于处理水中污染物。铁粉的氧化物层可以导电。利用纳米级的铁粉可以有效处理废水中的 和
和 ,去除机理如图甲所示。纳米级的铁粉去除污水中
,去除机理如图甲所示。纳米级的铁粉去除污水中 和
和 机理不同,请解释原因并简述两者的区别:
机理不同,请解释原因并简述两者的区别:___________ ;由图乙可知,当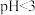 时,随
时,随 减小,
减小, 和
和 去除率减小的原因是
去除率减小的原因是___________ 。

(3)“纳米零价铁 ”体系可将烟气中难溶的NO氧化为可溶的
”体系可将烟气中难溶的NO氧化为可溶的 :在一定温度下,将
:在一定温度下,将 溶液和
溶液和 溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化。
溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化。
① 催化
催化 分解产生HO∙,HO∙将NO氧化为
分解产生HO∙,HO∙将NO氧化为 的机理如图所示,Y的化学式为
的机理如图所示,Y的化学式为___________ 。
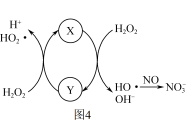
②NO与 反应生成
反应生成 的化学方程式为
的化学方程式为___________ 。
③纳米零价铁的作用是___________ 。
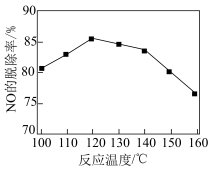
④NO脱除率随温度的变化如图所示。温度高于120℃时,NO脱除率随温度升高呈现下降趋势的主要原因是___________ 。
(1)已知:反应I:
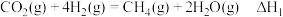
反应II:
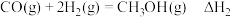
反应III:

若某反应的平衡常数表达式为
 ,请写出此反应的热化学方程式:
,请写出此反应的热化学方程式: 的代数式表示)
的代数式表示)(2)铁粉可用于处理水中污染物。铁粉的氧化物层可以导电。利用纳米级的铁粉可以有效处理废水中的
 和
和 ,去除机理如图甲所示。纳米级的铁粉去除污水中
,去除机理如图甲所示。纳米级的铁粉去除污水中 和
和 机理不同,请解释原因并简述两者的区别:
机理不同,请解释原因并简述两者的区别: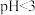 时,随
时,随 减小,
减小, 和
和 去除率减小的原因是
去除率减小的原因是
(3)“纳米零价铁
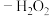 ”体系可将烟气中难溶的NO氧化为可溶的
”体系可将烟气中难溶的NO氧化为可溶的 :在一定温度下,将
:在一定温度下,将 溶液和
溶液和 溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化。
溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的NO氧化。①
 催化
催化 分解产生HO∙,HO∙将NO氧化为
分解产生HO∙,HO∙将NO氧化为 的机理如图所示,Y的化学式为
的机理如图所示,Y的化学式为
②NO与
 反应生成
反应生成 的化学方程式为
的化学方程式为③纳米零价铁的作用是
④NO脱除率随温度的变化如图所示。温度高于120℃时,NO脱除率随温度升高呈现下降趋势的主要原因是

您最近一年使用:0次



