名校
解题方法
1 . 红磷可用于制备半导体化合物,还可以用于制造火柴、烟火,以及三氯化磷等。
Ⅰ.研究小组以无水甲苯为溶剂, (易水解)和
(易水解)和 (叠氮化钠)为反应物制备红磷。
(叠氮化钠)为反应物制备红磷。
实验步骤如下:
①甲苯的干燥和收集:装置如图1所示(夹持及加热装置略)
已知:二苯甲酮为指示剂,无水时体系呈蓝色,甲苯的沸点为110.6℃。 的作用是
的作用是___________ 。
(2)先小火加热控温100℃一段时间,打开活塞___________ ,达到除水的目的。再升温至120℃左右,打开活塞___________ ,达到分离收集甲苯的目的。
②红磷的制备:装置如图2所示(夹持、搅拌、加热装置已略)。___________ 。用氩气赶走空气的目的是___________ 。
(4)离心分离和洗涤得到产品,洗涤时先后使用乙醇和水,依次洗去的物质是___________ 。
Ⅱ.该实验所需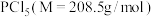 的纯度要求极高,对于的纯度测定如下:
的纯度要求极高,对于的纯度测定如下:
步骤Ⅰ:取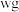 上述所用样品,置于盛有蒸馏水的水解瓶中摇动至完全水解,将水解液配成
上述所用样品,置于盛有蒸馏水的水解瓶中摇动至完全水解,将水解液配成 溶液;
溶液;
步骤Ⅱ:取 上述溶液于锥形瓶中,先加入足量稀硝酸,一段时间后再加入
上述溶液于锥形瓶中,先加入足量稀硝酸,一段时间后再加入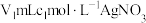 溶液(过量),使
溶液(过量),使 完全转化为
完全转化为 沉淀(
沉淀(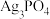 可溶于稀硝酸);
可溶于稀硝酸);
步骤Ⅲ:加入少量硝基苯,振荡,使沉淀表面被有机物覆盖。以硫酸铁溶液为指示剂,用 溶液滴定过量的
溶液滴定过量的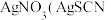 难溶于水),达到滴定终点时,共用去
难溶于水),达到滴定终点时,共用去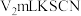 溶液。
溶液。
(5)产品中 的质量分数为
的质量分数为___________  ,若测定过程中没有加入硝基苯,则所测
,若测定过程中没有加入硝基苯,则所测 的含量会
的含量会___________ (填“偏大”“偏小”或“不变”)。
Ⅰ.研究小组以无水甲苯为溶剂,
 (易水解)和
(易水解)和 (叠氮化钠)为反应物制备红磷。
(叠氮化钠)为反应物制备红磷。实验步骤如下:
①甲苯的干燥和收集:装置如图1所示(夹持及加热装置略)
已知:二苯甲酮为指示剂,无水时体系呈蓝色,甲苯的沸点为110.6℃。
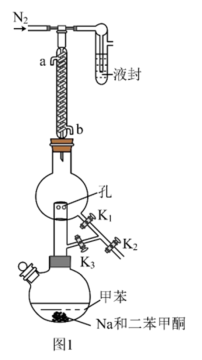
 的作用是
的作用是(2)先小火加热控温100℃一段时间,打开活塞
②红磷的制备:装置如图2所示(夹持、搅拌、加热装置已略)。
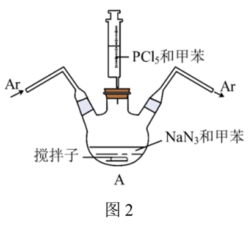
(4)离心分离和洗涤得到产品,洗涤时先后使用乙醇和水,依次洗去的物质是
Ⅱ.该实验所需
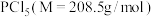 的纯度要求极高,对于的纯度测定如下:
的纯度要求极高,对于的纯度测定如下:步骤Ⅰ:取
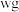 上述所用样品,置于盛有蒸馏水的水解瓶中摇动至完全水解,将水解液配成
上述所用样品,置于盛有蒸馏水的水解瓶中摇动至完全水解,将水解液配成 溶液;
溶液;步骤Ⅱ:取
 上述溶液于锥形瓶中,先加入足量稀硝酸,一段时间后再加入
上述溶液于锥形瓶中,先加入足量稀硝酸,一段时间后再加入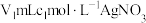 溶液(过量),使
溶液(过量),使 完全转化为
完全转化为 沉淀(
沉淀(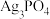 可溶于稀硝酸);
可溶于稀硝酸);步骤Ⅲ:加入少量硝基苯,振荡,使沉淀表面被有机物覆盖。以硫酸铁溶液为指示剂,用
 溶液滴定过量的
溶液滴定过量的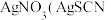 难溶于水),达到滴定终点时,共用去
难溶于水),达到滴定终点时,共用去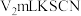 溶液。
溶液。(5)产品中
 的质量分数为
的质量分数为 ,若测定过程中没有加入硝基苯,则所测
,若测定过程中没有加入硝基苯,则所测 的含量会
的含量会
您最近半年使用:0次
解题方法
2 . 2023 年诺贝尔化学奖授予发现量子点的三位科学家,量子点的尺寸一般在1 nm~10 nm之间,是一种纳米级别的半导体。量子点的尺寸不同,则发光颜色不同,吸收光谱波长不同。实验室一种制备CdSe量子点的方法如下:
一、CdSe量子点前驱体的制备
Ⅰ.N2气氛中,取1 mmol Se粉于三颈烧瓶中,加入15 mL的十八烯溶剂,加热到280℃,Se粉完全溶解形成橙色透明溶液;
Ⅱ.N2气氛中,将1 mmol CdCl2溶于4 mL油酸,加热至120℃,使CdCl2完全溶于油酸,形成油酸镉澄清液体。
二、CdSe量子点的生长与制备
Ⅲ.将步骤Ⅱ中制备好的油酸镉溶液注射至步骤Ⅰ中含有Se粉的三颈烧瓶中,如下图所示,保持反应温度为260℃,反应45min。
Ⅳ.待反应液冷却后,加入20 mL乙醇溶液,CdSe析出,离心分离,加入正己烷分散后,再次加入乙醇,离心分离,重复2~3次后,用乙醇和丙酮洗涤 CdSe,即可得到干净的CdSe量子点。
回答下列问题:
(1)Cd为第五周期ⅡB族,则Cd的价层电子排布式为___________ 。
(2)步骤Ⅱ中N2的作用为___________ ,油酸与镉配位的原子为___________ 。
(3)Se的一种制备方法如下:向Na2SeO3水溶液中加入 进行还原,得Se单质,过滤,洗涤,干燥,静置。制备过程中,会产生一种对环境无污染的气体,则该反应的离子方程式为
进行还原,得Se单质,过滤,洗涤,干燥,静置。制备过程中,会产生一种对环境无污染的气体,则该反应的离子方程式为___________ ;此方法获得Se单质过程中无需使用的仪器是___________ (填名称)。___________ 现象时,证明CdSe量子点生长基本停止,制备完成。除此方法外,还可利用___________ 物理现象初步鉴定CdSe量子点制备成功。
(5)步骤Ⅳ中加入20 mL乙醇的作用是___________ 。
(6)CdSe洗涤干净的标志是___________ 。
一、CdSe量子点前驱体的制备
Ⅰ.N2气氛中,取1 mmol Se粉于三颈烧瓶中,加入15 mL的十八烯溶剂,加热到280℃,Se粉完全溶解形成橙色透明溶液;
Ⅱ.N2气氛中,将1 mmol CdCl2溶于4 mL油酸,加热至120℃,使CdCl2完全溶于油酸,形成油酸镉澄清液体。
二、CdSe量子点的生长与制备
Ⅲ.将步骤Ⅱ中制备好的油酸镉溶液注射至步骤Ⅰ中含有Se粉的三颈烧瓶中,如下图所示,保持反应温度为260℃,反应45min。
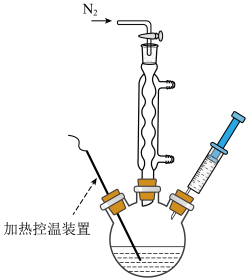
Ⅳ.待反应液冷却后,加入20 mL乙醇溶液,CdSe析出,离心分离,加入正己烷分散后,再次加入乙醇,离心分离,重复2~3次后,用乙醇和丙酮洗涤 CdSe,即可得到干净的CdSe量子点。
回答下列问题:
(1)Cd为第五周期ⅡB族,则Cd的价层电子排布式为
(2)步骤Ⅱ中N2的作用为
(3)Se的一种制备方法如下:向Na2SeO3水溶液中加入
 进行还原,得Se单质,过滤,洗涤,干燥,静置。制备过程中,会产生一种对环境无污染的气体,则该反应的离子方程式为
进行还原,得Se单质,过滤,洗涤,干燥,静置。制备过程中,会产生一种对环境无污染的气体,则该反应的离子方程式为
(5)步骤Ⅳ中加入20 mL乙醇的作用是
(6)CdSe洗涤干净的标志是
您最近半年使用:0次
7日内更新
|
43次组卷
|
2卷引用:东北三省四市教研联合体2024届高三下学期高考模拟(二)化学试题
名校
3 . 羟基氧化铁 为淡黄色固体,简称铁黄,可作颜料。制备铁黄的关键是先制备铁黄晶种,否则只能得到稀薄的、颜色暗淡的色浆,不具备颜料性能。实验室以硫酸亚铁铵为主要原料制备铁黄的实验步骤如下:
为淡黄色固体,简称铁黄,可作颜料。制备铁黄的关键是先制备铁黄晶种,否则只能得到稀薄的、颜色暗淡的色浆,不具备颜料性能。实验室以硫酸亚铁铵为主要原料制备铁黄的实验步骤如下:
 .产品制备及产率计算
.产品制备及产率计算
①制备晶种:称取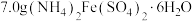 放入三颈烧瓶中,加入
放入三颈烧瓶中,加入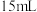 去离子水,恒温水浴加热至
去离子水,恒温水浴加热至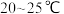 ,搅拌溶解,慢慢滴加
,搅拌溶解,慢慢滴加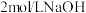 溶液,用
溶液,用 试纸检验至溶液
试纸检验至溶液 为
为 ,停止加碱,观察到出现沉淀并伴随沉淀颜色变化。
,停止加碱,观察到出现沉淀并伴随沉淀颜色变化。
②氧化过程:称取足量 ,加入上述溶液,于
,加入上述溶液,于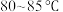 恒温水浴中进行氧化。氧化过程中,边搅拌边不断滴加
恒温水浴中进行氧化。氧化过程中,边搅拌边不断滴加 溶液至
溶液至 为
为 时,停止加热。
时,停止加热。
③洗涤、干燥:用去离子水洗涤生成的固体,抽滤,弃去母液,得到淡黄色固体。将其转入蒸发皿中,在水浴加热条件下烘干,称量,计算产率。
回答下列问题:
(1)用 试纸检验溶液
试纸检验溶液 的操作为
的操作为___________ 。
(2)①中观察到沉淀的颜色变为___________ 色时,证明已经成功制备晶种。
(3)②氧化过程中,发生反应的离子方程式为___________ 。
(4)抽滤装置如图,仪器c的作用为___________ ,和普通过滤相比,抽滤的优点有过滤速度更快和___________ 。 .产品纯度测定
.产品纯度测定
铁黄纯度可以通过产品的耗酸量确定。 ,
,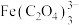 不与稀
不与稀 溶液反应。
溶液反应。
(5)铁黄溶于 标准液的离子方程式为
标准液的离子方程式为___________ 。
(6) 标准液和
标准液和 标准液浓度均为
标准液浓度均为 ,消耗两溶液的体积依次为
,消耗两溶液的体积依次为 ,计算铁黄的纯度为
,计算铁黄的纯度为___________ (列出计算式,不需化简)。
(7)若 溶液过量,会使测定结果
溶液过量,会使测定结果___________ (填“偏大”、“偏小”或“无影响”)。(已知草酸的电离平衡常数: )
)
 为淡黄色固体,简称铁黄,可作颜料。制备铁黄的关键是先制备铁黄晶种,否则只能得到稀薄的、颜色暗淡的色浆,不具备颜料性能。实验室以硫酸亚铁铵为主要原料制备铁黄的实验步骤如下:
为淡黄色固体,简称铁黄,可作颜料。制备铁黄的关键是先制备铁黄晶种,否则只能得到稀薄的、颜色暗淡的色浆,不具备颜料性能。实验室以硫酸亚铁铵为主要原料制备铁黄的实验步骤如下: .产品制备及产率计算
.产品制备及产率计算①制备晶种:称取
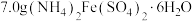 放入三颈烧瓶中,加入
放入三颈烧瓶中,加入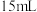 去离子水,恒温水浴加热至
去离子水,恒温水浴加热至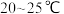 ,搅拌溶解,慢慢滴加
,搅拌溶解,慢慢滴加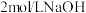 溶液,用
溶液,用 试纸检验至溶液
试纸检验至溶液 为
为 ,停止加碱,观察到出现沉淀并伴随沉淀颜色变化。
,停止加碱,观察到出现沉淀并伴随沉淀颜色变化。②氧化过程:称取足量
 ,加入上述溶液,于
,加入上述溶液,于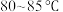 恒温水浴中进行氧化。氧化过程中,边搅拌边不断滴加
恒温水浴中进行氧化。氧化过程中,边搅拌边不断滴加 溶液至
溶液至 为
为 时,停止加热。
时,停止加热。③洗涤、干燥:用去离子水洗涤生成的固体,抽滤,弃去母液,得到淡黄色固体。将其转入蒸发皿中,在水浴加热条件下烘干,称量,计算产率。
回答下列问题:
(1)用
 试纸检验溶液
试纸检验溶液 的操作为
的操作为(2)①中观察到沉淀的颜色变为
(3)②氧化过程中,发生反应的离子方程式为
(4)抽滤装置如图,仪器c的作用为
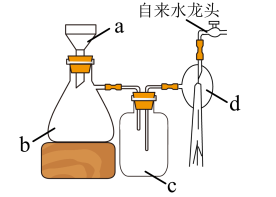
 .产品纯度测定
.产品纯度测定铁黄纯度可以通过产品的耗酸量确定。

 ,
,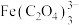 不与稀
不与稀 溶液反应。
溶液反应。(5)铁黄溶于
 标准液的离子方程式为
标准液的离子方程式为(6)
 标准液和
标准液和 标准液浓度均为
标准液浓度均为 ,消耗两溶液的体积依次为
,消耗两溶液的体积依次为 ,计算铁黄的纯度为
,计算铁黄的纯度为(7)若
 溶液过量,会使测定结果
溶液过量,会使测定结果 )
)
您最近半年使用:0次
7日内更新
|
237次组卷
|
2卷引用:2024届黑龙江省哈尔滨师范大学附属中学高三下学期三模化学试题
名校
解题方法
4 . 三氯三(四氢呋喃)合铬(Ⅲ)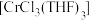 可催化烯烃加聚,制备的方法如下。
可催化烯烃加聚,制备的方法如下。
已知:①CrCl3易潮解,易升华,高温下易被氧气氧化。
②COCl2气体有毒,遇水发生水解产生两种酸性气体。
Ⅰ.制备无水CrCl3:
某化学小组用CCl4(沸点76.8℃)和1.52g Cr2O3在高温下制备无水CrCl3,同时生成COCl2气体,实验装置如图所示:___________ 。
(2)实验装置合理的连接顺序为A___________ B(填装置字母标号,装置不能重复使用)。
(3)g的作用是___________ 。
(4)尾气处理时发生反应的离子方程式___________ 。
Ⅱ.合成CrCl3(THF)3: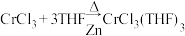
实验操作:按如图组装仪器,将步骤Ⅰ所得无水CrCl3和0.15g锌粉放入滤纸套筒内,双颈烧瓶中加入100mL无水四氢呋喃(THF),通N2 5min后关闭,接通冷却水,加热四氢呋喃至沸腾,在索氏提取器中发生反应,回流2.5h后再通入N2冷却至室温;取下双颈烧瓶,在通风橱中蒸发至有较多固体析出,冷却、抽滤、干燥后称量即得产品5.39g。___________ 。
(6)索氏提取器的提取管两侧分别是虹吸管和连接管,虹吸管是___________ (填2或3)。
(7)用电加热而不用明火加热的原因___________ 。
(8)产品产率为___________ %(结果保留小数点后一位)。
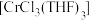 可催化烯烃加聚,制备的方法如下。
可催化烯烃加聚,制备的方法如下。已知:①CrCl3易潮解,易升华,高温下易被氧气氧化。
②COCl2气体有毒,遇水发生水解产生两种酸性气体。
Ⅰ.制备无水CrCl3:
某化学小组用CCl4(沸点76.8℃)和1.52g Cr2O3在高温下制备无水CrCl3,同时生成COCl2气体,实验装置如图所示:

(2)实验装置合理的连接顺序为A
(3)g的作用是
(4)尾气处理时发生反应的离子方程式
Ⅱ.合成CrCl3(THF)3:
①四氢呋喃( ,简写THF)为常见的有机溶剂,沸点66℃,易燃。
,简写THF)为常见的有机溶剂,沸点66℃,易燃。
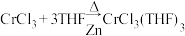
实验操作:按如图组装仪器,将步骤Ⅰ所得无水CrCl3和0.15g锌粉放入滤纸套筒内,双颈烧瓶中加入100mL无水四氢呋喃(THF),通N2 5min后关闭,接通冷却水,加热四氢呋喃至沸腾,在索氏提取器中发生反应,回流2.5h后再通入N2冷却至室温;取下双颈烧瓶,在通风橱中蒸发至有较多固体析出,冷却、抽滤、干燥后称量即得产品5.39g。
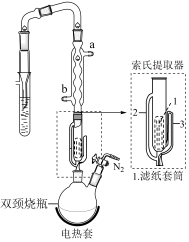
(6)索氏提取器的提取管两侧分别是虹吸管和连接管,虹吸管是
(7)用电加热而不用明火加热的原因
(8)产品产率为
您最近半年使用:0次
名校
5 . 磷酸亚铁锂(LiFePO4)电池工作电压适中、放电功率高、在高温和高热环境下的稳定性高,是新能源汽车的动力电池之一、一种利用硫酸法生产钛白粉过程的副产物硫酸亚铁(含钛、铜、锰、铅、锌、钙、镁等杂质离子)制备磷酸亚铁锂的生产流程如图:
已知:FePO4可溶于pH小于2的酸性溶液。
回答下列问题:
(1)铁在元素周期中的位置是___________ ,FePO4·2H2O中Fe元素的化合价是___________ 。
(2)操作2的名称是___________ 。
(3)TiO2是一种白色颜料,用TiCl4制备TiO2·xH2O的化学方程式是___________ 。
(4)滤液2与磷酸、双氧水生成FePO4·2H2O的离子方程式为___________ ,向滤液2中加入NaOH溶液调节溶液的pH,将溶液的pH控制在2.0的原因是___________ 。
(5)聚丙烯的作用是___________ 。
(6)LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成4个正八面体和4个正四面体,电池充电时,LiFePO4作极___________ (“阴”或“阳”),脱出部分Li+,进而转化为Li1-xFePO4,Li1-xFePO4结构示意图如(b)所示,则其中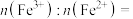
___________ 。

| 物质 | FeS | Mns | CuS | PbS | ZnS |
| Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 1.6×10-24 |
回答下列问题:
(1)铁在元素周期中的位置是
(2)操作2的名称是
(3)TiO2是一种白色颜料,用TiCl4制备TiO2·xH2O的化学方程式是
(4)滤液2与磷酸、双氧水生成FePO4·2H2O的离子方程式为
(5)聚丙烯的作用是
(6)LiFePO4的晶胞结构示意图如(a)所示。其中O围绕Fe和P分别形成4个正八面体和4个正四面体,电池充电时,LiFePO4作极
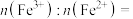

您最近半年使用:0次
名校
解题方法
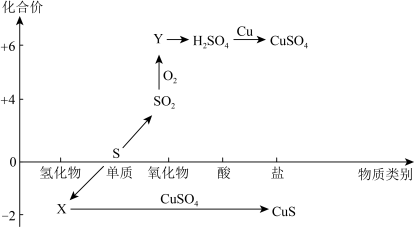
6 . 硫及其化合物的“价-类”二维图如下图所示,回答下列问题:___________ ,Y的化学式是___________ 。
(2)检验 时,取少量待测液于试管中,先加入
时,取少量待测液于试管中,先加入___________ ,无明显现象,再加入___________ 溶液,若产生白色沉淀,则溶液中含有 。
。
(3)CuS与足量浓硫酸反应也可制得SO2,该反应的化学方程式为:CuS+4H2SO4(浓) CuSO4+4SO2↑+4H2O。
CuSO4+4SO2↑+4H2O。
①请用“双线桥”法标明该反应电子转移的方向和数目___________ 。
②当有1.5NA电子发生转移时,理论上生成SO2的体积(标准状况)为___________ L。
(2)检验
 时,取少量待测液于试管中,先加入
时,取少量待测液于试管中,先加入 。
。(3)CuS与足量浓硫酸反应也可制得SO2,该反应的化学方程式为:CuS+4H2SO4(浓)
 CuSO4+4SO2↑+4H2O。
CuSO4+4SO2↑+4H2O。①请用“双线桥”法标明该反应电子转移的方向和数目
②当有1.5NA电子发生转移时,理论上生成SO2的体积(标准状况)为
您最近半年使用:0次
解题方法
7 . Ⅰ、化学实验中,通常需要使用到硫酸
(1)向Na2S2O3溶液滴加稀硫酸,产生淡黄色沉淀,写出反应的离子方程式___________ 。
(2)向硫酸酸化的KMnO4溶液中滴加草酸溶液,紫红色褪去。写出反应的离子方程式___________ 。
Ⅱ、氢气作为一种清洁能源,一直是能源研究的热点,工业上制取氢气有多种方法:
①C(s)+H2O(g)=CO(g)+H2(g) △H1=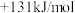
②CH4(g)+CO2(g)=2CO(g)+2H2(g) △H2=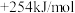
③CH4(g)+H2O(g)=CO(g)+3H2(g) △H3=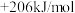
④CH3OH(1)=CO(g)+2H2(g) △H4=
(3)根据以上数据,请写出CH4(g)分解生成C(s)和H2(g)的热化学方程式___________ 。反应②需要在___________ (高温、低温)下才能自发进行
(4)几种化学键的键能如下表所示:
根据以上有关反应的△H,计算x=___________ 。
(5)我国科学家通过计算机模拟,研究了在某催化剂表面上发生反应④的反应历程(吸附在催化剂表面的物质,用"*"标注)。甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式Ⅰ: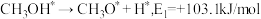
方式Ⅱ:
活化能E值推测,甲醇脱氢过程中主要历程的方式为___________ (填"Ⅰ"或"Ⅱ")。计算机模拟的各步反应的能量变化示意图如下。___________ 。
(1)向Na2S2O3溶液滴加稀硫酸,产生淡黄色沉淀,写出反应的离子方程式
(2)向硫酸酸化的KMnO4溶液中滴加草酸溶液,紫红色褪去。写出反应的离子方程式
Ⅱ、氢气作为一种清洁能源,一直是能源研究的热点,工业上制取氢气有多种方法:
①C(s)+H2O(g)=CO(g)+H2(g) △H1=
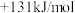
②CH4(g)+CO2(g)=2CO(g)+2H2(g) △H2=
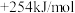
③CH4(g)+H2O(g)=CO(g)+3H2(g) △H3=
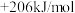
④CH3OH(1)=CO(g)+2H2(g) △H4=

(3)根据以上数据,请写出CH4(g)分解生成C(s)和H2(g)的热化学方程式
(4)几种化学键的键能如下表所示:
| 化学键 | C=O | H—H | 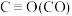 | C—H | O—H |
| 键能/kJ·mol-1 | 803 | 436 | x | 414 | 463 |
(5)我国科学家通过计算机模拟,研究了在某催化剂表面上发生反应④的反应历程(吸附在催化剂表面的物质,用"*"标注)。甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式Ⅰ:
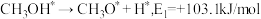
方式Ⅱ:

活化能E值推测,甲醇脱氢过程中主要历程的方式为
您最近半年使用:0次
解题方法
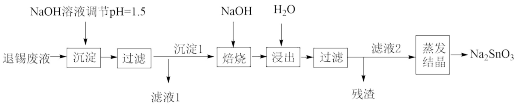
8 . 电子印制工业产生的某退锡废液含硝酸、锡化合物及少量Fe3+和Cu2+等,对其处理的流程如图。
(1)Na2SnO3的回收
①产品Na2SnO3中Sn的化合价是___________ 。
②退锡工艺是利用稀HNO3与Sn反应生成Sn2+,且无气体生成,则生成的硝酸盐是___________ ,废液中的Sn2+易转化成SnO2·xH2O。
③沉淀1的主要成分是SnO2,焙烧时,与NaOH反应的化学方程式为___________ 。
(2)滤液1的处理
①滤液1中Fe3+和Cu2+的浓度相近,加入NaOH溶液,先得到的沉淀是___________ 。
②25℃时,为了使Cu2+沉淀完全,需调节溶液H+浓度不大于___________ mol•L-1.
(3)产品中锡含量的测定
称取产品1.500g,用大量盐酸溶解,在CO2保护下,先用Al片将Sn4+还原为Sn2+,再用0.1000mol•L-1KIO3标准溶液滴定,以淀粉作指示剂滴定过程中IO 被还原为I—,终点时消耗KIO3溶液20.00mL。
被还原为I—,终点时消耗KIO3溶液20.00mL。
终点时的现象为___________ ,产生I2的离子反应方程式为___________ 。
| 化学式 | Sn(OH)4(或SnO2·2H2O) | Fe(OH)3 | Cu(OH)2 |
| 溶度积 | 1.0×10-56 | 4×10-38 | 2.5×10-20 |
①产品Na2SnO3中Sn的化合价是
②退锡工艺是利用稀HNO3与Sn反应生成Sn2+,且无气体生成,则生成的硝酸盐是
③沉淀1的主要成分是SnO2,焙烧时,与NaOH反应的化学方程式为
(2)滤液1的处理
①滤液1中Fe3+和Cu2+的浓度相近,加入NaOH溶液,先得到的沉淀是
②25℃时,为了使Cu2+沉淀完全,需调节溶液H+浓度不大于
(3)产品中锡含量的测定
称取产品1.500g,用大量盐酸溶解,在CO2保护下,先用Al片将Sn4+还原为Sn2+,再用0.1000mol•L-1KIO3标准溶液滴定,以淀粉作指示剂滴定过程中IO
 被还原为I—,终点时消耗KIO3溶液20.00mL。
被还原为I—,终点时消耗KIO3溶液20.00mL。终点时的现象为
您最近半年使用:0次
名校
9 .  是生产多晶硅的副产物。利用
是生产多晶硅的副产物。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料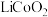 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下: 是粉红色固体,难溶于水。
是粉红色固体,难溶于水。
(1)Si在元素周期表的位置是___________ 。 的电子式为
的电子式为___________ 。
(2)烧渣是LiCl、 和
和 的混合物,“500℃焙烧”的化学方程式为
的混合物,“500℃焙烧”的化学方程式为___________ 。
(3)鉴别洗净的“滤饼3”和 中阳离子的常用方法是
中阳离子的常用方法是___________ 。
(4)实验室过滤操作时使用的玻璃仪器除玻璃棒还有___________ 。
(5)实验室检验 是否沉淀完全的操作是
是否沉淀完全的操作是___________ 。
(6)“850℃煅烧”时的化学方程式为___________ 。
 是生产多晶硅的副产物。利用
是生产多晶硅的副产物。利用 对废弃的锂电池正极材料
对废弃的锂电池正极材料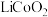 进行氯化处理以回收Li、Co等金属,工艺路线如下:
进行氯化处理以回收Li、Co等金属,工艺路线如下:
 是粉红色固体,难溶于水。
是粉红色固体,难溶于水。(1)Si在元素周期表的位置是
 的电子式为
的电子式为(2)烧渣是LiCl、
 和
和 的混合物,“500℃焙烧”的化学方程式为
的混合物,“500℃焙烧”的化学方程式为(3)鉴别洗净的“滤饼3”和
 中阳离子的常用方法是
中阳离子的常用方法是(4)实验室过滤操作时使用的玻璃仪器除玻璃棒还有
(5)实验室检验
 是否沉淀完全的操作是
是否沉淀完全的操作是(6)“850℃煅烧”时的化学方程式为
您最近半年使用:0次
名校
解题方法
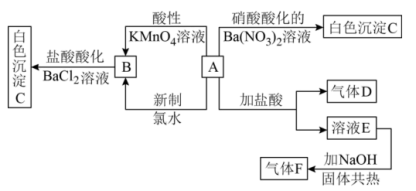
10 . 一种白色晶体A极易溶于水,将A配成溶液进行如下框图所示的实验,实验现象及转化关系如下列框图所示。其中A为正盐,气体D能使品红溶液褪色,气体F能使湿润的红色石蕊试纸变蓝。
(1)写出下列物质化学式:A___________ ;C___________ ;
(2)写出F的电子式:___________ ;
(3)写出溶液E与 共热反应的离子方程式:
共热反应的离子方程式:___________ ;
(4)写出A和新制氯水反应的离子方程式:___________ 。
(1)写出下列物质化学式:A
(2)写出F的电子式:
(3)写出溶液E与
 共热反应的离子方程式:
共热反应的离子方程式:(4)写出A和新制氯水反应的离子方程式:
您最近半年使用:0次



