解题方法
1 . Ⅰ、化学实验中,通常需要使用到硫酸
(1)向Na2S2O3溶液滴加稀硫酸,产生淡黄色沉淀,写出反应的离子方程式___________ 。
(2)向硫酸酸化的KMnO4溶液中滴加草酸溶液,紫红色褪去。写出反应的离子方程式___________ 。
Ⅱ、氢气作为一种清洁能源,一直是能源研究的热点,工业上制取氢气有多种方法:
①C(s)+H2O(g)=CO(g)+H2(g) △H1=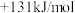
②CH4(g)+CO2(g)=2CO(g)+2H2(g) △H2=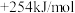
③CH4(g)+H2O(g)=CO(g)+3H2(g) △H3=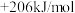
④CH3OH(1)=CO(g)+2H2(g) △H4=
(3)根据以上数据,请写出CH4(g)分解生成C(s)和H2(g)的热化学方程式___________ 。反应②需要在___________ (高温、低温)下才能自发进行
(4)几种化学键的键能如下表所示:
根据以上有关反应的△H,计算x=___________ 。
(5)我国科学家通过计算机模拟,研究了在某催化剂表面上发生反应④的反应历程(吸附在催化剂表面的物质,用"*"标注)。甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式Ⅰ: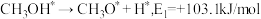
方式Ⅱ:
活化能E值推测,甲醇脱氢过程中主要历程的方式为___________ (填"Ⅰ"或"Ⅱ")。计算机模拟的各步反应的能量变化示意图如下。___________ 。
(1)向Na2S2O3溶液滴加稀硫酸,产生淡黄色沉淀,写出反应的离子方程式
(2)向硫酸酸化的KMnO4溶液中滴加草酸溶液,紫红色褪去。写出反应的离子方程式
Ⅱ、氢气作为一种清洁能源,一直是能源研究的热点,工业上制取氢气有多种方法:
①C(s)+H2O(g)=CO(g)+H2(g) △H1=
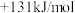
②CH4(g)+CO2(g)=2CO(g)+2H2(g) △H2=
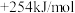
③CH4(g)+H2O(g)=CO(g)+3H2(g) △H3=
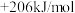
④CH3OH(1)=CO(g)+2H2(g) △H4=

(3)根据以上数据,请写出CH4(g)分解生成C(s)和H2(g)的热化学方程式
(4)几种化学键的键能如下表所示:
| 化学键 | C=O | H—H | 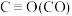 | C—H | O—H |
| 键能/kJ·mol-1 | 803 | 436 | x | 414 | 463 |
(5)我国科学家通过计算机模拟,研究了在某催化剂表面上发生反应④的反应历程(吸附在催化剂表面的物质,用"*"标注)。甲醇(CH3OH)脱氢反应的第一步历程,有两种可能方式:
方式Ⅰ:
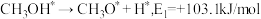
方式Ⅱ:

活化能E值推测,甲醇脱氢过程中主要历程的方式为
您最近一年使用:0次
解题方法
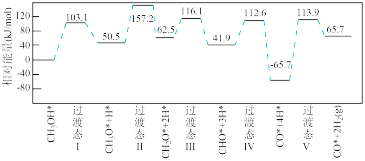
2 . 电子印制工业产生的某退锡废液含硝酸、锡化合物及少量Fe3+和Cu2+等,对其处理的流程如图。
(1)Na2SnO3的回收
①产品Na2SnO3中Sn的化合价是___________ 。
②退锡工艺是利用稀HNO3与Sn反应生成Sn2+,且无气体生成,则生成的硝酸盐是___________ ,废液中的Sn2+易转化成SnO2·xH2O。
③沉淀1的主要成分是SnO2,焙烧时,与NaOH反应的化学方程式为___________ 。
(2)滤液1的处理
①滤液1中Fe3+和Cu2+的浓度相近,加入NaOH溶液,先得到的沉淀是___________ 。
②25℃时,为了使Cu2+沉淀完全,需调节溶液H+浓度不大于___________ mol•L-1.
(3)产品中锡含量的测定
称取产品1.500g,用大量盐酸溶解,在CO2保护下,先用Al片将Sn4+还原为Sn2+,再用0.1000mol•L-1KIO3标准溶液滴定,以淀粉作指示剂滴定过程中IO 被还原为I—,终点时消耗KIO3溶液20.00mL。
被还原为I—,终点时消耗KIO3溶液20.00mL。
终点时的现象为___________ ,产生I2的离子反应方程式为___________ 。
| 化学式 | Sn(OH)4(或SnO2·2H2O) | Fe(OH)3 | Cu(OH)2 |
| 溶度积 | 1.0×10-56 | 4×10-38 | 2.5×10-20 |
①产品Na2SnO3中Sn的化合价是
②退锡工艺是利用稀HNO3与Sn反应生成Sn2+,且无气体生成,则生成的硝酸盐是
③沉淀1的主要成分是SnO2,焙烧时,与NaOH反应的化学方程式为
(2)滤液1的处理
①滤液1中Fe3+和Cu2+的浓度相近,加入NaOH溶液,先得到的沉淀是
②25℃时,为了使Cu2+沉淀完全,需调节溶液H+浓度不大于
(3)产品中锡含量的测定
称取产品1.500g,用大量盐酸溶解,在CO2保护下,先用Al片将Sn4+还原为Sn2+,再用0.1000mol•L-1KIO3标准溶液滴定,以淀粉作指示剂滴定过程中IO
 被还原为I—,终点时消耗KIO3溶液20.00mL。
被还原为I—,终点时消耗KIO3溶液20.00mL。终点时的现象为
您最近一年使用:0次
名校
解题方法
3 . 如下图所示装置可用来制取和观察  在空气中被氧化时颜色的变化。实验时必须使用铁屑和
在空气中被氧化时颜色的变化。实验时必须使用铁屑和  的硫酸,其他试剂任选。
的硫酸,其他试剂任选。
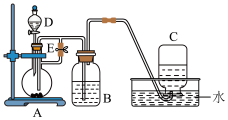
填写下列空白:
(1) 中盛一定量的
中盛一定量的  溶液,
溶液, 中应预先加入的试剂是
中应预先加入的试剂是_________________ , 中反应的离子方程式是
中反应的离子方程式是_____________________________________________________________________ 。
(2)实验开始时先将止水夹
_____________ (填“打开”或“关闭”),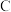 中收集到气体的主要成分
中收集到气体的主要成分_________________ 。
(3)简述生成 的操作过程:
的操作过程:_____________________________________________________ 。
(4)拔去装置 中的橡皮塞,使空气进入,写出有关反应的化学方程式:
中的橡皮塞,使空气进入,写出有关反应的化学方程式:_________________________________________________________ 。
(5)若直接向 溶液中加入
溶液中加入 溶液,现象:
溶液,现象:_____________ ;
 在空气中被氧化时颜色的变化。实验时必须使用铁屑和
在空气中被氧化时颜色的变化。实验时必须使用铁屑和  的硫酸,其他试剂任选。
的硫酸,其他试剂任选。
填写下列空白:
(1)
 中盛一定量的
中盛一定量的  溶液,
溶液, 中应预先加入的试剂是
中应预先加入的试剂是 中反应的离子方程式是
中反应的离子方程式是(2)实验开始时先将止水夹

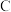 中收集到气体的主要成分
中收集到气体的主要成分(3)简述生成
 的操作过程:
的操作过程:(4)拔去装置
 中的橡皮塞,使空气进入,写出有关反应的化学方程式:
中的橡皮塞,使空气进入,写出有关反应的化学方程式:(5)若直接向
 溶液中加入
溶液中加入 溶液,现象:
溶液,现象:
您最近一年使用:0次
名校
解题方法
4 . 高纯活性氧化锌可用于光催化、光电极、彩色显影等领域。以工业级氧化锌(含 等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:
等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下: 。
。
回答下列问题:
(1)浸出时,为了提高浸出效率可采取的措施有(写两种):___________ 。
(2)氧化时,加入 溶液是为了将浸出液中的
溶液是为了将浸出液中的 和
和 均转化为沉淀而除去,(溶液中
均转化为沉淀而除去,(溶液中 元素全部转化为
元素全部转化为 ),请分别写出
),请分别写出 除去
除去 和
和 的离子方程式
的离子方程式___________ ,___________ 。
(3)加入锌粉的目的是___________ 。
(4)已知 浸出液中,
浸出液中, 、
、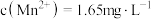 。
。
①若要除尽 上述浸出液中的
上述浸出液中的 和
和 ,需加入
,需加入___________ 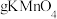 。
。
②加入 溶液反应一段时间后,溶液中
溶液反应一段时间后,溶液中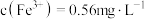 ,若溶液
,若溶液 ,则此时
,则此时
___________ (填“能”或“不能”)生成沉淀。
 等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:
等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下: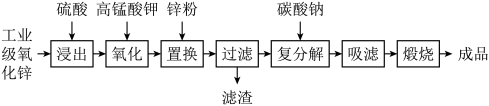
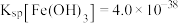 。
。回答下列问题:
(1)浸出时,为了提高浸出效率可采取的措施有(写两种):
(2)氧化时,加入
 溶液是为了将浸出液中的
溶液是为了将浸出液中的 和
和 均转化为沉淀而除去,(溶液中
均转化为沉淀而除去,(溶液中 元素全部转化为
元素全部转化为 ),请分别写出
),请分别写出 除去
除去 和
和 的离子方程式
的离子方程式(3)加入锌粉的目的是
(4)已知
 浸出液中,
浸出液中, 、
、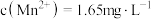 。
。①若要除尽
 上述浸出液中的
上述浸出液中的 和
和 ,需加入
,需加入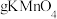 。
。②加入
 溶液反应一段时间后,溶液中
溶液反应一段时间后,溶液中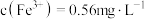 ,若溶液
,若溶液 ,则此时
,则此时
您最近一年使用:0次
2024-02-20更新
|
215次组卷
|
3卷引用:黑龙江省哈尔滨市第三中学校2020-2021学年高三上学期期末考试理科综合试卷-高中化学
黑龙江省哈尔滨市第三中学校2020-2021学年高三上学期期末考试理科综合试卷-高中化学(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)江西省南昌十九中2023-2024学年高三下学期第一次模拟考试化学试卷
名校
5 . 碳酸锰( )俗称“锰白”,在工业上广泛用作脱硫催化剂,瓷釉颜料。实验室以
)俗称“锰白”,在工业上广泛用作脱硫催化剂,瓷釉颜料。实验室以 为原料制备少量
为原料制备少量 并研究其性质,由
并研究其性质,由 制备
制备 的实验流程:
的实验流程: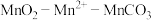
已知: 难溶于水、乙醇,潮湿的
难溶于水、乙醇,潮湿的 易被空气氧化。
易被空气氧化。
请回答下列问题:
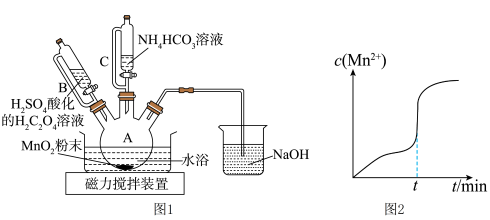
(1)仪器A的名称为________ 。
(2)在烧瓶中加入一定量的 固体,滴加硫酸酸化的
固体,滴加硫酸酸化的 溶液,其反应的离子方程式
溶液,其反应的离子方程式________ ,反应过程中 随时间的变化曲线如图2所示,则tmin时,
随时间的变化曲线如图2所示,则tmin时, 迅速增大的原因是
迅速增大的原因是________ 。
(3)反应一段时间后,当装置A中的黑色固体消失时,再滴加较浓的 溶液充分反应生成
溶液充分反应生成 。生成
。生成 的化学方程式为
的化学方程式为________ 。
(4)实验结束后,将装置A中的混合物过滤,用________ 洗涤滤渣,再低温烘干,即得到干燥的 固体。
固体。
(5)已知 既具有氧化性也具有还原性,某同学用
既具有氧化性也具有还原性,某同学用 (一般用30%)溶液代替草酸,请问是否可行?原因是:
(一般用30%)溶液代替草酸,请问是否可行?原因是:________ 。
(6)EDTA与锰络合形成1:1的螫合物。称取mg样品,加入适量水,滴加盐酸溶液使样品溶解,加水定容至100ml。量取VmL,cmol/LEDTA标准溶液于锥形瓶中,加入3-4滴铬黑T指示剂以及10ml氨-氯化铵缓冲溶液,使体系的pH呈9-10。在酸式滴定管中加入50ml样品溶液,开始滴定,滴定终点为溶液由纯蓝色转变为紫红色,记录消耗的样品溶液体积19ml,计算出样品中锰的含量________ (写出表达式)
 )俗称“锰白”,在工业上广泛用作脱硫催化剂,瓷釉颜料。实验室以
)俗称“锰白”,在工业上广泛用作脱硫催化剂,瓷釉颜料。实验室以 为原料制备少量
为原料制备少量 并研究其性质,由
并研究其性质,由 制备
制备 的实验流程:
的实验流程:
已知:
 难溶于水、乙醇,潮湿的
难溶于水、乙醇,潮湿的 易被空气氧化。
易被空气氧化。请回答下列问题:

(1)仪器A的名称为
(2)在烧瓶中加入一定量的
 固体,滴加硫酸酸化的
固体,滴加硫酸酸化的 溶液,其反应的离子方程式
溶液,其反应的离子方程式 随时间的变化曲线如图2所示,则tmin时,
随时间的变化曲线如图2所示,则tmin时, 迅速增大的原因是
迅速增大的原因是(3)反应一段时间后,当装置A中的黑色固体消失时,再滴加较浓的
 溶液充分反应生成
溶液充分反应生成 。生成
。生成 的化学方程式为
的化学方程式为(4)实验结束后,将装置A中的混合物过滤,用
 固体。
固体。(5)已知
 既具有氧化性也具有还原性,某同学用
既具有氧化性也具有还原性,某同学用 (一般用30%)溶液代替草酸,请问是否可行?原因是:
(一般用30%)溶液代替草酸,请问是否可行?原因是:(6)EDTA与锰络合形成1:1的螫合物。称取mg样品,加入适量水,滴加盐酸溶液使样品溶解,加水定容至100ml。量取VmL,cmol/LEDTA标准溶液于锥形瓶中,加入3-4滴铬黑T指示剂以及10ml氨-氯化铵缓冲溶液,使体系的pH呈9-10。在酸式滴定管中加入50ml样品溶液,开始滴定,滴定终点为溶液由纯蓝色转变为紫红色,记录消耗的样品溶液体积19ml,计算出样品中锰的含量
您最近一年使用:0次
名校
解题方法
6 . 高铁酸钾( )是一种新型高效的水处理剂,在碱性溶液中较稳定。工业上有干法与湿法两种制备高铁酸钾的方法。
)是一种新型高效的水处理剂,在碱性溶液中较稳定。工业上有干法与湿法两种制备高铁酸钾的方法。
(1)高铁酸钾( )具有
)具有___________ 性,可以用于杀菌消毒,其在消毒后可形成 胶体,常用于处理饮用水。
胶体,常用于处理饮用水。
(2)干法制备高铁酸钾( )时先制备高铁酸钠(
)时先制备高铁酸钠( ),制备过程中发生的反应为
),制备过程中发生的反应为 ,该反应中氧化剂是
,该反应中氧化剂是___________ (填化学式)。每生成 转移电子的物质的量为
转移电子的物质的量为___________ mol。
(3)湿法制备高铁酸钾的流程如下图
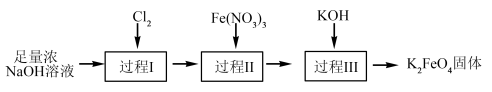
①过程Ⅱ为碱性条件下制备高铁酸钠( )。补全过程Ⅱ中发生反应的离子方程式,并用单线桥表示电子转移的情况:
)。补全过程Ⅱ中发生反应的离子方程式,并用单线桥表示电子转移的情况:___________ 。
______ ______
______ ______=______
______=______ ______
______ ______
______
②过程Ⅲ的反应能够发生的原因是___________ 。
③湿法制备 时,不同的温度下,不同质量浓度的
时,不同的温度下,不同质量浓度的 对
对 生成率有不同影响,由图可知工业生产中最佳条件(温度和
生成率有不同影响,由图可知工业生产中最佳条件(温度和 的质量浓度)为
的质量浓度)为___________ (填选项符号)。
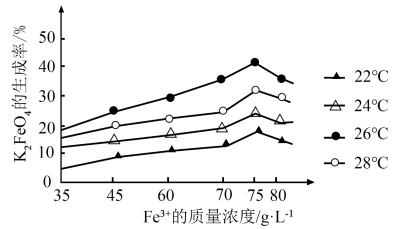
a.24℃,75g∙L-1 b.26℃,75g∙L-1 c.28℃,75g∙L-1 d.22℃,80g∙L-1
 )是一种新型高效的水处理剂,在碱性溶液中较稳定。工业上有干法与湿法两种制备高铁酸钾的方法。
)是一种新型高效的水处理剂,在碱性溶液中较稳定。工业上有干法与湿法两种制备高铁酸钾的方法。(1)高铁酸钾(
 )具有
)具有 胶体,常用于处理饮用水。
胶体,常用于处理饮用水。(2)干法制备高铁酸钾(
 )时先制备高铁酸钠(
)时先制备高铁酸钠( ),制备过程中发生的反应为
),制备过程中发生的反应为 ,该反应中氧化剂是
,该反应中氧化剂是 转移电子的物质的量为
转移电子的物质的量为(3)湿法制备高铁酸钾的流程如下图

①过程Ⅱ为碱性条件下制备高铁酸钠(
 )。补全过程Ⅱ中发生反应的离子方程式,并用单线桥表示电子转移的情况:
)。补全过程Ⅱ中发生反应的离子方程式,并用单线桥表示电子转移的情况:______
 ______
______ ______=______
______=______ ______
______ ______
______②过程Ⅲ的反应能够发生的原因是
③湿法制备
 时,不同的温度下,不同质量浓度的
时,不同的温度下,不同质量浓度的 对
对 生成率有不同影响,由图可知工业生产中最佳条件(温度和
生成率有不同影响,由图可知工业生产中最佳条件(温度和 的质量浓度)为
的质量浓度)为
a.24℃,75g∙L-1 b.26℃,75g∙L-1 c.28℃,75g∙L-1 d.22℃,80g∙L-1
您最近一年使用:0次
2024-01-21更新
|
230次组卷
|
2卷引用:黑龙江省大庆实验中学实验一部2023-2024学年高一上学期期末考试化学试题
名校
解题方法
7 . 白合金是铜钴矿冶炼过程的中间产物,一种从白合金(主要含Fe3O4、CoO、CuS、Cu2S及少量SiO2)中分离回收金属的流程如图:

(1)“酸浸1”中,可以加快化学反应速率的措施有___________ (任写其中一种),滤液1中含有金属阳离子___________ (写离子符号)和阴离子SO 。
。
(2)“焙烧1”中,晶体[Fe2(SO4)3·xH2O和CoSO4·yH2O]总质量随温度升高的变化情况如表:
①温度区间小于227℃,晶体总质量变小的原因是___________ ;
②“焙烧1”的温度应控制为600℃~630℃,焙烧的目的是___________ 。
(3)25℃时,Ksp(CuS)=6.3×10-36,H2S的Ka1=1.1×10-7,Ka2=1.3×10-13。反应CuS(s)+2H+(aq)=Cu2+(aq)+H2S(aq)的平衡常数K=___________ (列出计算式即可)。
(4)“焙烧2“中Cu2S发生反应的化学方程式为___________ ;“滤渣2”是___________ (填化学式)。

(1)“酸浸1”中,可以加快化学反应速率的措施有
 。
。(2)“焙烧1”中,晶体[Fe2(SO4)3·xH2O和CoSO4·yH2O]总质量随温度升高的变化情况如表:
| 温度区间℃ | <227 | 227~566 | 566~600 | 600~630 |
| 晶体总质量 | 变小 | 不变 | 变小 | 不变 |
②“焙烧1”的温度应控制为600℃~630℃,焙烧的目的是
(3)25℃时,Ksp(CuS)=6.3×10-36,H2S的Ka1=1.1×10-7,Ka2=1.3×10-13。反应CuS(s)+2H+(aq)=Cu2+(aq)+H2S(aq)的平衡常数K=
(4)“焙烧2“中Cu2S发生反应的化学方程式为
您最近一年使用:0次
名校
解题方法
8 . 化学在日常防疫中发挥了重要作用,各类杀菌消毒剂逐渐被人们所认识和使用。下列是我们常见的几种消毒剂:①“84”消毒液;②H2O2 (在水溶液中可部分电离);③ClO2;④O3;⑤碘酒;⑥75%酒精;⑦过氧乙酸(CH3COOOH);⑧高铁酸钠(Na2FeO4)。回答下列问题:
(1)上述杀菌消毒剂属于非电解质的是___________ (填序号)。
(2)各类杀菌消毒剂使用时,必须严格按照使用说明。某游泳场馆由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与H2O2反应产生O2促进藻类快速生长。当有0.1 mol O2生成时,反应中转移电子数目为___________ 。
(3)亚氯酸钠(NaClO2)是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出ClO2,ClO2有类似Cl2的性质。某兴趣小组探究亚氯酸钠的制备与性质。
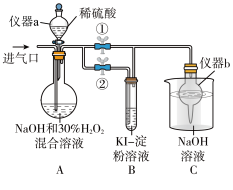
I.制备亚氯酸钠。操作步骤:
①关闭止水夹②,打开止水夹①,从进气口通入足量ClO2,充分反应。
②装置A中生成 NaClO2的化学方程式为___________ 。
③若从装置A反应后的溶液中获得NaClO2晶体,则主要操作有:___________ 、___________ 、过滤、洗涤、干燥等。
Ⅱ.探究亚氯酸钠的性质
停止通ClO2气体,再通入空气一段时间后,关闭止水夹①,打开止水夹②,向A中滴入稀硫酸。
①开始时A中反应缓慢,稍后产生气体的速率急剧加快,请解释可能的原因___________ 。
②B中现象为___________ 。产生该现象的离子方程式为___________ 。
(1)上述杀菌消毒剂属于非电解质的是
(2)各类杀菌消毒剂使用时,必须严格按照使用说明。某游泳场馆由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO与H2O2反应产生O2促进藻类快速生长。当有0.1 mol O2生成时,反应中转移电子数目为
(3)亚氯酸钠(NaClO2)是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出ClO2,ClO2有类似Cl2的性质。某兴趣小组探究亚氯酸钠的制备与性质。

I.制备亚氯酸钠。操作步骤:
①关闭止水夹②,打开止水夹①,从进气口通入足量ClO2,充分反应。
②装置A中生成 NaClO2的化学方程式为
③若从装置A反应后的溶液中获得NaClO2晶体,则主要操作有:
Ⅱ.探究亚氯酸钠的性质
停止通ClO2气体,再通入空气一段时间后,关闭止水夹①,打开止水夹②,向A中滴入稀硫酸。
①开始时A中反应缓慢,稍后产生气体的速率急剧加快,请解释可能的原因
②B中现象为
您最近一年使用:0次
名校
9 . 硫代硫酸钠晶体(Na2S2O3·5H2O,M=248g·mol-1),已知它易溶于水,难溶于乙醇,在40~50℃熔化,48℃分解。某兴趣小组用两种方法制取硫代硫酸钠晶体并加以应用。
Ⅰ.制备Na2S2O3·5H2O
方法一:亚硫酸钠法。
反应原理:S+Na2SO3=Na2S2O3
实验步骤:称取一定量的Na2SO3于烧杯中,溶于煮沸过的蒸馏水。另取过量的硫粉,加入少量乙醇充分搅拌均匀后,微沸,反应后趁热过滤。滤液蒸发浓缩、冷却结晶后析出Na2S2O3·5H2O晶体。再进行减压过滤、洗涤并低温干燥。
(1)向硫粉中加入少量乙醇充分搅拌均匀的目的是___________ 。
(2)下列说法不正确的是 ___________。
方法二:硫化碱法,装置如图。

(3)盛放70%硫酸的仪器名称___________ 。
(4)装置C中,通入SO2后Na2S和Na2CO3将以2:1的物质的量之比发生反应制得Na2S2O3和CO2反应的化学方程式为___________ 。
Ⅱ.Na2S2O3的应用
(5)Na2S2O3解毒氰化物原理:S2O +CN-→SCN-+SO
+CN-→SCN-+SO 。为检验该转化生成了SCN-,取反应后的少量溶液,先加入足量的盐酸,再加入的试剂是
。为检验该转化生成了SCN-,取反应后的少量溶液,先加入足量的盐酸,再加入的试剂是 ___________ 。
(6)设计以下实验测定粗产品中Na2S2O3·5H2O的含量:
步骤1:准确称取8.00g样品,溶于水,加入5mL甲醛,配成100ml的溶液。
步骤2:准确称取0.294g(0.001mol) K2Cr2O7于碘量瓶中,加入20mL蒸馏水溶解,再加入5mL1mol·L-1 H2SO4和20mL 10%KI溶液使铬元素完全转化为Cr3+,加水稀释至100mL。
步骤3:向碘量瓶中加入1mL 1%淀粉,用待测Na2S2O3溶液滴定碘量瓶中溶液至滴定终点,消耗Na2S2O3溶液20.00mL。(已知:I2+2S2O =2I-+S4O
=2I-+S4O )。
)。
①出“步骤2”中反应的离子方程式___________ 。
②试计算Na2S2O3·5H2O的纯度___________ 。
Ⅰ.制备Na2S2O3·5H2O
方法一:亚硫酸钠法。
反应原理:S+Na2SO3=Na2S2O3
实验步骤:称取一定量的Na2SO3于烧杯中,溶于煮沸过的蒸馏水。另取过量的硫粉,加入少量乙醇充分搅拌均匀后,微沸,反应后趁热过滤。滤液蒸发浓缩、冷却结晶后析出Na2S2O3·5H2O晶体。再进行减压过滤、洗涤并低温干燥。
(1)向硫粉中加入少量乙醇充分搅拌均匀的目的是
(2)下列说法不正确的是 ___________。
| A.蒸发浓缩至溶液表面出现大量沉淀时,停止加热 |
| B.快速冷却,可析出较大晶体颗粒 |
| C.冷却结晶后的固液混合物中加入乙醇可提高产率 |
| D.反应后趁热过滤是除去硫等不溶物 |
方法二:硫化碱法,装置如图。

(3)盛放70%硫酸的仪器名称
(4)装置C中,通入SO2后Na2S和Na2CO3将以2:1的物质的量之比发生反应制得Na2S2O3和CO2反应的化学方程式为
Ⅱ.Na2S2O3的应用
(5)Na2S2O3解毒氰化物原理:S2O
 +CN-→SCN-+SO
+CN-→SCN-+SO 。为检验该转化生成了SCN-,取反应后的少量溶液,先加入足量的盐酸,再加入的试剂是
。为检验该转化生成了SCN-,取反应后的少量溶液,先加入足量的盐酸,再加入的试剂是 (6)设计以下实验测定粗产品中Na2S2O3·5H2O的含量:
步骤1:准确称取8.00g样品,溶于水,加入5mL甲醛,配成100ml的溶液。
步骤2:准确称取0.294g(0.001mol) K2Cr2O7于碘量瓶中,加入20mL蒸馏水溶解,再加入5mL1mol·L-1 H2SO4和20mL 10%KI溶液使铬元素完全转化为Cr3+,加水稀释至100mL。
步骤3:向碘量瓶中加入1mL 1%淀粉,用待测Na2S2O3溶液滴定碘量瓶中溶液至滴定终点,消耗Na2S2O3溶液20.00mL。(已知:I2+2S2O
 =2I-+S4O
=2I-+S4O )。
)。①出“步骤2”中反应的离子方程式
②试计算Na2S2O3·5H2O的纯度
您最近一年使用:0次
2024-01-18更新
|
267次组卷
|
3卷引用:黑龙江省牡丹江市第一中学2023-2024学年高三上学期 期末化学试卷
黑龙江省牡丹江市第一中学2023-2024学年高三上学期 期末化学试卷新疆乌鲁木齐市第101中学2023-2024学年高二上学期1月期末化学试题(已下线)专题09 化学实验综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
名校
解题方法
10 . MgF2是一种重要的无机化工原料,可用于制备多晶材料、光学玻璃。现有如下两种途径可以制得。
途径Ⅰ:以工业级MgSO4溶液(含Fe3+和Mn2+等杂质)为原料制备MgF2,过程如下:

(1)除杂
①向硫酸镁溶液中加入Na2SO4,加热、保持溶液温度在80~95℃,将Fe3+转化为Na2Fe6(SO4)4(OH)12沉淀,反应后滤液的pH___________ (填“增大”、“不变”或“减小”);
②调节滤液的pH,使溶液呈弱碱性,向其中加入H2O2,将Mn2+转化为MnO2沉淀,写出该反应的离子方程式___________ 。
③Mn+(Fe3+、Mn2+、Mg2+)转变为氢氧化物沉淀的pH如图。除杂时未采取将Mn2+直接转化为Mn(OH)2的原因是___________ 。
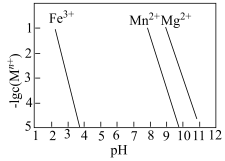
(2)沉镁
向“除杂”后滤液中加入Na2CO3,同时产生气体,写出生成Mg2(OH)2CO3的化学方程式___________ 。
(3)酸溶
将所得Mg2(OH)2CO3置于___________ (填“玻璃”、“聚丙烯”或“石英”)烧杯中,加入适量的HF,搅拌溶解。
途径Ⅰ:以工业级MgSO4溶液(含Fe3+和Mn2+等杂质)为原料制备MgF2,过程如下:

(1)除杂
①向硫酸镁溶液中加入Na2SO4,加热、保持溶液温度在80~95℃,将Fe3+转化为Na2Fe6(SO4)4(OH)12沉淀,反应后滤液的pH
②调节滤液的pH,使溶液呈弱碱性,向其中加入H2O2,将Mn2+转化为MnO2沉淀,写出该反应的离子方程式
③Mn+(Fe3+、Mn2+、Mg2+)转变为氢氧化物沉淀的pH如图。除杂时未采取将Mn2+直接转化为Mn(OH)2的原因是

(2)沉镁
向“除杂”后滤液中加入Na2CO3,同时产生气体,写出生成Mg2(OH)2CO3的化学方程式
(3)酸溶
将所得Mg2(OH)2CO3置于
您最近一年使用:0次
2024-01-10更新
|
71次组卷
|
2卷引用:黑龙江省齐齐哈尔市讷河市第二中学2023-2024学年高二上学期期末考试化学试题



