解题方法
1 . Co、La元素及其化合物在工业及生活方面有重要应用。回答下列问题:
(1)基态Co的价电子排布图_______ ,核外电子的空间运动状态有_______ 种。
(2)一定条件下, 、
、 、
、 和
和 反应可制得
反应可制得 ,反应的方程式为
,反应的方程式为_______ , 的配位数为
的配位数为_______ 。区别 和
和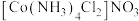 两种溶液的试剂是
两种溶液的试剂是_______ 。
(3) 的八配位金属羰基化合物
的八配位金属羰基化合物 的结构如图所示,
的结构如图所示, 作配体,配位原子为C,而不是O,其原因是
作配体,配位原子为C,而不是O,其原因是_______ ,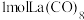 含
含_______  键。
键。 在储氢和超导等领域具有重要应用。高压下,
在储氢和超导等领域具有重要应用。高压下, 中的每个
中的每个 结合4个
结合4个 形成类似
形成类似 的结构独立存在,即得到晶体
的结构独立存在,即得到晶体 。则
。则
_______ 。晶体 的密度为
的密度为_______  。(写出计算式即可)
。(写出计算式即可)
(1)基态Co的价电子排布图
(2)一定条件下,
 、
、 、
、 和
和 反应可制得
反应可制得 ,反应的方程式为
,反应的方程式为 的配位数为
的配位数为 和
和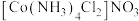 两种溶液的试剂是
两种溶液的试剂是(3)
 的八配位金属羰基化合物
的八配位金属羰基化合物 的结构如图所示,
的结构如图所示, 作配体,配位原子为C,而不是O,其原因是
作配体,配位原子为C,而不是O,其原因是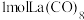 含
含 键。
键。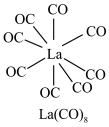
 在储氢和超导等领域具有重要应用。高压下,
在储氢和超导等领域具有重要应用。高压下, 中的每个
中的每个 结合4个
结合4个 形成类似
形成类似 的结构独立存在,即得到晶体
的结构独立存在,即得到晶体 。则
。则
 的密度为
的密度为 。(写出计算式即可)
。(写出计算式即可)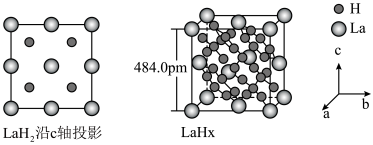
您最近一年使用:0次
2 . 采用选择性催化还原技术(SCR)可以有效脱除烟气中的氮氧化物( )。
)。
(1)钒基催化剂(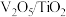 催化剂)可用于
催化剂)可用于 ,反应机理与催化剂表面
,反应机理与催化剂表面 的活性吸附位点有关。基于Lewis酸位点的SCR催化反应循环机理如图甲所示:
的活性吸附位点有关。基于Lewis酸位点的SCR催化反应循环机理如图甲所示: 的总反应化学方程式为
的总反应化学方程式为___________ ,该反应的中间体有___________ 种。
②若烟气中含有硫的氧化物,则会降低 的速率,可能的原因是
的速率,可能的原因是___________ 。
(2)研究发现:当烟气中 和
和 的物质的量相同时,会发生快速SCR反应过程:
的物质的量相同时,会发生快速SCR反应过程: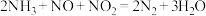 。臭氧对
。臭氧对 具有一定的辅助作用。臭氧先氧化
具有一定的辅助作用。臭氧先氧化 ,发生反应:
,发生反应: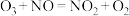 。在不同温度下,经过相同时间后测得
。在不同温度下,经过相同时间后测得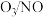 的物质的量之比与
的物质的量之比与 的脱除率关系如图乙所示。
的脱除率关系如图乙所示。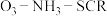 中
中 脱除率均有不同程度的降低,其原因是
脱除率均有不同程度的降低,其原因是___________ (写两条)。
②温度低于250℃,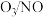 物质的量之比为0.5时,
物质的量之比为0.5时, 脱除率较高的原因是
脱除率较高的原因是___________ 。
③实验发现,向烟气中先通入 ,
, 脱除率低于先通入
脱除率低于先通入 ,可能的原因是
,可能的原因是___________
(3)以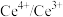 为媒介的间接电化学氧化法可以同时除去烟气中的
为媒介的间接电化学氧化法可以同时除去烟气中的 和
和 ,装置如图丙所示:
,装置如图丙所示:___________ , 参与反应的离子方程式为
参与反应的离子方程式为___________ 。
 )。
)。(1)钒基催化剂(
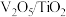 催化剂)可用于
催化剂)可用于 ,反应机理与催化剂表面
,反应机理与催化剂表面 的活性吸附位点有关。基于Lewis酸位点的SCR催化反应循环机理如图甲所示:
的活性吸附位点有关。基于Lewis酸位点的SCR催化反应循环机理如图甲所示: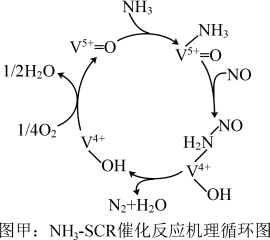
 的总反应化学方程式为
的总反应化学方程式为②若烟气中含有硫的氧化物,则会降低
 的速率,可能的原因是
的速率,可能的原因是(2)研究发现:当烟气中
 和
和 的物质的量相同时,会发生快速SCR反应过程:
的物质的量相同时,会发生快速SCR反应过程: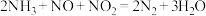 。臭氧对
。臭氧对 具有一定的辅助作用。臭氧先氧化
具有一定的辅助作用。臭氧先氧化 ,发生反应:
,发生反应: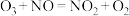 。在不同温度下,经过相同时间后测得
。在不同温度下,经过相同时间后测得 的物质的量之比与
的物质的量之比与 的脱除率关系如图乙所示。
的脱除率关系如图乙所示。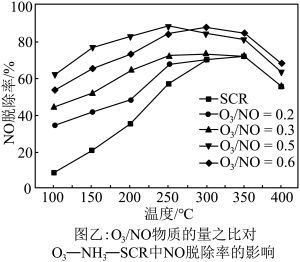
 中
中 脱除率均有不同程度的降低,其原因是
脱除率均有不同程度的降低,其原因是②温度低于250℃,
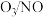 物质的量之比为0.5时,
物质的量之比为0.5时, 脱除率较高的原因是
脱除率较高的原因是③实验发现,向烟气中先通入
 ,
, 脱除率低于先通入
脱除率低于先通入 ,可能的原因是
,可能的原因是(3)以
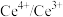 为媒介的间接电化学氧化法可以同时除去烟气中的
为媒介的间接电化学氧化法可以同时除去烟气中的 和
和 ,装置如图丙所示:
,装置如图丙所示: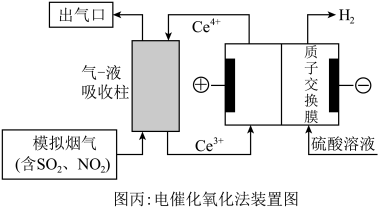
 参与反应的离子方程式为
参与反应的离子方程式为
您最近一年使用:0次
解题方法
3 . 锂离子电池正极材料(主要成分为 ,还含有少量铝箔、
,还含有少量铝箔、 等杂质),从废旧锂离子正极材料中回收氧化钴的工艺流程如图所示:
等杂质),从废旧锂离子正极材料中回收氧化钴的工艺流程如图所示: ,
, ,
, 。
。
回答下列问题:
(1)废旧电池拆解提取正极材料前,需将其浸入 溶液中,其目的是
溶液中,其目的是________ 。
(2)滤液1的主要成分是________ (填化学式,下同)。滤液2的主要成分是________ 。
(3)“酸溶”时发生的主要反应的离子方程式________ ;不用盐酸替代硫酸的原因是________ 。
(4)不宜使用 沉钴的原因是
沉钴的原因是________ 。
(5) ,若“沉钴”开始时
,若“沉钴”开始时 ,为了获得纯净的
,为了获得纯净的 ,应控制溶液的
,应控制溶液的
________ 。
(6)若最终得到产品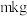 ,则可以重新制备
,则可以重新制备________  正极材料(含钴
正极材料(含钴 )。
)。
 ,还含有少量铝箔、
,还含有少量铝箔、 等杂质),从废旧锂离子正极材料中回收氧化钴的工艺流程如图所示:
等杂质),从废旧锂离子正极材料中回收氧化钴的工艺流程如图所示: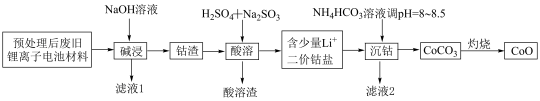
 ,
, ,
, 。
。回答下列问题:
(1)废旧电池拆解提取正极材料前,需将其浸入
 溶液中,其目的是
溶液中,其目的是(2)滤液1的主要成分是
(3)“酸溶”时发生的主要反应的离子方程式
(4)不宜使用
 沉钴的原因是
沉钴的原因是(5)
 ,若“沉钴”开始时
,若“沉钴”开始时 ,为了获得纯净的
,为了获得纯净的 ,应控制溶液的
,应控制溶液的
(6)若最终得到产品
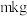 ,则可以重新制备
,则可以重新制备 正极材料(含钴
正极材料(含钴 )。
)。
您最近一年使用:0次
4 . 工业上以富钒炉渣(主要含FeO·V2O3、V2O5和少量的SiO2、Al2O3等)为原料制备V2O5的工艺流程如下:
已知:①+ 5价钒元素在溶液中的存在形式与溶液pH的关系:
②Ksp[Fe(OH)3]=2.6×10–39;Ksp[Al(OH)3]=1.0×10–33;Ksp(NH4VO3)=1.6×10–3
回答下列问题:
(1)“高温氧化”前将富钒炉渣研磨粉碎的目的是___________ ;“高温氧化”过程中发生主要反应的化学方程式为___________ 。
(2)滤渣1的主要成分为___________ ;“调pH”时需将Fe3+、Al3+除尽(浓度≤1×10–5 mol∙L–1时,可认为已除尽),需调节pH的范围为___________ 。
(3)若“沉钒”前溶液中c(VO )=0.2 mol∙L–1,忽略溶液体积变化,为使钒元素的沉降率达到99%,至少应调节c(NH
)=0.2 mol∙L–1,忽略溶液体积变化,为使钒元素的沉降率达到99%,至少应调节c(NH )为
)为___________ mol·L–1。过滤、洗涤、干燥得到NH4VO3沉淀,检验NH4VO3沉淀是否洗净的操作是___________ 。
(4)“焙烧”时生成两种参与大气循环的无毒物质,则该反应的化学方程式为___________ 。

已知:①+ 5价钒元素在溶液中的存在形式与溶液pH的关系:
| 溶液pH | <1.0 | 1.0~4.0 | 4.0~6.0 | 6.0~8.5 | 8.5~13.0 | >13.0 |
| 钒元素存在形式 | VO | V2O5 | 多矾酸根 | VO | 多矾酸根 | VO |
| 备注 | 多矾酸盐在水中溶解度较小 | |||||
回答下列问题:
(1)“高温氧化”前将富钒炉渣研磨粉碎的目的是
(2)滤渣1的主要成分为
(3)若“沉钒”前溶液中c(VO
 )=0.2 mol∙L–1,忽略溶液体积变化,为使钒元素的沉降率达到99%,至少应调节c(NH
)=0.2 mol∙L–1,忽略溶液体积变化,为使钒元素的沉降率达到99%,至少应调节c(NH )为
)为(4)“焙烧”时生成两种参与大气循环的无毒物质,则该反应的化学方程式为
您最近一年使用:0次
5 . 我国力争实现2030年前“碳达峰”、2060年前“碳中和”的目标,二氧化碳的捕捉与封存是目标实现的重要途径。回答下列问题:
I.常温下,某同学用 溶液捕捉一定体积空气中的
溶液捕捉一定体积空气中的 。为测定所得溶液的成分,该同学向其中逐滴加入
。为测定所得溶液的成分,该同学向其中逐滴加入 的盐酸,用压强传感器测得压强随盐酸体积的变化曲线如下图所示(忽虑
的盐酸,用压强传感器测得压强随盐酸体积的变化曲线如下图所示(忽虑 在水中的溶解)。
在水中的溶解)。
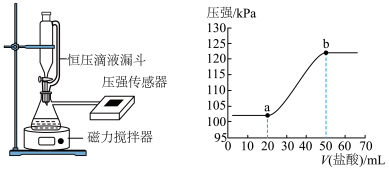
(1)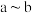 段反应的离子方程式为
段反应的离子方程式为___________ 。
(2)所得溶液的溶质成分为___________ (填化学式), 溶液的浓度为
溶液的浓度为___________  。
。
Ⅱ.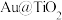 蛋黄型空心球催化剂技术实现了封存和能量储存双重效果,原理如图1所示。制得的
蛋黄型空心球催化剂技术实现了封存和能量储存双重效果,原理如图1所示。制得的 通过两步法可制取
通过两步法可制取 ,原理如图2所示。
,原理如图2所示。
(3)图1中 为
为___________ (填“氧化剂”“还原剂”或“既是氧化剂又是还原剂”),空心球催化过程的总反应方程式为___________ 。
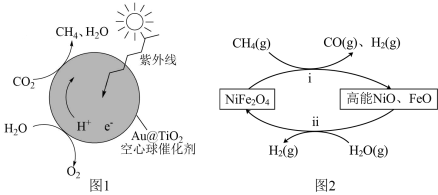
(4)图2第i步反应转移 时,该步反应生成
时,该步反应生成 的物质的量为
的物质的量为___________  ,若不考虑过程中原料损失,则
,若不考虑过程中原料损失,则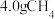 通过两步法最多可制得
通过两步法最多可制得 的物质的量为
的物质的量为___________  。
。
I.常温下,某同学用
 溶液捕捉一定体积空气中的
溶液捕捉一定体积空气中的 。为测定所得溶液的成分,该同学向其中逐滴加入
。为测定所得溶液的成分,该同学向其中逐滴加入 的盐酸,用压强传感器测得压强随盐酸体积的变化曲线如下图所示(忽虑
的盐酸,用压强传感器测得压强随盐酸体积的变化曲线如下图所示(忽虑 在水中的溶解)。
在水中的溶解)。
(1)
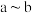 段反应的离子方程式为
段反应的离子方程式为(2)所得溶液的溶质成分为
 溶液的浓度为
溶液的浓度为 。
。Ⅱ.
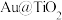 蛋黄型空心球催化剂技术实现了封存和能量储存双重效果,原理如图1所示。制得的
蛋黄型空心球催化剂技术实现了封存和能量储存双重效果,原理如图1所示。制得的 通过两步法可制取
通过两步法可制取 ,原理如图2所示。
,原理如图2所示。
(3)图1中
 为
为(4)图2第i步反应转移
 时,该步反应生成
时,该步反应生成 的物质的量为
的物质的量为 ,若不考虑过程中原料损失,则
,若不考虑过程中原料损失,则 通过两步法最多可制得
通过两步法最多可制得 的物质的量为
的物质的量为 。
。
您最近一年使用:0次
解题方法
6 .  是一种黑色固体,难溶于水、稀硫酸,可用于锰盐的制备,也用作氧化剂、催化剂等。某学习小组设计实验将粗
是一种黑色固体,难溶于水、稀硫酸,可用于锰盐的制备,也用作氧化剂、催化剂等。某学习小组设计实验将粗 样品(含有较多的
样品(含有较多的 和
和 )转化为纯
)转化为纯 ,其流程如图所示:
,其流程如图所示:
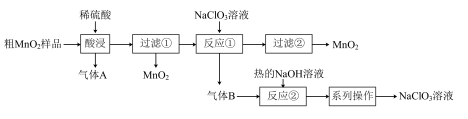
回答下列问题:
(1)“酸浸”中生成气体A的离子方程式为___________ 。
(2)反应①的离子方程式为___________ 。
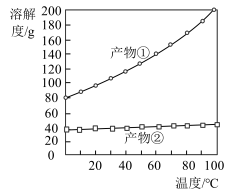
(3)若要得到较浓的 溶液,根据反应②产物的溶解度曲线(如图所示),产物②为
溶液,根据反应②产物的溶解度曲线(如图所示),产物②为___________ (写化学式),“系列操作”为先___________ ,后___________ 。
(4)若粗 样品的质量为
样品的质量为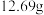 ,经“过滤①”得到
,经“过滤①”得到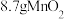 ,并收集到
,并收集到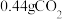 ,则在“反应①”中至少需要
,则在“反应①”中至少需要 的物质的量为
的物质的量为___________  。
。
(5)该流程中可循环利用的物质有___________ 。
 是一种黑色固体,难溶于水、稀硫酸,可用于锰盐的制备,也用作氧化剂、催化剂等。某学习小组设计实验将粗
是一种黑色固体,难溶于水、稀硫酸,可用于锰盐的制备,也用作氧化剂、催化剂等。某学习小组设计实验将粗 样品(含有较多的
样品(含有较多的 和
和 )转化为纯
)转化为纯 ,其流程如图所示:
,其流程如图所示:
回答下列问题:
(1)“酸浸”中生成气体A的离子方程式为
(2)反应①的离子方程式为
(3)若要得到较浓的
 溶液,根据反应②产物的溶解度曲线(如图所示),产物②为
溶液,根据反应②产物的溶解度曲线(如图所示),产物②为
(4)若粗
 样品的质量为
样品的质量为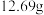 ,经“过滤①”得到
,经“过滤①”得到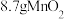 ,并收集到
,并收集到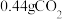 ,则在“反应①”中至少需要
,则在“反应①”中至少需要 的物质的量为
的物质的量为 。
。(5)该流程中可循环利用的物质有
您最近一年使用:0次
解题方法
7 . 草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4 2H2O实验流程如下:
2H2O实验流程如下:
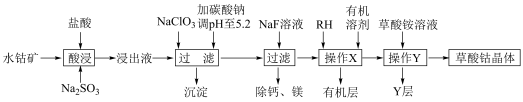
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)写出1种能提高酸浸速率的措施___________ ,“沉淀”的化学式为___________ 。
(2)操作X所用的玻璃仪器的名称为___________ 。
(3)“酸浸”过程中加入Na2SO3的目的是将___________ 还原(填离子符号);NaClO3的作用是将浸出液中的Fe2+氧化,产物中氯元素处于最低化合价,该反应的离子方程式为___________ 。
(4)试剂RH对金属离子的萃取率与pH的关系如图所示,加入萃取剂的作用是___________ ;使用萃取剂适宜的pH是___________ 。

A.接近2.0 B.接近3.0 C.接近4.0
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为氟化物沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液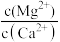 =
=___________ 。
 2H2O实验流程如下:
2H2O实验流程如下:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出1种能提高酸浸速率的措施
(2)操作X所用的玻璃仪器的名称为
(3)“酸浸”过程中加入Na2SO3的目的是将
(4)试剂RH对金属离子的萃取率与pH的关系如图所示,加入萃取剂的作用是

A.接近2.0 B.接近3.0 C.接近4.0
(5)“除钙、镁”是将溶液中Ca2+与Mg2+转化为氟化物沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液
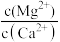 =
=
您最近一年使用:0次
解题方法
8 . 三氧化二镍( )是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(
)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍( ),再高温煅烧草酸镍制取
),再高温煅烧草酸镍制取 。工艺流程图如下所示:
。工艺流程图如下所示:

已知:i.草酸的钙、镁、镍盐以及 、
、 均难溶于水。
均难溶于水。
ii.溶液中金属阳离子的氢氧化物开始沉淀和沉淀完全的 (20℃)如下表:
(20℃)如下表:
请回答下列问题:
(1) 中
中 的化合价为
的化合价为______ ;进行操作b时的温度为______ 。
(2) 、
、 ,
, 三者的氧化性由弱到强是顺序为
三者的氧化性由弱到强是顺序为______ 。滤渣B中的主要物质是______ 。
(3)滤液B加入 的离子方程式为
的离子方程式为______ 。
(4)草酸镍( )在热空气中干燥脱水后,再高温下煅烧,可制得
)在热空气中干燥脱水后,再高温下煅烧,可制得 ,同时获得混合气体。
,同时获得混合气体。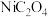 热分解的化学方程式为
热分解的化学方程式为______ 。
(5)若镍废料中镍含量为50.0%,用该方法处理1.00t镍废料得到0.415t (假设不含杂质),则产率为
(假设不含杂质),则产率为______ (保留3位有效数字)。
 )是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍(
)是一种重要的电子元件材料和蓄电池材料。工业上利用含镍废料(镍、铁、钙、镁合金为主)制取草酸镍( ),再高温煅烧草酸镍制取
),再高温煅烧草酸镍制取 。工艺流程图如下所示:
。工艺流程图如下所示:
已知:i.草酸的钙、镁、镍盐以及
 、
、 均难溶于水。
均难溶于水。ii.溶液中金属阳离子的氢氧化物开始沉淀和沉淀完全的
 (20℃)如下表:
(20℃)如下表:金属离子 |
|
|
|
|
|
开始沉淀时( | 7.7 | 7.5 | 2.2 | 12.3 | 9.6 |
完全时( | 9.2 | 9.0 | 3.2 | 微溶 | 11.1 |
(1)
 中
中 的化合价为
的化合价为(2)
 、
、 ,
, 三者的氧化性由弱到强是顺序为
三者的氧化性由弱到强是顺序为(3)滤液B加入
 的离子方程式为
的离子方程式为(4)草酸镍(
 )在热空气中干燥脱水后,再高温下煅烧,可制得
)在热空气中干燥脱水后,再高温下煅烧,可制得 ,同时获得混合气体。
,同时获得混合气体。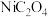 热分解的化学方程式为
热分解的化学方程式为(5)若镍废料中镍含量为50.0%,用该方法处理1.00t镍废料得到0.415t
 (假设不含杂质),则产率为
(假设不含杂质),则产率为
您最近一年使用:0次
解题方法
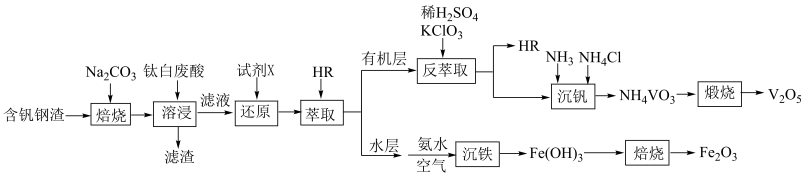
9 . 以含钒钢渣(含 、
、 和少量
和少量 、
、 )和钛白废酸(含
)和钛白废酸(含 、
、 、
、 、
、 )为原料提取钒,实现“以废治废”。工艺流程如图:
)为原料提取钒,实现“以废治废”。工艺流程如图:
已知:有机萃取剂 的萃取原理为
的萃取原理为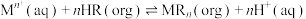 ,其中
,其中 表示有机溶液,酸性条件下
表示有机溶液,酸性条件下 能萃取
能萃取 而不能萃取
而不能萃取 ,
, 对+4价钒萃取能力强,而对+5价钒的萃取能力较弱。
对+4价钒萃取能力强,而对+5价钒的萃取能力较弱。
回答下列问题:
(1)在空气中“焙烧”时, 转化为
转化为 的化学方程式为
的化学方程式为___________ 。
(2)“溶浸”时生成的滤渣除了 外,还有
外,还有___________ (填化学式)。
(3)“还原”的目的是将溶液中的+5价钒和 分别转化为+4价钒与
分别转化为+4价钒与 ,利于+4价钒的萃取并实现钒和铁元素分离,加入的化学试剂
,利于+4价钒的萃取并实现钒和铁元素分离,加入的化学试剂 可能为___________(填标号)。
可能为___________(填标号)。
(4)在“萃取”操作后从水层中获得 的离子方程式是
的离子方程式是___________ 。
(5)在“反萃取”操作中 和
和 反应生成
反应生成 和
和 ,反应中氧化剂与还原剂的物质的量之比为
,反应中氧化剂与还原剂的物质的量之比为___________ 。
(6)上述流程中可循环利用的物质除 外,还有
外,还有___________ (填化学式)。
(7)常温“沉钒”,维持溶液中 的总浓度为
的总浓度为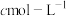 ,
, 。“沉钒”后溶液中
。“沉钒”后溶液中
___________  [已知
[已知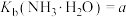 ;
; ]。
]。
 、
、 和少量
和少量 、
、 )和钛白废酸(含
)和钛白废酸(含 、
、 、
、 、
、 )为原料提取钒,实现“以废治废”。工艺流程如图:
)为原料提取钒,实现“以废治废”。工艺流程如图:
已知:有机萃取剂
 的萃取原理为
的萃取原理为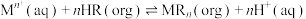 ,其中
,其中 表示有机溶液,酸性条件下
表示有机溶液,酸性条件下 能萃取
能萃取 而不能萃取
而不能萃取 ,
, 对+4价钒萃取能力强,而对+5价钒的萃取能力较弱。
对+4价钒萃取能力强,而对+5价钒的萃取能力较弱。回答下列问题:
(1)在空气中“焙烧”时,
 转化为
转化为 的化学方程式为
的化学方程式为(2)“溶浸”时生成的滤渣除了
 外,还有
外,还有(3)“还原”的目的是将溶液中的+5价钒和
 分别转化为+4价钒与
分别转化为+4价钒与 ,利于+4价钒的萃取并实现钒和铁元素分离,加入的化学试剂
,利于+4价钒的萃取并实现钒和铁元素分离,加入的化学试剂 可能为___________(填标号)。
可能为___________(填标号)。A. | B. | C. | D. |
(4)在“萃取”操作后从水层中获得
 的离子方程式是
的离子方程式是(5)在“反萃取”操作中
 和
和 反应生成
反应生成 和
和 ,反应中氧化剂与还原剂的物质的量之比为
,反应中氧化剂与还原剂的物质的量之比为(6)上述流程中可循环利用的物质除
 外,还有
外,还有(7)常温“沉钒”,维持溶液中
 的总浓度为
的总浓度为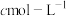 ,
, 。“沉钒”后溶液中
。“沉钒”后溶液中
 [已知
[已知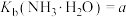 ;
; ]。
]。
您最近一年使用:0次
解题方法
10 . 低品位铜矿(主要含CuS、FeO)提铜是解决我国铜产量低这一问题的重要技术,利用低品位铜矿制备Cu2O的一种工艺流程如下图所示:

已知:Ⅰ.MnCO3难溶于水,CuS难溶于水及强酸。
Ⅱ.Cu2O是一种难溶于水的红色物质。
回答下列问题:
(1)“溶浸”包括以下操作:研磨、混合、加热并搅拌、冷却、______ 。“溶浸”中MnO2的作用是______ 。
(2)检验“溶浸”后所得溶液中是否含有 的试剂是
的试剂是______ 。
(3)“调pH”后判断 是否完全沉淀的操作是
是否完全沉淀的操作是______ 。
(4)“还原”中还原产物与氧化产物的物质的量之比为______ 。
(5)将Cu2O固体加入过量稀硫酸中,溶液变成蓝色,且仍有红色固体存在,发生反应的离子方程式为______ 。
(6)有人提出“将低品位铜矿灼烧后用酸溶解制得铜盐”的工艺流程,该流程不足之处有______ (写出一项即可)。

已知:Ⅰ.MnCO3难溶于水,CuS难溶于水及强酸。
Ⅱ.Cu2O是一种难溶于水的红色物质。
回答下列问题:
(1)“溶浸”包括以下操作:研磨、混合、加热并搅拌、冷却、
(2)检验“溶浸”后所得溶液中是否含有
 的试剂是
的试剂是(3)“调pH”后判断
 是否完全沉淀的操作是
是否完全沉淀的操作是(4)“还原”中还原产物与氧化产物的物质的量之比为
(5)将Cu2O固体加入过量稀硫酸中,溶液变成蓝色,且仍有红色固体存在,发生反应的离子方程式为
(6)有人提出“将低品位铜矿灼烧后用酸溶解制得铜盐”的工艺流程,该流程不足之处有
您最近一年使用:0次




 )的
)的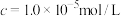 )的
)的

