1 . 废旧锌锰干电池内部的黑色物质A主要含有 、MnOOH、
、MnOOH、 、
、 、碳单质,用黑色物质A制备高纯
、碳单质,用黑色物质A制备高纯 的流程如图:
的流程如图: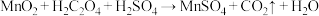 (未配平)。
(未配平)。
(1)第Ⅰ步操作是为了除去可溶性的__________ (填化学式)。
(2)第Ⅰ步后在空气中灼烧的目的有两个,一个是将MnOOH转化为 ,另一个是
,另一个是__________ 为灼烧时,MnOOH与空气中的氧气反应的化学方程式为____________________________ 。
(3)已知: 难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解;
难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解; 在pH大于7.7时,开始转化为
在pH大于7.7时,开始转化为 沉淀。第Ⅳ步中的多步操作可按如图步骤进行:
沉淀。第Ⅳ步中的多步操作可按如图步骤进行: 溶滴调节溶液pH的过程中有
溶滴调节溶液pH的过程中有 产生,则
产生,则 溶液与
溶液与 溶液反应的离子方程式为
溶液反应的离子方程式为____________ ,你认为操作③中检测的方法及现象是________________ 时可继续进行操作④:操作④中用无水乙醇洗涤的目的是_________________________ (答一条即可)。
 、MnOOH、
、MnOOH、 、
、 、碳单质,用黑色物质A制备高纯
、碳单质,用黑色物质A制备高纯 的流程如图:
的流程如图: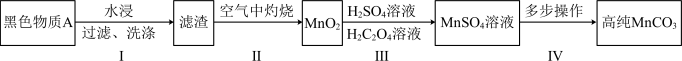
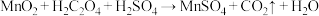 (未配平)。
(未配平)。(1)第Ⅰ步操作是为了除去可溶性的
(2)第Ⅰ步后在空气中灼烧的目的有两个,一个是将MnOOH转化为
 ,另一个是
,另一个是(3)已知:
 难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解;
难溶于水和乙醇,潮湿时易被空气氧化,100℃时开始分解; 在pH大于7.7时,开始转化为
在pH大于7.7时,开始转化为 沉淀。第Ⅳ步中的多步操作可按如图步骤进行:
沉淀。第Ⅳ步中的多步操作可按如图步骤进行:
 溶滴调节溶液pH的过程中有
溶滴调节溶液pH的过程中有 产生,则
产生,则 溶液与
溶液与 溶液反应的离子方程式为
溶液反应的离子方程式为
您最近一年使用:0次
名校
解题方法
2 . 下表为元素周期表的一部分,请参照元素①~⑨在表中的位置,回答下列问题:
(1)①④⑤三种元素形成既含离子键又含极性键的化合物,该化合物的电子式为___________ 。
(2)元素①⑤组成的化合物与水反应的化学方程式为___________ 。用一个化学反应证明元素⑨比元素③的得电子能力强,该反应的化学方程式为___________ 。
(3)甲同学查阅资料知:氨气( )的分解温度在850℃以上,甲烷(
)的分解温度在850℃以上,甲烷( )的分解温度是655℃,据此得出结论:元素②的非金属性比③的非金属性
)的分解温度是655℃,据此得出结论:元素②的非金属性比③的非金属性___________ (填“强”或“弱”)。乙同学对此结论持怀疑态度,甲同学通过实验间接证明了自己的结论,则甲同学的实验方案是___________ (请用离子方程式表示)。元素⑦的简单气态氢化物的空间构型为___________ 。
(4)①和④形成的18电子的化合物甲是一种应用广泛的化工原料,写出甲的结构式___________ 。
实验室中可用次氯酸钠溶液与氨反应制备①③组成的18电子化合物乙,化学方程式为___________ 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 1 | ① | ||||||
| 2 | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(2)元素①⑤组成的化合物与水反应的化学方程式为
(3)甲同学查阅资料知:氨气(
 )的分解温度在850℃以上,甲烷(
)的分解温度在850℃以上,甲烷( )的分解温度是655℃,据此得出结论:元素②的非金属性比③的非金属性
)的分解温度是655℃,据此得出结论:元素②的非金属性比③的非金属性(4)①和④形成的18电子的化合物甲是一种应用广泛的化工原料,写出甲的结构式
实验室中可用次氯酸钠溶液与氨反应制备①③组成的18电子化合物乙,化学方程式为
您最近一年使用:0次
3 . “协同去污,变废为宝”为处理工业废水提供了新思路。现有含 、
、 的电镀废液以及含
的电镀废液以及含 的废液。现联合处理废水,回收
的废液。现联合处理废水,回收 并生产铁红和媒染剂
并生产铁红和媒染剂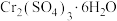 ,回收过程如下,请回答以下问题:
,回收过程如下,请回答以下问题:________ 。
(2)对于该工艺的说法错误的是________。
(3)写出铁铜废液中加入试剂1发生的离子方程式________ 。滤液与含酸性 的废液反应的离子方程式为
的废液反应的离子方程式为________ 。
(4)证明滤液已被试剂3完全氧化的实验方法是________ 。
(5)从 溶液制取
溶液制取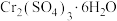 晶体的实验操作方法为蒸发浓缩、
晶体的实验操作方法为蒸发浓缩、________ 、过滤、________ 、干燥。
(6)已知 化学性质与
化学性质与 类似,若将流程中
类似,若将流程中 的溶液转化为氢氧化铬,则转化过程中发生的离子方程式为
的溶液转化为氢氧化铬,则转化过程中发生的离子方程式为________ 。
 、
、 的电镀废液以及含
的电镀废液以及含 的废液。现联合处理废水,回收
的废液。现联合处理废水,回收 并生产铁红和媒染剂
并生产铁红和媒染剂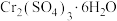 ,回收过程如下,请回答以下问题:
,回收过程如下,请回答以下问题: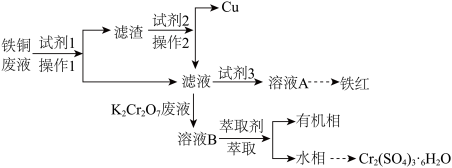
(2)对于该工艺的说法错误的是________。
| A.操作1和操作2都是过滤 |
B.试剂1是过量的 粉,试剂2是过量的 粉,试剂2是过量的 |
| C.可从有机相中提取出某成分加入到溶液A中,提高产量,剩余成分可循环利用 |
D.试剂3只能是 ,目的是将 ,目的是将 氧化成 氧化成 |
(3)写出铁铜废液中加入试剂1发生的离子方程式
 的废液反应的离子方程式为
的废液反应的离子方程式为(4)证明滤液已被试剂3完全氧化的实验方法是
(5)从
 溶液制取
溶液制取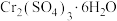 晶体的实验操作方法为蒸发浓缩、
晶体的实验操作方法为蒸发浓缩、(6)已知
 化学性质与
化学性质与 类似,若将流程中
类似,若将流程中 的溶液转化为氢氧化铬,则转化过程中发生的离子方程式为
的溶液转化为氢氧化铬,则转化过程中发生的离子方程式为
您最近一年使用:0次
解题方法
4 . 以软锰矿(含 及少量Fe、Al、Si、Ca、Mg等元素的氧化物)为原料制备高纯
及少量Fe、Al、Si、Ca、Mg等元素的氧化物)为原料制备高纯 的实验步骤如下:
的实验步骤如下:
(1)浸取。实验室浸取软锰矿的装置如图所示:
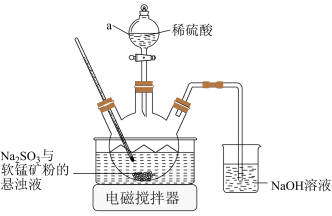
①为了提高软锰矿的浸出速率和浸取率,上述装置中采取的措施有_____ 。(答出一点即可)
②仪器a为_____ ;NaOH溶液的作用是_____ 。
③反应通常在70℃下反应,写出 转化为
转化为 的离子方程式
的离子方程式_____ 。
(2)除杂。向已经除去铁、铝、硅元素的 溶液(pH约为5)中加入NaF溶液,溶液中
溶液(pH约为5)中加入NaF溶液,溶液中 、
、 形成氟化物沉淀。但若pH太低,会显著增加NaF的用量,其原因为
形成氟化物沉淀。但若pH太低,会显著增加NaF的用量,其原因为_____ (用必要的离子方程式结合勒夏特列原理解释)。
(3)沉锰。向 溶液中缓慢滴加
溶液中缓慢滴加 溶液,过滤、洗涤、干燥,得到
溶液,过滤、洗涤、干燥,得到 固体。解释生成
固体。解释生成 固体所需要的平衡理论有
固体所需要的平衡理论有_____ 。
a、 的沉淀溶解平衡 b、
的沉淀溶解平衡 b、 的水解平衡 c、
的水解平衡 c、 的电离平衡 d、
的电离平衡 d、 的电离平衡
的电离平衡
(4)热解。将 置于热解装置中,通入足量空气,加热到450℃。将固体冷却后研成粉末,边搅拌边加入一定量稀硫酸除去少量的MnO、
置于热解装置中,通入足量空气,加热到450℃。将固体冷却后研成粉末,边搅拌边加入一定量稀硫酸除去少量的MnO、 ,加热,充分反应后过滤、洗涤、干燥,即可获得高纯
,加热,充分反应后过滤、洗涤、干燥,即可获得高纯 (已知:加热条件下
(已知:加热条件下 在酸性溶液中转化为
在酸性溶液中转化为 和
和 )。检验是否“洗涤”干净的操作方法为
)。检验是否“洗涤”干净的操作方法为_____ 。
 及少量Fe、Al、Si、Ca、Mg等元素的氧化物)为原料制备高纯
及少量Fe、Al、Si、Ca、Mg等元素的氧化物)为原料制备高纯 的实验步骤如下:
的实验步骤如下:(1)浸取。实验室浸取软锰矿的装置如图所示:

①为了提高软锰矿的浸出速率和浸取率,上述装置中采取的措施有
②仪器a为
③反应通常在70℃下反应,写出
 转化为
转化为 的离子方程式
的离子方程式(2)除杂。向已经除去铁、铝、硅元素的
 溶液(pH约为5)中加入NaF溶液,溶液中
溶液(pH约为5)中加入NaF溶液,溶液中 、
、 形成氟化物沉淀。但若pH太低,会显著增加NaF的用量,其原因为
形成氟化物沉淀。但若pH太低,会显著增加NaF的用量,其原因为(3)沉锰。向
 溶液中缓慢滴加
溶液中缓慢滴加 溶液,过滤、洗涤、干燥,得到
溶液,过滤、洗涤、干燥,得到 固体。解释生成
固体。解释生成 固体所需要的平衡理论有
固体所需要的平衡理论有a、
 的沉淀溶解平衡 b、
的沉淀溶解平衡 b、 的水解平衡 c、
的水解平衡 c、 的电离平衡 d、
的电离平衡 d、 的电离平衡
的电离平衡(4)热解。将
 置于热解装置中,通入足量空气,加热到450℃。将固体冷却后研成粉末,边搅拌边加入一定量稀硫酸除去少量的MnO、
置于热解装置中,通入足量空气,加热到450℃。将固体冷却后研成粉末,边搅拌边加入一定量稀硫酸除去少量的MnO、 ,加热,充分反应后过滤、洗涤、干燥,即可获得高纯
,加热,充分反应后过滤、洗涤、干燥,即可获得高纯 (已知:加热条件下
(已知:加热条件下 在酸性溶液中转化为
在酸性溶液中转化为 和
和 )。检验是否“洗涤”干净的操作方法为
)。检验是否“洗涤”干净的操作方法为
您最近一年使用:0次
名校
解题方法
5 . 次氯酸消毒液高效安全,适用于一般物体表面消毒、空间和环境消毒。实验室利用如下装置制取氯气并制取次氯酸消毒液。
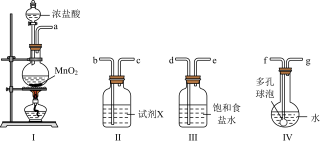
回答下列问题:
(1)装置合理的连接顺序为a→___________ (按气流方向填各接口的编号)。
(2)装置Ⅰ中反应的化学方程式是___________ 。
(3)装置Ⅱ中试剂X是___________ ;装置Ⅲ的作用是___________ ;装置Ⅳ中多孔球泡的作用为___________ 。
(4)反应结束后,取V中少量液体于试管中,滴入几滴石蕊观察到的现象是___________ ,请结合离子方程式说明原因___________ 。

回答下列问题:
(1)装置合理的连接顺序为a→
(2)装置Ⅰ中反应的化学方程式是
(3)装置Ⅱ中试剂X是
(4)反应结束后,取V中少量液体于试管中,滴入几滴石蕊观察到的现象是
您最近一年使用:0次
名校
6 . 高效灭菌消毒剂 气态时不稳定,受热或光照易分解,浓度过高时甚至会发生爆炸。工业上通常以氯酸盐(
气态时不稳定,受热或光照易分解,浓度过高时甚至会发生爆炸。工业上通常以氯酸盐( )、过氧化氢和碳酸盐为主要原料制备稳定性
)、过氧化氢和碳酸盐为主要原料制备稳定性 溶液的流程如图:
溶液的流程如图:
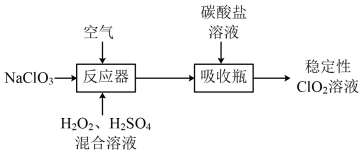
(1)①反应器中发生的主要反应为_________ (离子方程式)。
②制备时向反应器中通入空气的作用是_________ 。
(2)反应器中的反应温度控制在80℃左右为宜。
①工业上采用的加热方式为_________ 。
②当温度超过80℃, 的收率
的收率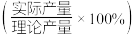 随温度升高而减小,其原因可能是
随温度升高而减小,其原因可能是_________ (写出两条即可)。
(3)吸收瓶中发生反应 获得稳定性
获得稳定性 溶液。当有
溶液。当有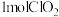 参加反应,转移的电子数为
参加反应,转移的电子数为_________  。
。
(4)亚氯酸钠( )也是一种高效的消毒剂和漂白剂。
)也是一种高效的消毒剂和漂白剂。 法制备亚氯酸钠的流程如下:
法制备亚氯酸钠的流程如下:
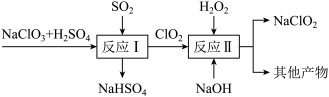
请写出反应 的化学方程式
的化学方程式_________ ;反应 中的其他产物包含
中的其他产物包含_________ 。
 气态时不稳定,受热或光照易分解,浓度过高时甚至会发生爆炸。工业上通常以氯酸盐(
气态时不稳定,受热或光照易分解,浓度过高时甚至会发生爆炸。工业上通常以氯酸盐( )、过氧化氢和碳酸盐为主要原料制备稳定性
)、过氧化氢和碳酸盐为主要原料制备稳定性 溶液的流程如图:
溶液的流程如图:
(1)①反应器中发生的主要反应为
②制备时向反应器中通入空气的作用是
(2)反应器中的反应温度控制在80℃左右为宜。
①工业上采用的加热方式为
②当温度超过80℃,
 的收率
的收率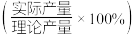 随温度升高而减小,其原因可能是
随温度升高而减小,其原因可能是(3)吸收瓶中发生反应
 获得稳定性
获得稳定性 溶液。当有
溶液。当有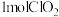 参加反应,转移的电子数为
参加反应,转移的电子数为 。
。(4)亚氯酸钠(
 )也是一种高效的消毒剂和漂白剂。
)也是一种高效的消毒剂和漂白剂。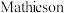 法制备亚氯酸钠的流程如下:
法制备亚氯酸钠的流程如下:
请写出反应
 的化学方程式
的化学方程式 中的其他产物包含
中的其他产物包含
您最近一年使用:0次
名校
解题方法
7 . 利用水钴矿(主要成分为 、
、 、FeO、
、FeO、 、
、 )制备二次电池添加剂
)制备二次电池添加剂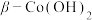 的流程如下。
的流程如下。
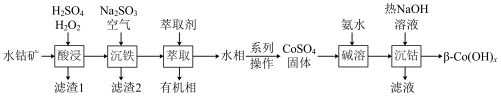
已知:i.沉淀过快无法形成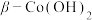 ,
, 在碱性溶液中易被
在碱性溶液中易被 氧化。
氧化。
ii.25℃时,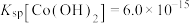 ,
, 的
的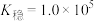 。
。
(1)“酸浸”中 与
与 、
、 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(2)“沉铁”中 被
被 与空气混合产生的
与空气混合产生的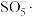 自由基氧化,
自由基氧化,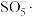 被还原为
被还原为_______ 。
(3)“萃取”可分离Co、Mn元素。下列物质可作萃取剂的是___________ 。(填标号)
A. B.
B. C.
C.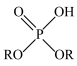
(4)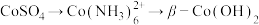 过程中:
过程中:
①“沉钴”中,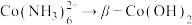 的离子方程式为
的离子方程式为___________ ,该反应的
___________ 。
②制备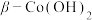 ,先加氨水再加NaOH溶液的理由是
,先加氨水再加NaOH溶液的理由是___________ 。
③“沉钴”中使用热NaOH溶液的目的是___________ 。
 、
、 、FeO、
、FeO、 、
、 )制备二次电池添加剂
)制备二次电池添加剂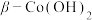 的流程如下。
的流程如下。
已知:i.沉淀过快无法形成
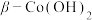 ,
, 在碱性溶液中易被
在碱性溶液中易被 氧化。
氧化。ii.25℃时,
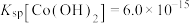 ,
, 的
的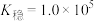 。
。(1)“酸浸”中
 与
与 、
、 发生反应的离子方程式为
发生反应的离子方程式为(2)“沉铁”中
 被
被 与空气混合产生的
与空气混合产生的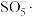 自由基氧化,
自由基氧化,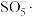 被还原为
被还原为(3)“萃取”可分离Co、Mn元素。下列物质可作萃取剂的是
A.
 B.
B. C.
C.
(4)
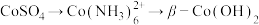 过程中:
过程中:①“沉钴”中,
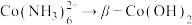 的离子方程式为
的离子方程式为
②制备
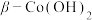 ,先加氨水再加NaOH溶液的理由是
,先加氨水再加NaOH溶液的理由是③“沉钴”中使用热NaOH溶液的目的是
您最近一年使用:0次
名校
8 .  气体是一种优良的消毒剂,常用于自来水的消毒。工业上常将
气体是一种优良的消毒剂,常用于自来水的消毒。工业上常将 制备成
制备成 固体以便运输和贮存,具体流程如图:
固体以便运输和贮存,具体流程如图:
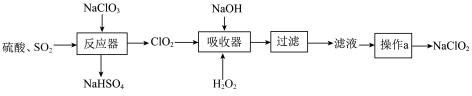
(1)反应器中发生反应的化学方程式为___________ 。
(2)吸收器中反应时有使带火星的木条复燃的气体产生,则 的作用为
的作用为___________ (填“氧化剂”或“还原剂”)。
(3)为了测定获得产品中 的纯度,进行如下实验:
的纯度,进行如下实验:
①准确称取2.000g上述产品,溶于水配成250.00mL的溶液。
②取25.00mL待测液,加入过量的KI溶液和 溶液发生如下反应:
溶液发生如下反应: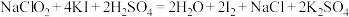 ,杂质不与KI反应。
,杂质不与KI反应。
③以淀粉作指示剂,再加入
 溶液;恰好完全反应时消耗
溶液;恰好完全反应时消耗 溶液的体积为40.00mL。已知:
溶液的体积为40.00mL。已知: )。
)。
计算该样品中 的纯度
的纯度___________ 。
(4)以 和稀盐酸为原料制备
和稀盐酸为原料制备 ,其原理如下:
,其原理如下: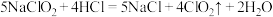 。当有1mol
。当有1mol 发生上述反应,转移电子的数目为
发生上述反应,转移电子的数目为___________ ,若盐酸浓度过大,则在上述过程中 会发生副反应产生
会发生副反应产生 。写出副反应的离子方程式
。写出副反应的离子方程式___________ 。
(5)“有效氯”的定义为:每克含氯消毒剂的氧化能力相当于多少克 的氧化能力。则
的氧化能力。则 的“有效氯”为
的“有效氯”为___________ (保留两位小数)。
 气体是一种优良的消毒剂,常用于自来水的消毒。工业上常将
气体是一种优良的消毒剂,常用于自来水的消毒。工业上常将 制备成
制备成 固体以便运输和贮存,具体流程如图:
固体以便运输和贮存,具体流程如图:
(1)反应器中发生反应的化学方程式为
(2)吸收器中反应时有使带火星的木条复燃的气体产生,则
 的作用为
的作用为(3)为了测定获得产品中
 的纯度,进行如下实验:
的纯度,进行如下实验:①准确称取2.000g上述产品,溶于水配成250.00mL的溶液。
②取25.00mL待测液,加入过量的KI溶液和
 溶液发生如下反应:
溶液发生如下反应: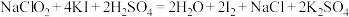 ,杂质不与KI反应。
,杂质不与KI反应。③以淀粉作指示剂,再加入

 溶液;恰好完全反应时消耗
溶液;恰好完全反应时消耗 溶液的体积为40.00mL。已知:
溶液的体积为40.00mL。已知: )。
)。计算该样品中
 的纯度
的纯度(4)以
 和稀盐酸为原料制备
和稀盐酸为原料制备 ,其原理如下:
,其原理如下: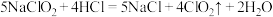 。当有1mol
。当有1mol 发生上述反应,转移电子的数目为
发生上述反应,转移电子的数目为 会发生副反应产生
会发生副反应产生 。写出副反应的离子方程式
。写出副反应的离子方程式(5)“有效氯”的定义为:每克含氯消毒剂的氧化能力相当于多少克
 的氧化能力。则
的氧化能力。则 的“有效氯”为
的“有效氯”为
您最近一年使用:0次
名校
9 . 有一包固体,可能含有镁粉、炭粉、氧化铜、氢氧化钠、氯化钾中的一种或几种。为探究固体的组成,某化学兴趣小组进行了如图所示实验:
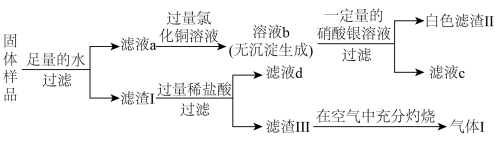
已知:①常温下,镁粉不与冷水反应;②滤液d的颜色为蓝色。
回答下列问题:
(1)滤渣Ⅲ的主要成分为___________ 。
(2)镁粉在氮气中燃烧生成 ,该物质能与水发生反应生成沉淀与气体,两种元素的化合价均不发生变化,写出
,该物质能与水发生反应生成沉淀与气体,两种元素的化合价均不发生变化,写出 与水发生反应的化学方程式为
与水发生反应的化学方程式为___________ 。
(3)由滤液a→溶液b可知,该固体中一定不含___________ (填化学式)。
(4)白色滤渣Ⅱ为________ (填名称)。能否据此判断该固体中含有氯化钾?_____ (填“能”或“不能”)。
(5)某金属氯化物 的摩尔质量为
的摩尔质量为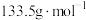 ,取该金属氯化物26.7g配成水汽液,与足量
,取该金属氯化物26.7g配成水汽液,与足量 溶液完全反应,生成86.1g白色沉淀。则金属M的摩尔质量为
溶液完全反应,生成86.1g白色沉淀。则金属M的摩尔质量为___________ 。

已知:①常温下,镁粉不与冷水反应;②滤液d的颜色为蓝色。
回答下列问题:
(1)滤渣Ⅲ的主要成分为
(2)镁粉在氮气中燃烧生成
 ,该物质能与水发生反应生成沉淀与气体,两种元素的化合价均不发生变化,写出
,该物质能与水发生反应生成沉淀与气体,两种元素的化合价均不发生变化,写出 与水发生反应的化学方程式为
与水发生反应的化学方程式为(3)由滤液a→溶液b可知,该固体中一定不含
(4)白色滤渣Ⅱ为
(5)某金属氯化物
 的摩尔质量为
的摩尔质量为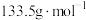 ,取该金属氯化物26.7g配成水汽液,与足量
,取该金属氯化物26.7g配成水汽液,与足量 溶液完全反应,生成86.1g白色沉淀。则金属M的摩尔质量为
溶液完全反应,生成86.1g白色沉淀。则金属M的摩尔质量为
您最近一年使用:0次
名校
解题方法
10 . 随着第三代半导体材料砷化镓、砷化铟的发展,使得高纯砷的需求量越来越大。用含砷废渣(主要成分为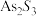 )制备高纯砷工艺流程如图。
)制备高纯砷工艺流程如图。
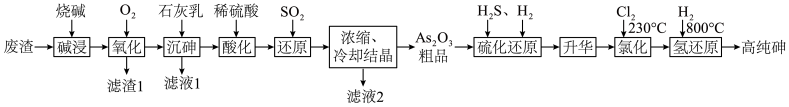
已知:①砷的主要化合价有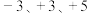 ;
;
②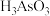 低温可分解;
低温可分解;
③砷与氯气在200~250℃时生成低价氯化物。
回答下列问题:
(1)“碱浸”发生的反应为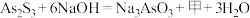 ,则甲的化学式为
,则甲的化学式为___________ 。
(2)“滤渣1”的主要成分为___________ 。
(3)“沉砷”生成 的最佳温度是85℃,温度过高,沉淀率却下降,原因为
的最佳温度是85℃,温度过高,沉淀率却下降,原因为___________ 。
(4)“还原”反应的离子方程式为___________ 。
(5)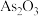 俗称砒霜,剧毒,法医学上鉴定砷的马氏试砷法是将试样与锌、盐酸混合,将生成的
俗称砒霜,剧毒,法医学上鉴定砷的马氏试砷法是将试样与锌、盐酸混合,将生成的 导入热玻璃管,分解,观察玻璃管壁是否有黑亮的“砷镜”生成,用反应的化学方程式解释该原理
导入热玻璃管,分解,观察玻璃管壁是否有黑亮的“砷镜”生成,用反应的化学方程式解释该原理___________ 。
(6)“氢还原”反应中氧化剂和还原剂的物质的量之比为___________ 。
(7)可循环利用的物质有___________ 。
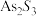 )制备高纯砷工艺流程如图。
)制备高纯砷工艺流程如图。
已知:①砷的主要化合价有
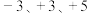 ;
;②
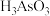 低温可分解;
低温可分解;③砷与氯气在200~250℃时生成低价氯化物。
回答下列问题:
(1)“碱浸”发生的反应为
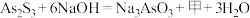 ,则甲的化学式为
,则甲的化学式为(2)“滤渣1”的主要成分为
(3)“沉砷”生成
 的最佳温度是85℃,温度过高,沉淀率却下降,原因为
的最佳温度是85℃,温度过高,沉淀率却下降,原因为(4)“还原”反应的离子方程式为
(5)
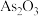 俗称砒霜,剧毒,法医学上鉴定砷的马氏试砷法是将试样与锌、盐酸混合,将生成的
俗称砒霜,剧毒,法医学上鉴定砷的马氏试砷法是将试样与锌、盐酸混合,将生成的 导入热玻璃管,分解,观察玻璃管壁是否有黑亮的“砷镜”生成,用反应的化学方程式解释该原理
导入热玻璃管,分解,观察玻璃管壁是否有黑亮的“砷镜”生成,用反应的化学方程式解释该原理(6)“氢还原”反应中氧化剂和还原剂的物质的量之比为
(7)可循环利用的物质有
您最近一年使用:0次



