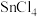名校
解题方法
1 . 含硫的物质与人们的生活密切相关。已知硫元素常见的化合价有-2、0、+4、+6四种,其不同价态的物质间可相互转化。完成下列填空:
(1)请写出硫在元素周期表的位置:___________ 。
(2)硫与硅为同一周期元素,通过下列事实能比较两者非金属性强弱的是___________。
(3)二氧化硫是形成酸雨的“元凶”之一,由二氧化硫形成的酸雨的主要成分是硫酸。以下是二氧化硫形成酸雨的两种途径: 转化成
转化成 的化学方程式:
的化学方程式:___________ 。
你认为减少酸雨产生的无效措施是___________ (填字母序号)
A.少用煤作燃料 B.把工厂烟囱造高 C.燃料脱硫 D.开发新能源
某同学利用如图所示装置探究二氧化硫气体的性质,回答下列问题:___________ 。
(5)当观察到②中溶液颜色变浅时,①中的现象是___________ 。
(6)装置③的作用是___________ 。
(7)②中的现象说明二氧化硫具有的性质是___________ 。
(8)从氧化还原角度制备硫代硫酸钠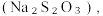 下列方案合理的是(填编号)___________。
下列方案合理的是(填编号)___________。
(9)为进一步减少 的污染并变废为宝,我国正在探索在一定条件下,用CO还原
的污染并变废为宝,我国正在探索在一定条件下,用CO还原 得到单质硫的方法来除去
得到单质硫的方法来除去 写出该反应的化学方程式:
写出该反应的化学方程式:___________ 。
(1)请写出硫在元素周期表的位置:
(2)硫与硅为同一周期元素,通过下列事实能比较两者非金属性强弱的是___________。
A.热稳定性: | B.溶解度: 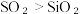 |
C.单质的熔点: | D.酸性:  |
(3)二氧化硫是形成酸雨的“元凶”之一,由二氧化硫形成的酸雨的主要成分是硫酸。以下是二氧化硫形成酸雨的两种途径:

 转化成
转化成 的化学方程式:
的化学方程式:你认为减少酸雨产生的无效措施是
A.少用煤作燃料 B.把工厂烟囱造高 C.燃料脱硫 D.开发新能源
某同学利用如图所示装置探究二氧化硫气体的性质,回答下列问题:
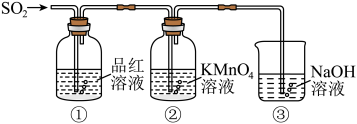
(5)当观察到②中溶液颜色变浅时,①中的现象是
(6)装置③的作用是
(7)②中的现象说明二氧化硫具有的性质是
(8)从氧化还原角度制备硫代硫酸钠
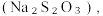 下列方案合理的是(填编号)___________。
下列方案合理的是(填编号)___________。A.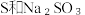 | B. 和浓 和浓 | C. 和 和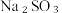 | D.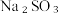 和 和 |
(9)为进一步减少
 的污染并变废为宝,我国正在探索在一定条件下,用CO还原
的污染并变废为宝,我国正在探索在一定条件下,用CO还原 得到单质硫的方法来除去
得到单质硫的方法来除去 写出该反应的化学方程式:
写出该反应的化学方程式:
您最近一年使用:0次
名校
2 . 利用氯元素价类二维图可以从不同角度研究含氯物质的性质及其转化关系。
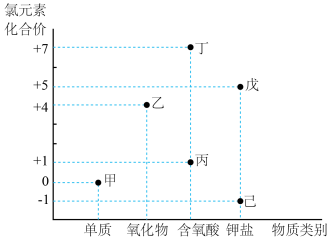
(1)纯净的H2在甲中安静的燃烧,火焰颜色为_______ 。
(2)检测丙溶液的酸性强弱_______ (填“可以”或“不可以”)用 试纸测定。
试纸测定。
(3)将甲通入 溶液并加热,同时生成丙的盐和戊,且数目比为2∶1,则该反应离子方程式为
溶液并加热,同时生成丙的盐和戊,且数目比为2∶1,则该反应离子方程式为_______ , 该反应的氧化剂和还原剂质量比为_______ 。
(4)已知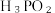 是一元弱酸,则
是一元弱酸,则 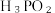 与足量
与足量 溶液反应的离子方程式为
溶液反应的离子方程式为_______ ; 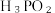 可以与甲的水溶液反应,生成
可以与甲的水溶液反应,生成  ,写出该反应的化学方程式
,写出该反应的化学方程式_______ 。

(1)纯净的H2在甲中安静的燃烧,火焰颜色为
(2)检测丙溶液的酸性强弱
 试纸测定。
试纸测定。(3)将甲通入
 溶液并加热,同时生成丙的盐和戊,且数目比为2∶1,则该反应离子方程式为
溶液并加热,同时生成丙的盐和戊,且数目比为2∶1,则该反应离子方程式为(4)已知
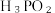 是一元弱酸,则
是一元弱酸,则 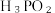 与足量
与足量 溶液反应的离子方程式为
溶液反应的离子方程式为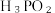 可以与甲的水溶液反应,生成
可以与甲的水溶液反应,生成  ,写出该反应的化学方程式
,写出该反应的化学方程式
您最近一年使用:0次
名校
3 . 亚氯酸钠( )是一种重要的含氯消毒剂,在水中溶解度较大,遇酸放出
)是一种重要的含氯消毒剂,在水中溶解度较大,遇酸放出 ,是一种高效的氧化剂和优质漂白剂,可用子各种纤维和某些食品的漂白,过氧化氢法制备
,是一种高效的氧化剂和优质漂白剂,可用子各种纤维和某些食品的漂白,过氧化氢法制备 固体的实验装置如图所示:
固体的实验装置如图所示:
① 的熔点为
的熔点为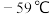 、沸点为
、沸点为 极易溶于水,遇热水、见光易分解:气体浓度较大时易发生爆炸,若用空气、
极易溶于水,遇热水、见光易分解:气体浓度较大时易发生爆炸,若用空气、 、氮气等气体稀释时,爆炸性则降低。
、氮气等气体稀释时,爆炸性则降低。
②
(1)A中盛放 的仪器名称为
的仪器名称为_________ ;按图组装好仪器后,首先应该进行的操作是_________ .
(2)装置 的作用是
的作用是_________ ; 装置使用冰水浴的目的
装置使用冰水浴的目的_________ (写序号)。
①减少 的分解 ②增大
的分解 ②增大 的溶解度 ③减少
的溶解度 ③减少 的分解
的分解
(3) 是合成
是合成 的重要原料,写出三颈烧瓶中由
的重要原料,写出三颈烧瓶中由 生成
生成 的化学方程式:
的化学方程式:__________________ .
(4)装置 中加入
中加入 溶液的目的除了作反应物外,还可以
溶液的目的除了作反应物外,还可以__________________ ;空气的流速过慢或过快都会影响 的产率,试分析空气流速过慢影响
的产率,试分析空气流速过慢影响 产率的原因:
产率的原因:__________________ .
(5)该套装置存在的明显缺陷是__________________ .
(6)若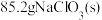 最终制得纯净的
最终制得纯净的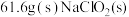 ,则
,则 的产率是
的产率是_________ (保留两位有效数字)。
 )是一种重要的含氯消毒剂,在水中溶解度较大,遇酸放出
)是一种重要的含氯消毒剂,在水中溶解度较大,遇酸放出 ,是一种高效的氧化剂和优质漂白剂,可用子各种纤维和某些食品的漂白,过氧化氢法制备
,是一种高效的氧化剂和优质漂白剂,可用子各种纤维和某些食品的漂白,过氧化氢法制备 固体的实验装置如图所示:
固体的实验装置如图所示: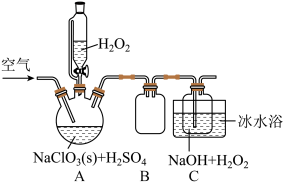
①
 的熔点为
的熔点为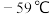 、沸点为
、沸点为 极易溶于水,遇热水、见光易分解:气体浓度较大时易发生爆炸,若用空气、
极易溶于水,遇热水、见光易分解:气体浓度较大时易发生爆炸,若用空气、 、氮气等气体稀释时,爆炸性则降低。
、氮气等气体稀释时,爆炸性则降低。②

(1)A中盛放
 的仪器名称为
的仪器名称为(2)装置
 的作用是
的作用是 装置使用冰水浴的目的
装置使用冰水浴的目的①减少
 的分解 ②增大
的分解 ②增大 的溶解度 ③减少
的溶解度 ③减少 的分解
的分解(3)
 是合成
是合成 的重要原料,写出三颈烧瓶中由
的重要原料,写出三颈烧瓶中由 生成
生成 的化学方程式:
的化学方程式:(4)装置
 中加入
中加入 溶液的目的除了作反应物外,还可以
溶液的目的除了作反应物外,还可以 的产率,试分析空气流速过慢影响
的产率,试分析空气流速过慢影响 产率的原因:
产率的原因:(5)该套装置存在的明显缺陷是
(6)若
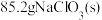 最终制得纯净的
最终制得纯净的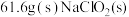 ,则
,则 的产率是
的产率是
您最近一年使用:0次
2023-12-04更新
|
140次组卷
|
4卷引用:天津市第四十七中学2023-2024学年高三上学期期中考试化学试题
名校
解题方法
4 . 国际化学年的中国宣传口号是“化学-我们的生活,我们的未来”。学习化学应该明白“从生活中来,到生活中去”道理。请填空:
(1)①若金属钠等活泼金属着火时,应该用______ 来灭火。
②小苏打可治疗胃酸过多,其反应的离子反应方程式为:______ 。
(2)火药是中国的“四大发明”之一、黑火药在发生爆炸时,发生如下反应: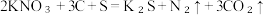 ,其中被氧化的元素是
,其中被氧化的元素是______ ,还原产物是______ 。
(3)人体内铁元素是以Fe2+和Fe3+的形式存在。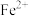 易被人体吸收,服用维生素C,可使Fe3+转化成Fe2+,有利于人体吸收,说明维生素C具有
易被人体吸收,服用维生素C,可使Fe3+转化成Fe2+,有利于人体吸收,说明维生素C具有______ (填“氧化性”或“还原性”)。
(4)探究碳酸氢钠的热稳定性,并利用其产物验证过氧化钠与二氧化碳的反应,按如图装置图进行实验。
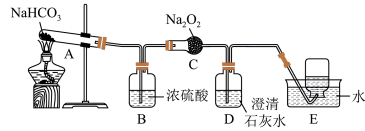
①C中反应的化学方程式为______ 。
②E中收集的气体主要是______ 。
(5)请将5种物质: 、
、 、
、 (N
(N )3、HNO3和
)3、HNO3和 分别填入下面对应的横线上,组成一个已配平的化学方程式
分别填入下面对应的横线上,组成一个已配平的化学方程式______ 。
→▢______+▢______→▢______+▢______+▢______+▢
(1)①若金属钠等活泼金属着火时,应该用
②小苏打可治疗胃酸过多,其反应的离子反应方程式为:
(2)火药是中国的“四大发明”之一、黑火药在发生爆炸时,发生如下反应:
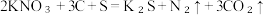 ,其中被氧化的元素是
,其中被氧化的元素是(3)人体内铁元素是以Fe2+和Fe3+的形式存在。
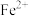 易被人体吸收,服用维生素C,可使Fe3+转化成Fe2+,有利于人体吸收,说明维生素C具有
易被人体吸收,服用维生素C,可使Fe3+转化成Fe2+,有利于人体吸收,说明维生素C具有(4)探究碳酸氢钠的热稳定性,并利用其产物验证过氧化钠与二氧化碳的反应,按如图装置图进行实验。

①C中反应的化学方程式为
②E中收集的气体主要是
(5)请将5种物质:
 、
、 、
、 (N
(N )3、HNO3和
)3、HNO3和 分别填入下面对应的横线上,组成一个已配平的化学方程式
分别填入下面对应的横线上,组成一个已配平的化学方程式→▢______+▢______→▢______+▢______+▢______+▢

您最近一年使用:0次
解题方法
5 . 有资料显示过量的氨气和氯气在常温下可合成岩脑砂(主要成分为NH4Cl),某实验小组对该反应进行探究,并对岩脑砂进行元素测定,回答下列问题:
(1)岩脑砂的制备:

①利用装置A制取实验所需的氨气,写出反应的化学方程式:___________ 。
②该实验中用浓盐酸与MnO2反应制取所需氯气,写出该反应的离子方程式:___________ 。则装置E中的试剂是(填写试剂名称)___________ 。
③为了使氨气和氯气在D中充分混合,请确定上述装置的合理连接顺序__________
a→d→c→___________←j←i←h←g←b。
④证明氨气和氯气反应有岩脑砂生成,需要的检验试剂中,除了蒸馏水、稀HNO3、NaOH溶液外,还需要___________ 、 ___________ 等两种。
(2)氨气和氯气反应制取岩脑砂时同时生成N2。
①氨气和氯气反应生成N2的化学方程式是___________ 。
②在制取到16.05 g NH4Cl时,同时生成___________ L的N2(标准状况下)。
(1)岩脑砂的制备:

①利用装置A制取实验所需的氨气,写出反应的化学方程式:
②该实验中用浓盐酸与MnO2反应制取所需氯气,写出该反应的离子方程式:
③为了使氨气和氯气在D中充分混合,请确定上述装置的合理连接顺序
a→d→c→___________←j←i←h←g←b。
④证明氨气和氯气反应有岩脑砂生成,需要的检验试剂中,除了蒸馏水、稀HNO3、NaOH溶液外,还需要
(2)氨气和氯气反应制取岩脑砂时同时生成N2。
①氨气和氯气反应生成N2的化学方程式是
②在制取到16.05 g NH4Cl时,同时生成
您最近一年使用:0次
2023-06-06更新
|
188次组卷
|
2卷引用:天津市红桥区2022-2023学年高三上学期期中考试化学试题
名校
解题方法
6 . 无机非金属元素在化工生产中扮演着重要的角色,请利用相关知识回答下列问题:
(1)硅单质可作为硅半导体材料,三氯硅烷( )还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
)还原法是当前制备高纯硅的主要方法,生产过程示意图如下: ;ii.三氯硅烷易被氧化。
;ii.三氯硅烷易被氧化。
①硅在周期表中的位置是___________ 。
②工业上原料石英砂常用 溶液浸泡除杂,实验室检验溶液中存在
溶液浸泡除杂,实验室检验溶液中存在 的操作与现象为
的操作与现象为___________ 。
③写出制粗硅的化学方程式___________ 。
④整个制备过程必须严格控制无水无氧。 遇水剧烈反应生成
遇水剧烈反应生成 、
、 和一种气体单质,该气体单质是
和一种气体单质,该气体单质是___________ (填名称);在制备高纯硅的过程中若混入 ,可能引起的后果是
,可能引起的后果是___________ 。
⑤用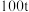 含二氧化硅
含二氧化硅 的石英矿,整个制备提纯过程硅元素损失了
的石英矿,整个制备提纯过程硅元素损失了 ,最终获得高纯硅的质量为
,最终获得高纯硅的质量为___________ t(结果精确到小数点后两位)。
(2)瓷器成分大多为硅酸盐,如蓝紫色的硅酸铜钡(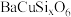 ,铜为
,铜为 价),下列说法正确的是___________。
价),下列说法正确的是___________。
(3)在人体器官受到损伤时,需要使用一种新型无机非金属材料来植入体内,这种材料是___________(填序号)。
(1)硅单质可作为硅半导体材料,三氯硅烷(
 )还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
)还原法是当前制备高纯硅的主要方法,生产过程示意图如下:
 ;ii.三氯硅烷易被氧化。
;ii.三氯硅烷易被氧化。①硅在周期表中的位置是
②工业上原料石英砂常用
 溶液浸泡除杂,实验室检验溶液中存在
溶液浸泡除杂,实验室检验溶液中存在 的操作与现象为
的操作与现象为③写出制粗硅的化学方程式
④整个制备过程必须严格控制无水无氧。
 遇水剧烈反应生成
遇水剧烈反应生成 、
、 和一种气体单质,该气体单质是
和一种气体单质,该气体单质是 ,可能引起的后果是
,可能引起的后果是⑤用
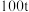 含二氧化硅
含二氧化硅 的石英矿,整个制备提纯过程硅元素损失了
的石英矿,整个制备提纯过程硅元素损失了 ,最终获得高纯硅的质量为
,最终获得高纯硅的质量为(2)瓷器成分大多为硅酸盐,如蓝紫色的硅酸铜钡(
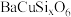 ,铜为
,铜为 价),下列说法正确的是___________。
价),下列说法正确的是___________。A. | B.可用氧化物形式表示为  |
| C.硅酸铜钡易溶于强酸和强碱 | D.唐宋时期,我国的瓷器已享誉海内外 |
| A.压电陶瓷 | B.高温结构陶瓷 | C.生物陶瓷 | D.超导陶瓷 |
您最近一年使用:0次
2023-05-03更新
|
206次组卷
|
2卷引用:天津市第五十四中学2023-2024学年高一下学期期中考试化学试卷
名校
解题方法
7 . 海洋资源的利用具有广阔前景。
I.从海水中提取溴的工艺流程如图所示。

(1)步骤Ⅰ、步骤Ⅲ发生反应的离子反应方程式为_________ 、_______________ 。
(2)步骤Ⅱ通入热空气或水蒸气吹出 ,利用了溴的
,利用了溴的______________ (填性质)
(3)步骤Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:________________ 。
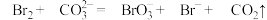
(4)步骤Ⅱ中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。若海水中溴含量约为65 从1000L海水中提取溴,理论上需要
从1000L海水中提取溴,理论上需要 的质量为
的质量为______________ 。
Ⅱ.海带中含有碘元素。实验室提取碘的步骤如下所示:
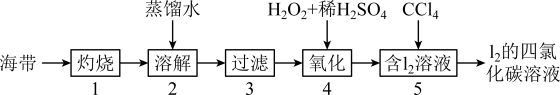
(5)灼烧海带至灰烬时会用到下列仪器中的______________ 。(填字母)
A.酒精灯 B.漏斗 C.坩埚 D.泥三角 E.烧杯
(6)海带灰中含有硫酸镁、碳酸钠等,在实验步骤______________ (填序号)中实现与碘分离。
(7)写出步骤④反应的离子方程式________________ 。
I.从海水中提取溴的工艺流程如图所示。

(1)步骤Ⅰ、步骤Ⅲ发生反应的离子反应方程式为
(2)步骤Ⅱ通入热空气或水蒸气吹出
 ,利用了溴的
,利用了溴的(3)步骤Ⅱ中涉及的离子反应如下,请在下面方框内填入适当的化学计量数:
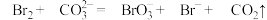
(4)步骤Ⅱ中吹出的溴蒸气,也可先用二氧化硫水溶液吸收,再用氯气氧化后蒸馏。若海水中溴含量约为65
 从1000L海水中提取溴,理论上需要
从1000L海水中提取溴,理论上需要 的质量为
的质量为Ⅱ.海带中含有碘元素。实验室提取碘的步骤如下所示:

(5)灼烧海带至灰烬时会用到下列仪器中的
A.酒精灯 B.漏斗 C.坩埚 D.泥三角 E.烧杯
(6)海带灰中含有硫酸镁、碳酸钠等,在实验步骤
(7)写出步骤④反应的离子方程式
您最近一年使用:0次
解题方法
8 . 高铁酸盐是优良的多功能水处理剂。 为紫色固体,可溶于水,微溶于浓
为紫色固体,可溶于水,微溶于浓 溶液,难溶于有机物;在0~5℃、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出
溶液,难溶于有机物;在0~5℃、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出 。某实验小组制备高铁酸钾
。某实验小组制备高铁酸钾 并测定产品纯度。回答下列问题:
并测定产品纯度。回答下列问题:
I.制备
装置如图所示,夹持、加热等装置略。
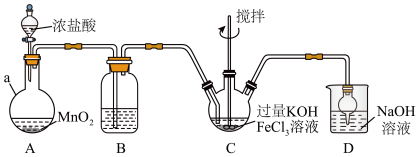
(1)仪器a的名称是__________ ,装置B中除杂质所用试剂是__________ 。
(2)A中发生反应的离子方程式为__________ 。
(3)C中反应为放热反应,而反应温度须控制在0~50℃,采用的控温方法为__________ ,反应中 必须过量的原因是
必须过量的原因是__________ 。
(4)C中由 制备
制备 ,若生成
,若生成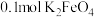 ,则该反应过程中转移的电子数目
,则该反应过程中转移的电子数目______ 。
II.产品纯度的测定
准确称取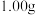 制得的晶体,配成
制得的晶体,配成 溶液,准确量取
溶液,准确量取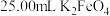 溶液放入锥形瓶,加入足量
溶液放入锥形瓶,加入足量 和
和 溶液,振荡,再加入稀硫酸酸化后得
溶液,振荡,再加入稀硫酸酸化后得 和
和 ,滴入几滴二苯胺磺酸钠作指示剂,用
,滴入几滴二苯胺磺酸钠作指示剂,用 标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗
标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗 标准溶液
标准溶液 。
。
(5)根据以上数据,样品中 的质量分数为
的质量分数为__________ 。
 为紫色固体,可溶于水,微溶于浓
为紫色固体,可溶于水,微溶于浓 溶液,难溶于有机物;在0~5℃、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出
溶液,难溶于有机物;在0~5℃、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出 。某实验小组制备高铁酸钾
。某实验小组制备高铁酸钾 并测定产品纯度。回答下列问题:
并测定产品纯度。回答下列问题:I.制备

装置如图所示,夹持、加热等装置略。

(1)仪器a的名称是
(2)A中发生反应的离子方程式为
(3)C中反应为放热反应,而反应温度须控制在0~50℃,采用的控温方法为
 必须过量的原因是
必须过量的原因是(4)C中由
 制备
制备 ,若生成
,若生成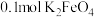 ,则该反应过程中转移的电子数目
,则该反应过程中转移的电子数目II.产品纯度的测定
准确称取
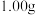 制得的晶体,配成
制得的晶体,配成 溶液,准确量取
溶液,准确量取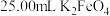 溶液放入锥形瓶,加入足量
溶液放入锥形瓶,加入足量 和
和 溶液,振荡,再加入稀硫酸酸化后得
溶液,振荡,再加入稀硫酸酸化后得 和
和 ,滴入几滴二苯胺磺酸钠作指示剂,用
,滴入几滴二苯胺磺酸钠作指示剂,用 标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗
标准溶液滴定至终点(溶液显浅紫红色),平行测定三次,平均消耗 标准溶液
标准溶液 。
。(5)根据以上数据,样品中
 的质量分数为
的质量分数为
您最近一年使用:0次
解题方法
9 . A、B、D、E、X是原子序数依次增大的五种短周期元素。A是周期表中相对原子质量最小的元素,A、B能形成两种液态化合物 和
和 。D是短周期中原子半径最大的主族元素,E的周期序数和族序数相等,D、X的原子最外层电子数之和为8。回答下列问题:(用化学用语填空)
。D是短周期中原子半径最大的主族元素,E的周期序数和族序数相等,D、X的原子最外层电子数之和为8。回答下列问题:(用化学用语填空)
(1) 的电子式为
的电子式为__________ ;离子半径D__________ B(填“>”或“<”)。
(2)如图所示,将少量X单质的水溶液分别滴入盛有不同试剂的试管中。

管a中发生反应的化学方程式为__________ ,该反应可用于制备漂白液。
②试管b中的实验现象为__________ ,说明X的非金属性强于碘元素,从原子结构的角度解释其原因是__________ 。
(3)镓 与E为同主族元素,氮化镓
与E为同主族元素,氮化镓 作为第三代半导体材料,具有耐高温、耐高电压等特性。下列相关说法中,正确的是
作为第三代半导体材料,具有耐高温、耐高电压等特性。下列相关说法中,正确的是__________ (填字母序号)。
a. 位于元素周期表的第四周期
位于元素周期表的第四周期
b. 中
中 的化合价为
的化合价为
c. 的离子半径小于
的离子半径小于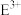 的离子半径
的离子半径
(4)工业上用 处理中性废水中的
处理中性废水中的 ,使其转化为
,使其转化为 沉淀除去,X被还原至最低价,该反应的离子方程式为
沉淀除去,X被还原至最低价,该反应的离子方程式为__________ 。
 和
和 。D是短周期中原子半径最大的主族元素,E的周期序数和族序数相等,D、X的原子最外层电子数之和为8。回答下列问题:(用化学用语填空)
。D是短周期中原子半径最大的主族元素,E的周期序数和族序数相等,D、X的原子最外层电子数之和为8。回答下列问题:(用化学用语填空) (1)
 的电子式为
的电子式为(2)如图所示,将少量X单质的水溶液分别滴入盛有不同试剂的试管中。

管a中发生反应的化学方程式为
②试管b中的实验现象为
(3)镓
 与E为同主族元素,氮化镓
与E为同主族元素,氮化镓 作为第三代半导体材料,具有耐高温、耐高电压等特性。下列相关说法中,正确的是
作为第三代半导体材料,具有耐高温、耐高电压等特性。下列相关说法中,正确的是a.
 位于元素周期表的第四周期
位于元素周期表的第四周期b.
 中
中 的化合价为
的化合价为
c.
 的离子半径小于
的离子半径小于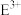 的离子半径
的离子半径(4)工业上用
 处理中性废水中的
处理中性废水中的 ,使其转化为
,使其转化为 沉淀除去,X被还原至最低价,该反应的离子方程式为
沉淀除去,X被还原至最低价,该反应的离子方程式为
您最近一年使用:0次
名校
解题方法
10 . 无水四氯化锡( )用于制作FTO导电玻璃,FTO玻璃广泛用于液晶显示屏、光催化、薄膜太阳能电池基底等;军事上四氯化锡蒸气与
)用于制作FTO导电玻璃,FTO玻璃广泛用于液晶显示屏、光催化、薄膜太阳能电池基底等;军事上四氯化锡蒸气与 及水汽混合呈浓烟状,可制作烟幕弹。实验室可用熔融的金属锡与干燥氯气利用图装置制备四氯化锡。有关信息如下表:
及水汽混合呈浓烟状,可制作烟幕弹。实验室可用熔融的金属锡与干燥氯气利用图装置制备四氯化锡。有关信息如下表:
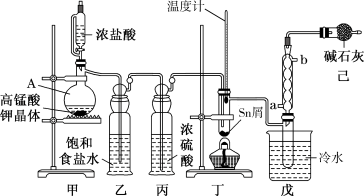
(1)实验室用二氧化锰制氯气的离子方程式为_______________________ 。
(2)装置己的作用有___________________ 。
(3) 和Sn的反应产物可能会有
和Sn的反应产物可能会有 和
和 为防止产品中带入
为防止产品中带入 ,除了通入过量氯气外,应控制温度在
,除了通入过量氯气外,应控制温度在_________ 范围内。(填标号)
a.114~232℃ b.232~652℃ c.652~2260℃
(4)为了确认丁中 的生成,可选用以下
的生成,可选用以下_____ 检验。(填标号)
a.稀盐酸
b.滴有KSCN(KSCN遇 变红)溶液的
变红)溶液的 溶液
溶液
c.酸性高锰酸钾溶液
(5)氯气在实际生活中的用途很多,可用于饮用水消毒。但对饮用水消毒副作用够,产生影响人体健康的有机氯衍生物。可用氯气制取高铁酸钠净水,补全缺项,并配平离子方程式______ 。
______ ______(______)+______
______(______)+______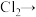 ______
______ ______(______)+
______(______)+
(6)工业上常将氯气转化为漂白粉,工业上利用氯气和石灰乳生产漂白粉的主要化学方程式是_________________ ,在空气中漂白粉长期存放会变质而失效的原理是(用化学方程式说明)____________ _____ 。
 )用于制作FTO导电玻璃,FTO玻璃广泛用于液晶显示屏、光催化、薄膜太阳能电池基底等;军事上四氯化锡蒸气与
)用于制作FTO导电玻璃,FTO玻璃广泛用于液晶显示屏、光催化、薄膜太阳能电池基底等;军事上四氯化锡蒸气与 及水汽混合呈浓烟状,可制作烟幕弹。实验室可用熔融的金属锡与干燥氯气利用图装置制备四氯化锡。有关信息如下表:
及水汽混合呈浓烟状,可制作烟幕弹。实验室可用熔融的金属锡与干燥氯气利用图装置制备四氯化锡。有关信息如下表:
化学式 | Sn |
|
|
熔点/℃ | 232 | 246 | -33 |
沸点/℃ | 2260 | 652 | 114 |
其他性质 | 银白色固体金属 | 无色晶体,Sn(Ⅱ)易被氧化 | 无色液体,遇水反应 |
(2)装置己的作用有
(3)
 和Sn的反应产物可能会有
和Sn的反应产物可能会有 和
和 为防止产品中带入
为防止产品中带入 ,除了通入过量氯气外,应控制温度在
,除了通入过量氯气外,应控制温度在a.114~232℃ b.232~652℃ c.652~2260℃
(4)为了确认丁中
 的生成,可选用以下
的生成,可选用以下a.稀盐酸
b.滴有KSCN(KSCN遇
 变红)溶液的
变红)溶液的 溶液
溶液c.酸性高锰酸钾溶液
(5)氯气在实际生活中的用途很多,可用于饮用水消毒。但对饮用水消毒副作用够,产生影响人体健康的有机氯衍生物。可用氯气制取高铁酸钠净水,补全缺项,并配平离子方程式
______
 ______(______)+______
______(______)+______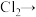 ______
______ ______(______)+
______(______)+
(6)工业上常将氯气转化为漂白粉,工业上利用氯气和石灰乳生产漂白粉的主要化学方程式是
您最近一年使用:0次
2022-11-18更新
|
274次组卷
|
2卷引用:天津市第一中学2022-2023学年高一上学期期中质量调查化学试题