1 . 化石燃料的综合利用既能减少污染,又能提高资源利用率。回答下列问题:
(1)煤的气化是将煤转化为气体燃料,其中重要的一步反应是高温下焦炭与水蒸气反应制备水煤气(CO、H2),该反应的化学方程式为___________ 。
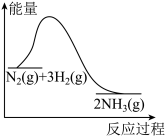
(2)合成氨工业是煤化工产业链中非常重要的一步。合成氨反应过程中的能量变化如图所示,则该反应为___________ (填“吸热”或“放热”)反应。
(3)实验室模拟工业合成氨,向2L恒容密闭容器内充入1molN2反应过程和3molH2,在一定条件下发生反应。若经过5min后,测得容器内NH3的物质的量为1mol,则这段时间内,v(N2)=___________ ,此时容器内H2的物质的量浓度为___________ 。
(4)天然气的主要成分是CH4.在酸性介质中,利用反应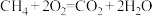 可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图所示(其中质子交换膜只允许H+通过):
可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图所示(其中质子交换膜只允许H+通过):
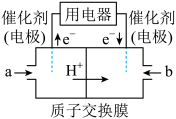
通入b气体的电极名称为___________ ,通入a气体的电极上反应式为___________ 。
(1)煤的气化是将煤转化为气体燃料,其中重要的一步反应是高温下焦炭与水蒸气反应制备水煤气(CO、H2),该反应的化学方程式为
(2)合成氨工业是煤化工产业链中非常重要的一步。合成氨反应过程中的能量变化如图所示,则该反应为

(3)实验室模拟工业合成氨,向2L恒容密闭容器内充入1molN2反应过程和3molH2,在一定条件下发生反应。若经过5min后,测得容器内NH3的物质的量为1mol,则这段时间内,v(N2)=
(4)天然气的主要成分是CH4.在酸性介质中,利用反应
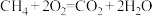 可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图所示(其中质子交换膜只允许H+通过):
可设计成结构简单、能量转化率高、对环境无污染的燃料电池,其工作原理如图所示(其中质子交换膜只允许H+通过):
通入b气体的电极名称为
您最近一年使用:0次
2023-07-16更新
|
88次组卷
|
2卷引用:青海省西宁市大通回族土族自治县2022-2023学年高一下学期期末考试化学试题
2 . 含硼化合物硼酸( )、硼氢化钠(
)、硼氢化钠( )、硼酸甲酯
)、硼酸甲酯 在工业上有重要用途。回答下列问题:
在工业上有重要用途。回答下列问题:
(1) 在水溶液中会发生如下反应:
在水溶液中会发生如下反应: (反应实质为水电离出的
(反应实质为水电离出的 被还原)。实验测得溶液的碱性越强,该反应的反应速率越小,试解释其中的原因
被还原)。实验测得溶液的碱性越强,该反应的反应速率越小,试解释其中的原因_______ 。
(2)利用硼砂(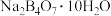 )制备硼酸(
)制备硼酸( )的流程如下图所示:
)的流程如下图所示:
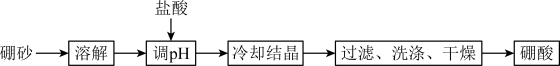
①“调 ”时需要控制溶液
”时需要控制溶液 ,写出用
,写出用 试纸检测溶液
试纸检测溶液 的操作方法:
的操作方法:_______ 。
②“调 ”后溶液中有硼酸生成,写出反应的离子方程式:
”后溶液中有硼酸生成,写出反应的离子方程式:_______ 。
③ 在水中电离方程式为:
在水中电离方程式为: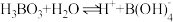 ,
,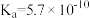 ,据此可判断
,据此可判断 属于
属于_______ 元弱酸,常温下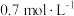 的硼酸溶液中
的硼酸溶液中 的浓度约为
的浓度约为_______ (计算结果保留小数点后一位)。
(3)利用硼酸和甲醇制备硼酸甲酯,发生的反应为: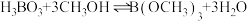 ,不同温度下,硼酸的转化率(
,不同温度下,硼酸的转化率( )随时间变化如图所示:
)随时间变化如图所示:

①该反应的
_______ (填“<”“=”或“>”)0。
②达到平衡时,升高温度,_______ [填“ ”或“
”或“ ”]增大的程度更大。
”]增大的程度更大。
 )、硼氢化钠(
)、硼氢化钠( )、硼酸甲酯
)、硼酸甲酯 在工业上有重要用途。回答下列问题:
在工业上有重要用途。回答下列问题:(1)
 在水溶液中会发生如下反应:
在水溶液中会发生如下反应: (反应实质为水电离出的
(反应实质为水电离出的 被还原)。实验测得溶液的碱性越强,该反应的反应速率越小,试解释其中的原因
被还原)。实验测得溶液的碱性越强,该反应的反应速率越小,试解释其中的原因(2)利用硼砂(
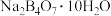 )制备硼酸(
)制备硼酸( )的流程如下图所示:
)的流程如下图所示:
①“调
 ”时需要控制溶液
”时需要控制溶液 ,写出用
,写出用 试纸检测溶液
试纸检测溶液 的操作方法:
的操作方法:②“调
 ”后溶液中有硼酸生成,写出反应的离子方程式:
”后溶液中有硼酸生成,写出反应的离子方程式:③
 在水中电离方程式为:
在水中电离方程式为: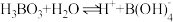 ,
,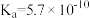 ,据此可判断
,据此可判断 属于
属于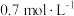 的硼酸溶液中
的硼酸溶液中 的浓度约为
的浓度约为(3)利用硼酸和甲醇制备硼酸甲酯,发生的反应为:
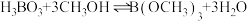 ,不同温度下,硼酸的转化率(
,不同温度下,硼酸的转化率( )随时间变化如图所示:
)随时间变化如图所示:
①该反应的

②达到平衡时,升高温度,
 ”或“
”或“ ”]增大的程度更大。
”]增大的程度更大。
您最近一年使用:0次
2023-02-20更新
|
55次组卷
|
2卷引用:青海省西宁市大通回族土族自治县2022-2023学年高二上学期期末考试化学试题
名校
解题方法
3 . 某含锰废料中主要含MnCO3及少量的FeCO3、SiO2、Cu2(OH)2CO3,以此为原料制备MnO2的流程如下:
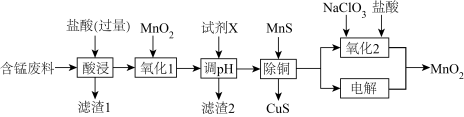
Ⅰ.氢氧化物开始沉淀和完全沉淀的pH如下表:
Ⅱ.常温下Ksp(MnS)=2.0×10-10、Ksp(CuS)=6.0×10-36。
回答下列问题:
(1)滤渣1的主要成分是_________ (填化学式)。
(2)“氧化1”的目的是_________ (用离子方程式表示)。
(3)“调pH”时,试剂X为_________ (任写一种),pH的调节范围为_________ 。
(4)“除铜”时,当溶液中c(Mn2+)=12mol·L-1,溶液中c(Cu2+)=_________  。
。
(5)“氧化2”制备MnO2 (恰好完全反应)时,n(Mn2+):n(ClO )=
)=_________ ( ClO →Cl-);“电解”制备MnO2的阳极电极反应式为
→Cl-);“电解”制备MnO2的阳极电极反应式为_________ 。

Ⅰ.氢氧化物开始沉淀和完全沉淀的pH如下表:
| 氢氧化物 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 |
| 开始沉淀时pH | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时pH | 9.8 | 8.3 | 3.7 | 6.7 |
回答下列问题:
(1)滤渣1的主要成分是
(2)“氧化1”的目的是
(3)“调pH”时,试剂X为
(4)“除铜”时,当溶液中c(Mn2+)=12mol·L-1,溶液中c(Cu2+)=
 。
。(5)“氧化2”制备MnO2 (恰好完全反应)时,n(Mn2+):n(ClO
 )=
)= →Cl-);“电解”制备MnO2的阳极电极反应式为
→Cl-);“电解”制备MnO2的阳极电极反应式为
您最近一年使用:0次
2022-11-25更新
|
126次组卷
|
4卷引用:青海省西宁市大通县2023-2024学年高二上学期期末考试化学试题
解题方法
4 .  是一种重要的杀菌消毒剂,也常用来漂白织物等,已知:
是一种重要的杀菌消毒剂,也常用来漂白织物等,已知: 饱和溶液在温度低于
饱和溶液在温度低于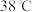 时析出晶体
时析出晶体 ,温度高于
,温度高于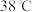 时析出晶体
时析出晶体 ,温度高于
,温度高于 时
时 分解生成
分解生成 和
和 。生产工艺流程如下:
。生产工艺流程如下:
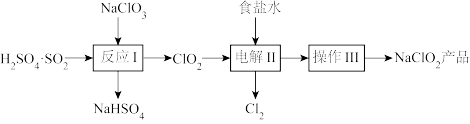
回答下列问题:
(1) 中Cl的化合价为
中Cl的化合价为___________ 。
(2)看图补全反应I的化学方程式: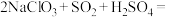
___________ +___________ (须配平),其中SO2做___________ (填“氧化剂”或“还原剂”)。
(3)电解II:
①所用食盐水由粗盐水精制而成,精制时,为除去粗盐水中的 和
和 ,需要加入的试剂分别为
,需要加入的试剂分别为___________ 、___________ 。
②可用 溶液吸收电解产生的
溶液吸收电解产生的 ,反应的离子方程式为
,反应的离子方程式为___________ 。
(4)操作III:从滤液获得 的操作步骤:①加热蒸发;②趁热过滤;③洗涤;④干燥,得到成品。趁热过滤应控制的温度范围是
的操作步骤:①加热蒸发;②趁热过滤;③洗涤;④干燥,得到成品。趁热过滤应控制的温度范围是___________ 。
 是一种重要的杀菌消毒剂,也常用来漂白织物等,已知:
是一种重要的杀菌消毒剂,也常用来漂白织物等,已知: 饱和溶液在温度低于
饱和溶液在温度低于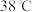 时析出晶体
时析出晶体 ,温度高于
,温度高于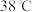 时析出晶体
时析出晶体 ,温度高于
,温度高于 时
时 分解生成
分解生成 和
和 。生产工艺流程如下:
。生产工艺流程如下:
回答下列问题:
(1)
 中Cl的化合价为
中Cl的化合价为(2)看图补全反应I的化学方程式:
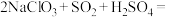
(3)电解II:
①所用食盐水由粗盐水精制而成,精制时,为除去粗盐水中的
 和
和 ,需要加入的试剂分别为
,需要加入的试剂分别为②可用
 溶液吸收电解产生的
溶液吸收电解产生的 ,反应的离子方程式为
,反应的离子方程式为(4)操作III:从滤液获得
 的操作步骤:①加热蒸发;②趁热过滤;③洗涤;④干燥,得到成品。趁热过滤应控制的温度范围是
的操作步骤:①加热蒸发;②趁热过滤;③洗涤;④干燥,得到成品。趁热过滤应控制的温度范围是
您最近一年使用:0次
名校
5 . 化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效广谱的灭菌消毒剂。棕黄色的 气体是次氯酸的酸酐,溶于水生成次氯酸,实验室模拟工业制备次氯酸的装置如图所示(夹持装置已略)。
气体是次氯酸的酸酐,溶于水生成次氯酸,实验室模拟工业制备次氯酸的装置如图所示(夹持装置已略)。

已知:
① 气体在42℃以上会发生分解,浓度过大会发生爆炸;
气体在42℃以上会发生分解,浓度过大会发生爆炸;
②工业上用氯气与潮湿的碳酸钠反应制得 ,同时生成两种钠盐该反应放热。
,同时生成两种钠盐该反应放热。
(1)仪器m的名称___________ ;装置A中发生反应的离子反应方程式___________ ;
(2)装置B中盛放的适宜试剂是___________ ;B中通入空气的原因是___________ ;
(3)装置C中主要发生反应的化学方程式___________ ;
(4)实验中,装置C需要冷却的原因是___________ ;
(5)装置D中多孔球泡的作用___________ ;装置E中碱石灰的作用是___________ ;
(6)此法相对于用氯气直接溶于水制备次氯酸溶液的优点是___________ (答出一条即可)。
 气体是次氯酸的酸酐,溶于水生成次氯酸,实验室模拟工业制备次氯酸的装置如图所示(夹持装置已略)。
气体是次氯酸的酸酐,溶于水生成次氯酸,实验室模拟工业制备次氯酸的装置如图所示(夹持装置已略)。
已知:
①
 气体在42℃以上会发生分解,浓度过大会发生爆炸;
气体在42℃以上会发生分解,浓度过大会发生爆炸;②工业上用氯气与潮湿的碳酸钠反应制得
 ,同时生成两种钠盐该反应放热。
,同时生成两种钠盐该反应放热。(1)仪器m的名称
(2)装置B中盛放的适宜试剂是
(3)装置C中主要发生反应的化学方程式
(4)实验中,装置C需要冷却的原因是
(5)装置D中多孔球泡的作用
(6)此法相对于用氯气直接溶于水制备次氯酸溶液的优点是
您最近一年使用:0次
2021-12-04更新
|
539次组卷
|
3卷引用:青海省西宁市2021-2022学年高三上学期期末统考化学试题
解题方法
6 . 溴元素被称为海洋元素,它主要以溴离子形式存在于海水中。工业上制备粗溴( )的流程如图:
)的流程如图:

已知:①在酸性条件下, 具有强氧化性;②
具有强氧化性;② 。回答下列问题:
。回答下列问题:
(1)“置换”时通入 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(2)单质溴可用热空气吹出,其原因是___________ 。
(3)写出“酸化”时发生反应的化学方程式:___________ 。
(4)用 溶液而不用盐酸“酸化”的原因可能是
溶液而不用盐酸“酸化”的原因可能是___________ 。
(5)为了除去粗溴中微量的氯气,可向粗溴中加入适量___________ (填字母),充分反应后,分液。
a.饱和NaCl溶液 b.NaOH溶液 c. 溶液 d.
溶液 d. 溶液
溶液
 )的流程如图:
)的流程如图:
已知:①在酸性条件下,
 具有强氧化性;②
具有强氧化性;② 。回答下列问题:
。回答下列问题:(1)“置换”时通入
 发生反应的离子方程式为
发生反应的离子方程式为(2)单质溴可用热空气吹出,其原因是
(3)写出“酸化”时发生反应的化学方程式:
(4)用
 溶液而不用盐酸“酸化”的原因可能是
溶液而不用盐酸“酸化”的原因可能是(5)为了除去粗溴中微量的氯气,可向粗溴中加入适量
a.饱和NaCl溶液 b.NaOH溶液 c.
 溶液 d.
溶液 d. 溶液
溶液
您最近一年使用:0次
7 . 铁是应用最广泛的金属,铁的氯化物、氧化物均为重要化合物。
(1)工业上常用 作印刷电路板的蚀刻剂。某实验小组欲从印刷电路板的废液中回收铜,并获得
作印刷电路板的蚀刻剂。某实验小组欲从印刷电路板的废液中回收铜,并获得 溶液,设计了如下方案:
溶液,设计了如下方案:

①试剂D为___________ (填名称)。
②滤液B的溶质为___________ (填化学式)。
③通入气体F时发生反应的离子方程式为___________ 。
④实验中若要证明蚀刻废液中不含 而可能含有
而可能含有 ,正确的实验操作为
,正确的实验操作为___________ 。
(2)水热法制备 纳米颗粒的反应为
纳米颗粒的反应为 。请回答下列问题:
。请回答下列问题:
①水热法制备 纳米颗粒的反应中,被氧化的元素为
纳米颗粒的反应中,被氧化的元素为___________ (填元素符号)。
②该反应的化学方程式中
___________ 。
③每生成 ,反应转移的电子为
,反应转移的电子为___________  。
。
(1)工业上常用
 作印刷电路板的蚀刻剂。某实验小组欲从印刷电路板的废液中回收铜,并获得
作印刷电路板的蚀刻剂。某实验小组欲从印刷电路板的废液中回收铜,并获得 溶液,设计了如下方案:
溶液,设计了如下方案:
①试剂D为
②滤液B的溶质为
③通入气体F时发生反应的离子方程式为
④实验中若要证明蚀刻废液中不含
 而可能含有
而可能含有 ,正确的实验操作为
,正确的实验操作为(2)水热法制备
 纳米颗粒的反应为
纳米颗粒的反应为 。请回答下列问题:
。请回答下列问题:①水热法制备
 纳米颗粒的反应中,被氧化的元素为
纳米颗粒的反应中,被氧化的元素为②该反应的化学方程式中

③每生成
 ,反应转移的电子为
,反应转移的电子为 。
。
您最近一年使用:0次
2021-01-30更新
|
460次组卷
|
5卷引用:青海省海东市2020-2021学年高一上学期期末考试化学试题



