名校
1 . Li2CO3是制备锂离子电极材料LiFePO4的重要原料。以盐湖卤水(主要含有NaCl、MgCl2、LiCl和Na2B4O7等)为原料提取Li2CO3并制备LiFePO4的工艺流程如图所示:

已知:“日晒蒸发喷雾干燥”后固体含NaCl、LiCl、MgCl2•6H2O等。
(1)硼酸在水中的溶解度随温度的变化关系如图所示:
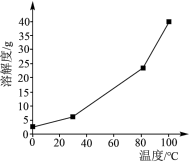
已知:H3BO3+H2O⇌[B(OH)4]-+H+。6.2gH3BO3最多与______ mL2.5mol/LNaOH溶液完全反应。“酸化脱硼”中采用______ (填“加热”或“冷却”),其目的是______ 。
(2)“水浸”后的溶液中溶质的主要成分是______ 。
(3)“蒸发分解”生成Li2CO3的化学方程式为______ 。
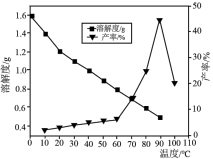
(4)已知不同温度下蒸发分解得到Li2CO3的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是______ ,制得的Li2CO3沉淀需要进行洗涤,具体操作为______ 。
(5)制备LiFePO4时同时生成CO2,其中FePO4与C6H12O6物质的量之比为24:1,该化学反应方程式为______ 。

已知:“日晒蒸发喷雾干燥”后固体含NaCl、LiCl、MgCl2•6H2O等。
(1)硼酸在水中的溶解度随温度的变化关系如图所示:

已知:H3BO3+H2O⇌[B(OH)4]-+H+。6.2gH3BO3最多与
(2)“水浸”后的溶液中溶质的主要成分是
(3)“蒸发分解”生成Li2CO3的化学方程式为
(4)已知不同温度下蒸发分解得到Li2CO3的产率及其溶解度随温度的变化关系如图所示。则“蒸发分解”的最佳温度是

(5)制备LiFePO4时同时生成CO2,其中FePO4与C6H12O6物质的量之比为24:1,该化学反应方程式为
您最近一年使用:0次
名校
解题方法
2 . 绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分,某化学兴趣小组利用工厂的废铁屑(主要成分为Fe,此外还含有少量Cu、Al,Al2O3和Fe2O3)制备磁性Fe3O4胶体粒子、绿矾和净水剂Na2FeO4的实验流程如图:
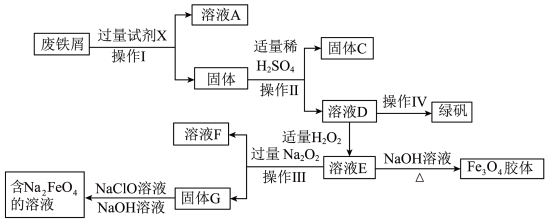
请回答下列问题:
(1)试剂X化学式为______ 。
(2)铁元素在元素周期表的位置为______ 。
(3)固体C化学名称为______ 。溶液D中加入 溶液,无红色产生,原因是
溶液,无红色产生,原因是______ (用离子方程式表示)。
(4)为得到绿矾晶体需要将溶液D倒入______ (填仪器名称)中进行浓缩,结晶。
(5)D中加入适量H2O2生成E的离子方程式______ 。若D中含3amolFe2+,则理论上加入______  H2O2可使溶液E中铁元素恰好转化为Fe3O4胶体。
H2O2可使溶液E中铁元素恰好转化为Fe3O4胶体。
(6)由固体G生成Na2FeO4的离子方程式为______ 。

请回答下列问题:
(1)试剂X化学式为
(2)铁元素在元素周期表的位置为
(3)固体C化学名称为
 溶液,无红色产生,原因是
溶液,无红色产生,原因是(4)为得到绿矾晶体需要将溶液D倒入
(5)D中加入适量H2O2生成E的离子方程式
 H2O2可使溶液E中铁元素恰好转化为Fe3O4胶体。
H2O2可使溶液E中铁元素恰好转化为Fe3O4胶体。(6)由固体G生成Na2FeO4的离子方程式为
您最近一年使用:0次
名校
解题方法
3 . 某化学兴趣小组在研究“铁及其化合物性质”时,发现向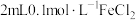 溶液中滴加2滴
溶液中滴加2滴 溶液,无明显现象,再滴加
溶液,无明显现象,再滴加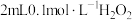 溶液溶液(
溶液溶液( 约为5),溶液先变红,后褪色,并有气泡产生。为了弄清楚产生这种异常现象的原因,他们进行了如下探究:
约为5),溶液先变红,后褪色,并有气泡产生。为了弄清楚产生这种异常现象的原因,他们进行了如下探究:
(1)溶液先变红的原因是_____ (用两个离子方程式表示)。
(2)同学们对溶液褪色的原因提出了不同的看法并进行实验:
I.甲同学认为是 被
被 还原。
还原。
取褪色后溶液,滴加 溶液,无明显现象,证明甲同学观点不正确。
溶液,无明显现象,证明甲同学观点不正确。
Ⅱ.乙同学认为是 被氧化。
被氧化。
取褪色后溶液,滴加 溶液,出现红色。
溶液,出现红色。
根据上述实验现象,同学们认为溶液褪色的原因可能有两种:
乙同学认为 被
被 氧化。
氧化。
丙同学认为_____ 。
为了探究溶液褪色的原因究竞是上述的哪一种,该兴趣小组进行了如下实验。
向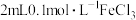 溶液中滴加2滴
溶液中滴加2滴 溶液,后通入
溶液,后通入 。发现溶液
。发现溶液_____ ,证明溶液褪色的原因不是乙同学认为的原因,而是丙同学认为的原因。
(3)该兴趣小组通过查阅资料,发现 可以被氧化成
可以被氧化成 和两种可直接排放到空气中的气体。
和两种可直接排放到空气中的气体。
设计实验方案验证褪色后的溶液中存在 :
:_____ 。
(4)写出上述实验中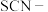 被氧化的离子方程式:
被氧化的离子方程式:_____ 。
(5)根据题目所给信息及实验现象推断物质还原性强弱:
_____ 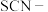 (填“>”或“<”),理由:
(填“>”或“<”),理由:_____ 。
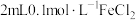 溶液中滴加2滴
溶液中滴加2滴 溶液,无明显现象,再滴加
溶液,无明显现象,再滴加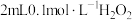 溶液溶液(
溶液溶液( 约为5),溶液先变红,后褪色,并有气泡产生。为了弄清楚产生这种异常现象的原因,他们进行了如下探究:
约为5),溶液先变红,后褪色,并有气泡产生。为了弄清楚产生这种异常现象的原因,他们进行了如下探究:(1)溶液先变红的原因是
(2)同学们对溶液褪色的原因提出了不同的看法并进行实验:
I.甲同学认为是
 被
被 还原。
还原。取褪色后溶液,滴加
 溶液,无明显现象,证明甲同学观点不正确。
溶液,无明显现象,证明甲同学观点不正确。Ⅱ.乙同学认为是
 被氧化。
被氧化。取褪色后溶液,滴加
 溶液,出现红色。
溶液,出现红色。根据上述实验现象,同学们认为溶液褪色的原因可能有两种:
乙同学认为
 被
被 氧化。
氧化。丙同学认为
为了探究溶液褪色的原因究竞是上述的哪一种,该兴趣小组进行了如下实验。
向
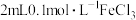 溶液中滴加2滴
溶液中滴加2滴 溶液,后通入
溶液,后通入 。发现溶液
。发现溶液(3)该兴趣小组通过查阅资料,发现
 可以被氧化成
可以被氧化成 和两种可直接排放到空气中的气体。
和两种可直接排放到空气中的气体。设计实验方案验证褪色后的溶液中存在
 :
:(4)写出上述实验中
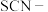 被氧化的离子方程式:
被氧化的离子方程式:(5)根据题目所给信息及实验现象推断物质还原性强弱:

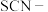 (填“>”或“<”),理由:
(填“>”或“<”),理由:
您最近一年使用:0次
名校
解题方法
4 . 某化学活动小组利用如下装置制备氯气并进行相关的性质验证。
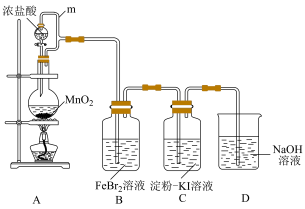
已知:
① 易溶于有机溶剂四氯化碳(
易溶于有机溶剂四氯化碳( ),且所得溶液呈橙红色;
),且所得溶液呈橙红色;
② 不溶于水,密度比水大。
不溶于水,密度比水大。
(1)装置A中发生反应的化学方程式为
(2)m的作用是
(3)装置C中的现象是
(4)装置D中发生反应的离子方程式为
(5)取少量反应后的B中溶液,向其中加入
 ,振荡后静置,若出现
,振荡后静置,若出现 被氧化。
被氧化。(6)另取少量反应后的B中溶液于试管中,向其中加入少量
 被氧化。
被氧化。(7)已知氧化性
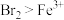 ,向200mL 0.1mol/L
,向200mL 0.1mol/L  溶液中通入标准状况下0.56L
溶液中通入标准状况下0.56L  时反应的离子方程式为
时反应的离子方程式为
您最近一年使用:0次
名校
5 . 某铜合金中 的质量分数为80%~90%,还含有
的质量分数为80%~90%,还含有 等。通常用间接碘量法测定其中
等。通常用间接碘量法测定其中 的含量,步骤如下:
的含量,步骤如下:
1.称取 样品,加入稀
样品,加入稀 和
和 溶液使其溶解,煮沸除去过量的
溶液使其溶解,煮沸除去过量的 ,冷却后过滤,将滤液配制成
,冷却后过滤,将滤液配制成 溶液;
溶液;
Ⅱ.取 滤液于锥形瓶中,加入
滤液于锥形瓶中,加入 溶液,将溶液中的
溶液,将溶液中的 转化为无色稳定的
转化为无色稳定的 ,充分反应后,加入过量的
,充分反应后,加入过量的 溶液,生成白色沉淀,加入淀粉做指示剂;
溶液,生成白色沉淀,加入淀粉做指示剂;
Ⅲ.向Ⅱ的锥形瓶中加入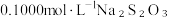 溶液滴定,发生反应:
溶液滴定,发生反应:
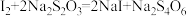 (无色);
(无色);
Ⅳ.平行测定四次,四次滴定实验消耗 标准溶液体积读数如下表所示:
标准溶液体积读数如下表所示:
V.计算铜的质量分数。
已知: 为白色难溶于水的难溶物。
为白色难溶于水的难溶物。
(1)盛装 溶液,应选择下图中的
溶液,应选择下图中的_____________ (填“a”或“b”)。

(2)滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):_______
检漏→蒸馏水洗涤→→→→→→开始滴定。
A.烘干 B.装入滴定液至零刻度以上 C.调整滴定液液面至零刻度或零刻度以下 D.用量筒量取一定体积的溶液倒入锥形瓶中 E.排除气泡 F.用滴定液润洗2至3次G记录起始读数
(3)Ⅱ中 和
和 反应生成
反应生成 白色沉淀和
白色沉淀和 。
。 和
和 反应的离子方程式是
反应的离子方程式是_____________ 。
(4)滴定终点的现象_____________ 。
(5)Ⅳ所消耗的 标准溶液平均体积为
标准溶液平均体积为_____________  ,V计算得到样品中
,V计算得到样品中 的质量分数为
的质量分数为_____________ (结果保留两位小数)。
(6)以下操作造成铜的含量偏高的是_____________ 。
A.滴定管未用标准溶液润洗
B.锥形瓶未用待测液润洗
C.盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失
D.盛装标准溶液的滴定管,滴定前仰视凹液面最低处,滴定后俯视读数
E.若滴定过程中刚出现颜色变化就停止滴定
F.步骤Ⅱ中未加入 溶液
溶液
 的质量分数为80%~90%,还含有
的质量分数为80%~90%,还含有 等。通常用间接碘量法测定其中
等。通常用间接碘量法测定其中 的含量,步骤如下:
的含量,步骤如下:1.称取
 样品,加入稀
样品,加入稀 和
和 溶液使其溶解,煮沸除去过量的
溶液使其溶解,煮沸除去过量的 ,冷却后过滤,将滤液配制成
,冷却后过滤,将滤液配制成 溶液;
溶液;Ⅱ.取
 滤液于锥形瓶中,加入
滤液于锥形瓶中,加入 溶液,将溶液中的
溶液,将溶液中的 转化为无色稳定的
转化为无色稳定的 ,充分反应后,加入过量的
,充分反应后,加入过量的 溶液,生成白色沉淀,加入淀粉做指示剂;
溶液,生成白色沉淀,加入淀粉做指示剂;Ⅲ.向Ⅱ的锥形瓶中加入
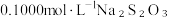 溶液滴定,发生反应:
溶液滴定,发生反应: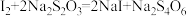 (无色);
(无色);Ⅳ.平行测定四次,四次滴定实验消耗
 标准溶液体积读数如下表所示:
标准溶液体积读数如下表所示:| 滴定次数 | 待测溶液的体积/ |  溶液的体积/ 溶液的体积/ | |
| 滴定前刻度 | 滴定后刻度 | ||
| 第一次 | 50.00 | 0.00 | 18.02 |
| 第二次 | 50.00 | 0.56 | 18.96 |
| 第三次 | 50.00 | 0.22 | 18.20 |
| 第四次 | 50.00 | 0.35 | 18.35 |
已知:
 为白色难溶于水的难溶物。
为白色难溶于水的难溶物。(1)盛装
 溶液,应选择下图中的
溶液,应选择下图中的
(2)滴定前,有关滴定管的正确操作为(选出正确操作并按序排列):
检漏→蒸馏水洗涤→→→→→→开始滴定。
A.烘干 B.装入滴定液至零刻度以上 C.调整滴定液液面至零刻度或零刻度以下 D.用量筒量取一定体积的溶液倒入锥形瓶中 E.排除气泡 F.用滴定液润洗2至3次G记录起始读数
(3)Ⅱ中
 和
和 反应生成
反应生成 白色沉淀和
白色沉淀和 。
。 和
和 反应的离子方程式是
反应的离子方程式是(4)滴定终点的现象
(5)Ⅳ所消耗的
 标准溶液平均体积为
标准溶液平均体积为 ,V计算得到样品中
,V计算得到样品中 的质量分数为
的质量分数为(6)以下操作造成铜的含量偏高的是
A.滴定管未用标准溶液润洗
B.锥形瓶未用待测液润洗
C.盛装标准溶液的滴定管,滴定前尖端有气泡,滴定后气泡消失
D.盛装标准溶液的滴定管,滴定前仰视凹液面最低处,滴定后俯视读数
E.若滴定过程中刚出现颜色变化就停止滴定
F.步骤Ⅱ中未加入
 溶液
溶液
您最近一年使用:0次
名校
解题方法
6 . 硫酸亚铁晶体( ,摩尔质量为278g/mol)是一种重要的无机化工原料,应用广泛。
,摩尔质量为278g/mol)是一种重要的无机化工原料,应用广泛。
Ⅰ.硫酸亚铁晶体的制备
用焙烧铁矿石产生的工业废渣(主要成分为 ,含有少量FeO、
,含有少量FeO、 )为原料生产硫酸亚铁晶体的工艺流程如下。
)为原料生产硫酸亚铁晶体的工艺流程如下。
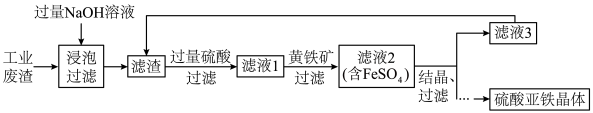
(1)加入过量NaOH溶液进行浸泡时发生反应的离子方程式为________ 。
(2)黄铁矿的主要成分是 ,其作用是
,其作用是________ 。是否可以使用Cu粉替代
________ (填“是”或“否”),解释原因________ 。
(3)为检验加入过量的黄铁矿是否充分起到作用,可以向滤液2中加入的试剂为________ (填化学式),通过________ 现象判断已经充分发挥作用。为灵敏检验滤液2中主要的金属阳离子,选择的试剂为________ (填化学式)。
(4)将滤液3(母液)循环加入滤渣中的目的是________ ,发生反应的离子方程式为________ 。
(5)配制250mL0.2mol/L的 溶液,需称量硫酸亚铁晶体质量为
溶液,需称量硫酸亚铁晶体质量为________ g,下列操作会导致所配溶液浓度偏高的是________ (填字母)。
A.所称取的晶体失去了部分结晶水 B.转移溶液前容量瓶中存在少量蒸馏水
C.定容前未洗涤烧杯和玻璃棒 D.定容时俯视刻度线
(6)产品纯度测定
已知:
取ag硫酸亚铁晶体产品,用稀 和新煮沸过的蒸馏水溶解后,立即滴入
和新煮沸过的蒸馏水溶解后,立即滴入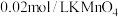 溶液至恰好完全反应,共消耗
溶液至恰好完全反应,共消耗 溶液bmL。
溶液bmL。 的质量分数是
的质量分数是________ 。
Ⅱ.用制备颜料铵铁蓝
(7) 用稀
用稀 溶解后,加入
溶解后,加入 溶液和
溶液和 溶液,加热,产生白色沉淀
溶液,加热,产生白色沉淀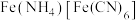 。酸性条件下再加入
。酸性条件下再加入 溶液,充分反应,得到铵铁蓝。补全离子方程式:
溶液,充分反应,得到铵铁蓝。补全离子方程式:_______
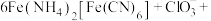 ________
________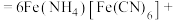 ________+________+________
________+________+________
 ,摩尔质量为278g/mol)是一种重要的无机化工原料,应用广泛。
,摩尔质量为278g/mol)是一种重要的无机化工原料,应用广泛。Ⅰ.硫酸亚铁晶体的制备
用焙烧铁矿石产生的工业废渣(主要成分为
 ,含有少量FeO、
,含有少量FeO、 )为原料生产硫酸亚铁晶体的工艺流程如下。
)为原料生产硫酸亚铁晶体的工艺流程如下。
(1)加入过量NaOH溶液进行浸泡时发生反应的离子方程式为
(2)黄铁矿的主要成分是
 ,其作用是
,其作用是
(3)为检验加入过量的黄铁矿是否充分起到作用,可以向滤液2中加入的试剂为
(4)将滤液3(母液)循环加入滤渣中的目的是
(5)配制250mL0.2mol/L的
 溶液,需称量硫酸亚铁晶体质量为
溶液,需称量硫酸亚铁晶体质量为A.所称取的晶体失去了部分结晶水 B.转移溶液前容量瓶中存在少量蒸馏水
C.定容前未洗涤烧杯和玻璃棒 D.定容时俯视刻度线
(6)产品纯度测定
已知:

取ag硫酸亚铁晶体产品,用稀
 和新煮沸过的蒸馏水溶解后,立即滴入
和新煮沸过的蒸馏水溶解后,立即滴入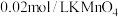 溶液至恰好完全反应,共消耗
溶液至恰好完全反应,共消耗 溶液bmL。
溶液bmL。 的质量分数是
的质量分数是Ⅱ.用制备颜料铵铁蓝
(7)
 用稀
用稀 溶解后,加入
溶解后,加入 溶液和
溶液和 溶液,加热,产生白色沉淀
溶液,加热,产生白色沉淀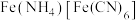 。酸性条件下再加入
。酸性条件下再加入 溶液,充分反应,得到铵铁蓝。补全离子方程式:
溶液,充分反应,得到铵铁蓝。补全离子方程式: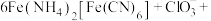 ________
________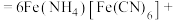 ________+________+________
________+________+________
您最近一年使用:0次
名校
解题方法
7 . 亚氯酸钠( )主要用于棉纺,造纸业的漂白,也用于食品消毒、水处理等。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下
)主要用于棉纺,造纸业的漂白,也用于食品消毒、水处理等。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下 )受热易分解;
)受热易分解;
②高浓度的 易爆炸。
易爆炸。
(1) 与
与 ,因有强氧化性而用作常用消毒剂,消毒时均被还原为
,因有强氧化性而用作常用消毒剂,消毒时均被还原为 ,则
,则 的消毒能力是等质量的
的消毒能力是等质量的 的
的_____ 倍(保留小数点后一位)。
(2)反应1涉及的反应方程式为: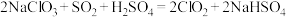 反应中生成的氧化产物与还原产物的个数比为
反应中生成的氧化产物与还原产物的个数比为_____ ;“反应1”需要鼓入空气,空气的作用是_____ 。
(3)“反应2”发生反应的化学方程式:_____ 。“反应2”需要控制反应温度不能过高,温度过高可能导致_____ ;_____ 。
(4)从“母液”中可回收的主要物质是_____ 。
(5)为探究 的氧化性,可以选择下列试剂
的氧化性,可以选择下列试剂_____ 。根据选择的试剂,描述能体现 氧化性的实验现象是
氧化性的实验现象是_____ 。
A.淀粉 溶液 B.酸性高锰酸钾溶液 C.氯水 D.
溶液 B.酸性高锰酸钾溶液 C.氯水 D. 溶液
溶液
(6)针对不同物品的消毒,亚氯酸钠溶液需要稀释到不同的浓度来使用。取含亚氯酸钠18.1g/L的消毒液lmL,加水稀释至100mL,则稀释后的溶液中亚氯酸钠的物质的量浓度为_____  。
。
 )主要用于棉纺,造纸业的漂白,也用于食品消毒、水处理等。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下
)主要用于棉纺,造纸业的漂白,也用于食品消毒、水处理等。以氯酸钠等为原料制备亚氯酸钠的工艺流程如下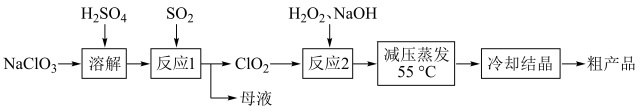
 )受热易分解;
)受热易分解;②高浓度的
 易爆炸。
易爆炸。(1)
 与
与 ,因有强氧化性而用作常用消毒剂,消毒时均被还原为
,因有强氧化性而用作常用消毒剂,消毒时均被还原为 ,则
,则 的消毒能力是等质量的
的消毒能力是等质量的 的
的(2)反应1涉及的反应方程式为:
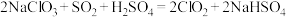 反应中生成的氧化产物与还原产物的个数比为
反应中生成的氧化产物与还原产物的个数比为(3)“反应2”发生反应的化学方程式:
(4)从“母液”中可回收的主要物质是
(5)为探究
 的氧化性,可以选择下列试剂
的氧化性,可以选择下列试剂 氧化性的实验现象是
氧化性的实验现象是A.淀粉
 溶液 B.酸性高锰酸钾溶液 C.氯水 D.
溶液 B.酸性高锰酸钾溶液 C.氯水 D. 溶液
溶液(6)针对不同物品的消毒,亚氯酸钠溶液需要稀释到不同的浓度来使用。取含亚氯酸钠18.1g/L的消毒液lmL,加水稀释至100mL,则稀释后的溶液中亚氯酸钠的物质的量浓度为
 。
。
您最近一年使用:0次
名校
解题方法
8 . 锗是当代高新技术产业配套的重要材料之一,从含锗烟尘中富集提取锗的一种工艺方法如下,其中烟尘中主要成分如表1所示:
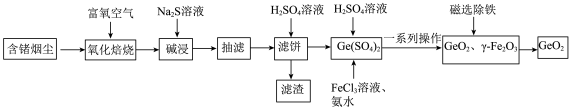
已知:i.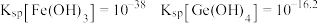
ii.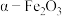 没有磁性,
没有磁性,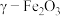 具有磁性。
具有磁性。
表1:含锗烟尘的主要成分
(1) 元素在周期表中的位置为:第
元素在周期表中的位置为:第___________ 周期第___________ 族。
(2)氧化焙烧时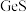 转化成
转化成 和一种污染性气体,该反应的化学方程式为:
和一种污染性气体,该反应的化学方程式为:___________ 。
(3)抽滤的优点___________ 和___________ 。
(4)滤渣成分为 、
、___________ 和___________ 。
(5)碱浸时生成 同时产生具有臭鸡蛋气味的气体,该过程的离子方程式为:
同时产生具有臭鸡蛋气味的气体,该过程的离子方程式为:_______ 。
(6)硫酸锗浸出液在调整酸碱度时发生氨水沉淀锗、铁的反应,则常温下,此过程需调节 的范围为
的范围为___________ 。
(7)多结砷化镓锗太阳能电池(图1)效率优异,工作原理如图2所示。
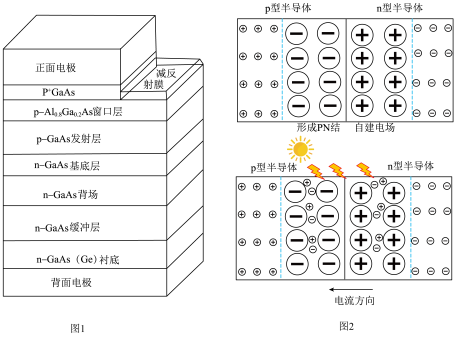
当光照射在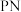 结上,
结上, 原子的电子跃迁,形成自由电子和空穴,在电场力影响下定向移动,外接回路即可形成电流。则外接回路时,空穴定向移动至
原子的电子跃迁,形成自由电子和空穴,在电场力影响下定向移动,外接回路即可形成电流。则外接回路时,空穴定向移动至___________ 方向(填“p型半导体”或“n型半导体”)。

已知:i.
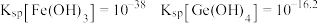
ii.
 没有磁性,
没有磁性,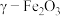 具有磁性。
具有磁性。表1:含锗烟尘的主要成分
| 成分 |  |  |  |  |  |  |  |
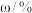 | 0.97 | 49.43 | 13.70 | 11.07 | 8.76 | 2.97 | 1.60 |
(1)
 元素在周期表中的位置为:第
元素在周期表中的位置为:第(2)氧化焙烧时
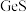 转化成
转化成 和一种污染性气体,该反应的化学方程式为:
和一种污染性气体,该反应的化学方程式为:(3)抽滤的优点
(4)滤渣成分为
 、
、(5)碱浸时生成
 同时产生具有臭鸡蛋气味的气体,该过程的离子方程式为:
同时产生具有臭鸡蛋气味的气体,该过程的离子方程式为:(6)硫酸锗浸出液在调整酸碱度时发生氨水沉淀锗、铁的反应,则常温下,此过程需调节
 的范围为
的范围为(7)多结砷化镓锗太阳能电池(图1)效率优异,工作原理如图2所示。

当光照射在
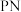 结上,
结上, 原子的电子跃迁,形成自由电子和空穴,在电场力影响下定向移动,外接回路即可形成电流。则外接回路时,空穴定向移动至
原子的电子跃迁,形成自由电子和空穴,在电场力影响下定向移动,外接回路即可形成电流。则外接回路时,空穴定向移动至
您最近一年使用:0次
名校
解题方法
9 . 钼( )及其化合物广泛地应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以
)及其化合物广泛地应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以 和
和 形式存在,从镍钼矿中分离钼,并得到
形式存在,从镍钼矿中分离钼,并得到 的一种工艺流程如下:
的一种工艺流程如下:
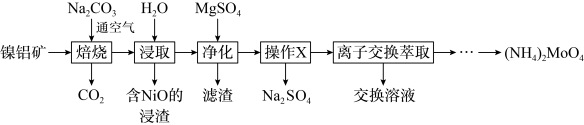
回答下列问题:
(1) 位于元素周期表第
位于元素周期表第_______ 周期第_______ 族。 中钼元素的化合价为
中钼元素的化合价为_______ 。
(2)“焙烧”中生成 的化学方程式为
的化学方程式为_______ 。
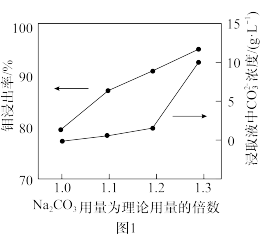
(3) 用量对钼浸出率和浸取液中
用量对钼浸出率和浸取液中 浓度的影响如图1所示,分析实际生产中选择
浓度的影响如图1所示,分析实际生产中选择 用量为理论用量1.2倍的原因:
用量为理论用量1.2倍的原因:_______ 。
(4) 的溶解度曲线如图2所示,为充分分离
的溶解度曲线如图2所示,为充分分离 ,工艺流程中的“操作
,工艺流程中的“操作 ”应为_______(填标号)。
”应为_______(填标号)。

(5)为充分利用资源,“离子交换萃取”步骤产生的交换溶液应返回“_______ ”步骤。
(6) 分解可得
分解可得 。高温下,用铝粉还原
。高温下,用铝粉还原 得到金属钼的化学方程式为
得到金属钼的化学方程式为_______ 。
 )及其化合物广泛地应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以
)及其化合物广泛地应用于医疗卫生、国防等领域。某镍钼矿中的镍和钼以 和
和 形式存在,从镍钼矿中分离钼,并得到
形式存在,从镍钼矿中分离钼,并得到 的一种工艺流程如下:
的一种工艺流程如下:
回答下列问题:
(1)
 位于元素周期表第
位于元素周期表第 中钼元素的化合价为
中钼元素的化合价为(2)“焙烧”中生成
 的化学方程式为
的化学方程式为(3)
 用量对钼浸出率和浸取液中
用量对钼浸出率和浸取液中 浓度的影响如图1所示,分析实际生产中选择
浓度的影响如图1所示,分析实际生产中选择 用量为理论用量1.2倍的原因:
用量为理论用量1.2倍的原因:
(4)
 的溶解度曲线如图2所示,为充分分离
的溶解度曲线如图2所示,为充分分离 ,工艺流程中的“操作
,工艺流程中的“操作 ”应为_______(填标号)。
”应为_______(填标号)。
| A.蒸发结晶 | B.低温结晶 | C.蒸馏 | D.萃取 |
(5)为充分利用资源,“离子交换萃取”步骤产生的交换溶液应返回“
(6)
 分解可得
分解可得 。高温下,用铝粉还原
。高温下,用铝粉还原 得到金属钼的化学方程式为
得到金属钼的化学方程式为
您最近一年使用:0次
2024-01-22更新
|
1101次组卷
|
7卷引用:黑龙江省大庆市大庆中学2023-2024学年高三下学期开学化学试题
黑龙江省大庆市大庆中学2023-2024学年高三下学期开学化学试题2024年1月安徽普通高等学校招生考试适应性测试化学试题(已下线)T16-工业流程题(已下线)2024年1月“九省联考”安徽真题完全解读与考后提升(已下线)热点23 化学工艺流程综合题(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)江西省宜春市丰城市第九中学2023-2024学年高三(复读班)上学期期末考试化学试题
名校
解题方法
10 . 工业上以黄铁矿(主要成分FeS2)为原料生产硫酸,并将产出的炉渣和尾气进行资源综合利用,减轻对环境的污染,其中一种流程如图所示:
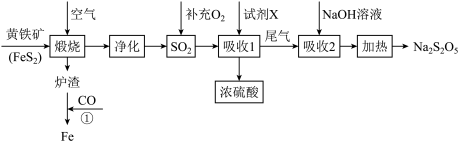
已知: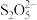 与
与 反应生成沉淀,与盐酸反应生成SO2。
反应生成沉淀,与盐酸反应生成SO2。
回答下列问题:
(1)为了加快黄铁矿煅烧的速率,可采取的措施为___________ (写出1种即可)。
(2)煅烧过程中主要发生的反应为 ,将该反应生成的SO2通入酸性高锰酸钾溶液中,可观察到酸性高锰酸钾溶液褪色,体现了SO2的
,将该反应生成的SO2通入酸性高锰酸钾溶液中,可观察到酸性高锰酸钾溶液褪色,体现了SO2的___________ 性,发生该反应的离子方程式为___________ 。
(3)“吸收1”中试剂X是___________ 。
(4)“吸收2”后得到NaHSO3溶液,加热后得Na2S2O5和水,写出加热反应的化学方程式___________ 。
(5)Na2S2O5在保存过程中易变质生成Na2SO4.欲检验Na2S2O5是否变质的具体实验操作方法为:___________ 。
(6)某企业利用下列流程综合处理工厂排放的含SO2的烟气,以减少其对环境造成的污染。该流程中可循环利用的物质为___________ (填化学式)。图中的氨气来源于工业生产,而实验室制取NH3的方法与其不同,写出实验室制取氨气的化学方程式___________ 。


已知:
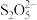 与
与 反应生成沉淀,与盐酸反应生成SO2。
反应生成沉淀,与盐酸反应生成SO2。回答下列问题:
(1)为了加快黄铁矿煅烧的速率,可采取的措施为
(2)煅烧过程中主要发生的反应为
 ,将该反应生成的SO2通入酸性高锰酸钾溶液中,可观察到酸性高锰酸钾溶液褪色,体现了SO2的
,将该反应生成的SO2通入酸性高锰酸钾溶液中,可观察到酸性高锰酸钾溶液褪色,体现了SO2的(3)“吸收1”中试剂X是
(4)“吸收2”后得到NaHSO3溶液,加热后得Na2S2O5和水,写出加热反应的化学方程式
(5)Na2S2O5在保存过程中易变质生成Na2SO4.欲检验Na2S2O5是否变质的具体实验操作方法为:
(6)某企业利用下列流程综合处理工厂排放的含SO2的烟气,以减少其对环境造成的污染。该流程中可循环利用的物质为

您最近一年使用:0次



