解题方法
1 . 高铁酸钠(Na2FeO4)是一种优良的多功能水处理剂,具有很强的氧化性,工业上可采取干法和湿法制备Na2FeO4。回答下列问题:
(1)干法制备Na2FeO4,反应原理为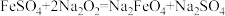 。
。
①Na2FeO4属于______________ (填“盐”“碱”或“氧化物”)。
②写出Na2O2的电子式:_______________ 。
③氧化性:Na2O2______________ (填“<”或“>”)Na2FeO4,每消耗1 mol FeSO4转移______________ mole-。
(2)湿法制备Na2FeO4,将Fe(OH)3固体加入含有一定浓度的NaClO和NaOH的混合溶液中,搅拌一段时间后,可得到Na2FeO4和NaCl。
①实验需要480mL0.2mol·L-1NaOH溶液,如图所示的仪器中配制溶液肯定不需要的是_______________ (填字母,下同)。_______________ 。
A.使用容量瓶之前应检查它是否漏水
B.容量瓶用蒸馏水洗净后,无需用待配溶液润洗
C.定容时,将蒸馏水小心倒入容量瓶中直至与刻度线齐平
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中定容
③在配制NaOH溶液时,若NaOH固体溶解后立即移入容量瓶→洗烧杯→洗涤液移入容量瓶→定容,则所得溶液浓度_______________ (填“>”“<”或“=”)0.2mol·L-1。
④写出湿法制备Na2FeO4的化学方程式:_______________ 。
(3)如果以单位质量的氧化剂所得到的电子数来表示消毒的效率,Na2FeO4的消毒效率为______________ (用分数表示, →Fe3+)。
→Fe3+)。
(1)干法制备Na2FeO4,反应原理为
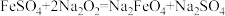 。
。①Na2FeO4属于
②写出Na2O2的电子式:
③氧化性:Na2O2
(2)湿法制备Na2FeO4,将Fe(OH)3固体加入含有一定浓度的NaClO和NaOH的混合溶液中,搅拌一段时间后,可得到Na2FeO4和NaCl。
①实验需要480mL0.2mol·L-1NaOH溶液,如图所示的仪器中配制溶液肯定不需要的是
A.使用容量瓶之前应检查它是否漏水
B.容量瓶用蒸馏水洗净后,无需用待配溶液润洗
C.定容时,将蒸馏水小心倒入容量瓶中直至与刻度线齐平
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中定容
③在配制NaOH溶液时,若NaOH固体溶解后立即移入容量瓶→洗烧杯→洗涤液移入容量瓶→定容,则所得溶液浓度
④写出湿法制备Na2FeO4的化学方程式:
(3)如果以单位质量的氧化剂所得到的电子数来表示消毒的效率,Na2FeO4的消毒效率为
 →Fe3+)。
→Fe3+)。
您最近一年使用:0次
名校
2 . 宏微结合是研究化学的重要方法,从微观的角度了解物质及其变化,有助于更好地认识物质的组成和变化的本质。
I.
(1)下表为部分元素的原子结构示意图:
①表中硫元素的核电荷数x=___________ 。
②R3+离子与氖原子的核外电子排布相同,则R元素为___________ 元素(填元素名称)。
③一个水分子中所含电子总数为___________ 。
④硫元素与氧元素的化学性质相似的原因是___________ 。
(2)甲和乙在一定条件下反应生成丙和丁,反应的微观模型如图所示。

①该反应的生成物中,属于氧化物的是___________ (填化学式)
②每个甲分子是由___________ 构成的。
③参加反应的甲和乙分子个数比为___________ 。
(3)如图是稀硫酸与甲溶液发生复分解反应的微观模型,请写出一种符合图示的a微粒的符号:___________ 。

II.人们在实验研究中总结出常见金属的活动性顺序:

(4)请在表中 内填写对应的元素符号
内填写对应的元素符号___________ 。
(5)Mg、Sn、Pb、Cu、Ag五种金属,能与稀盐酸(或稀硫酸)发生置换反应的金属有___________ 种;写出其中最活泼的金属与稀盐酸反应的化学方程式___________ 。
I.
(1)下表为部分元素的原子结构示意图:
| 元素名称 | 氢 | 氧 | 氟 | 氖 | 钠 | 硫 | 氯 |
| 原子结构示意图 | 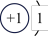 |  | 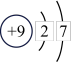 | 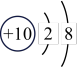 |  | 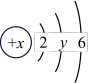 |  |
②R3+离子与氖原子的核外电子排布相同,则R元素为
③一个水分子中所含电子总数为
④硫元素与氧元素的化学性质相似的原因是
(2)甲和乙在一定条件下反应生成丙和丁,反应的微观模型如图所示。

①该反应的生成物中,属于氧化物的是
②每个甲分子是由
③参加反应的甲和乙分子个数比为
(3)如图是稀硫酸与甲溶液发生复分解反应的微观模型,请写出一种符合图示的a微粒的符号:

II.人们在实验研究中总结出常见金属的活动性顺序:

(4)请在表中
 内填写对应的元素符号
内填写对应的元素符号(5)Mg、Sn、Pb、Cu、Ag五种金属,能与稀盐酸(或稀硫酸)发生置换反应的金属有
您最近一年使用:0次
名校
3 . 完成以下离子方程式:
(1)向酸性高锰酸钾溶液中加入草酸溶液_______ 。
(2)向硫酸铝铵溶液中加入过量的氢氧化钡溶液_______ 。
(3)用亚硫酸钠溶液吸收少量氯气_______ 。
(4)泡沫灭火器的工作原理_______ 。
(5)向氯化镁溶液中滴加碳酸钠溶液,生成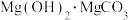
_______ 。
(1)向酸性高锰酸钾溶液中加入草酸溶液
(2)向硫酸铝铵溶液中加入过量的氢氧化钡溶液
(3)用亚硫酸钠溶液吸收少量氯气
(4)泡沫灭火器的工作原理
(5)向氯化镁溶液中滴加碳酸钠溶液,生成
您最近一年使用:0次
2023-09-22更新
|
121次组卷
|
2卷引用:黑龙江省哈尔滨师范大学附属中学2022-2023学年高三下学期开学考试化学试题
名校
解题方法
4 . 回答下列问题:
Ⅰ.双氧水和“84”消毒液是生活中常用的两种消毒剂。
(1)某同学设计如下实验研究 的性质,能证明
的性质,能证明 有还原性的实验是
有还原性的实验是___________ (填序号),可作为证据的实验现象是___________ (填字母序号)。
(2)某届奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种原因可能是 与
与 反应产生
反应产生 促进藻类快速生长。该反应说明氧化性:NaClO
促进藻类快速生长。该反应说明氧化性:NaClO___________  (填“>”或“<”);当有
(填“>”或“<”);当有 生成时,转移电子的物质的量为
生成时,转移电子的物质的量为___________ mol。
Ⅱ.锑(Sb)被广泛用于生产各种阻燃剂、合金、陶瓷、半导体元件、医药用品等。以辉锑矿为原料制备金属锑的一种工艺流程如下。已知:辉锑矿的主要成分为,还含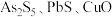 和
和 等;浸出液主要含盐酸和
等;浸出液主要含盐酸和 ,还含
,还含 和
和 等。
等。

(3)“酸浸”过程中 和
和 反应有S生成,该反应的还原产物是
反应有S生成,该反应的还原产物是___________ (填化学式)。
(4)写出“还原”反应的化学方程式___________ 。
Ⅰ.双氧水和“84”消毒液是生活中常用的两种消毒剂。
(1)某同学设计如下实验研究
 的性质,能证明
的性质,能证明 有还原性的实验是
有还原性的实验是| 序号 | 实验 | 实验现象 |
| 1 | 向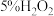 溶液中滴加酸性 溶液中滴加酸性 溶液 溶液 | a.溶液紫色褪去; b.有大量气泡产生 |
| 2 | 向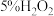 溶液中滴加淀粉—碘化钾溶液 溶液中滴加淀粉—碘化钾溶液 | c.溶液变蓝 |
 与
与 反应产生
反应产生 促进藻类快速生长。该反应说明氧化性:NaClO
促进藻类快速生长。该反应说明氧化性:NaClO (填“>”或“<”);当有
(填“>”或“<”);当有 生成时,转移电子的物质的量为
生成时,转移电子的物质的量为Ⅱ.锑(Sb)被广泛用于生产各种阻燃剂、合金、陶瓷、半导体元件、医药用品等。以辉锑矿为原料制备金属锑的一种工艺流程如下。已知:辉锑矿的主要成分为,还含
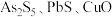 和
和 等;浸出液主要含盐酸和
等;浸出液主要含盐酸和 ,还含
,还含 和
和 等。
等。
(3)“酸浸”过程中
 和
和 反应有S生成,该反应的还原产物是
反应有S生成,该反应的还原产物是(4)写出“还原”反应的化学方程式
您最近一年使用:0次
2023-09-10更新
|
171次组卷
|
2卷引用:黑龙江省鸡西实验学校2023-2024学年高三上学期开学化学试题
5 . 二氧化氯( )是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。回答下列问题:
)是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。回答下列问题:
(1) 的制备:制备
的制备:制备 的常用方法有两种,分别为
的常用方法有两种,分别为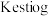 法、
法、 与
与 反应法。
反应法。
①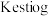 法制备
法制备 的原理为
的原理为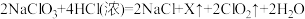 ,X的化学式为
,X的化学式为___________ ,将 通入
通入 溶液中,有红褐色沉淀生成,溶液中的主要阴离子为
溶液中,有红褐色沉淀生成,溶液中的主要阴离子为 、
、 ,若消耗
,若消耗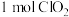 ,则被氧化的
,则被氧化的 为
为___________  。
。
② 与
与 反应法制备
反应法制备 ,生成物只有两种,参加反应的
,生成物只有两种,参加反应的 与
与 物质的量之比为
物质的量之比为___________ ,与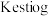 法相比,
法相比, 与
与 反应法的优点是
反应法的优点是___________ (填一条)。
(2) 的用途:除毒、除异味。
的用途:除毒、除异味。
① 可以将剧毒的氰化物氧化成
可以将剧毒的氰化物氧化成 和
和 ,离子方程式为
,离子方程式为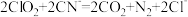 ,
, 属于
属于___________ (填“酸”“碱”或“两”)性氧化物,每转移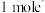 ,生成
,生成___________ L(标准状况下) 。
。
② 能把水溶液中有异味的
能把水溶液中有异味的 氧化成四价锰,使之形成不溶于水的
氧化成四价锰,使之形成不溶于水的 ,该反应的离子方程式为
,该反应的离子方程式为___________ 。
 )是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。回答下列问题:
)是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。回答下列问题:(1)
 的制备:制备
的制备:制备 的常用方法有两种,分别为
的常用方法有两种,分别为 法、
法、 与
与 反应法。
反应法。①
 法制备
法制备 的原理为
的原理为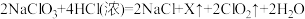 ,X的化学式为
,X的化学式为 通入
通入 溶液中,有红褐色沉淀生成,溶液中的主要阴离子为
溶液中,有红褐色沉淀生成,溶液中的主要阴离子为 、
、 ,若消耗
,若消耗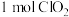 ,则被氧化的
,则被氧化的 为
为 。
。②
 与
与 反应法制备
反应法制备 ,生成物只有两种,参加反应的
,生成物只有两种,参加反应的 与
与 物质的量之比为
物质的量之比为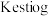 法相比,
法相比, 与
与 反应法的优点是
反应法的优点是(2)
 的用途:除毒、除异味。
的用途:除毒、除异味。①
 可以将剧毒的氰化物氧化成
可以将剧毒的氰化物氧化成 和
和 ,离子方程式为
,离子方程式为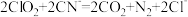 ,
, 属于
属于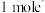 ,生成
,生成 。
。②
 能把水溶液中有异味的
能把水溶液中有异味的 氧化成四价锰,使之形成不溶于水的
氧化成四价锰,使之形成不溶于水的 ,该反应的离子方程式为
,该反应的离子方程式为
您最近一年使用:0次
2023-02-07更新
|
367次组卷
|
2卷引用:黑龙江省黑河市第九中学2023-2024学年高三上学期摸底考试化学试题
6 . 依据物质类别和元素价态,可以对物质的性质进行解释和预测。
Ⅰ、有二种物质: 、
、 、
、
(1)其中氧元素的化合价均为_______ 价。
(2)从氧化剂和还原剂的角度,分析反应中的 作用。请完成下表内容。
作用。请完成下表内容。
(3)由 、
、 的名称可推知
的名称可推知 的名称为
的名称为_______ 。
(4)已知 可与
可与 反应产生
反应产生 ,请写出
,请写出 与水反应的化学方程式
与水反应的化学方程式_______ ,由此可推测 也可做供氧剂。
也可做供氧剂。
Ⅱ、亚硝酸钠( )外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。误食
)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。误食 会导致血红蛋白中的
会导致血红蛋白中的 转化为
转化为 而中毒。
而中毒。
(5)误食 后可服用维生素C解毒。下列分析错误的是_______(填序号)
后可服用维生素C解毒。下列分析错误的是_______(填序号)
(6)亚硝酸钠在320℃时能分解产生氧化钠固体、一氧化氮和一种常见的助燃性气体。请填写并配平该反应的化学方程式_______ 。
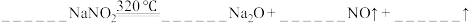
Ⅰ、有二种物质:
 、
、 、
、
(1)其中氧元素的化合价均为
(2)从氧化剂和还原剂的角度,分析反应中的
 作用。请完成下表内容。
作用。请完成下表内容。| 序号 | 化学反应方程式 | 作用 |
| ① | 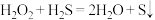 | |
| ② |  | |
| ③ | 既作氧化剂,又作还原剂 |
 、
、 的名称可推知
的名称可推知 的名称为
的名称为(4)已知
 可与
可与 反应产生
反应产生 ,请写出
,请写出 与水反应的化学方程式
与水反应的化学方程式 也可做供氧剂。
也可做供氧剂。Ⅱ、亚硝酸钠(
 )外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。误食
)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。误食 会导致血红蛋白中的
会导致血红蛋白中的 转化为
转化为 而中毒。
而中毒。(5)误食
 后可服用维生素C解毒。下列分析错误的是_______(填序号)
后可服用维生素C解毒。下列分析错误的是_______(填序号)A. 被还原 被还原 | B.维生素C具有还原性 |
C.还原性:维生素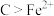 | D. 是还原剂 是还原剂 |
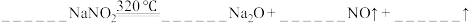
您最近一年使用:0次
2022-11-24更新
|
160次组卷
|
2卷引用:黑龙江省大庆市大庆中学2023-2024学年高一下学期开学化学试题
7 . 请回答下列问题:
(1)实验室常用KMnO4和浓盐酸反应制取Cl2,反应的化学方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。被还原的元素是_______ ,还原剂是_______ ,氧化产物是_______ 。
(2)在NaIO3溶液中滴加少量NaHSO3溶液,发生下列反应。配平反应方程式,并用双线桥标出电子转移的方向和数目_______ 。
□NaIO3+□NaHSO3→□I2+□Na2SO4+□H2SO4+□H2O
(1)实验室常用KMnO4和浓盐酸反应制取Cl2,反应的化学方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。被还原的元素是
(2)在NaIO3溶液中滴加少量NaHSO3溶液,发生下列反应。配平反应方程式,并用双线桥标出电子转移的方向和数目
□NaIO3+□NaHSO3→□I2+□Na2SO4+□H2SO4+□H2O
您最近一年使用:0次
名校
解题方法
8 . 镍(Ni)及其化合物广泛应用于生产电池、电镀和催化剂等领域。
(1) 晶体是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有
晶体是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有 、
、 、
、 等)为原料获得。操作步骤如图:
等)为原料获得。操作步骤如图:

①加入 的目的是
的目的是___________ 。[已知: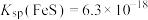 ,
, ,
, ,
, ]
]
②可用氯酸钠 代替
代替 ,写出氯酸钠与滤液Ⅱ反应的离子方程式为
,写出氯酸钠与滤液Ⅱ反应的离子方程式为___________ 。
③向滤液II中加入NaOH调节pH在一范围内生成氢氧化铁沉淀。已知常温下 的
的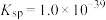 ,若要使溶液中
,若要使溶液中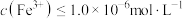 ,则应该控制溶液pH范围不小于
,则应该控制溶液pH范围不小于_____ 。
(2)双膜三室电解法处理含镍废水并回收金属镍的原理如下图所示:
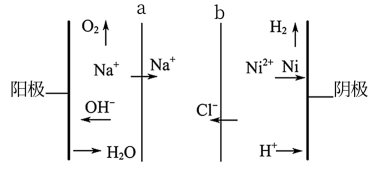
判断a是____ (填“阳膜”或“阴膜”);电解过程中,需要控制溶液pH为4左右,原因是____ 。
(1)
 晶体是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有
晶体是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有 、
、 、
、 等)为原料获得。操作步骤如图:
等)为原料获得。操作步骤如图:
①加入
 的目的是
的目的是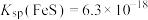 ,
, ,
, ,
, ]
]②可用氯酸钠
 代替
代替 ,写出氯酸钠与滤液Ⅱ反应的离子方程式为
,写出氯酸钠与滤液Ⅱ反应的离子方程式为③向滤液II中加入NaOH调节pH在一范围内生成氢氧化铁沉淀。已知常温下
 的
的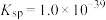 ,若要使溶液中
,若要使溶液中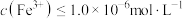 ,则应该控制溶液pH范围不小于
,则应该控制溶液pH范围不小于(2)双膜三室电解法处理含镍废水并回收金属镍的原理如下图所示:

判断a是
您最近一年使用:0次
2022-01-15更新
|
447次组卷
|
2卷引用:黑龙江省齐齐哈尔市第八中学2021-2022学年高二下学期开学考试化学试题
9 . 过氧化钙(CaO2·8H2O)是一种在水产养殖中广泛使用的供氧剂。
(1)Ca(OH)2悬浊液与H2O2溶液反应可制备CaO2·8H2O。Ca(OH)2+H2O2+6H2O=CaO2·8H2O;反应时通常加入过量Ca(OH)2,其目的_______ ,
(2)向池塘水中加入一定量CaO2·8H2O后,池塘水中浓度增加的离子有_______(填序号)。
(3)水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置,加入适量稀H2SO4,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系为:
O2 MnO(OH)2
MnO(OH)2 I2
I2 S4O
S4O
写出O2将Mn2+氧化成MnO(OH)2的离子方程式:_______
(4)利用电解后的溶液制备重铬酸钠晶体(Na2Cr2O7·2H2O)的流程如图。已知:重铬酸钠晶体(Na2Cr2O7·2H2O)俗称红矾钠,桔红色晶体,略有吸湿性,易溶于水,不溶于乙醇;Na2Cr2O7·2H2O的式量为298。
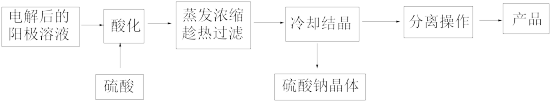
①流程中分离操作包括_______ 、洗涤、干燥,其中洗涤时最好选用_______ (填试剂名称)。
②准确称取上述流程中的产品3.1700 g配成250 mL溶液,取出25.00 mL放于锥形瓶中,加入10 mL 2 mol·L-1 H2SO4溶液和足量碘化钾溶液,放于暗处5 min;然后加入100 mL水和2-3滴淀粉指示剂;最后根据I2+2S2O =2I—+S4O
=2I—+S4O 用0.1000 mol·L-1 Na2S2O3标准溶液滴定,判断达到滴定终点的依据是:
用0.1000 mol·L-1 Na2S2O3标准溶液滴定,判断达到滴定终点的依据是:_______ 。若实验中平均用去Na2S2O3标准溶液60.00 mL,则所得产品中的重铬酸钠晶体的纯度为_______ 。
(1)Ca(OH)2悬浊液与H2O2溶液反应可制备CaO2·8H2O。Ca(OH)2+H2O2+6H2O=CaO2·8H2O;反应时通常加入过量Ca(OH)2,其目的
(2)向池塘水中加入一定量CaO2·8H2O后,池塘水中浓度增加的离子有_______(填序号)。
| A.Ca2+ | B.H+ | C.CO | D.OH— |
O2
 MnO(OH)2
MnO(OH)2 I2
I2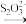 S4O
S4O
写出O2将Mn2+氧化成MnO(OH)2的离子方程式:
(4)利用电解后的溶液制备重铬酸钠晶体(Na2Cr2O7·2H2O)的流程如图。已知:重铬酸钠晶体(Na2Cr2O7·2H2O)俗称红矾钠,桔红色晶体,略有吸湿性,易溶于水,不溶于乙醇;Na2Cr2O7·2H2O的式量为298。

①流程中分离操作包括
②准确称取上述流程中的产品3.1700 g配成250 mL溶液,取出25.00 mL放于锥形瓶中,加入10 mL 2 mol·L-1 H2SO4溶液和足量碘化钾溶液,放于暗处5 min;然后加入100 mL水和2-3滴淀粉指示剂;最后根据I2+2S2O
 =2I—+S4O
=2I—+S4O 用0.1000 mol·L-1 Na2S2O3标准溶液滴定,判断达到滴定终点的依据是:
用0.1000 mol·L-1 Na2S2O3标准溶液滴定,判断达到滴定终点的依据是:
您最近一年使用:0次
名校
解题方法
10 . 按要求书写方程式
(1) 使酸性
使酸性 溶液褪色(离子方程式)
溶液褪色(离子方程式)_______ ;
(2)硝酸保存在棕色试剂瓶的原因(化学方程式)_______ ;
(3) 溶液与稀硫酸的反应(离子方程式)
溶液与稀硫酸的反应(离子方程式)_______ ;
(4)已知 的燃烧热是
的燃烧热是 ,表示
,表示 燃烧热的热化学方程式
燃烧热的热化学方程式_______ ;
(5)铅酸蓄电池充电时的阴极反应式_______ 。
(1)
 使酸性
使酸性 溶液褪色(离子方程式)
溶液褪色(离子方程式)(2)硝酸保存在棕色试剂瓶的原因(化学方程式)
(3)
 溶液与稀硫酸的反应(离子方程式)
溶液与稀硫酸的反应(离子方程式)(4)已知
 的燃烧热是
的燃烧热是 ,表示
,表示 燃烧热的热化学方程式
燃烧热的热化学方程式(5)铅酸蓄电池充电时的阴极反应式
您最近一年使用:0次



