解题方法
1 . 高铁酸钠(Na2FeO4)是一种优良的多功能水处理剂,具有很强的氧化性,工业上可采取干法和湿法制备Na2FeO4。回答下列问题:
(1)干法制备Na2FeO4,反应原理为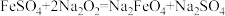 。
。
①Na2FeO4属于______________ (填“盐”“碱”或“氧化物”)。
②写出Na2O2的电子式:_______________ 。
③氧化性:Na2O2______________ (填“<”或“>”)Na2FeO4,每消耗1 mol FeSO4转移______________ mole-。
(2)湿法制备Na2FeO4,将Fe(OH)3固体加入含有一定浓度的NaClO和NaOH的混合溶液中,搅拌一段时间后,可得到Na2FeO4和NaCl。
①实验需要480mL0.2mol·L-1NaOH溶液,如图所示的仪器中配制溶液肯定不需要的是_______________ (填字母,下同)。_______________ 。
A.使用容量瓶之前应检查它是否漏水
B.容量瓶用蒸馏水洗净后,无需用待配溶液润洗
C.定容时,将蒸馏水小心倒入容量瓶中直至与刻度线齐平
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中定容
③在配制NaOH溶液时,若NaOH固体溶解后立即移入容量瓶→洗烧杯→洗涤液移入容量瓶→定容,则所得溶液浓度_______________ (填“>”“<”或“=”)0.2mol·L-1。
④写出湿法制备Na2FeO4的化学方程式:_______________ 。
(3)如果以单位质量的氧化剂所得到的电子数来表示消毒的效率,Na2FeO4的消毒效率为______________ (用分数表示, →Fe3+)。
→Fe3+)。
(1)干法制备Na2FeO4,反应原理为
 。
。①Na2FeO4属于
②写出Na2O2的电子式:
③氧化性:Na2O2
(2)湿法制备Na2FeO4,将Fe(OH)3固体加入含有一定浓度的NaClO和NaOH的混合溶液中,搅拌一段时间后,可得到Na2FeO4和NaCl。
①实验需要480mL0.2mol·L-1NaOH溶液,如图所示的仪器中配制溶液肯定不需要的是
A.使用容量瓶之前应检查它是否漏水
B.容量瓶用蒸馏水洗净后,无需用待配溶液润洗
C.定容时,将蒸馏水小心倒入容量瓶中直至与刻度线齐平
D.配制溶液时,如果试样是液体,用量筒量取试样后直接倒入容量瓶中定容
③在配制NaOH溶液时,若NaOH固体溶解后立即移入容量瓶→洗烧杯→洗涤液移入容量瓶→定容,则所得溶液浓度
④写出湿法制备Na2FeO4的化学方程式:
(3)如果以单位质量的氧化剂所得到的电子数来表示消毒的效率,Na2FeO4的消毒效率为
 →Fe3+)。
→Fe3+)。
您最近半年使用:0次
名校
2 . 碘元素在海带中主要以I-的形式存在,加碘食盐中主要以 的形式存在,几种微粒之间的转化关系如图所示。
的形式存在,几种微粒之间的转化关系如图所示。
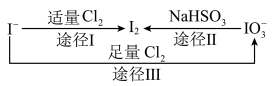
(1)写出相关反应离子方程式:
途径Ⅰ:__________________ ;
途径Ⅱ:__________________ ;
途径Ⅲ:__________________ 。
(2)溶液中I-与一定量Cl2反应,生成物质的量相同的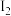 和
和 ,则反应的总离子方程式为
,则反应的总离子方程式为____________ 。
 的形式存在,几种微粒之间的转化关系如图所示。
的形式存在,几种微粒之间的转化关系如图所示。
(1)写出相关反应离子方程式:
途径Ⅰ:
途径Ⅱ:
途径Ⅲ:
(2)溶液中I-与一定量Cl2反应,生成物质的量相同的
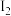 和
和 ,则反应的总离子方程式为
,则反应的总离子方程式为
您最近半年使用:0次
23-24高一下·吉林·开学考试
名校
3 . Ⅰ.氯气及其化合物在自来水的消毒,农药的生产、药物的合成等领域都有着重要的应用。
(1)黄色气体 可用于污水杀菌和饮用水净化。
可用于污水杀菌和饮用水净化。
① 与
与 在强酸性溶液中反应可制得
在强酸性溶液中反应可制得 ,
, 被氧化为
被氧化为 ,该反应的离子方程式为
,该反应的离子方程式为________ 。
② 可将废水中的
可将废水中的 氧化为
氧化为 而除去,本身被还原为
而除去,本身被还原为 ,该反应过程中氧化剂与还原剂的物质的量之比为
,该反应过程中氧化剂与还原剂的物质的量之比为________ 。
Ⅱ.某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(该反应为放热反应),回答下列问题:
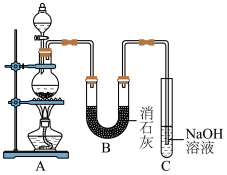
(2)C装置的作用是________ 。
(3)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成 ,为避免此副反应的发生,可采取的措施是
,为避免此副反应的发生,可采取的措施是________ 。
②另一个副反应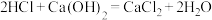 ,为避免此副反应的发生,装置的改进措施为
,为避免此副反应的发生,装置的改进措施为________ 。
(1)黄色气体
 可用于污水杀菌和饮用水净化。
可用于污水杀菌和饮用水净化。①
 与
与 在强酸性溶液中反应可制得
在强酸性溶液中反应可制得 ,
, 被氧化为
被氧化为 ,该反应的离子方程式为
,该反应的离子方程式为②
 可将废水中的
可将废水中的 氧化为
氧化为 而除去,本身被还原为
而除去,本身被还原为 ,该反应过程中氧化剂与还原剂的物质的量之比为
,该反应过程中氧化剂与还原剂的物质的量之比为Ⅱ.某学生设计如图所示的实验装置,利用氯气与潮湿的消石灰反应制取少量漂白粉(该反应为放热反应),回答下列问题:

(2)C装置的作用是
(3)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应。
①温度较高时氯气与消石灰反应生成
 ,为避免此副反应的发生,可采取的措施是
,为避免此副反应的发生,可采取的措施是②另一个副反应
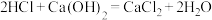 ,为避免此副反应的发生,装置的改进措施为
,为避免此副反应的发生,装置的改进措施为
您最近半年使用:0次
23-24高一下·吉林·开学考试
名校
4 . 按要求完成下列问题:
(1)写出下列反应的化学方程式,是离子反应的只需写出离子方程式:
①实验室制备氢氧化铝________ 。
②实验室制备氯气________ 。
(2)配平下列化学方程式
①_____
________ ________
________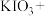 ________
________ ________
________ ________
________ ________
________
②____
________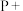 ________
________ ________
________ ________
________ ________
________ ________
________
③____
________ ________
________ ________
________ ________
________ ________
________ ________
________
④________
________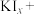 ________
________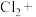 ________
________ ________KCl+________
________KCl+________ ________HCl
________HCl
(1)写出下列反应的化学方程式,是离子反应的只需写出离子方程式:
①实验室制备氢氧化铝
②实验室制备氯气
(2)配平下列化学方程式
①
________
 ________
________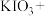 ________
________ ________
________ ________
________ ________
________
②
________
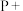 ________
________ ________
________ ________
________ ________
________ ________
________
③
________
 ________
________ ________
________ ________
________ ________
________ ________
________
④
________
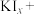 ________
________ ________
________ ________KCl+________
________KCl+________ ________HCl
________HCl
您最近半年使用:0次
名校
解题方法
5 . 现有以下物质:
①KHSO4 固体 ②Al ③KIO3固体 ④Fe(OH)3胶体 ⑤FeSO4溶液 ⑥干冰 ⑦氯水 ⑧乙醇 ⑨熔融碳酸钠
回答下列问题:
(1)以上物质在上述状态下能导电的是___________ 。
(2)①在水溶液中的电离方程式为___________ 。
(3)向碳酸钠溶液中通入CO2反应的化学方程式:___________ 。
(4)③可发生如下反应 (未配平);配平该反应并用双线桥法分析电子转移的情况:
(未配平);配平该反应并用双线桥法分析电子转移的情况:___________ ;每生成3.81g I2,反应中转移电子的数目为___________ 。
(5)氯水中含有多种成分,因而具有多种性质。
①向氯水中滴加品红溶液观察到的现象是___________ ,可证明氯水中存在___________ 微粒。
②氯水久置过程中发生的变化,用化学反应方程式表示为___________ 。
③数字化实验将传感器、数据采集器和计算机相连,可利用信息技术对化学实验进行数据的采集和分析。下图是将传感器插入盛有氯水的广口瓶中测定光照氯水过程所得到的图像,该图像的纵坐标表示的意义是___________ 。
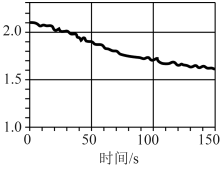
A.氯离子浓度 B.氧气体积分数 C.氯水的 D.Cl2的含量 E.氯水导电能力
D.Cl2的含量 E.氯水导电能力
①KHSO4 固体 ②Al ③KIO3固体 ④Fe(OH)3胶体 ⑤FeSO4溶液 ⑥干冰 ⑦氯水 ⑧乙醇 ⑨熔融碳酸钠
回答下列问题:
(1)以上物质在上述状态下能导电的是
(2)①在水溶液中的电离方程式为
(3)向碳酸钠溶液中通入CO2反应的化学方程式:
(4)③可发生如下反应
 (未配平);配平该反应并用双线桥法分析电子转移的情况:
(未配平);配平该反应并用双线桥法分析电子转移的情况:(5)氯水中含有多种成分,因而具有多种性质。
①向氯水中滴加品红溶液观察到的现象是
②氯水久置过程中发生的变化,用化学反应方程式表示为
③数字化实验将传感器、数据采集器和计算机相连,可利用信息技术对化学实验进行数据的采集和分析。下图是将传感器插入盛有氯水的广口瓶中测定光照氯水过程所得到的图像,该图像的纵坐标表示的意义是

A.氯离子浓度 B.氧气体积分数 C.氯水的
 D.Cl2的含量 E.氯水导电能力
D.Cl2的含量 E.氯水导电能力
您最近半年使用:0次
解题方法
6 . 攀枝花铁矿,探明储量的钒钛磁铁矿达近百亿吨,其中钒、钛储量分别占全国已探明储量的87%和94.3%,分别居世界第三位和第一位,有“世界钒钛之都”之称,是全国四大铁矿区之一,炼铁厂以磁铁矿石、焦炭、空气等为主要原料炼铁,主要反应过程如图所示:

请根据所学知识回答下列问题。
(1)磁铁矿的主要成分是___________ (填化学式),铁元素在元素周期表中位于第___________ 周期第___________ 族。
(2)生铁和钢相比,含碳量更高的是___________ 。
(3)原料中焦炭的作用是___________ 。写出反应③的化学方程式:___________ 。
(4)铁的化合物之一聚合硫酸铁[Fe2(OH)6-2n(SO4)n]m高铁酸盐均可用作水处理剂。以绿矾(FeSO4·7H2O)为原料,可制备聚合硫酸铁和高铁酸盐。
①为检验绿矾是否变质,可采取的操作方法是___________ 。
②取2ml FeSO4溶液于试管中,向其中滴加氢氧化钠溶液,观察到生成的白色沉淀迅速变为灰绿色, 最终变为红褐色,写出此过程中涉及的氧化还原反应的化学方程式:___________ 。已知在浓碱溶液中,NaClO能将Fe(OH)3,氧化为含FeO 的紫红色溶液,请写出该过程中发生反应的离子方程式:
的紫红色溶液,请写出该过程中发生反应的离子方程式:___________ 。

请根据所学知识回答下列问题。
(1)磁铁矿的主要成分是
(2)生铁和钢相比,含碳量更高的是
(3)原料中焦炭的作用是
(4)铁的化合物之一聚合硫酸铁[Fe2(OH)6-2n(SO4)n]m高铁酸盐均可用作水处理剂。以绿矾(FeSO4·7H2O)为原料,可制备聚合硫酸铁和高铁酸盐。
①为检验绿矾是否变质,可采取的操作方法是
②取2ml FeSO4溶液于试管中,向其中滴加氢氧化钠溶液,观察到生成的白色沉淀迅速变为灰绿色, 最终变为红褐色,写出此过程中涉及的氧化还原反应的化学方程式:
 的紫红色溶液,请写出该过程中发生反应的离子方程式:
的紫红色溶液,请写出该过程中发生反应的离子方程式:
您最近半年使用:0次
名校
7 . 请根据已知信息回答下列各问题:
Ⅰ 我国古代四大发明之一的黑火药足由硫黄粉、硝酸钾和木炭粉按一定比例混合而成,爆炸时发生的反应为: 。请回答:
。请回答:
(1)X的化学式是______ 。
(2)在上述反应中,还原产物是(填化学式)______ 。
Ⅱ 磷酸(H3PO4)、亚磷酸(H3PO3)、次磷酸(H3PO2)都是重要的化工产品。
(3)已知:1 mol磷酸、亚磷酸、次磷酸最多消耗NaOH的物质的量依次为3 mol、2 mol、1 mol。则Na2HPO4、NaH2PO2、Na2HPO3中属于酸式盐的是______ (填化学式)。
(4)NaHSO4可用作清洁剂、防腐剂等。下列关于NaHSO4的说法正确的是______ 。
a.NaHSO4固体不能导电
b.NaHSO4溶液的导电性一定强于CH3COOH溶液
c.NaHSO4属于电解质
d.NaHSO4溶液显中性
Ⅲ 实验室中需0.2 mol/L的Na2CO3溶液80 mL,请回答下列问题。
(5)配制上述溶液所需的玻璃 仪器有:玻璃棒、烧杯和______ ,用托盘天平称取Na2CO3固体,其质量是______ g。
(6)实验时下图所示操作的先后顺序为______ (填编号)。

(7)取用任意体积的该Na2CO3溶液时,下列物理量不随所取体积的多少而变化的是______ 。
a.溶液中Na2CO3的物质的量 b.溶液的浓度
c.溶液中 的数目 d.溶液的密度
的数目 d.溶液的密度
Ⅰ 我国古代四大发明之一的黑火药足由硫黄粉、硝酸钾和木炭粉按一定比例混合而成,爆炸时发生的反应为:
 。请回答:
。请回答:(1)X的化学式是
(2)在上述反应中,还原产物是(填化学式)
Ⅱ 磷酸(H3PO4)、亚磷酸(H3PO3)、次磷酸(H3PO2)都是重要的化工产品。
(3)已知:1 mol磷酸、亚磷酸、次磷酸最多消耗NaOH的物质的量依次为3 mol、2 mol、1 mol。则Na2HPO4、NaH2PO2、Na2HPO3中属于酸式盐的是
(4)NaHSO4可用作清洁剂、防腐剂等。下列关于NaHSO4的说法正确的是
a.NaHSO4固体不能导电
b.NaHSO4溶液的导电性一定强于CH3COOH溶液
c.NaHSO4属于电解质
d.NaHSO4溶液显中性
Ⅲ 实验室中需0.2 mol/L的Na2CO3溶液80 mL,请回答下列问题。
(5)配制上述溶液所需的
(6)实验时下图所示操作的先后顺序为

(7)取用任意体积的该Na2CO3溶液时,下列物理量不随所取体积的多少而变化的是
a.溶液中Na2CO3的物质的量 b.溶液的浓度
c.溶液中
 的数目 d.溶液的密度
的数目 d.溶液的密度
您最近半年使用:0次
名校
8 . Ⅰ.阳离子交换膜法电解饱和食盐水具有综合能耗低、环境污染小等优点。生产流程如下图所示:
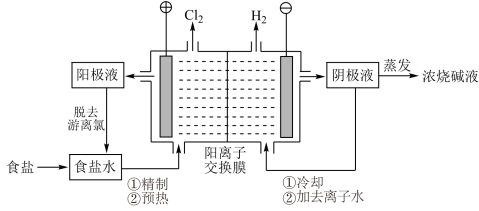
(1)电解饱和食盐水的化学方程式为__________ 。
(2)电解结束后,能够脱去阳极液中游离氯的试剂或方法是__________ (填字母序号)。
a. b.
b.
c.热空气吹出 d.降低阳极区液面上方的气压
Ⅱ.食盐水中的 若进入电解槽,可被电解产生的
若进入电解槽,可被电解产生的 氧化为,并进一步转化为
氧化为,并进一步转化为 。
。 可继续被氧化为高碘酸根
可继续被氧化为高碘酸根 ,与
,与 结合生成溶解度较小的
结合生成溶解度较小的 沉积于阳离子交换膜上,影响膜的寿命。
沉积于阳离子交换膜上,影响膜的寿命。
(3)从元素性质角度解释 中碘元素的为
中碘元素的为 价的原因:
价的原因:__________ 。
(4) 被氧化为
被氧化为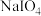 的化学方程式为
的化学方程式为__________ 。
Ⅲ.在酸性条件下加入稍过量的 溶液,可将食盐水中的
溶液,可将食盐水中的 转化为
转化为 ,再进一步除去。通过测定体系的吸光度,可以检测不同pH下
,再进一步除去。通过测定体系的吸光度,可以检测不同pH下 的生成量随时间的变化,如下图所示。
的生成量随时间的变化,如下图所示。

已知:吸光度越高表明该体系中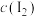 越大。
越大。
(5)结合化学用语解释 时,不同pH体系吸光度不同的原因:
时,不同pH体系吸光度不同的原因:__________ 。
(6) 时,体系的吸光度很快达到最大值,之后快速下降,且溶液中仍有
时,体系的吸光度很快达到最大值,之后快速下降,且溶液中仍有 未完全反应。吸光度快速下降的可能原因:
未完全反应。吸光度快速下降的可能原因:__________ 。
(7)一种测定溶液中 浓度的方法为:取V mL溶液,将溶液中
浓度的方法为:取V mL溶液,将溶液中 等杂质离子除去后,加入
等杂质离子除去后,加入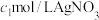 溶液
溶液 ,充分反应后,过量的
,充分反应后,过量的 用
用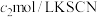 标准溶液滴定,消耗标准溶液
标准溶液滴定,消耗标准溶液 ,溶液中
,溶液中 浓度为
浓度为__________  。
。

(1)电解饱和食盐水的化学方程式为
(2)电解结束后,能够脱去阳极液中游离氯的试剂或方法是
a.
 b.
b.
c.热空气吹出 d.降低阳极区液面上方的气压
Ⅱ.食盐水中的
 若进入电解槽,可被电解产生的
若进入电解槽,可被电解产生的 氧化为,并进一步转化为
氧化为,并进一步转化为 。
。 可继续被氧化为高碘酸根
可继续被氧化为高碘酸根 ,与
,与 结合生成溶解度较小的
结合生成溶解度较小的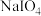 沉积于阳离子交换膜上,影响膜的寿命。
沉积于阳离子交换膜上,影响膜的寿命。(3)从元素性质角度解释
 中碘元素的为
中碘元素的为 价的原因:
价的原因:(4)
 被氧化为
被氧化为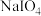 的化学方程式为
的化学方程式为Ⅲ.在酸性条件下加入稍过量的
 溶液,可将食盐水中的
溶液,可将食盐水中的 转化为
转化为 ,再进一步除去。通过测定体系的吸光度,可以检测不同pH下
,再进一步除去。通过测定体系的吸光度,可以检测不同pH下 的生成量随时间的变化,如下图所示。
的生成量随时间的变化,如下图所示。
已知:吸光度越高表明该体系中
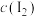 越大。
越大。(5)结合化学用语解释
 时,不同pH体系吸光度不同的原因:
时,不同pH体系吸光度不同的原因:(6)
 时,体系的吸光度很快达到最大值,之后快速下降,且溶液中仍有
时,体系的吸光度很快达到最大值,之后快速下降,且溶液中仍有 未完全反应。吸光度快速下降的可能原因:
未完全反应。吸光度快速下降的可能原因:(7)一种测定溶液中
 浓度的方法为:取V mL溶液,将溶液中
浓度的方法为:取V mL溶液,将溶液中 等杂质离子除去后,加入
等杂质离子除去后,加入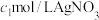 溶液
溶液 ,充分反应后,过量的
,充分反应后,过量的 用
用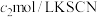 标准溶液滴定,消耗标准溶液
标准溶液滴定,消耗标准溶液 ,溶液中
,溶液中 浓度为
浓度为 。
。
您最近半年使用:0次
名校
解题方法
9 . 构建知识网络是一种有效的学习方法,化学学习中的“价-类”二维图就是其中一种,如图所示是铁及其化合物的“价-类”二维图,请回答下列问题:

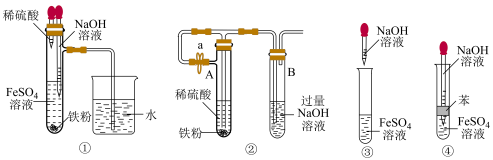
(1)在空气中C→B的现象是_____ 。
(2)下列各图示中能较长时间观察到 的是
的是_____ 。
(3)铁单质可与水蒸气在高温下发生反应,写出反应的方程式_____ ,当生成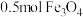 时,转移电子数为
时,转移电子数为_____ 。
(4)将 溶于盐酸后再加入1滴
溶于盐酸后再加入1滴 溶液,则溶液变红时发生反应的离子方程式为
溶液,则溶液变红时发生反应的离子方程式为_____ 。
(5)绿矾 是补血剂的原料,易变质。将硫酸亚铁溶液加热浓缩,冷却结晶,之后
是补血剂的原料,易变质。将硫酸亚铁溶液加热浓缩,冷却结晶,之后_____ 可获得绿矾晶体,如何检验绿矾是否完全变质_____ 。
(6)将硫酸亚铁固体隔绝空气煅烧,可发生以下反应,请将方程式配平:_____ 。
_____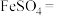 _____
_____ _____
_____ _____
_____

(1)在空气中C→B的现象是
(2)下列各图示中能较长时间观察到
 的是
的是
(3)铁单质可与水蒸气在高温下发生反应,写出反应的方程式
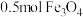 时,转移电子数为
时,转移电子数为(4)将
 溶于盐酸后再加入1滴
溶于盐酸后再加入1滴 溶液,则溶液变红时发生反应的离子方程式为
溶液,则溶液变红时发生反应的离子方程式为(5)绿矾
 是补血剂的原料,易变质。将硫酸亚铁溶液加热浓缩,冷却结晶,之后
是补血剂的原料,易变质。将硫酸亚铁溶液加热浓缩,冷却结晶,之后(6)将硫酸亚铁固体隔绝空气煅烧,可发生以下反应,请将方程式配平:
_____
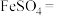 _____
_____ _____
_____ _____
_____
您最近半年使用:0次
10 . 完成下列问题。
(1)饮用水中的 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,可以在碱性条件下用铝粉将
的浓度,可以在碱性条件下用铝粉将 还原为
还原为 ,其化学方程式为:
,其化学方程式为: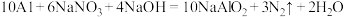 。
。
①上述反应中,被还原的元素是_______ (填写元素符号);氧化产物是_______ (写化学式);若反应生成 (标况下)的
(标况下)的 ,该反应转移电子的数目为
,该反应转移电子的数目为___  。
。
②用双线桥法表示反应中电子转移的方向和数目:________  。
。
③请配平下列离子方程式:____ 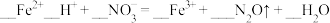 。
。
(2)食品工业经常使用 和
和 作膨松剂。室温下,向含
作膨松剂。室温下,向含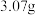 某膨松剂试样(
某膨松剂试样(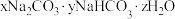 )溶液中逐滴加入稀盐酸,反应过程中含碳元素微粒的物质的量随
)溶液中逐滴加入稀盐酸,反应过程中含碳元素微粒的物质的量随 变化的图象如图所示。
变化的图象如图所示。
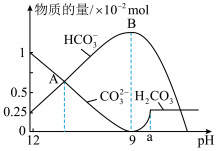
①图中B点溶液溶质的主要成分为________ (填化学式)。
②图中A点所含 的物质的量为
的物质的量为_____ mol。(提醒:注意纵坐标的数量级)
③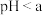 时发生反应的离子反应方程式为
时发生反应的离子反应方程式为_________ 。
④某同学用酒精灯对该试样固体充分加热至恒重,从开始至恒重固体失重______ g。
(1)饮用水中的
 对人类健康会产生危害,为了降低饮用水中
对人类健康会产生危害,为了降低饮用水中 的浓度,可以在碱性条件下用铝粉将
的浓度,可以在碱性条件下用铝粉将 还原为
还原为 ,其化学方程式为:
,其化学方程式为: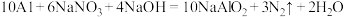 。
。①上述反应中,被还原的元素是
 (标况下)的
(标况下)的 ,该反应转移电子的数目为
,该反应转移电子的数目为 。
。②用双线桥法表示反应中电子转移的方向和数目:
 。
。③请配平下列离子方程式:
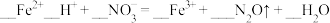 。
。(2)食品工业经常使用
 和
和 作膨松剂。室温下,向含
作膨松剂。室温下,向含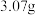 某膨松剂试样(
某膨松剂试样(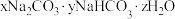 )溶液中逐滴加入稀盐酸,反应过程中含碳元素微粒的物质的量随
)溶液中逐滴加入稀盐酸,反应过程中含碳元素微粒的物质的量随 变化的图象如图所示。
变化的图象如图所示。
①图中B点溶液溶质的主要成分为
②图中A点所含
 的物质的量为
的物质的量为③
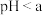 时发生反应的离子反应方程式为
时发生反应的离子反应方程式为④某同学用酒精灯对该试样固体充分加热至恒重,从开始至恒重固体失重
您最近半年使用:0次
2024-03-04更新
|
60次组卷
|
2卷引用:河南省许昌高级中学2023-2024学年高一下学期开学化学试题



