名校
解题方法
1 . 2020年11月24日,搭载“嫦娥五号”探测器的“长征五号”大型运载火箭成功发射升空,12月17日“嫦娥五号”返回器顺利返回。
(1)“长征五号”的第一、二子级火箭用偏二甲肼(C2H8N2)和四氧化二氮(N2O4) 做推进剂,该反应的能量转化形式是___________ ,化学方程式为C2H8N2+2N2O4=3N2+4H2O+2X, 则X的化学式是___________ 。
(2)“长征五号”的第三子级火箭采用液氢、液氧做推进剂。制取与储存氢气是氢能源利用领域的研究热点。
I.制氢:铁酸锌(ZnFe2O4)可用于循环分解水制氢气。如图所示,制氢过程中,ZnFe2O4的作用是____________ , 该循环制氢中不断消耗的物质是___________ (填化学式)。
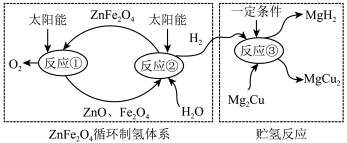
II.贮氢:请写出反应③的化学方程式___________ 。氢化物MgH2与水反应生成一种碱,并释放出H2,其化学方程式为___________ 。
III.如图是氢气和氧气在密闭容器中燃烧的微观示意图,请回答:
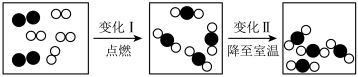
变化I和变化II的本质区别是___________ 。
(3)本次探月的重要任务是寻找月球矿物成分,以探索未来新能源。月壤中含有丰富的氦-3,氦-3是世界公认的高效、清洁、安全的核聚变发电燃料。下列关于氦- 3的叙述正确的是___________(填字母序号)。
(1)“长征五号”的第一、二子级火箭用偏二甲肼(C2H8N2)和四氧化二氮(N2O4) 做推进剂,该反应的能量转化形式是
(2)“长征五号”的第三子级火箭采用液氢、液氧做推进剂。制取与储存氢气是氢能源利用领域的研究热点。
I.制氢:铁酸锌(ZnFe2O4)可用于循环分解水制氢气。如图所示,制氢过程中,ZnFe2O4的作用是

II.贮氢:请写出反应③的化学方程式
III.如图是氢气和氧气在密闭容器中燃烧的微观示意图,请回答:

变化I和变化II的本质区别是
(3)本次探月的重要任务是寻找月球矿物成分,以探索未来新能源。月壤中含有丰富的氦-3,氦-3是世界公认的高效、清洁、安全的核聚变发电燃料。下列关于氦- 3的叙述正确的是___________(填字母序号)。
| A.其原子核内质子数为3 | B.其原子核外电子数为2 |
| C.其相对原子质量约为2 | D.其化学性质肯定比较活泼 |
您最近一年使用:0次
名校
2 . 亚氯酸钠(NaClO2)是一种高效的消毒剂,一种制备NaClO2晶体的流程如下:

已知:高浓度的ClO2气体易爆炸。
(1)“电解”采用无隔膜环境制备NaClO3,阴极生成的气体是___________ 。(写化学式)
(2)该流程中“制备ClO2”时,为防止ClO2气体爆炸所采取的措施是___________ 。充分反应一段时间,ClO2逸出后,溶液中主要的阴离子为___________ 。(写化学式)
(3)“吸收ClO2”时反应的离子方程式为___________ 。“吸收ClO2”时温度不能过高,原因是___________ 、___________ 。

已知:高浓度的ClO2气体易爆炸。
(1)“电解”采用无隔膜环境制备NaClO3,阴极生成的气体是
(2)该流程中“制备ClO2”时,为防止ClO2气体爆炸所采取的措施是
(3)“吸收ClO2”时反应的离子方程式为
您最近一年使用:0次
2022-01-10更新
|
113次组卷
|
2卷引用:江苏省扬州市江都区大桥高级中学2021-2022学年高三上学期开学检测(二)化学试题
3 . 过氧化钙(CaO2·8H2O)是一种在水产养殖中广泛使用的供氧剂。
(1)Ca(OH)2悬浊液与H2O2溶液反应可制备CaO2·8H2O。Ca(OH)2+H2O2+6H2O=CaO2·8H2O;反应时通常加入过量Ca(OH)2,其目的_______ ,
(2)向池塘水中加入一定量CaO2·8H2O后,池塘水中浓度增加的离子有_______(填序号)。
(3)水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置,加入适量稀H2SO4,待MnO(OH)2与I-完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系为:
O2 MnO(OH)2
MnO(OH)2 I2
I2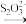 S4O
S4O
写出O2将Mn2+氧化成MnO(OH)2的离子方程式:_______
(4)利用电解后的溶液制备重铬酸钠晶体(Na2Cr2O7·2H2O)的流程如图。已知:重铬酸钠晶体(Na2Cr2O7·2H2O)俗称红矾钠,桔红色晶体,略有吸湿性,易溶于水,不溶于乙醇;Na2Cr2O7·2H2O的式量为298。
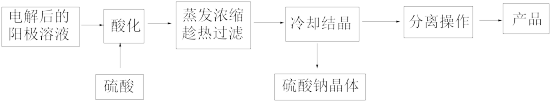
①流程中分离操作包括_______ 、洗涤、干燥,其中洗涤时最好选用_______ (填试剂名称)。
②准确称取上述流程中的产品3.1700 g配成250 mL溶液,取出25.00 mL放于锥形瓶中,加入10 mL 2 mol·L-1 H2SO4溶液和足量碘化钾溶液,放于暗处5 min;然后加入100 mL水和2-3滴淀粉指示剂;最后根据I2+2S2O =2I—+S4O
=2I—+S4O 用0.1000 mol·L-1 Na2S2O3标准溶液滴定,判断达到滴定终点的依据是:
用0.1000 mol·L-1 Na2S2O3标准溶液滴定,判断达到滴定终点的依据是:_______ 。若实验中平均用去Na2S2O3标准溶液60.00 mL,则所得产品中的重铬酸钠晶体的纯度为_______ 。
(1)Ca(OH)2悬浊液与H2O2溶液反应可制备CaO2·8H2O。Ca(OH)2+H2O2+6H2O=CaO2·8H2O;反应时通常加入过量Ca(OH)2,其目的
(2)向池塘水中加入一定量CaO2·8H2O后,池塘水中浓度增加的离子有_______(填序号)。
| A.Ca2+ | B.H+ | C.CO | D.OH— |
O2
 MnO(OH)2
MnO(OH)2 I2
I2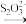 S4O
S4O
写出O2将Mn2+氧化成MnO(OH)2的离子方程式:
(4)利用电解后的溶液制备重铬酸钠晶体(Na2Cr2O7·2H2O)的流程如图。已知:重铬酸钠晶体(Na2Cr2O7·2H2O)俗称红矾钠,桔红色晶体,略有吸湿性,易溶于水,不溶于乙醇;Na2Cr2O7·2H2O的式量为298。

①流程中分离操作包括
②准确称取上述流程中的产品3.1700 g配成250 mL溶液,取出25.00 mL放于锥形瓶中,加入10 mL 2 mol·L-1 H2SO4溶液和足量碘化钾溶液,放于暗处5 min;然后加入100 mL水和2-3滴淀粉指示剂;最后根据I2+2S2O
 =2I—+S4O
=2I—+S4O 用0.1000 mol·L-1 Na2S2O3标准溶液滴定,判断达到滴定终点的依据是:
用0.1000 mol·L-1 Na2S2O3标准溶液滴定,判断达到滴定终点的依据是:
您最近一年使用:0次
名校
解题方法
4 . 2021年7月,第32届奥运会在东京召开,我国运动健儿在奥运会上取得了非凡的成绩。
(1)东京奥运会火炬的燃料是氢气,写出氢气燃烧的化学方程式_______ 。
(2)杨倩在10米气步枪比赛中获得了奥运会首金,气步枪的子弹是铅弹,构成铅的微粒是_______ (填序号)。
A.原子 B.分子 C.离子
(3)14岁的全红婵在跳水10米台的赛事中夺冠,震撼全场。下列物质中,使用的主要材料属于合成材料的是_______ (填序号)。
A.航空级铝合金跳板 B.聚酯纤维泳衣 C.金牌
(4)苏炳添在田径男子百米半决赛中以9.83秒的成绩打破了亚洲纪录。发令枪内的药粉中含有氯酸钾和红磷,扣动扳机,发生两个化学反应:①氯酸钾受撞击迅速分解产生氧气;②红磷燃烧产生白烟。写出其中任意一个化学反应的化学方程式_______ 。
(1)东京奥运会火炬的燃料是氢气,写出氢气燃烧的化学方程式
(2)杨倩在10米气步枪比赛中获得了奥运会首金,气步枪的子弹是铅弹,构成铅的微粒是
A.原子 B.分子 C.离子
(3)14岁的全红婵在跳水10米台的赛事中夺冠,震撼全场。下列物质中,使用的主要材料属于合成材料的是
A.航空级铝合金跳板 B.聚酯纤维泳衣 C.金牌
(4)苏炳添在田径男子百米半决赛中以9.83秒的成绩打破了亚洲纪录。发令枪内的药粉中含有氯酸钾和红磷,扣动扳机,发生两个化学反应:①氯酸钾受撞击迅速分解产生氧气;②红磷燃烧产生白烟。写出其中任意一个化学反应的化学方程式
您最近一年使用:0次
5 . 已知铜在常温下能被稀硝酸溶解,其反应的化学方程式如下: Cu+HNO3(稀)  Cu(NO3)2+NO↑+H2O
Cu(NO3)2+NO↑+H2O
(1)配平化学方程式______ ____Cu + _____HNO3(稀)= ____Cu(NO3)2 +_____NO↑+____H2O
(2)被氧化的元素是___________ ,被还原的元素是___________ ,发生氧化反应的物质是___________ ,发生还原反应的物质是___________ ,氧化剂是___________ ,还原剂是___________ 。
(3)用双线桥法表示反应电子得失的方向和数目:___________ 。
(4)在参加反应的硝酸中,起氧化剂作用的HNO3与起酸性作用的HNO3的质量比为___________ 。
(5)该反应中每生成4分子NO转移电子数为___________ 个。
 Cu(NO3)2+NO↑+H2O
Cu(NO3)2+NO↑+H2O(1)配平化学方程式
(2)被氧化的元素是
(3)用双线桥法表示反应电子得失的方向和数目:
(4)在参加反应的硝酸中,起氧化剂作用的HNO3与起酸性作用的HNO3的质量比为
(5)该反应中每生成4分子NO转移电子数为
您最近一年使用:0次
6 .  是微电子工业中一种优良的等离子蚀刻气体.在1个标准大气压下,
是微电子工业中一种优良的等离子蚀刻气体.在1个标准大气压下, 的沸点为
的沸点为 ,能与空气中的水蒸气反应生成
,能与空气中的水蒸气反应生成 、
、 和
和 。
。 可通过如下方法制备:
可通过如下方法制备:
(1)气—气反应:在常温下将 与干燥的空气混合即得
与干燥的空气混合即得 和
和 。
。
①原料 中氧元素的化合价为
中氧元素的化合价为_______ 。
②已知反应中每消耗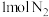 转移
转移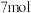 电子,配平反应:
电子,配平反应:_______
_______ _______
_______ _______
_______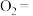 _______
_______ _______
_______
反应中氧化剂与还原剂的物质的量之比为_______ 。
(2)气—固反应:由于气—气反应容易腐蚀设备,研究人员提出用气—固反应制备 。气—固反应包括如下两个步骤:
。气—固反应包括如下两个步骤:


①气—固反应的总化学方程式为_______ ,若有 完全氧化,则可制得
完全氧化,则可制得
_______ L(标准状况下)。
②若要制备 ,共有
,共有_______  电子发生转移。
电子发生转移。
(3) 在空气中泄漏,还是易于发现的。判断发生了
在空气中泄漏,还是易于发现的。判断发生了 泄漏的现象是
泄漏的现象是_______ 。一但 发生泄漏,可以用烧碱溶液喷淋的方法减少污染,其产物除
发生泄漏,可以用烧碱溶液喷淋的方法减少污染,其产物除 、
、 、
、 外还一定有
外还一定有_______ (填化学式)。
 是微电子工业中一种优良的等离子蚀刻气体.在1个标准大气压下,
是微电子工业中一种优良的等离子蚀刻气体.在1个标准大气压下, 的沸点为
的沸点为 ,能与空气中的水蒸气反应生成
,能与空气中的水蒸气反应生成 、
、 和
和 。
。 可通过如下方法制备:
可通过如下方法制备:(1)气—气反应:在常温下将
 与干燥的空气混合即得
与干燥的空气混合即得 和
和 。
。①原料
 中氧元素的化合价为
中氧元素的化合价为②已知反应中每消耗
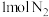 转移
转移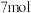 电子,配平反应:
电子,配平反应:_______
 _______
_______ _______
_______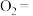 _______
_______ _______
_______
反应中氧化剂与还原剂的物质的量之比为
(2)气—固反应:由于气—气反应容易腐蚀设备,研究人员提出用气—固反应制备
 。气—固反应包括如下两个步骤:
。气—固反应包括如下两个步骤:

①气—固反应的总化学方程式为
 完全氧化,则可制得
完全氧化,则可制得
②若要制备
 ,共有
,共有 电子发生转移。
电子发生转移。(3)
 在空气中泄漏,还是易于发现的。判断发生了
在空气中泄漏,还是易于发现的。判断发生了 泄漏的现象是
泄漏的现象是 发生泄漏,可以用烧碱溶液喷淋的方法减少污染,其产物除
发生泄漏,可以用烧碱溶液喷淋的方法减少污染,其产物除 、
、 、
、 外还一定有
外还一定有
您最近一年使用:0次
2021-09-29更新
|
543次组卷
|
3卷引用:河北省邯郸市肥乡区第一中学2022届高三开学考试化学试卷
7 . 全球一半左右的碘是以智利硝石提取硝酸钠后的母液为原料,加入亚硫酸氢钠制取,相关反应如下:
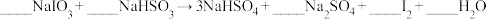 (未配平)
(未配平)
完成下列填空:
(1)配平上述化学方程式,单线桥标出电子转移的方向和数目_______ 。
(2)该反应实质是两步反应:①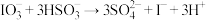 ,则第二步反应的离子方程式为②
,则第二步反应的离子方程式为②_______ ;若要使碘酸钠的利用率最高,碘酸钠在第一步和第二步反应中的用量之比是_______ 。
(3)过滤反应析出的碘沉淀得到粗碘,再用升华法即可得到99%左右的碘产品.碘升华克服的微粒间作用力为_______ 。
(4)检验亚硫酸钠固体是否氧化变质的方法是_______ 。
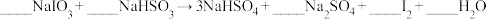 (未配平)
(未配平)完成下列填空:
(1)配平上述化学方程式,单线桥标出电子转移的方向和数目
(2)该反应实质是两步反应:①
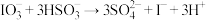 ,则第二步反应的离子方程式为②
,则第二步反应的离子方程式为②(3)过滤反应析出的碘沉淀得到粗碘,再用升华法即可得到99%左右的碘产品.碘升华克服的微粒间作用力为
(4)检验亚硫酸钠固体是否氧化变质的方法是
您最近一年使用:0次
名校
8 . 针对以下A~D四个涉及H2O2的反应(未配平)填空:
A.
B.
C.
D.
(1)H2O2仅体现氧化性的反应是___________ (填序号,下同),H2O2仅体现还原性的反应是___________ ,H2O2既体现氧化性又体现还原性的反应是___________ ,H2O2既不作氧化剂又不作还原剂的反应是___________ 。
(2)请将D反应配平,并用单线桥标出D反应中电子转移的方向和数目:□H2O2+□Cr2(SO4)3+□KOH=□K2CrO4+□K2SO4+□H2O,___________
A.

B.

C.

D.

(1)H2O2仅体现氧化性的反应是
(2)请将D反应配平,并用单线桥标出D反应中电子转移的方向和数目:□H2O2+□Cr2(SO4)3+□KOH=□K2CrO4+□K2SO4+□H2O,
您最近一年使用:0次
名校
解题方法
9 . 氮、磷对水体的污染情况越来越受到人们的重视。回答下列问题:
(1)常温下,在 约为9时,用澄清石灰水可将水体中的
约为9时,用澄清石灰水可将水体中的 转化为
转化为 沉淀除去,该反应的离子方程式为
沉淀除去,该反应的离子方程式为_______ 。
(2)除去地下水中的硝态氮通常用还原剂将其还原为 。
。
①Prusse等提出的用 作催化剂,常温下,在
作催化剂,常温下,在 为4.0~6.0时,可直接用
为4.0~6.0时,可直接用 将
将 还原为
还原为 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。研究发现用 和
和 的混合气体代替
的混合气体代替 ,
, 的去除效果比只用
的去除效果比只用 时更好,其原因是
时更好,其原因是_______ 。
②在 约为5时,用纳米
约为5时,用纳米 粉可将
粉可将 还原为
还原为 ,
, 粉被氧化为
粉被氧化为 ,该反应中氧化产物与还原产物的物质的量之比为
,该反应中氧化产物与还原产物的物质的量之比为_______ 。
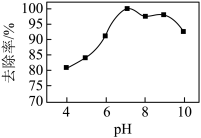
(3)实验测得相同条件下,用次氯酸钠脱除水体中的氨态氮的过程中(
 ),
), 与氨态氮的去除率关系如图所示,在
与氨态氮的去除率关系如图所示,在 大于9时,
大于9时, 越大,去除率越小,其原因是
越大,去除率越小,其原因是_______ 。
(1)常温下,在
 约为9时,用澄清石灰水可将水体中的
约为9时,用澄清石灰水可将水体中的 转化为
转化为 沉淀除去,该反应的离子方程式为
沉淀除去,该反应的离子方程式为(2)除去地下水中的硝态氮通常用还原剂将其还原为
 。
。①Prusse等提出的用
 作催化剂,常温下,在
作催化剂,常温下,在 为4.0~6.0时,可直接用
为4.0~6.0时,可直接用 将
将 还原为
还原为 ,该反应的离子方程式为
,该反应的离子方程式为 和
和 的混合气体代替
的混合气体代替 ,
, 的去除效果比只用
的去除效果比只用 时更好,其原因是
时更好,其原因是②在
 约为5时,用纳米
约为5时,用纳米 粉可将
粉可将 还原为
还原为 ,
, 粉被氧化为
粉被氧化为 ,该反应中氧化产物与还原产物的物质的量之比为
,该反应中氧化产物与还原产物的物质的量之比为(3)实验测得相同条件下,用次氯酸钠脱除水体中的氨态氮的过程中(

 ),
), 与氨态氮的去除率关系如图所示,在
与氨态氮的去除率关系如图所示,在 大于9时,
大于9时, 越大,去除率越小,其原因是
越大,去除率越小,其原因是
您最近一年使用:0次
2021-09-14更新
|
397次组卷
|
10卷引用:广东省普通高中2022届高三9月阶段性质量检测化学试题
广东省普通高中2022届高三9月阶段性质量检测化学试题(已下线)第14周 周测卷-备战2022年高考化学周测与晚练(新高考专用)吉林省长春吉大附中实验学校2021-2022学年高三上学期第三次摸底考试化学试题江西省丰城市第九中学2022-2023学年高三上学期摸底考(日新班)化学试题山东省临沂市第一中学2020届高三10月月考化学试题2019年湖北省黄冈市高三11月新高考备考监测联考化学试题山东省新高考备考监测2020届高三10月联考化学试题(已下线)考点11 弱电解质的电离及溶液pH-2020年高考化学命题预测与模拟试题分类精编黑龙江省牡丹江市第二高级中学2022-2023学年高三上学期第三次月考化学试题(已下线)第3讲 氧化还原反应
10 . 烟气中SO2和NO的转化和综合利用既有利于节约资源,又有利于保护环境。
(1)采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,在一定浓度的NaClO2溶液中通入含有SO2和NO的烟气,反应温度为323K。
已知: 4H++ClO =4ClO2+Cl-+2H2O;ClO2氧化性大于NaClO2。
=4ClO2+Cl-+2H2O;ClO2氧化性大于NaClO2。
①写出NaClO2溶液将NO氧化为NO 的离子方程式:
的离子方程式:___________ 。
②已知脱硫反应速率大于脱硝反应速率,原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________ 。
③当调节溶液初始pH由7升至12时,通入烟气后,NO转化率由100%降为51%,可能的原因是___________ 。
(2)有氧条件下,NO在催化剂作用下可被NH3还原为N2。在钒基催化剂(V2O5)作用下的脱硝反应机理如图1所示。
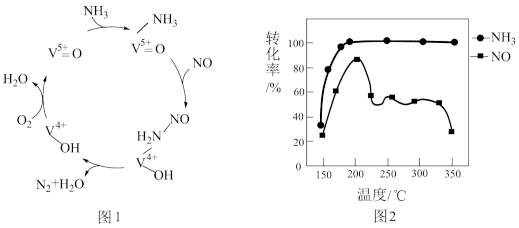
①根据图1机理,NO、NH3在有氧条件下的总化学方程式是___________ 。
②按上述图1中NH3、NO和O2的比例进行催化脱硝反应。相同反应时间,NH3和NO的转化率与温度的关系如图2所示,200℃后,NO转化率急剧下降的原因是___________ 。
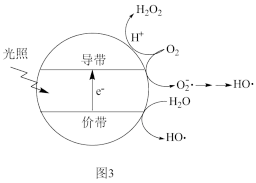
(3)羟基自由基(HO·)也可以用于脱硫脱硝。图3表示光催化氧化技术可生成HO·:光照时,价带失去电子产生有强氧化性的空穴,价带上生成HO·;描述产生HO·的另一种过程:___________ 。
(1)采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,在一定浓度的NaClO2溶液中通入含有SO2和NO的烟气,反应温度为323K。
已知: 4H++ClO
 =4ClO2+Cl-+2H2O;ClO2氧化性大于NaClO2。
=4ClO2+Cl-+2H2O;ClO2氧化性大于NaClO2。①写出NaClO2溶液将NO氧化为NO
 的离子方程式:
的离子方程式:②已知脱硫反应速率大于脱硝反应速率,原因是除了SO2和NO在烟气中的初始浓度不同,还可能是
③当调节溶液初始pH由7升至12时,通入烟气后,NO转化率由100%降为51%,可能的原因是
(2)有氧条件下,NO在催化剂作用下可被NH3还原为N2。在钒基催化剂(V2O5)作用下的脱硝反应机理如图1所示。

①根据图1机理,NO、NH3在有氧条件下的总化学方程式是
②按上述图1中NH3、NO和O2的比例进行催化脱硝反应。相同反应时间,NH3和NO的转化率与温度的关系如图2所示,200℃后,NO转化率急剧下降的原因是
(3)羟基自由基(HO·)也可以用于脱硫脱硝。图3表示光催化氧化技术可生成HO·:光照时,价带失去电子产生有强氧化性的空穴,价带上生成HO·;描述产生HO·的另一种过程:

您最近一年使用:0次
2021-09-12更新
|
527次组卷
|
4卷引用:江苏省海安市2021-2022学年高三上学期期初学业质量监测化学试题
江苏省海安市2021-2022学年高三上学期期初学业质量监测化学试题江苏省宿迁青华中学2021-2022学年高三上学期9月月考化学试题(已下线)第12讲 化学反应的调控-【帮课堂】2022-2023学年高二化学同步精品讲义(人教2019选择性必修1)(已下线)常见无机物的性质



