1 . 碱式硫酸铁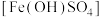 难溶于水,可做净水剂、媒染剂、颜料和药物。可由硫酸亚铁与稀硝酸共热制得。某实验小组欲用如图所示装置进行实验,回答下列问题:
难溶于水,可做净水剂、媒染剂、颜料和药物。可由硫酸亚铁与稀硝酸共热制得。某实验小组欲用如图所示装置进行实验,回答下列问题:
(1)锥形瓶中发生反应的化学方程式为___________ ;某同学认为用 溶液代替稀硝酸更好,理由是
溶液代替稀硝酸更好,理由是___________ 。
(2)酸性高锰酸钾溶液可除去一氧化氮,反应的离子方程式为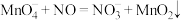 。
。
该反应分两步进行。第一步是高锰酸钾把一氧化氮氧化为二氧化氮,反应的离子方程式为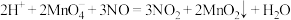 ,则第二步反应的离子方程式为
,则第二步反应的离子方程式为___________ 。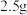 产物溶于适量稀硫酸中,加入足量KI溶液,充分反应后,滴入几滴淀粉溶液,用
产物溶于适量稀硫酸中,加入足量KI溶液,充分反应后,滴入几滴淀粉溶液,用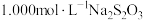 标准溶液滴定至终点,消耗标准液
标准溶液滴定至终点,消耗标准液 (涉及的反应方程式为
(涉及的反应方程式为 、
、 )。
)。
①盛装 标准溶液的滴定管应选用
标准溶液的滴定管应选用___________ (填“酸式”或“碱式”)滴定管。
②判断达到滴定终点的方法为___________ 。
③该产品的纯度为___________  ,滴定过程中,如果滴定速度过慢,可能导致所测结果
,滴定过程中,如果滴定速度过慢,可能导致所测结果___________ (填“偏高”“偏低”或“无影响”)。
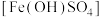 难溶于水,可做净水剂、媒染剂、颜料和药物。可由硫酸亚铁与稀硝酸共热制得。某实验小组欲用如图所示装置进行实验,回答下列问题:
难溶于水,可做净水剂、媒染剂、颜料和药物。可由硫酸亚铁与稀硝酸共热制得。某实验小组欲用如图所示装置进行实验,回答下列问题:(1)锥形瓶中发生反应的化学方程式为
 溶液代替稀硝酸更好,理由是
溶液代替稀硝酸更好,理由是(2)酸性高锰酸钾溶液可除去一氧化氮,反应的离子方程式为
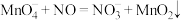 。
。该反应分两步进行。第一步是高锰酸钾把一氧化氮氧化为二氧化氮,反应的离子方程式为
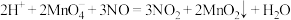 ,则第二步反应的离子方程式为
,则第二步反应的离子方程式为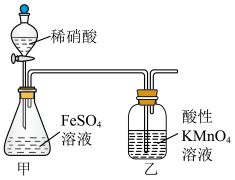
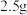 产物溶于适量稀硫酸中,加入足量KI溶液,充分反应后,滴入几滴淀粉溶液,用
产物溶于适量稀硫酸中,加入足量KI溶液,充分反应后,滴入几滴淀粉溶液,用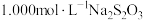 标准溶液滴定至终点,消耗标准液
标准溶液滴定至终点,消耗标准液 (涉及的反应方程式为
(涉及的反应方程式为 、
、 )。
)。①盛装
 标准溶液的滴定管应选用
标准溶液的滴定管应选用②判断达到滴定终点的方法为
③该产品的纯度为
 ,滴定过程中,如果滴定速度过慢,可能导致所测结果
,滴定过程中,如果滴定速度过慢,可能导致所测结果
您最近一年使用:0次
2023-12-21更新
|
93次组卷
|
2卷引用:安徽省淮北市树人高级中学2023-2024学年高二下学期开学考试化学试题
名校
2 . “7•20特大洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效措施之一。“84”消毒液、漂白粉和 等都是有效的消杀试剂。
等都是有效的消杀试剂。
(1)用化学方程式表示氯气与烧碱溶液制备“84”消毒液的原理______ ,标况下56L氯气完全被吸收,需要______ L 1mol/L的NaOH溶液。
(2)使用漂白粉漂白,只需取适量漂白粉溶于水即可,漂白原理用化学方程式表示为______ 。
(3)漂白粉的保存要注意密封,为了判断一份儿久置的漂白粉是①没有失效②部分失效③完全失效。某化学兴趣小组设计实验进行验证。
已知: 溶液呈碱性;
溶液呈碱性; ;
;
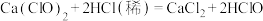
a.甲同学取适量漂白粉样品,滴加浓盐酸,将产生的气体直接通入澄清石灰水中,没有发现石灰水变浑浊。由此,判断结论为①,乙同学不同意这一观点,你认为的结论是______ 。
A.② B.③ C.①或② D.①②③均有可能
b.乙同学改用滴加稀盐酸,发现产生大量气泡,将气体通入澄清石灰水中,石灰水变浑浊;他又取少量漂白粉样品配成溶液,滴在pH试纸上,最终试纸变白。据此你得出的结论是______ (从①②③中选填)。
(4)目前普遍使用 代替
代替 及次氯酸盐作为广谱抗菌消毒剂,因为它安全、低毒,高效。
及次氯酸盐作为广谱抗菌消毒剂,因为它安全、低毒,高效。 还可以将剧毒的NaCN转化为无毒物质除去,产物是氯化钠和两种常见气体。试写出该反应的化学方程式
还可以将剧毒的NaCN转化为无毒物质除去,产物是氯化钠和两种常见气体。试写出该反应的化学方程式______ 。
 等都是有效的消杀试剂。
等都是有效的消杀试剂。(1)用化学方程式表示氯气与烧碱溶液制备“84”消毒液的原理
(2)使用漂白粉漂白,只需取适量漂白粉溶于水即可,漂白原理用化学方程式表示为
(3)漂白粉的保存要注意密封,为了判断一份儿久置的漂白粉是①没有失效②部分失效③完全失效。某化学兴趣小组设计实验进行验证。
已知:
 溶液呈碱性;
溶液呈碱性; ;
;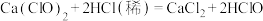
a.甲同学取适量漂白粉样品,滴加浓盐酸,将产生的气体直接通入澄清石灰水中,没有发现石灰水变浑浊。由此,判断结论为①,乙同学不同意这一观点,你认为的结论是
A.② B.③ C.①或② D.①②③均有可能
b.乙同学改用滴加稀盐酸,发现产生大量气泡,将气体通入澄清石灰水中,石灰水变浑浊;他又取少量漂白粉样品配成溶液,滴在pH试纸上,最终试纸变白。据此你得出的结论是
(4)目前普遍使用
 代替
代替 及次氯酸盐作为广谱抗菌消毒剂,因为它安全、低毒,高效。
及次氯酸盐作为广谱抗菌消毒剂,因为它安全、低毒,高效。 还可以将剧毒的NaCN转化为无毒物质除去,产物是氯化钠和两种常见气体。试写出该反应的化学方程式
还可以将剧毒的NaCN转化为无毒物质除去,产物是氯化钠和两种常见气体。试写出该反应的化学方程式
您最近一年使用:0次
2023-01-07更新
|
136次组卷
|
2卷引用:福建省福清第一中学2023-2024学年高一下学期开学适应性练习化学试题
名校
3 . 针对以下A~D四个涉及H2O2的反应(未配平)填空:
A.
B.
C.
D.
(1)H2O2仅体现氧化性的反应是___________ (填序号,下同),H2O2仅体现还原性的反应是___________ ,H2O2既体现氧化性又体现还原性的反应是___________ ,H2O2既不作氧化剂又不作还原剂的反应是___________ 。
(2)请将D反应配平,并用单线桥标出D反应中电子转移的方向和数目:□H2O2+□Cr2(SO4)3+□KOH=□K2CrO4+□K2SO4+□H2O,___________
A.

B.

C.

D.

(1)H2O2仅体现氧化性的反应是
(2)请将D反应配平,并用单线桥标出D反应中电子转移的方向和数目:□H2O2+□Cr2(SO4)3+□KOH=□K2CrO4+□K2SO4+□H2O,
您最近一年使用:0次
4 . 化学实验中,若使某步中的有害产物作为另一步的反应物,形成一个循环,就可不再向环境中排放该有害物质。例如:

(1)配平并回答问题,用单线桥法标出两个反应电子转移的方向和数目。
①Na2Cr2O7+HCl=NaCl+CrCl3+Cl2↑+ H2O,_____ ,氧化剂为____ ,氧化产物为_____ 。
② +
+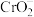 + =Cl-+
+ =Cl-+ +H2O,
+H2O,_____ ,还原剂为______ ,还原产物为_____ 。
(2)在上述有编号的反应中,除了①⑥外,需用氧化剂的反应是_______ (填编号)。

(1)配平并回答问题,用单线桥法标出两个反应电子转移的方向和数目。
①Na2Cr2O7+HCl=NaCl+CrCl3+Cl2↑+ H2O,
②
 +
+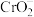 + =Cl-+
+ =Cl-+ +H2O,
+H2O,(2)在上述有编号的反应中,除了①⑥外,需用氧化剂的反应是
您最近一年使用:0次
2020-11-10更新
|
1229次组卷
|
5卷引用:云南省玉溪市民族中学2021-2022年高一下学期开学考试化学试题
名校
5 . 根据所学知识,回答下列问题。
(1)汽车尾气中常含有NO、CO等气体,在催化剂的作用下NO和CO可反应生成 和
和 ,请写出该反应的化学方程式:
,请写出该反应的化学方程式:___________________________________ 。
(2)生活中若将“84”消毒液(有效成分是NaClO)和洁厕精(主要成分是HCl)混合,易产生黄绿色有毒气体,请写出该反应的离子方程式:___________________________ 。
(3)胶体和溶液的本质区别是_______ (填标号)。
A.能否发生电泳 B.分散质粒子的直径大小不同 C.能否产生丁达尔效应
(4)下列状态的物质既属于电解质又能导电的是________ (填标号)。
A.熔融的NaCl B.纯净的矿泉水
C.某品牌的饮料 D.熟石灰固体
(1)汽车尾气中常含有NO、CO等气体,在催化剂的作用下NO和CO可反应生成
 和
和 ,请写出该反应的化学方程式:
,请写出该反应的化学方程式:(2)生活中若将“84”消毒液(有效成分是NaClO)和洁厕精(主要成分是HCl)混合,易产生黄绿色有毒气体,请写出该反应的离子方程式:
(3)胶体和溶液的本质区别是
A.能否发生电泳 B.分散质粒子的直径大小不同 C.能否产生丁达尔效应
(4)下列状态的物质既属于电解质又能导电的是
A.熔融的NaCl B.纯净的矿泉水
C.某品牌的饮料 D.熟石灰固体
您最近一年使用:0次
2020-10-03更新
|
2565次组卷
|
5卷引用:河南省林州市第一中学2021-2022学年高一上学期开学检测(普通班)化学试题
名校
解题方法
6 . 已知将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一个氧化还原反应体系,共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质。
(1)该反应中,化合价升高的反应物是__ ,化合价没有发生变化的反应物是__ 。
(2)写出一个包含上述七种物质的氧化还原反应方程式(需配平)__ 。
(3)上述反应中,氧化剂是__ ,1mol氧化剂在反应中__ (填“得到”或“失去”)__ mol电子。
(4)如果在反应后的溶液中加入NaBiO3,溶液又显紫红色。此现象说明NaBiO3具有__ (填“氧化性”或“还原性”)。写出该反应的离子方程式:__ 。
(提示:NaBiO3为黄色或棕色粉末,不溶于冷水,在该反应中转化为Bi3+)
(1)该反应中,化合价升高的反应物是
(2)写出一个包含上述七种物质的氧化还原反应方程式(需配平)
(3)上述反应中,氧化剂是
(4)如果在反应后的溶液中加入NaBiO3,溶液又显紫红色。此现象说明NaBiO3具有
(提示:NaBiO3为黄色或棕色粉末,不溶于冷水,在该反应中转化为Bi3+)
您最近一年使用:0次
2020-09-10更新
|
109次组卷
|
5卷引用:黑龙江省伊春市伊美区第二中学2021届高三上学期开学考试化学试题
名校
7 . 某城市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5 μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)PM2.5分散在空气中形成的分散系________ (填“属于”或“不属于”)胶体。
(2)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断待测试样为________ (填“酸”或“碱”)性,表示该试样酸碱性的c(H+)或c(OH-)=________ mol·L-1。
(3)煤燃烧排放的烟气含有SO2和NOx,形成酸雨,污染大气,采用NaClO2溶液在碱性条件下可对烟气进行脱硫,脱硝,效果非常好。完成下列对烟气脱硝过程的离子方程式。______ 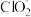 +
+______ NO+______ =______ Cl-+______  +
+______
(4)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。写出焦炭与水蒸气反应的化学方程式:__________________ 。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是______ (填字母)。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(5)汽车尾气中NOx和CO的生成及转化。
①汽车启动后,汽缸温度越高,单位时间内NO排放量越大,写出汽缸中生成NO的化学方程式:_________________________________________________________________ 。
②汽车燃油不完全燃烧时产生CO,目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为__________________________________________________ 。
(1)PM2.5分散在空气中形成的分散系
(2)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ |  | 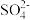 |  | Cl- |
| 浓度/mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断待测试样为
(3)煤燃烧排放的烟气含有SO2和NOx,形成酸雨,污染大气,采用NaClO2溶液在碱性条件下可对烟气进行脱硫,脱硝,效果非常好。完成下列对烟气脱硝过程的离子方程式。
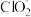 +
+ +
+(4)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。写出焦炭与水蒸气反应的化学方程式:
②洗涤含SO2的烟气。以下物质可作洗涤剂的是
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(5)汽车尾气中NOx和CO的生成及转化。
①汽车启动后,汽缸温度越高,单位时间内NO排放量越大,写出汽缸中生成NO的化学方程式:
②汽车燃油不完全燃烧时产生CO,目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为
您最近一年使用:0次
2020-08-14更新
|
128次组卷
|
10卷引用:黑龙江省齐齐哈尔三立高级中学2022届高三上学期开学考试化学试题
黑龙江省齐齐哈尔三立高级中学2022届高三上学期开学考试化学试题天津市耀华中学2017-2018学年高一上学期期末考试化学试题鲁科版必修一2019—2020学年高一上学期期末考试模拟试题贵州省施秉县一中2019-2020学年高一上学期期末考试化学试题广西壮族自治区崇左市大新县大新中学2019-2020学年高一上学期期末考试化学试题广西来宾市忻城县高级中学2019-2020学年高一上学期期末考试化学试题(已下线)4.3 防治二氧化硫对环境的污染练习(1)——《高中新教材同步备课》(苏教版 必修第一册)鲁科版(2019)高一必修第一册第3章 物质的性质与转化 总结检测山东省威海乳山市第一中学2022-2023学年高一上学期12月月考化学试题微项目 论证重污染天气“汽车限行”的合理性
名校
解题方法
8 . (1)合成氨工业生产中所用的αFe催化剂的主要成分是FeO、Fe2O3。
①某FeO、Fe2O3混合物中,铁原子、氧原子的物质的量之比为4∶5,其中FeO、Fe2O3的物质的量之比为____ 。
②当催化剂中+2价Fe与+3价Fe的物质的量之比为1∶2时,其催化活性最高,此时铁的氧化物的混合物中铁原子的质量分数为____ (用小数表示,保留2位小数)。
(2)电子工业常用30%的FeCl3溶液腐蚀绝缘板上的铜箔,制造印刷电路板。
①用FeO稀盐酸、氯气制取FeCl3溶液的离子方程式为____ 、____ 。检验溶液中Fe3+的试剂是____ 。
②写出FeCl3溶液与金属铜发生反应的化学方程式:____ ,当转移电子数为6.02×1024时,被氧化的物质的质量为____ 。
①某FeO、Fe2O3混合物中,铁原子、氧原子的物质的量之比为4∶5,其中FeO、Fe2O3的物质的量之比为
②当催化剂中+2价Fe与+3价Fe的物质的量之比为1∶2时,其催化活性最高,此时铁的氧化物的混合物中铁原子的质量分数为
(2)电子工业常用30%的FeCl3溶液腐蚀绝缘板上的铜箔,制造印刷电路板。
①用FeO稀盐酸、氯气制取FeCl3溶液的离子方程式为
②写出FeCl3溶液与金属铜发生反应的化学方程式:
您最近一年使用:0次
解题方法
9 . 以下是与绿色化学、环境保护和人类健康息息相关的三个主题,请根据已知信息回答下列问题:
(1)下列制备氯乙烷的反应中原子经济性最高的是_____ (填字母)。
A.CH2=CH2+HCl→CH3CH2Cl
B.CH3CH2OH+HCl CH3CH2Cl+H2O
CH3CH2Cl+H2O
C.CH3CH3+Cl2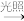 CH3CH2Cl+HCl
CH3CH2Cl+HCl
D.CH2=CHCl+H2 CH3CH2Cl
CH3CH2Cl
由上述四个反应可归纳出,原子经济性最高的是______ (填反应类型)。
(2)有毒物质的无害化处理也是绿色化学研究的内容之一。ClO2是一种性能优良的消毒剂,它可将废水中少量的CN-等有毒的酸根离子氧化而除去。请写出用ClO2将废水中的CN-氧化成无毒气体的离子方程式:______ ,该方法的优点是_______ 。
(3)某饮用水厂由天然水制备纯净水(去离子水)的工艺流程示意图如图:
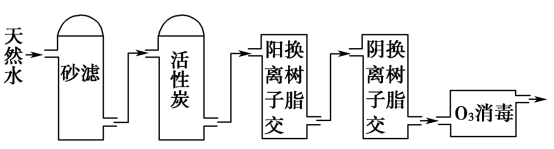
活性炭的作用是_______ ;O3消毒的优点是_______ 。
(1)下列制备氯乙烷的反应中原子经济性最高的是
A.CH2=CH2+HCl→CH3CH2Cl
B.CH3CH2OH+HCl
 CH3CH2Cl+H2O
CH3CH2Cl+H2OC.CH3CH3+Cl2
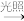 CH3CH2Cl+HCl
CH3CH2Cl+HClD.CH2=CHCl+H2
 CH3CH2Cl
CH3CH2Cl由上述四个反应可归纳出,原子经济性最高的是
(2)有毒物质的无害化处理也是绿色化学研究的内容之一。ClO2是一种性能优良的消毒剂,它可将废水中少量的CN-等有毒的酸根离子氧化而除去。请写出用ClO2将废水中的CN-氧化成无毒气体的离子方程式:
(3)某饮用水厂由天然水制备纯净水(去离子水)的工艺流程示意图如图:

活性炭的作用是
您最近一年使用:0次
2020-01-13更新
|
777次组卷
|
10卷引用:云南省富宁县一中2019-2020学年高二上学期开学考试化学试题
云南省富宁县一中2019-2020学年高二上学期开学考试化学试题步步为赢 高一化学暑假作业:作业十七 资源综合利用 环境保护云南省通海三中2019-2020学年高二上学期期末考试化学试题云南省盈江县民族完全中学2019-2020学年高二上学期期末考试化学试题人教版高中化学必修二第四单元《化学与自然资源的开发利用》测试卷人教版2019必修第二册 第八章 本章复习提升(已下线)8.3 环境保护与绿色化学(练好题)(基础过关)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)(已下线)第30讲 环境保护与绿色化学(word讲义)-【帮课堂】2021-2022学年高一化学同步精品讲义(人教版2019必修第二册)(已下线)8.3 环境保护与绿色化学——同步学习必备知识(已下线)第8讲 化学与可持续发展
名校
10 . Ⅰ.某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉-碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4mL 0.5 mol·L-1的亚硫酸钠溶液,蓝色恰好完全褪去。
(1)写出实验①中发生反应的离子方程式:____ 。
(2)实验②的化学反应中转移电子的物质的量是____ 。
Ⅱ.(3)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1mol O3转化为1mol O2和1mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是____ (填序号)。
A.Cl2 B.H2O2 C.ClO2 D.O3
(4)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是____ (用离子方程式表示)。
实验①:在淀粉-碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4mL 0.5 mol·L-1的亚硫酸钠溶液,蓝色恰好完全褪去。
(1)写出实验①中发生反应的离子方程式:
(2)实验②的化学反应中转移电子的物质的量是
Ⅱ.(3)Cl2、H2O2、ClO2(还原产物为Cl-)、O3(1mol O3转化为1mol O2和1mol H2O)等物质常被用作消毒剂。等物质的量的上述物质消毒效率最高的是
A.Cl2 B.H2O2 C.ClO2 D.O3
(4)“84”消毒液(主要成分是NaClO)和洁厕剂(主要成分是浓盐酸)不能混用,原因是
您最近一年使用:0次
2019-09-20更新
|
232次组卷
|
3卷引用:福建省长泰县第一中学2020届高三上学期期初考试化学试题
福建省长泰县第一中学2020届高三上学期期初考试化学试题江苏省淮安市涟水县第一中学2020届高三上学期10月月考化学试题(已下线)4.2.2 氧化还原方程式的配平练习(2)——《高中新教材同步备课》(苏教版 必修第一册)



