名校
1 . 某学习小组将氯气和空气按体积比1∶3混合,通入含水 的碳酸钠中制备
的碳酸钠中制备 ,然后用水吸收
,然后用水吸收 制备次氯酸溶液。
制备次氯酸溶液。
ⅰ. 在饱和食盐水中溶解度很小,能与含水
在饱和食盐水中溶解度很小,能与含水 的碳酸钠反应生成
的碳酸钠反应生成 。
。
ⅱ. 极易溶于水生成
极易溶于水生成 ;
; 的沸点为
的沸点为 ,
, 以上分解为
以上分解为 和
和 。
。
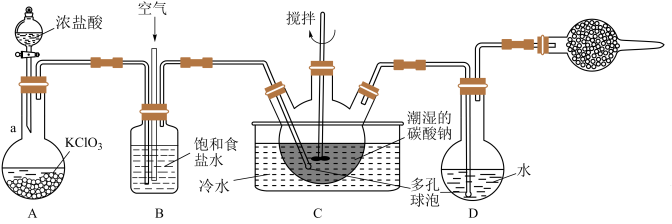
(1)仪器 的名称是
的名称是_________ ,A中发生反应的离子方程式为_________ 。
(2)实验中须控制 与空气(不参与反应)的体积比为
与空气(不参与反应)的体积比为 ,装置
,装置 的作用
的作用__________________ (答出2条即可)
(3)装置 中生成
中生成 ,反应的化学方程式为
,反应的化学方程式为__________________ 。
(4)将制得的 溶液加入滴有酚酞的氢氧化钠溶液中,观察到溶液红色褪去。溶液褪色的原因可能有两个:①
溶液加入滴有酚酞的氢氧化钠溶液中,观察到溶液红色褪去。溶液褪色的原因可能有两个:① 与
与 发生中和反应,②
发生中和反应,②____________ 。设计实验探究溶液红色褪去的原因___________________________ 。
(5)测定装置D中 溶液的物质的量浓度的实验方案:取
溶液的物质的量浓度的实验方案:取 溶液,加入足量
溶液,加入足量 溶液,再加入足量硝酸银溶液,过滤,洗涤,干燥,用电子天平称量沉淀的质量为
溶液,再加入足量硝酸银溶液,过滤,洗涤,干燥,用电子天平称量沉淀的质量为 ,则
,则 溶液的物质的量浓度为
溶液的物质的量浓度为______  (
( 可被
可被 还原成
还原成 )。
)。
 的碳酸钠中制备
的碳酸钠中制备 ,然后用水吸收
,然后用水吸收 制备次氯酸溶液。
制备次氯酸溶液。ⅰ.
 在饱和食盐水中溶解度很小,能与含水
在饱和食盐水中溶解度很小,能与含水 的碳酸钠反应生成
的碳酸钠反应生成 。
。ⅱ.
 极易溶于水生成
极易溶于水生成 ;
; 的沸点为
的沸点为 ,
, 以上分解为
以上分解为 和
和 。
。
(1)仪器
 的名称是
的名称是(2)实验中须控制
 与空气(不参与反应)的体积比为
与空气(不参与反应)的体积比为 ,装置
,装置 的作用
的作用(3)装置
 中生成
中生成 ,反应的化学方程式为
,反应的化学方程式为(4)将制得的
 溶液加入滴有酚酞的氢氧化钠溶液中,观察到溶液红色褪去。溶液褪色的原因可能有两个:①
溶液加入滴有酚酞的氢氧化钠溶液中,观察到溶液红色褪去。溶液褪色的原因可能有两个:① 与
与 发生中和反应,②
发生中和反应,②(5)测定装置D中
 溶液的物质的量浓度的实验方案:取
溶液的物质的量浓度的实验方案:取 溶液,加入足量
溶液,加入足量 溶液,再加入足量硝酸银溶液,过滤,洗涤,干燥,用电子天平称量沉淀的质量为
溶液,再加入足量硝酸银溶液,过滤,洗涤,干燥,用电子天平称量沉淀的质量为 ,则
,则 溶液的物质的量浓度为
溶液的物质的量浓度为 (
( 可被
可被 还原成
还原成 )。
)。
您最近一年使用:0次
2023-08-22更新
|
739次组卷
|
5卷引用:黑龙江省大庆铁人中学2023-2024学年高一上学期期末考试化学试题
黑龙江省大庆铁人中学2023-2024学年高一上学期期末考试化学试题 山东省淄博实验中学2022-2023学年高一上学期期末考试化学试题(已下线)专题04 钠、氯及其化合物-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)海南省白沙学校2023-2024学年高一上学期期末考试化学试题四川省射洪中学校2023-2024学年高一(强基班)上学期第三次月考化学试题
名校
2 . 化合物X是一种由三种元素组成的重要化工原料,其相对分子质量小于200,已知B、D含有一种相同的元素且在常温下均为气体化合物,其中气体B可使品红溶液褪色,C可通过单质间的化合反应得到。(部分反应条件省略)请回答:
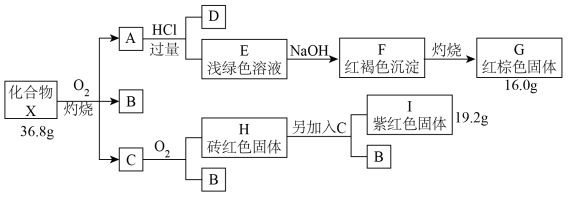
(1)写出X与 反应生成A、B、C的化学方程式
反应生成A、B、C的化学方程式______ 。
(2)检验溶液E中金属阳离子的实验操作是______ 。
(3)B和D两种气体混合发生的反应中,氧化产物与还原产物的质量之比为______ 。
(4)F溶于适量的盐酸中得到J,将5∼6滴J滴入 沸腾的蒸馏水中加热可得到K,区别J和K的方法是
沸腾的蒸馏水中加热可得到K,区别J和K的方法是______ 。
(5)如图中所示,生成 紫红色固体I,吸收
紫红色固体I,吸收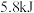 热量,写出该反应的热化学方程式
热量,写出该反应的热化学方程式______ 。
(6)将固体I溶于 与
与 的混合溶液,向其中滴加
的混合溶液,向其中滴加 的氨水直至沉淀溶解,写出沉淀溶解的离子方程式
的氨水直至沉淀溶解,写出沉淀溶解的离子方程式______ ,再加入 95%的乙醇后得到深蓝色晶体,该晶体的化学式为
95%的乙醇后得到深蓝色晶体,该晶体的化学式为______ 。

(1)写出X与
 反应生成A、B、C的化学方程式
反应生成A、B、C的化学方程式(2)检验溶液E中金属阳离子的实验操作是
(3)B和D两种气体混合发生的反应中,氧化产物与还原产物的质量之比为
(4)F溶于适量的盐酸中得到J,将5∼6滴J滴入
 沸腾的蒸馏水中加热可得到K,区别J和K的方法是
沸腾的蒸馏水中加热可得到K,区别J和K的方法是(5)如图中所示,生成
 紫红色固体I,吸收
紫红色固体I,吸收 热量,写出该反应的热化学方程式
热量,写出该反应的热化学方程式(6)将固体I溶于
 与
与 的混合溶液,向其中滴加
的混合溶液,向其中滴加 的氨水直至沉淀溶解,写出沉淀溶解的离子方程式
的氨水直至沉淀溶解,写出沉淀溶解的离子方程式 95%的乙醇后得到深蓝色晶体,该晶体的化学式为
95%的乙醇后得到深蓝色晶体,该晶体的化学式为
您最近一年使用:0次
名校
解题方法
3 . 汽车尾气中含有CO、 等有害气体。
等有害气体。
(1) 能形成酸雨,写出
能形成酸雨,写出 转化为
转化为 的化学方程式:
的化学方程式:___________ 。
(2)汽车尾气中NO生成过程的能量变化示意图如图甲所示:

甲
该条件下, 和
和 完全反应生成2 mol NO时需要
完全反应生成2 mol NO时需要___________ (吸收或释放)___________ kJ的能量。
(3)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图乙所示:

①NiO电极上发生的是___________ 反应(填“氧化”或“还原”)。
②外电路中,电子的流动方向是从___________ 电极流出(填NiO或Pt);Pt电极上的电极反应式为___________ 。
 等有害气体。
等有害气体。(1)
 能形成酸雨,写出
能形成酸雨,写出 转化为
转化为 的化学方程式:
的化学方程式:(2)汽车尾气中NO生成过程的能量变化示意图如图甲所示:

甲
该条件下,
 和
和 完全反应生成2 mol NO时需要
完全反应生成2 mol NO时需要(3)通过NO传感器可监测汽车尾气中NO的含量,其工作原理如图乙所示:

①NiO电极上发生的是
②外电路中,电子的流动方向是从
您最近一年使用:0次
名校
4 . Ⅰ.海水中提取溴和镁的流程如下:

(1)①海水中通入氯气反应的离子方程式为:___________ 。
(2)步骤②③的目的是___________ 。
(3)④步骤方程式:___________ 。
Ⅱ. 的一种制备方法如下图所示:
的一种制备方法如下图所示:

(4)加入Fe粉进行转化反应的离子方程式为___________ ,生成的沉淀与硝酸反应,生成___________ 后可循环使用。
(5)通入 的过程中,若氧化产物只有一种,反应的化学方程式为
的过程中,若氧化产物只有一种,反应的化学方程式为___________ 。
(6)氧化过程的氧化剂可以选用 溶液,混合可生成
溶液,混合可生成 沉淀和
沉淀和 ,若生成
,若生成 ,消耗的KI至少为
,消耗的KI至少为___________ mol。

(1)①海水中通入氯气反应的离子方程式为:
(2)步骤②③的目的是
(3)④步骤方程式:
Ⅱ.
 的一种制备方法如下图所示:
的一种制备方法如下图所示:
(4)加入Fe粉进行转化反应的离子方程式为
(5)通入
 的过程中,若氧化产物只有一种,反应的化学方程式为
的过程中,若氧化产物只有一种,反应的化学方程式为(6)氧化过程的氧化剂可以选用
 溶液,混合可生成
溶液,混合可生成 沉淀和
沉淀和 ,若生成
,若生成 ,消耗的KI至少为
,消耗的KI至少为
您最近一年使用:0次
2023-07-21更新
|
74次组卷
|
2卷引用:黑龙江省实验中学2022-2023学年高一下学期期末考试化学试题
名校
解题方法
5 . 海洋资源丰富,其化学资源的开发利用应用广泛。
Ⅰ.工业以浓缩海水为原料提取溴的部分过程如图:
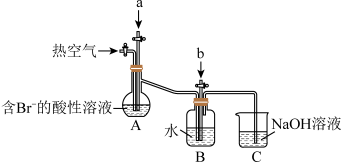
某课外小组在实验室模拟上述过程设计如图装置进行实验(所有橡胶制品均已被保护,夹持装置已略去)。
(1)浓缩海水可以用于提取冶炼金属镁,冶炼Mg的化学方程式为___________ 。
(2)B装置中通入气体b反应的离子方程式为___________ 。
(3)为提取B装置中的溴元素进行如下实验:向反应后B装置的溶液中通入氯气,充分反应得到混合液。从混合液中提取溴单质还需要___________ (填实验操作名称)。
Ⅱ.海带中含丰富的碘。为了从海带中提取碘,某研究性学习小组设计如下实验:

(4)步骤⑤中涉及到的操作名称为___________ ,该步骤还可以选取下列中的哪种试剂替代苯:___________ (填标号)。
A.乙醇 B.四氯化碳 C.乙酸 D.裂化汽油
(5)若要制取127g碘单质,理论上转移电子的物质的量为___________ 。
Ⅰ.工业以浓缩海水为原料提取溴的部分过程如图:

某课外小组在实验室模拟上述过程设计如图装置进行实验(所有橡胶制品均已被保护,夹持装置已略去)。
(1)浓缩海水可以用于提取冶炼金属镁,冶炼Mg的化学方程式为
(2)B装置中通入气体b反应的离子方程式为
(3)为提取B装置中的溴元素进行如下实验:向反应后B装置的溶液中通入氯气,充分反应得到混合液。从混合液中提取溴单质还需要
Ⅱ.海带中含丰富的碘。为了从海带中提取碘,某研究性学习小组设计如下实验:

(4)步骤⑤中涉及到的操作名称为
A.乙醇 B.四氯化碳 C.乙酸 D.裂化汽油
(5)若要制取127g碘单质,理论上转移电子的物质的量为
您最近一年使用:0次
名校
解题方法
6 . 科学、安全、有效和合理地开发自然资源,对生产、生活有重要价值。请回答下列问题:
(1)活性炭吸附法是工业提取碘的方法之一,其流程如下:
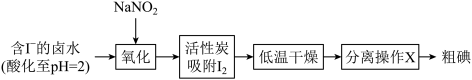
已知:pH=2时,Ⅰ.NaNO2溶液只能将I-氧化为I2,同时生成NO
Ⅱ.2 +I2+4H+=2
+I2+4H+=2 +2Mn2++2H2O
+2Mn2++2H2O
①氧化过程的离子方程式为___________ 。
②根据I2的特性,分离操作X为___________ ,冷凝得到粗碘。
③酸性KMnO4是常用的强氧化剂,但该方法中却选择了价格较高的NaNO2,原因是___________ 。
④活性炭上吸附的I2还能用浓Na2CO3溶液吸收,每吸收3molI2转移5mol电子,同时有气体放出,该反应的离子方程式是___________ 。
(2)以金红石(主要成分为 )为原料,制取Ti的工艺流程如图所示:
)为原料,制取Ti的工艺流程如图所示:

①Ⅰ在高温条件下进行,产物中有一种可燃性无色气体。Ⅰ中反应的化学方程式为___________ 。
②Ⅱ中钛的提取率在不同温度下随时间变化的曲线如图所示,则反应适宜的温度为___________ ℃。

③Ⅱ中氩气的作用是___________ 。
(1)活性炭吸附法是工业提取碘的方法之一,其流程如下:

已知:pH=2时,Ⅰ.NaNO2溶液只能将I-氧化为I2,同时生成NO
Ⅱ.2
 +I2+4H+=2
+I2+4H+=2 +2Mn2++2H2O
+2Mn2++2H2O①氧化过程的离子方程式为
②根据I2的特性,分离操作X为
③酸性KMnO4是常用的强氧化剂,但该方法中却选择了价格较高的NaNO2,原因是
④活性炭上吸附的I2还能用浓Na2CO3溶液吸收,每吸收3molI2转移5mol电子,同时有气体放出,该反应的离子方程式是
(2)以金红石(主要成分为
 )为原料,制取Ti的工艺流程如图所示:
)为原料,制取Ti的工艺流程如图所示:
①Ⅰ在高温条件下进行,产物中有一种可燃性无色气体。Ⅰ中反应的化学方程式为
②Ⅱ中钛的提取率在不同温度下随时间变化的曲线如图所示,则反应适宜的温度为

③Ⅱ中氩气的作用是
您最近一年使用:0次
名校
解题方法
7 . 某兴趣小组用铬铁矿(FeCr2O4,含Al、Si氧化物等杂质)为主要原料制备K2Cr2O7晶体,流程如下:

(1)焙烧时向矿料中加入碳酸钠和氧气,发生如下反应FeCr2O4转化为Na2CrO4,Na2CO3+SiO2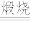 Na2SiO3+CO2↑,Na2CO3+Al2O3
Na2SiO3+CO2↑,Na2CO3+Al2O3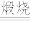 2NaAlO2+CO2↑
2NaAlO2+CO2↑
写出FeCr2O4转化为Na2CrO4的化学方程式_____________________________ 。
(2)滤渣1的主要成分是_____ 。
(3)滤渣2的成分是_____ 和__ 。
(4)流程中调pH:已知2CrO +2H+⇌Cr2O
+2H+⇌Cr2O +H2O,蒸发结晶所产生的副产品是
+H2O,蒸发结晶所产生的副产品是_____ 。
(5)结晶步骤Na2Cr2O7+2KCl= K2Cr2O7+2NaCl该反应是_________ 类型(四种基本反应类型)。
(6)该小组用m1 kg铬铁矿(FeCr2O4 50%)制备K2Cr2O7,最终得到m2 kg,产率为____ 。

(1)焙烧时向矿料中加入碳酸钠和氧气,发生如下反应FeCr2O4转化为Na2CrO4,Na2CO3+SiO2
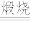 Na2SiO3+CO2↑,Na2CO3+Al2O3
Na2SiO3+CO2↑,Na2CO3+Al2O3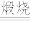 2NaAlO2+CO2↑
2NaAlO2+CO2↑写出FeCr2O4转化为Na2CrO4的化学方程式
(2)滤渣1的主要成分是
(3)滤渣2的成分是
(4)流程中调pH:已知2CrO
 +2H+⇌Cr2O
+2H+⇌Cr2O +H2O,蒸发结晶所产生的副产品是
+H2O,蒸发结晶所产生的副产品是(5)结晶步骤Na2Cr2O7+2KCl= K2Cr2O7+2NaCl该反应是
(6)该小组用m1 kg铬铁矿(FeCr2O4 50%)制备K2Cr2O7,最终得到m2 kg,产率为
您最近一年使用:0次
名校
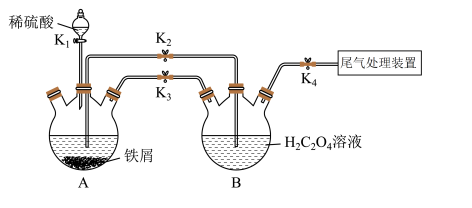
8 . K3[Fe(C2O4)3]·3H2O[三草酸合铁酸钾(M=491 g·mol-1)]易溶于水,难溶于乙醇,常用作有机反应的催化剂。某同学利用下图装置制备FeC2O4·2H2O,然后再制备三草酸合铁酸钾。
回答下列问题:
I.晶体的制备
(1)三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O,中心离子价层电子轨道表示式______________ 。
(2)打开K1、K3、K4,关闭K2,制备FeSO4。为使生成的FeSO4溶液与H2C2O4溶液接触,应进行的操作为__________________ 。
(3)向制得的FeC2O4(s)中加入过量K2C2O4溶液和H2C2O4溶液,水浴40°C下加热,缓慢滴加H2O2溶液,制得K3[Fe(C2O4)3],该反应的化学方程式为______________________ ;将上述混合物煮沸,加入饱和H2C2O4溶液,充分反应后冷却、结晶;结晶完全后减压抽滤、洗涤、干燥得到目标产物。
i.缓慢滴加H2O2溶液,水浴控温在40°C的原因是___________________ 。
ii.制备K3[Fe(C2O4)3]·3H2O时可能有红褐色沉淀生成,则H2C2O4的作用是_______________ 。
iii.为促进结晶,冷却后可加入_____________ (填试剂名称)。
II.阴离子电荷的测定
准确称取mg三草酸合铁酸钾加水溶解,控制流速,使其全部通过装有阴离子交换树脂(用R≡N+Cl-表示)的交换柱,发生阴离子(Xz-)交换:zR≡N+Cl-+ Xz- (R≡N+)zXz-+zCl-。结束后,用去离子水洗涤交换柱,合并流出液,并将其配成250 mL溶液。取25.00mL该溶液,以K2CrO4溶液为指示剂,用c mol·L-1 AgNO3标准液滴定至终点,消耗标准液V mL。
(R≡N+)zXz-+zCl-。结束后,用去离子水洗涤交换柱,合并流出液,并将其配成250 mL溶液。取25.00mL该溶液,以K2CrO4溶液为指示剂,用c mol·L-1 AgNO3标准液滴定至终点,消耗标准液V mL。
(4)阴离子电荷数为____________ (用含字母的代数式表示);若交换时样品液的流速过快,则会导致测定结果_____ (填“偏高“偏低”或“无影响”)。

回答下列问题:
I.晶体的制备
(1)三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O,中心离子价层电子轨道表示式
(2)打开K1、K3、K4,关闭K2,制备FeSO4。为使生成的FeSO4溶液与H2C2O4溶液接触,应进行的操作为
(3)向制得的FeC2O4(s)中加入过量K2C2O4溶液和H2C2O4溶液,水浴40°C下加热,缓慢滴加H2O2溶液,制得K3[Fe(C2O4)3],该反应的化学方程式为
i.缓慢滴加H2O2溶液,水浴控温在40°C的原因是
ii.制备K3[Fe(C2O4)3]·3H2O时可能有红褐色沉淀生成,则H2C2O4的作用是
iii.为促进结晶,冷却后可加入
II.阴离子电荷的测定
准确称取mg三草酸合铁酸钾加水溶解,控制流速,使其全部通过装有阴离子交换树脂(用R≡N+Cl-表示)的交换柱,发生阴离子(Xz-)交换:zR≡N+Cl-+ Xz-
 (R≡N+)zXz-+zCl-。结束后,用去离子水洗涤交换柱,合并流出液,并将其配成250 mL溶液。取25.00mL该溶液,以K2CrO4溶液为指示剂,用c mol·L-1 AgNO3标准液滴定至终点,消耗标准液V mL。
(R≡N+)zXz-+zCl-。结束后,用去离子水洗涤交换柱,合并流出液,并将其配成250 mL溶液。取25.00mL该溶液,以K2CrO4溶液为指示剂,用c mol·L-1 AgNO3标准液滴定至终点,消耗标准液V mL。(4)阴离子电荷数为
您最近一年使用:0次
名校
解题方法
9 . 利用锌精矿(ZnS)和软锰矿(MnO2)两种矿料(含少量杂质Fe、Cu、Pb等元素的化合物及SiO2)生产硫酸锌和硫酸锰的流程如下:

已知常温下:①H2S的电离常数为:Ka1=1.0 ×10-7,Ka2=1.0 ×10-13;
②Ksp(ZnS)=1.0 ×10-22,Ksp(MnS)=1.0 ×10-13;
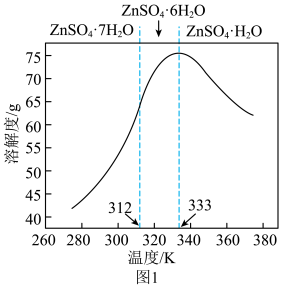
③ZnSO4的溶解度如图1所示:
回答下列问题:
(1)基态S原子占据最高能级的原子轨道形状为_________________________ 。
(2)“滤渣1”主要成分为_____________ 和硫;写出“酸浸”过程中MnO2和ZnS反应的化学方程式_________________ 。
(3)“除铁”的萃取剂为磷酸二(2-乙基己基)酯(用HA表示),萃取后含铁的物质为[Fe(HA)2(H2O)2]ASO4,该物质中Fe3+的配位数为___________ 。
(4)BaS为可溶性钡盐。向“水相1”中加入适量BaS,发生主要反应的离子方程式为_____________ ;若溶液中S2-的浓度控制不当,会造成Zn2+、Mn2+沉淀而损失,若溶液中Zn2+、Mn2+的浓度为0.10 mol·L-1,则应控制溶液中c(H+)不小于_____________ mol·L-1。(已知溶液中H2S的浓度为1.0×10-3 mol/L)
(5)从“反萃取液”中获得ZnSO4·H2O晶体的操作为:控制温度在_________________ K以上,蒸发至有大量固体析出、________________ 、洗涤、干燥。
(6)ZnSO4·H2O产品的纯度可用配位滴定法测定。下列关于滴定分析,正确的是 。

已知常温下:①H2S的电离常数为:Ka1=1.0 ×10-7,Ka2=1.0 ×10-13;
②Ksp(ZnS)=1.0 ×10-22,Ksp(MnS)=1.0 ×10-13;
③ZnSO4的溶解度如图1所示:

回答下列问题:
(1)基态S原子占据最高能级的原子轨道形状为
(2)“滤渣1”主要成分为
(3)“除铁”的萃取剂为磷酸二(2-乙基己基)酯(用HA表示),萃取后含铁的物质为[Fe(HA)2(H2O)2]ASO4,该物质中Fe3+的配位数为
(4)BaS为可溶性钡盐。向“水相1”中加入适量BaS,发生主要反应的离子方程式为
(5)从“反萃取液”中获得ZnSO4·H2O晶体的操作为:控制温度在
(6)ZnSO4·H2O产品的纯度可用配位滴定法测定。下列关于滴定分析,正确的是 。
| A.滴定前,锥形瓶和滴定管均须用标准溶液润洗 |
| B.将标准溶液装入滴定管时,应借助漏斗转移 |
| C.滴定终点时,读取标准液体积时俯视滴定管液面,则测得的体积比实际消耗的小 |
| D.滴定前滴定管尖嘴内有气泡,滴定后尖嘴内无气泡,则测得的体积比实际消耗的大 |
您最近一年使用:0次
名校
10 . 依据研究,含氯消毒剂可以有效灭活新冠病毒,为阻断疫情做出了巨大贡献。二氧化氯( )就是其中一种高效消毒灭菌剂。但其稳定性较差,可转化为
)就是其中一种高效消毒灭菌剂。但其稳定性较差,可转化为 保存。分别利用吸收法和电解法两种方法得到较稳定的
保存。分别利用吸收法和电解法两种方法得到较稳定的 。其工艺流程示意图如图所示:
。其工艺流程示意图如图所示:

已知:
①纯 易分解爆炸,一般用稀有气体或空气稀释到10%以下。
易分解爆炸,一般用稀有气体或空气稀释到10%以下。
②长期放置或高于60℃时 易分解生成
易分解生成 和NaCl。
和NaCl。
(1)步骤1中,生成 的离子方程式是
的离子方程式是___________ ,通入空气的作用是___________ 。
(2)方法1中,反应的离子方程式是___________ ,利用方法1制 时,温度不能超过20℃,可能的原因是
时,温度不能超过20℃,可能的原因是___________ 。
(3)方法2中, 是被
是被___________ (填“氧化”或“还原”)而生成。
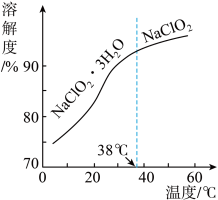
(4) 的溶解度曲线如图所示,步骤3中从
的溶解度曲线如图所示,步骤3中从 溶液中获得
溶液中获得 晶体的操作是
晶体的操作是___________ 。
(5)为测定制得的晶体中 的含量,做如下操作:
的含量,做如下操作:
①称取a g样品于烧杯中,加入适量蒸馏水溶解后加过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知: 。将所得混合液配成100mL待测溶液。
。将所得混合液配成100mL待测溶液。
②取25.00mL待测溶液,用b
 反应消耗,测得消耗标准溶液的体积为cmL(已知:
反应消耗,测得消耗标准溶液的体积为cmL(已知: )。
)。
样品中 的质量分数为
的质量分数为___________ (用含a、b、c的代数式表示)。
 )就是其中一种高效消毒灭菌剂。但其稳定性较差,可转化为
)就是其中一种高效消毒灭菌剂。但其稳定性较差,可转化为 保存。分别利用吸收法和电解法两种方法得到较稳定的
保存。分别利用吸收法和电解法两种方法得到较稳定的 。其工艺流程示意图如图所示:
。其工艺流程示意图如图所示:
已知:
①纯
 易分解爆炸,一般用稀有气体或空气稀释到10%以下。
易分解爆炸,一般用稀有气体或空气稀释到10%以下。②长期放置或高于60℃时
 易分解生成
易分解生成 和NaCl。
和NaCl。(1)步骤1中,生成
 的离子方程式是
的离子方程式是(2)方法1中,反应的离子方程式是
 时,温度不能超过20℃,可能的原因是
时,温度不能超过20℃,可能的原因是(3)方法2中,
 是被
是被(4)
 的溶解度曲线如图所示,步骤3中从
的溶解度曲线如图所示,步骤3中从 溶液中获得
溶液中获得 晶体的操作是
晶体的操作是
(5)为测定制得的晶体中
 的含量,做如下操作:
的含量,做如下操作:①称取a g样品于烧杯中,加入适量蒸馏水溶解后加过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:
 。将所得混合液配成100mL待测溶液。
。将所得混合液配成100mL待测溶液。②取25.00mL待测溶液,用b

 反应消耗,测得消耗标准溶液的体积为cmL(已知:
反应消耗,测得消耗标准溶液的体积为cmL(已知: )。
)。样品中
 的质量分数为
的质量分数为
您最近一年使用:0次



