名校
解题方法
1 . 科学、安全、有效和合理地开发自然资源,对生产、生活有重要价值。请回答下列问题:
(1)活性炭吸附法是工业提取碘的方法之一,其流程如下:
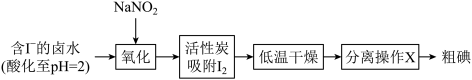
已知:pH=2时,Ⅰ.NaNO2溶液只能将I-氧化为I2,同时生成NO
Ⅱ.2 +I2+4H+=2
+I2+4H+=2 +2Mn2++2H2O
+2Mn2++2H2O
①氧化过程的离子方程式为___________ 。
②根据I2的特性,分离操作X为___________ ,冷凝得到粗碘。
③酸性KMnO4是常用的强氧化剂,但该方法中却选择了价格较高的NaNO2,原因是___________ 。
④活性炭上吸附的I2还能用浓Na2CO3溶液吸收,每吸收3molI2转移5mol电子,同时有气体放出,该反应的离子方程式是___________ 。
(2)以金红石(主要成分为 )为原料,制取Ti的工艺流程如图所示:
)为原料,制取Ti的工艺流程如图所示:

①Ⅰ在高温条件下进行,产物中有一种可燃性无色气体。Ⅰ中反应的化学方程式为___________ 。
②Ⅱ中钛的提取率在不同温度下随时间变化的曲线如图所示,则反应适宜的温度为___________ ℃。

③Ⅱ中氩气的作用是___________ 。
(1)活性炭吸附法是工业提取碘的方法之一,其流程如下:

已知:pH=2时,Ⅰ.NaNO2溶液只能将I-氧化为I2,同时生成NO
Ⅱ.2
 +I2+4H+=2
+I2+4H+=2 +2Mn2++2H2O
+2Mn2++2H2O①氧化过程的离子方程式为
②根据I2的特性,分离操作X为
③酸性KMnO4是常用的强氧化剂,但该方法中却选择了价格较高的NaNO2,原因是
④活性炭上吸附的I2还能用浓Na2CO3溶液吸收,每吸收3molI2转移5mol电子,同时有气体放出,该反应的离子方程式是
(2)以金红石(主要成分为
 )为原料,制取Ti的工艺流程如图所示:
)为原料,制取Ti的工艺流程如图所示:
①Ⅰ在高温条件下进行,产物中有一种可燃性无色气体。Ⅰ中反应的化学方程式为
②Ⅱ中钛的提取率在不同温度下随时间变化的曲线如图所示,则反应适宜的温度为

③Ⅱ中氩气的作用是
您最近一年使用:0次
2 . 某工厂的工业废水中含有大量的 和
和 ,为了减少污染并变废为宝,工厂拟定用以下流程从该废水中回收
,为了减少污染并变废为宝,工厂拟定用以下流程从该废水中回收 和金属
和金属 。请根据以下流程图,回答相关问题:
。请根据以下流程图,回答相关问题:

(1)操作Ⅰ和操作Ⅱ的方法是_______ 。
(2)步骤①加入的铁粉应_______ (选填“过量”或“少量”),写出该步骤中发生的所有氧化还原反应的离子方程式_______ 。
(3)固体A的成分是_______ (填名称)。
(4)操作Ⅱ加入试剂B的稀溶液,B的化学式为_______ ,该物质在该反应中作_______ 剂(选填“氧化”或“还原”)。
(5)取 溶液于试管中,滴加几滴
溶液于试管中,滴加几滴 溶液,生成的白色沉淀迅速变为灰绿色,最后变成红褐色,写出该反应中沉淀转化的化学反应方程式
溶液,生成的白色沉淀迅速变为灰绿色,最后变成红褐色,写出该反应中沉淀转化的化学反应方程式_______ 。
(6)如何检验所得 中不含有
中不含有
_______ 。
 和
和 ,为了减少污染并变废为宝,工厂拟定用以下流程从该废水中回收
,为了减少污染并变废为宝,工厂拟定用以下流程从该废水中回收 和金属
和金属 。请根据以下流程图,回答相关问题:
。请根据以下流程图,回答相关问题:
(1)操作Ⅰ和操作Ⅱ的方法是
(2)步骤①加入的铁粉应
(3)固体A的成分是
(4)操作Ⅱ加入试剂B的稀溶液,B的化学式为
(5)取
 溶液于试管中,滴加几滴
溶液于试管中,滴加几滴 溶液,生成的白色沉淀迅速变为灰绿色,最后变成红褐色,写出该反应中沉淀转化的化学反应方程式
溶液,生成的白色沉淀迅速变为灰绿色,最后变成红褐色,写出该反应中沉淀转化的化学反应方程式(6)如何检验所得
 中不含有
中不含有
您最近一年使用:0次
2023-01-01更新
|
186次组卷
|
3卷引用:黑龙江省鹤岗市第一中学2022-2023学年高一上学期期末考试化学试题
名校
3 . 按要求完成下列问题
(1)已知实验室制备NO的反应为: 。反应中氧化剂是
。反应中氧化剂是_______ ; 被氧化的元素是_______ ;氧化产物是_______ 。
(2)请配平下列方程式_______
_______Al +_______ + _______NaOH= _______
+ _______NaOH= _______ + _______
+ _______ ↑ + _______
↑ + _______
(3)用 溶液与Cu反应制作的印刷电路板,其制作原理可用
溶液与Cu反应制作的印刷电路板,其制作原理可用 表示。
表示。
①上式中X的化学式为_______ 。
②该反应的离子方程式为_______ 。
③请写出反应物氯化铁的电离方程式_______ 。
(1)已知实验室制备NO的反应为:
 。反应中氧化剂是
。反应中氧化剂是(2)请配平下列方程式
_______Al +_______
 + _______NaOH= _______
+ _______NaOH= _______ + _______
+ _______ ↑ + _______
↑ + _______
(3)用
 溶液与Cu反应制作的印刷电路板,其制作原理可用
溶液与Cu反应制作的印刷电路板,其制作原理可用 表示。
表示。①上式中X的化学式为
②该反应的离子方程式为
③请写出反应物氯化铁的电离方程式
您最近一年使用:0次
2022-12-20更新
|
126次组卷
|
2卷引用:黑龙江省鹤岗市绥滨县第一中学2021-2022年度高一上学期期中考试化学试题
名校
解题方法
4 . 煤中硫的存在形态分为有机硫和无机硫(CaSO4、硫化物及微量单质硫等)。库仑滴定法是常用的快捷检测煤中全硫含量的方法。其主要过程如下图所示。
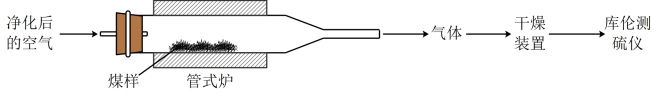
已知:在催化剂作用下,煤在管式炉中燃烧,出口气体主要含O2、CO2、H2O、N2、SO2。
(1)煤样需研磨成细小粉末,其目的是___________ 。
(2)高温下,煤中CaSO4完全转化为SO2,该反应的化学方程式为___________ 。
(3)通过干燥装置后,待测气体进入库仑测硫仪进行测定。
已知:库仑测硫仪中电解原理示意图如下。检测前,电解质溶液中 保持定值时,电解池不工作。待测气体进入电解池后,SO2溶解并将
保持定值时,电解池不工作。待测气体进入电解池后,SO2溶解并将 还原,测硫仪便立即自动进行电解到
还原,测硫仪便立即自动进行电解到 又回到原定值,测定结束,通过测定电解消耗的电量可以求得煤中含硫量。
又回到原定值,测定结束,通过测定电解消耗的电量可以求得煤中含硫量。
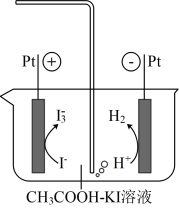
①SO2在电解池中发生反应的离子方程式为___________ 。
②测硫仪工作时电解池的阳极反应式为___________ 。
(4)煤样为ag,电解消耗的电量为x库仑,煤样中硫的质量分数为___________ 。已知:电解中转移1mol电子所消耗的电量为96500库仑。

已知:在催化剂作用下,煤在管式炉中燃烧,出口气体主要含O2、CO2、H2O、N2、SO2。
(1)煤样需研磨成细小粉末,其目的是
(2)高温下,煤中CaSO4完全转化为SO2,该反应的化学方程式为
(3)通过干燥装置后,待测气体进入库仑测硫仪进行测定。
已知:库仑测硫仪中电解原理示意图如下。检测前,电解质溶液中
 保持定值时,电解池不工作。待测气体进入电解池后,SO2溶解并将
保持定值时,电解池不工作。待测气体进入电解池后,SO2溶解并将 还原,测硫仪便立即自动进行电解到
还原,测硫仪便立即自动进行电解到 又回到原定值,测定结束,通过测定电解消耗的电量可以求得煤中含硫量。
又回到原定值,测定结束,通过测定电解消耗的电量可以求得煤中含硫量。
①SO2在电解池中发生反应的离子方程式为
②测硫仪工作时电解池的阳极反应式为
(4)煤样为ag,电解消耗的电量为x库仑,煤样中硫的质量分数为
您最近一年使用:0次
名校
解题方法
5 . 某小组利用 溶液和硫酸酸化的
溶液和硫酸酸化的 溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性
溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性 溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:
溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:
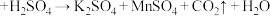
(1)配平下列化学方程式:___________ 。
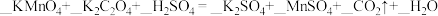
(2)表中
___________ mL,
___________ mL。
(3)探究温度对化学反应速率影响的实验编号是___________ (填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号___________ 。
(4)除通过测定酸性 溶液褪色所需时间来比较反应速率外,本实验还可通过测定
溶液褪色所需时间来比较反应速率外,本实验还可通过测定___________ 来比较化学反应速率。
(5)小组同学发现反应速率总是如图所示,其中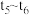 时间内速率变快的主要原因可能是①产物
时间内速率变快的主要原因可能是①产物 是该反应的催化剂、②
是该反应的催化剂、②___________ 。
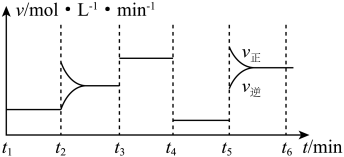
(6)实验①测得 溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率
溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率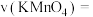
___________  。
。
 溶液和硫酸酸化的
溶液和硫酸酸化的 溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性
溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性 溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:
溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:
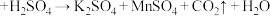
| 实验编号 | 实验温度/℃ |  酸性 酸性 溶液的体积/mL | 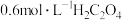 溶液的体积/mL |  的体 的体积/mL | 溶液褪色所 需时间/min |
| ① | 25 | 10 | 10 | 30 | |
| ② | 50 | 10 | 10 |  | |
| ③ | 25 | 10 |  | 35 |
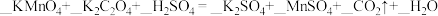
(2)表中


(3)探究温度对化学反应速率影响的实验编号是
(4)除通过测定酸性
 溶液褪色所需时间来比较反应速率外,本实验还可通过测定
溶液褪色所需时间来比较反应速率外,本实验还可通过测定(5)小组同学发现反应速率总是如图所示,其中
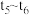 时间内速率变快的主要原因可能是①产物
时间内速率变快的主要原因可能是①产物 是该反应的催化剂、②
是该反应的催化剂、②
(6)实验①测得
 溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率
溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率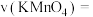
 。
。
您最近一年使用:0次
名校
解题方法
6 . 以硫铁矿(主要成分为FeS2,还有少量CuS、SiO2等杂质)为原料制备绿矾晶体(FeSO4·7H2O)的工艺流程如下:
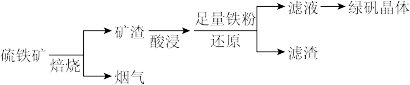
(1)“酸浸”过程,矿渣中的Fe2O3与稀H2SO4反应的离子方程式___________ 。
(2)烟气中的SO2会污染环境,可用足量氨水吸收,写出该反应的离子方程式___________ 。
(3)滤液中金属阳离子的检验方法___________ 。
(4)FeSO4溶液制备绿矾晶体过程中要保持H2SO4过量,理由___________ (结合化学用语说明原因)。
(5)燃料细菌脱硫法是用氧化亚铁硫杆菌(T。f)对硫铁矿进行催化脱硫,同时得到FeSO4溶液。其过程如图所示:
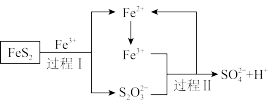
已知总反应为:FeS2+14Fe3++8H2O=2 +15Fe2++16H+
+15Fe2++16H+
将过程I离子方程式补充完整___________ 。
___________FeS2+___________Fe3++___________=7Fe2++___________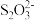 +___________H+
+___________H+
(6)绿矾晶体在空气中易被氧化。取xg样品,加水完全溶解,用酸化的amol·L-1K2Cr2O7溶液滴定至终点,消耗K2Cr2O7溶液bmL。反应原理:6Fe2++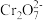 +14H+=6Fe3++2Cr3++7H2O。则绿矾晶体纯度的计算式为
+14H+=6Fe3++2Cr3++7H2O。则绿矾晶体纯度的计算式为___________ 。(FeSO4·7H2O摩尔质量为278g/mol)
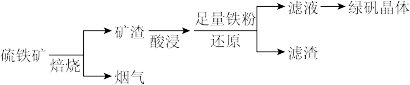
(1)“酸浸”过程,矿渣中的Fe2O3与稀H2SO4反应的离子方程式
(2)烟气中的SO2会污染环境,可用足量氨水吸收,写出该反应的离子方程式
(3)滤液中金属阳离子的检验方法
(4)FeSO4溶液制备绿矾晶体过程中要保持H2SO4过量,理由
(5)燃料细菌脱硫法是用氧化亚铁硫杆菌(T。f)对硫铁矿进行催化脱硫,同时得到FeSO4溶液。其过程如图所示:

已知总反应为:FeS2+14Fe3++8H2O=2
 +15Fe2++16H+
+15Fe2++16H+将过程I离子方程式补充完整
___________FeS2+___________Fe3++___________=7Fe2++___________
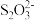 +___________H+
+___________H+(6)绿矾晶体在空气中易被氧化。取xg样品,加水完全溶解,用酸化的amol·L-1K2Cr2O7溶液滴定至终点,消耗K2Cr2O7溶液bmL。反应原理:6Fe2++
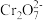 +14H+=6Fe3++2Cr3++7H2O。则绿矾晶体纯度的计算式为
+14H+=6Fe3++2Cr3++7H2O。则绿矾晶体纯度的计算式为
您最近一年使用:0次
名校
解题方法
7 . Ⅰ.钛(Ti)及其合金是理想的高强度、低密度结构材料。以钛渣(主要成分为TiO2,含少量V、Si和Al的氧化物杂质)为原料,制备金属钛的工艺流程如下:

已知“降温收尘”后,粗TiCl4中含有的几种物质的沸点:
回答下列问题:
(1)TiO2与C、Cl2,在600℃的沸腾炉中充分反应后,混合气体中各组分的分压如下表:
①该温度下,TiO2与C、Cl2反应的总化学方程式为_______ ;
②随着温度升高,尾气中CO的含量升高,原因是_______ 。
(2)“除钒”过程中的化学方程式为_______ ;“除硅、铝”过程中,分离TiCl4中含Si、Al杂质的方法是_______ 。
(3)“除钒”和“除硅、铝”的顺序_______ (填“能”或“不能”)交换,理由是_______ 。
(4)在稀有气体(如氩)氛围和加热的条件下,用镁与TiCl4反应可得到Ti,金属冶炼方法与本工艺流程中加入Mg冶炼Ti的方法相似的是_______。
Ⅱ.完成下列问题
(5)在一定条件下,工业上也可用CO2合成甲醇(CH3OH),其化学方程式为 。将amolCO2与bmolH2充入容积为2L的密闭容器中发生上述反应,tmin时测得甲醇的物质的量为cmol。计算0~tmin内CO2的反应速率为
。将amolCO2与bmolH2充入容积为2L的密闭容器中发生上述反应,tmin时测得甲醇的物质的量为cmol。计算0~tmin内CO2的反应速率为_______  。
。
(6)下列说法不正确的是(选填序号字母)_______ 。
a.氮气可用作保护气
b.向鸡蛋清溶液中加入少量CuSO4溶液,出现浑浊,分离沉淀后加足量水,沉淀不溶解,蛋白质发生了盐析
c.硝酸可用于制化肥、农药、炸药、染料、盐类等
d.某浓硝酸中含有溶质2mol,该浓硝酸与足量的铜充分反应生成1molNO2

已知“降温收尘”后,粗TiCl4中含有的几种物质的沸点:
| 物质 | TiCl4 | VOCl3 | SiCl4 | AlCl3 |
| 沸点/℃ | 136 | 127 | 57 | 180 |
回答下列问题:
(1)TiO2与C、Cl2,在600℃的沸腾炉中充分反应后,混合气体中各组分的分压如下表:
| 物质 | TiCl4 | CO | CO2 | Cl2 |
| 分压MPa | 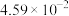 | 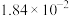 |  |  |
①该温度下,TiO2与C、Cl2反应的总化学方程式为
②随着温度升高,尾气中CO的含量升高,原因是
(2)“除钒”过程中的化学方程式为
(3)“除钒”和“除硅、铝”的顺序
(4)在稀有气体(如氩)氛围和加热的条件下,用镁与TiCl4反应可得到Ti,金属冶炼方法与本工艺流程中加入Mg冶炼Ti的方法相似的是_______。
| A.氧化汞分解制汞 | B.高炉炼铁 |
| C.铝热反应制锰 | D.电解熔融氯化钠制钠 |
Ⅱ.完成下列问题
(5)在一定条件下,工业上也可用CO2合成甲醇(CH3OH),其化学方程式为
 。将amolCO2与bmolH2充入容积为2L的密闭容器中发生上述反应,tmin时测得甲醇的物质的量为cmol。计算0~tmin内CO2的反应速率为
。将amolCO2与bmolH2充入容积为2L的密闭容器中发生上述反应,tmin时测得甲醇的物质的量为cmol。计算0~tmin内CO2的反应速率为 。
。(6)下列说法不正确的是(选填序号字母)
a.氮气可用作保护气
b.向鸡蛋清溶液中加入少量CuSO4溶液,出现浑浊,分离沉淀后加足量水,沉淀不溶解,蛋白质发生了盐析
c.硝酸可用于制化肥、农药、炸药、染料、盐类等
d.某浓硝酸中含有溶质2mol,该浓硝酸与足量的铜充分反应生成1molNO2
您最近一年使用:0次
2022-08-10更新
|
182次组卷
|
2卷引用:黑龙江省鹤岗市第一中学2021-2022学年高一下学期期末考试化学试题
名校
8 . 某混合物的无色溶液中,可能含有以下离子中的若干种:K+、Ca2+、Fe3+、NH 、Cl-、CO
、Cl-、CO 和SO
和SO 。现每次取10.00mL进行实验:
。现每次取10.00mL进行实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH后加热,收集到气体448mL(标准状况下);
③第三份加入足量BaCl2溶液后,生成白色沉淀,过滤、干燥,得到固体4.30g,该固体经足量盐酸洗涤,干燥后剩余2.33g。
(1)c(CO )=
)=_______ mol·L−1;
(2)某同学认为该溶液中一定存在K+,浓度范围是_______ ;
(3)根据以上实验,某离子可能存在。检验该离子是否存在的方法是:_______ ;
(4)写出③中固体加入足量盐酸洗涤的离子方程式为_______ 。
(5)以NaIO3为原料制备I2的方法是:先向NaIO3溶液中加入计量的NaHSO3,生成碘化物;再向混合溶液中加入NaIO3溶液,反应得到I2,上述制备I2的总反应的离子方程式为_______ 。
(6)KI溶液和CuSO4溶液混合可生成CuI沉淀和I2,若生成1mol I2,消耗的KI至少为_______ mol。I2在溶液中可发生反应I2+I- I
I 。实验室中使用过量的KI与CuSO4溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量KI的原因是
。实验室中使用过量的KI与CuSO4溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量KI的原因是_______ 。
 、Cl-、CO
、Cl-、CO 和SO
和SO 。现每次取10.00mL进行实验:
。现每次取10.00mL进行实验:①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH后加热,收集到气体448mL(标准状况下);
③第三份加入足量BaCl2溶液后,生成白色沉淀,过滤、干燥,得到固体4.30g,该固体经足量盐酸洗涤,干燥后剩余2.33g。
(1)c(CO
 )=
)=(2)某同学认为该溶液中一定存在K+,浓度范围是
(3)根据以上实验,某离子可能存在。检验该离子是否存在的方法是:
(4)写出③中固体加入足量盐酸洗涤的离子方程式为
(5)以NaIO3为原料制备I2的方法是:先向NaIO3溶液中加入计量的NaHSO3,生成碘化物;再向混合溶液中加入NaIO3溶液,反应得到I2,上述制备I2的总反应的离子方程式为
(6)KI溶液和CuSO4溶液混合可生成CuI沉淀和I2,若生成1mol I2,消耗的KI至少为
 I
I 。实验室中使用过量的KI与CuSO4溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量KI的原因是
。实验室中使用过量的KI与CuSO4溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量KI的原因是
您最近一年使用:0次
9 . 二氧化硫既能污染环境,又在生活、生产中有着广泛的作用,根据要求回答问题。
Ⅰ.如图所示是酸雨的形成示意图,根据图示回答下列问题。

(1)某实验小组采集硫酸型酸雨样品,随着时间的变化多次测定该样品的pH,得到表中数据:酸雨样品放置时pH变化的主要原因是_______ (用化学方程式表示)。
(2)你认为减少酸雨的产生可采取的措施是_______(填字母)。
①减少用煤作燃料 ②开发新能源 ③燃料脱硫 ④在已酸化的土壤中洒石灰⑤监测并治理汽车排出的大量尾气 ⑥收集大气中氮氧化物制备硝酸
Ⅱ.某同学根据铜与浓硫酸反应能生成 ,预测锌与浓硫酸反应生成的产物可能为混合气体(水蒸气除外),设计如图装置进行验证(加热和部分夹持装置略):
,预测锌与浓硫酸反应生成的产物可能为混合气体(水蒸气除外),设计如图装置进行验证(加热和部分夹持装置略):

回答下列问题:
(3)A中盛放浓硫酸的仪器名称为_______ 。
(4)该同学预测的混合气体的成分可能为_______ 。
(5)C装置所盛试剂可以是_______ (填一种),实验过程中,理论上可观察到E、F装置的实验现象分别为_______ 、_______ 。
Ⅲ.为测定空气中 的含量,某课外小组的同学将空气样品经过管道通入密闭容器中的300mL 0.100mol/L的酸性高锰酸钾溶液。若管道中空气流量为a L/min,经过b min溶液恰好褪色,假定样品中的
的含量,某课外小组的同学将空气样品经过管道通入密闭容器中的300mL 0.100mol/L的酸性高锰酸钾溶液。若管道中空气流量为a L/min,经过b min溶液恰好褪色,假定样品中的 可以被溶液充分吸收。
可以被溶液充分吸收。
(6)写出上述反应的离子方程式:_______ 。
(7)该样品中的 含量是
含量是_______ g/L。
Ⅰ.如图所示是酸雨的形成示意图,根据图示回答下列问题。

(1)某实验小组采集硫酸型酸雨样品,随着时间的变化多次测定该样品的pH,得到表中数据:酸雨样品放置时pH变化的主要原因是
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水的pH | 4.75 | 4.60 | 4.58 | 4.50 | 4.50 |
①减少用煤作燃料 ②开发新能源 ③燃料脱硫 ④在已酸化的土壤中洒石灰⑤监测并治理汽车排出的大量尾气 ⑥收集大气中氮氧化物制备硝酸
| A.①②③④⑤⑥ | B.②③⑤⑥ | C.①②③④⑤ | D.①②③⑤ |
Ⅱ.某同学根据铜与浓硫酸反应能生成
 ,预测锌与浓硫酸反应生成的产物可能为混合气体(水蒸气除外),设计如图装置进行验证(加热和部分夹持装置略):
,预测锌与浓硫酸反应生成的产物可能为混合气体(水蒸气除外),设计如图装置进行验证(加热和部分夹持装置略):
回答下列问题:
(3)A中盛放浓硫酸的仪器名称为
(4)该同学预测的混合气体的成分可能为
(5)C装置所盛试剂可以是
Ⅲ.为测定空气中
 的含量,某课外小组的同学将空气样品经过管道通入密闭容器中的300mL 0.100mol/L的酸性高锰酸钾溶液。若管道中空气流量为a L/min,经过b min溶液恰好褪色,假定样品中的
的含量,某课外小组的同学将空气样品经过管道通入密闭容器中的300mL 0.100mol/L的酸性高锰酸钾溶液。若管道中空气流量为a L/min,经过b min溶液恰好褪色,假定样品中的 可以被溶液充分吸收。
可以被溶液充分吸收。(6)写出上述反应的离子方程式:
(7)该样品中的
 含量是
含量是
您最近一年使用:0次
2022-05-03更新
|
427次组卷
|
3卷引用:黑龙江省鹤岗市第一中学2021-2022学年高一下学期期末考试化学试题
名校
10 . 高纯氮化铝( )是一种理想的半导体物质。一种以含铝废料(主要成分为
)是一种理想的半导体物质。一种以含铝废料(主要成分为 ,含有少量
,含有少量 、
、 、
、 、
、 )为原料制备
)为原料制备 的工艺流程如下:
的工艺流程如下:
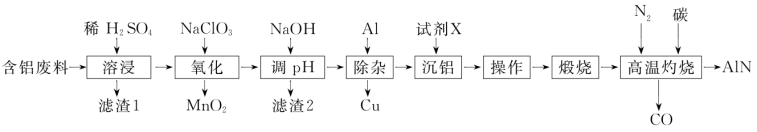
回答下列问题:
(1)“溶浸”过程中发生的基本反应类型为___________ ,滤渣1的主要成分是___________ (填化学式)。
(2)写出“氧化”时生成 的离子方程式:
的离子方程式:___________ 。
(3)常温下,“氧化”后溶液中 ,若“调
,若“调 ”,是否有
”,是否有 沉淀生成?
沉淀生成?___________ {写出计算过程,已知常温下, }。
}。
(4)“沉铝”时,加入试剂X的名称是___________ 。
(5)“操作”步骤包含___________ 。
(6)写出“高温灼烧”时反应的化学方程式:___________ ;该步骤反应后期需通入一定量的空气,其目的是___________ (从提高 纯度角度考虑)。
纯度角度考虑)。
 )是一种理想的半导体物质。一种以含铝废料(主要成分为
)是一种理想的半导体物质。一种以含铝废料(主要成分为 ,含有少量
,含有少量 、
、 、
、 、
、 )为原料制备
)为原料制备 的工艺流程如下:
的工艺流程如下:
回答下列问题:
(1)“溶浸”过程中发生的基本反应类型为
(2)写出“氧化”时生成
 的离子方程式:
的离子方程式:(3)常温下,“氧化”后溶液中
 ,若“调
,若“调 ”,是否有
”,是否有 沉淀生成?
沉淀生成? }。
}。(4)“沉铝”时,加入试剂X的名称是
(5)“操作”步骤包含
(6)写出“高温灼烧”时反应的化学方程式:
 纯度角度考虑)。
纯度角度考虑)。
您最近一年使用:0次
2021-12-31更新
|
653次组卷
|
3卷引用:黑龙江省鹤岗市第一中学2021-2022学年高三上学期期末考试理综化学试题



