解题方法
1 . 碳酸锂是制取各种精细锂化合物、金属锂等的基础锂盐。一种用锂辉矿烧渣(主要成分为β-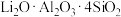 ,还含有少量MgO、Fe2O3及FeO等杂质)制备Li2CO3的工艺流程如下:
,还含有少量MgO、Fe2O3及FeO等杂质)制备Li2CO3的工艺流程如下:

回答下列问题:
(1)步骤II加CaCO3粉末的作用是_______ 。
(2)步骤IV加入H2O2发生反应的离子方程式_______ ;步骤V“过滤”前需调整溶液的pH范围为_______ 。(已知Fe3+开始沉淀的pH为2.2,沉淀完全的pH为3.5;Al3+开始沉淀的pH为4.1,沉淀完全的pH为5.4,pH大于7.8时沉淀开始溶解)。
(3)步骤VII“过滤”时得到的滤渣的主要成分是_______ (填化学式)。
(4)步骤X“洗涤”时,为检验是否洗涤完全,可选用的试剂是_______ 。
(5)LiBF4可用作锂离子电池的电解质,可用HBF4(氟硼酸)与Li2CO3在水溶液中制取,该反应的化学方程式为_______ 。
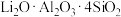 ,还含有少量MgO、Fe2O3及FeO等杂质)制备Li2CO3的工艺流程如下:
,还含有少量MgO、Fe2O3及FeO等杂质)制备Li2CO3的工艺流程如下:
回答下列问题:
(1)步骤II加CaCO3粉末的作用是
(2)步骤IV加入H2O2发生反应的离子方程式
(3)步骤VII“过滤”时得到的滤渣的主要成分是
(4)步骤X“洗涤”时,为检验是否洗涤完全,可选用的试剂是
(5)LiBF4可用作锂离子电池的电解质,可用HBF4(氟硼酸)与Li2CO3在水溶液中制取,该反应的化学方程式为
您最近一年使用:0次
名校
2 . 某工厂采用辉铋矿(主要成分为 ,含有
,含有 、
、 杂质)与软锰矿(主要成分为
杂质)与软锰矿(主要成分为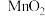 )联合焙烧法制各BiOCl和
)联合焙烧法制各BiOCl和 ,工艺流程如下:
,工艺流程如下:
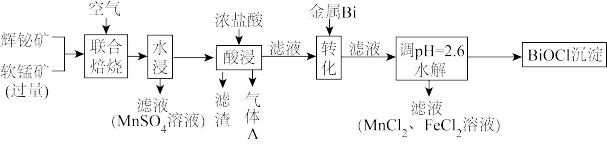
已知:①焙烧时过量的 分解为
分解为 ,
, 转变为
转变为 ;
;
②金属活动性:Fe>(H)>Bi>Cu;
③相关金属离子形成氢氧化物的pH范围如下:
回答下列问题:
(1)为提高焙烧效率,可采取的措施为_________ 。
a.进一步粉碎矿石 b.鼓入适当过量的空气 c.降低焙烧温度
(2) 在空气中单独焙烧生成
在空气中单独焙烧生成 ,反应的化学方程式为
,反应的化学方程式为_________ 。
(3)滤渣的主要成分为_________ (填化学式)。
(4)生成气体A的离子方程式为_________ 。
(5)加入金属Bi的目的是_________ 。
(6)将100kg辉铋矿进行联合焙烧,转化时消耗1.1kg金属Bi,假设其余各步损失不计,干燥后称量BiOCl产品质量为32kg,滴定测得产品中Bi的质量分数为78.5%。辉铋矿中Bi元素的质量分数为_________ (保留四位有效数字)。
 ,含有
,含有 、
、 杂质)与软锰矿(主要成分为
杂质)与软锰矿(主要成分为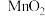 )联合焙烧法制各BiOCl和
)联合焙烧法制各BiOCl和 ,工艺流程如下:
,工艺流程如下:
已知:①焙烧时过量的
 分解为
分解为 ,
, 转变为
转变为 ;
;②金属活动性:Fe>(H)>Bi>Cu;
③相关金属离子形成氢氧化物的pH范围如下:
| 开始沉淀pH | 完全沉淀pH | |
 | 6.5 | 8.3 |
 | 1.6 | 2.8 |
 | 8.1 | 10.1 |
(1)为提高焙烧效率,可采取的措施为
a.进一步粉碎矿石 b.鼓入适当过量的空气 c.降低焙烧温度
(2)
 在空气中单独焙烧生成
在空气中单独焙烧生成 ,反应的化学方程式为
,反应的化学方程式为(3)滤渣的主要成分为
(4)生成气体A的离子方程式为
(5)加入金属Bi的目的是
(6)将100kg辉铋矿进行联合焙烧,转化时消耗1.1kg金属Bi,假设其余各步损失不计,干燥后称量BiOCl产品质量为32kg,滴定测得产品中Bi的质量分数为78.5%。辉铋矿中Bi元素的质量分数为
您最近一年使用:0次
名校
解题方法
3 . I. CO2、SO2的资源化利用既能解决环保问题,又能提供化工原料,解决能源紧张,具有重要的现实意义和广阔的应用前景。氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:
(1)反应I的化学方程式是_________ 。
(2)已知反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) ΔH=+550kJ·mol-1
它由两步反应组成:
i. H2SO4(l)=SO3(g)+H2O(g) ΔH=+177kJ•mol-1
ii. SO3(g)分解
则SO3(g)分解的热化学方程式为_________ 。
(3)电催化还原CO2的方法具有催化效率更高、反应条件更温和的优点,CO2在 纳米颗粒表面电还原的进程如图所示。据此判断该过程的决速步骤为
纳米颗粒表面电还原的进程如图所示。据此判断该过程的决速步骤为_________ (填“a”“b”或“c”)。

II.在肉制品加工中,使用发色剂-亚硝酸钠时必须严格控制用量,确保使用安全。某一反应体系中反应物和生成物共有六种:NaNO2、H2O、NO、I2、NaI、HI。
(4)已知该反应中NaNO2只发生了如下过程:NaNO2→NO;写出该反应的化学方程式_________ 。
III.磷的一种化合物叫亚磷酸(H3PO3)。已知:
a. 0.1mol/L H3PO3溶液的pH=1.7;
b. H3PO3与NaOH反应只能生成Na2HPO3和NaH2PO3两种盐;
c. H3PO3和碘水反应,碘水棕黄色褪去,再加AgNO3有黄色沉淀生成。
(5)关于H3PO3的说法:①强电解质;②弱电解质;③二元酸;④三元酸;⑥氧化性酸;⑥还原性酸,其中正确的是_________。
(6)写出H3PO3与过量NaOH溶液反应的离子方程式_________ 。

(1)反应I的化学方程式是
(2)已知反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) ΔH=+550kJ·mol-1
它由两步反应组成:
i. H2SO4(l)=SO3(g)+H2O(g) ΔH=+177kJ•mol-1
ii. SO3(g)分解
则SO3(g)分解的热化学方程式为
(3)电催化还原CO2的方法具有催化效率更高、反应条件更温和的优点,CO2在
 纳米颗粒表面电还原的进程如图所示。据此判断该过程的决速步骤为
纳米颗粒表面电还原的进程如图所示。据此判断该过程的决速步骤为
II.在肉制品加工中,使用发色剂-亚硝酸钠时必须严格控制用量,确保使用安全。某一反应体系中反应物和生成物共有六种:NaNO2、H2O、NO、I2、NaI、HI。
(4)已知该反应中NaNO2只发生了如下过程:NaNO2→NO;写出该反应的化学方程式
III.磷的一种化合物叫亚磷酸(H3PO3)。已知:
a. 0.1mol/L H3PO3溶液的pH=1.7;
b. H3PO3与NaOH反应只能生成Na2HPO3和NaH2PO3两种盐;
c. H3PO3和碘水反应,碘水棕黄色褪去,再加AgNO3有黄色沉淀生成。
(5)关于H3PO3的说法:①强电解质;②弱电解质;③二元酸;④三元酸;⑥氧化性酸;⑥还原性酸,其中正确的是_________。
| A.②④⑥ | B.②③⑥ | C.①④⑤ | D.②③⑤ |
您最近一年使用:0次
名校
解题方法
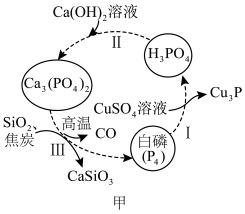
4 . 磷及其化合物在工农业生产中具有重要用途。回答下列问题:
(1)如图甲所示为提纯白磷样品(含惰性杂质)的工艺流程。过程I中,氧化产物与还原产物的物质的量之比为___________ ,过程Ⅲ的化学方程式为___________ 。
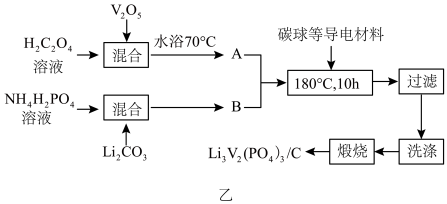
(2)磷酸钒锂/碳复合材料[Li3V2(PO4)3/C]具有能量密度高,循环寿命长,稳定安全等优点,是一种十分具有商业潜力的电极材料,我国科学家研发的一种制备流程如图乙所示:
①向复合材料中加入碳单质的作用是___________ 。
②A的主要成分为V2(C2O4)3,合成A反应的化学方程式为___________ 。
③已知常温下,Li2CO3微溶于水,LiHCO3可溶于水。工业级Li2CO3中含有少量难溶于水且与CO2不反应的杂质。补全下列实验方案:将工业级Li2CO3与水混合,___________ ,得到LiHCO3溶液,控温加热使LiHCO3分解形成Li2CO3沉淀,过滤、洗涤、干燥得到Li2CO3纯品。
④锂离子电池是一种二次电池。若用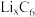 和Li3V2(PO4)3/C作电极,放电时的电池总反应为
和Li3V2(PO4)3/C作电极,放电时的电池总反应为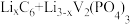 =Li3V2(PO4)3+C6,则电池放电时正极的电极反应式为
=Li3V2(PO4)3+C6,则电池放电时正极的电极反应式为___________ 。
(1)如图甲所示为提纯白磷样品(含惰性杂质)的工艺流程。过程I中,氧化产物与还原产物的物质的量之比为

(2)磷酸钒锂/碳复合材料[Li3V2(PO4)3/C]具有能量密度高,循环寿命长,稳定安全等优点,是一种十分具有商业潜力的电极材料,我国科学家研发的一种制备流程如图乙所示:

①向复合材料中加入碳单质的作用是
②A的主要成分为V2(C2O4)3,合成A反应的化学方程式为
③已知常温下,Li2CO3微溶于水,LiHCO3可溶于水。工业级Li2CO3中含有少量难溶于水且与CO2不反应的杂质。补全下列实验方案:将工业级Li2CO3与水混合,
④锂离子电池是一种二次电池。若用
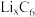 和Li3V2(PO4)3/C作电极,放电时的电池总反应为
和Li3V2(PO4)3/C作电极,放电时的电池总反应为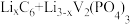 =Li3V2(PO4)3+C6,则电池放电时正极的电极反应式为
=Li3V2(PO4)3+C6,则电池放电时正极的电极反应式为
您最近一年使用:0次
2022-02-22更新
|
824次组卷
|
6卷引用:黑龙江省佳木斯市第一中学2022届高三下学期验收测试化学试题
黑龙江省佳木斯市第一中学2022届高三下学期验收测试化学试题河北省衡水中学2021-2022学年高三上学期五调考试化学试题(已下线)二轮拔高卷2-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(北京专用)(已下线)专项15 工艺流程综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)(已下线)押江苏卷第15题 化学工业流程综合题 -备战2022年高考化学临考题号押题(江苏卷)河北省新乐市第一中学2023-2024学年上学期高三第一次月考化学试题
名校
解题方法
5 . 高性能磁带的磁粉主要成分是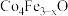 ,某探究小组设计了下图所示流程制取
,某探究小组设计了下图所示流程制取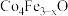 ,图中正极材料的主要成分是
,图中正极材料的主要成分是 ,还含有少量Al和Fe,{已知常温下,
,还含有少量Al和Fe,{已知常温下,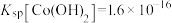 }。
}。
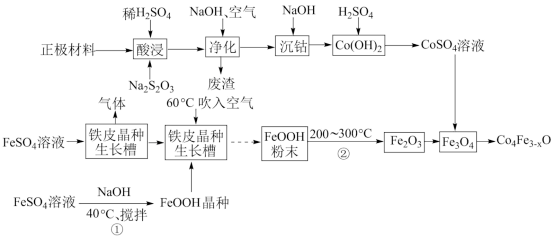
请根据流程回答下列问题:
(1)流程中放出的“气体”的化学式为___________ 。
(2)提高酸浸浸取率的措施是___________ (写两条即可)。
(3)在“酸浸”过程中,加入 的作用是
的作用是___________ 。
(4)实验室要完成②的操作会用到下列仪器中的___________ (填字母)。
a.坩埚 b.烧杯 c.蒸发皿 d.泥三角
(5)写出①的化学方程式:___________ 。
(6)常温时,“沉钴”过程中,当溶液的 时,
时,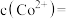
______ 。
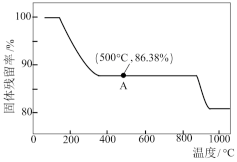
(7)在空气中加热 ,固体残留率随温度的变化如图所示,则A点主要的固体产物为
,固体残留率随温度的变化如图所示,则A点主要的固体产物为___________ (属于氧化物,填化学式)。
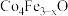 ,某探究小组设计了下图所示流程制取
,某探究小组设计了下图所示流程制取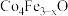 ,图中正极材料的主要成分是
,图中正极材料的主要成分是 ,还含有少量Al和Fe,{已知常温下,
,还含有少量Al和Fe,{已知常温下,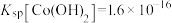 }。
}。
请根据流程回答下列问题:
(1)流程中放出的“气体”的化学式为
(2)提高酸浸浸取率的措施是
(3)在“酸浸”过程中,加入
 的作用是
的作用是(4)实验室要完成②的操作会用到下列仪器中的
a.坩埚 b.烧杯 c.蒸发皿 d.泥三角
(5)写出①的化学方程式:
(6)常温时,“沉钴”过程中,当溶液的
 时,
时,
(7)在空气中加热
 ,固体残留率随温度的变化如图所示,则A点主要的固体产物为
,固体残留率随温度的变化如图所示,则A点主要的固体产物为
您最近一年使用:0次
2022-01-23更新
|
772次组卷
|
4卷引用:黑龙江省佳木斯市第一中学2022届高三下学期验收测试化学试题
黑龙江省佳木斯市第一中学2022届高三下学期验收测试化学试题重庆市2022届高三第一次联合诊断测试化学试题(已下线)二轮拔高卷3-【赢在高考·黄金20卷】备战2022年高考化学模拟卷(全国卷专用)(已下线)专项15 工艺流程综合题-备战2022年高考化学阶段性新题精选专项特训(全国卷)(3月期)
名校
6 . 从铝土矿(主要成分为A12O3,还含有少量SiO2、Fe2O3,等杂质)中提取A12O3并生产AlN的工艺流程如下:
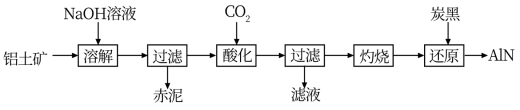
注:SiO2在NaOH“溶解”时转化为铝硅酸钠沉淀
回答下列问题:
(1)赤泥的主要成分为_______ (填化学式)。
(2)“酸化”时通入过量CO2的离子方程式_______ 。
(3)“还原”时,炭黑在高温下被氧化为CO,反应的化学方程式为_______ 。
(4)将铝粉和氧化铁 的混合物点燃,反应放出大量的热量,称为铝热反应。该反应在生活中常被用于_______ 。

注:SiO2在NaOH“溶解”时转化为铝硅酸钠沉淀
回答下列问题:
(1)赤泥的主要成分为
(2)“酸化”时通入过量CO2的离子方程式
(3)“还原”时,炭黑在高温下被氧化为CO,反应的化学方程式为
(4)将铝粉和
您最近一年使用:0次
名校
解题方法
7 . 氟碳铈矿(主要成分为CeFCO3)是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图所示,回答下列问题:
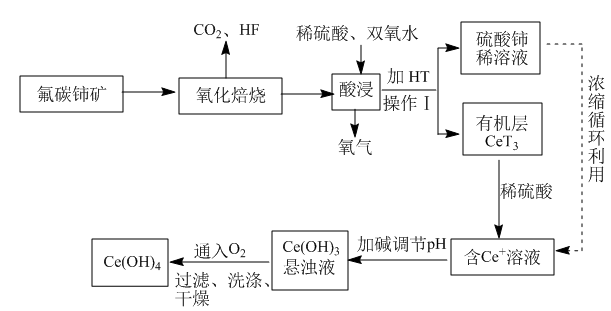
(1)操作Ⅰ的名称为___ 。
(2)氧化焙烧操作不能使用陶瓷容器,原因是_____ (用化学方程式解释)。
(3)焙烧后的产物之一为CeO2,则酸浸时主要反应的离子方程式为__ 。
(4)酸浸时不能用浓盐酸,原因是__ (用化学方程式解释)。
(5)为了提高酸浸率,可以适当提高反应温度,但温度偏高浸出率反而会减小,其原因是_____ 。
(6)有机物HT能将Ce3+从水溶液中提取出来,该过程可表示为:Ce3+(水层)+3HT(有机层) CeT3(有机层)+3H+(水层),试解释向CeT3(有机层)中加入稀硫酸的作用及其原理:
CeT3(有机层)+3H+(水层),试解释向CeT3(有机层)中加入稀硫酸的作用及其原理:__ 。
(7)写出向Ce(OH)3悬浊液中通入氧气得到产品Ce(OH)4的化学方程式:_____ 。

(1)操作Ⅰ的名称为
(2)氧化焙烧操作不能使用陶瓷容器,原因是
(3)焙烧后的产物之一为CeO2,则酸浸时主要反应的离子方程式为
(4)酸浸时不能用浓盐酸,原因是
(5)为了提高酸浸率,可以适当提高反应温度,但温度偏高浸出率反而会减小,其原因是
(6)有机物HT能将Ce3+从水溶液中提取出来,该过程可表示为:Ce3+(水层)+3HT(有机层)
 CeT3(有机层)+3H+(水层),试解释向CeT3(有机层)中加入稀硫酸的作用及其原理:
CeT3(有机层)+3H+(水层),试解释向CeT3(有机层)中加入稀硫酸的作用及其原理:(7)写出向Ce(OH)3悬浊液中通入氧气得到产品Ce(OH)4的化学方程式:
您最近一年使用:0次
名校
解题方法
8 . 有资料显示过量的氨气和氯气在常温下可合成岩脑砂(主要成分为NH4Cl),某实验小组对该反应进行探究,并对岩脑砂进行元素测定。回答下列问题:
Ⅰ.岩脑砂的制备
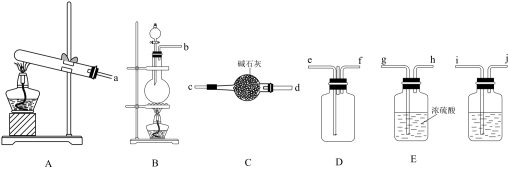
(1)该实验中制取氨气的化学方程式是:_____ 。
(2)为了使氨气与氯气在D中充分混合,请确定上述装置的合理连接顺序:_____ →ef←_____ (用小写字母和箭头表示,箭头方向与气流方向一致)。
(3)装置F中的试剂是_____ (填试剂名称)。
(4)该套装置有两个明显的不足之处_____ ,_____ 。
Ⅱ.岩脑砂中元素的测定:准确称取ag岩脑砂,与足量的氧化铜混合加热,利用如图装置测定岩脑砂中氮元素和氯元素的质量之比。充分加热后,G中产生红色固体,H、I装置质量增加,K中收集到无色气体。

(5)写出G中发生反应的方程式:_____ 。
(6)若没有H装置,会导致测量值_____ (填“偏高”,“偏低”或“无影响”)。
(7)若装置I增重bg,利用装置K测得气体体积为VL(已知常温常压下气体摩尔体积为24.5L/mol),则岩脑砂中m(N):m(Cl)=_____ (用含b、V的代数式表示,不必化简)。
Ⅰ.岩脑砂的制备

(1)该实验中制取氨气的化学方程式是:
(2)为了使氨气与氯气在D中充分混合,请确定上述装置的合理连接顺序:
(3)装置F中的试剂是
(4)该套装置有两个明显的不足之处
Ⅱ.岩脑砂中元素的测定:准确称取ag岩脑砂,与足量的氧化铜混合加热,利用如图装置测定岩脑砂中氮元素和氯元素的质量之比。充分加热后,G中产生红色固体,H、I装置质量增加,K中收集到无色气体。

(5)写出G中发生反应的方程式:
(6)若没有H装置,会导致测量值
(7)若装置I增重bg,利用装置K测得气体体积为VL(已知常温常压下气体摩尔体积为24.5L/mol),则岩脑砂中m(N):m(Cl)=
您最近一年使用:0次
名校
9 . 氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备 和NaClO,探究其氧化还原性质。
和NaClO,探究其氧化还原性质。
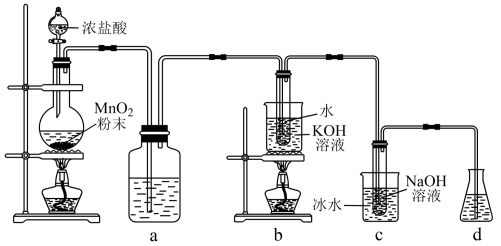
回答下列问题:
(1)盛放 粉末的仪器名称是
粉末的仪器名称是___________ 。
(2)c中化学反应的离子方程式是___________ 。
(3)d的作用是___________ ,可选用试剂___________ (填标号)。
A.NaOH B.NaCl C. D.
D.
(4)实验室也可用高锰酸钾与浓盐酸反应制取
①写出上述方法制取 的化学方程式
的化学方程式___________
②在反应后的溶液中加入 (不溶于冷水),溶液又变为紫红色,
(不溶于冷水),溶液又变为紫红色, 反应后变为无色的
反应后变为无色的 。写出该实验中涉及反应的离子方程式
。写出该实验中涉及反应的离子方程式___________ ,该反应的发生说明还原性
___________  (填>,<或=)
(填>,<或=)
 和NaClO,探究其氧化还原性质。
和NaClO,探究其氧化还原性质。
回答下列问题:
(1)盛放
 粉末的仪器名称是
粉末的仪器名称是(2)c中化学反应的离子方程式是
(3)d的作用是
A.NaOH B.NaCl C.
 D.
D.
(4)实验室也可用高锰酸钾与浓盐酸反应制取

①写出上述方法制取
 的化学方程式
的化学方程式②在反应后的溶液中加入
 (不溶于冷水),溶液又变为紫红色,
(不溶于冷水),溶液又变为紫红色, 反应后变为无色的
反应后变为无色的 。写出该实验中涉及反应的离子方程式
。写出该实验中涉及反应的离子方程式
 (填>,<或=)
(填>,<或=)
您最近一年使用:0次
名校
10 . 回答下列问题:
(1)甲、乙、丙、丁四种易溶于水的物质,分别由NH 、Ba2+、Mg2+、H+、OH-、Cl-、HCO
、Ba2+、Mg2+、H+、OH-、Cl-、HCO 、SO
、SO 中的不同阳离子和阴离子各一种组成,已知:
中的不同阳离子和阴离子各一种组成,已知:
①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;
②0.1 mol·L-1乙溶液中pH<1;
③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。推断甲、乙、丙、丁的化学式:甲___________ ,乙___________ ,丙___________ ,丁___________ 。写出过量的甲与丁的稀溶液反应的离子方程式:___________ 。
(2)一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH (B元素的化合价为+3价)与Fe2+反应生成纳米铁粉、H2和B(OH)
(B元素的化合价为+3价)与Fe2+反应生成纳米铁粉、H2和B(OH) ,其离子方程式为
,其离子方程式为___________ 。
(3)无水条件下制备高铁酸钠的主要反应为2FeSO4+aNa2O2=2Na2FeO4+bX+2Na2SO4+cO2↑,该反应中物质X的化学式为___________ ,b与c的关系是___________ 。
(1)甲、乙、丙、丁四种易溶于水的物质,分别由NH
 、Ba2+、Mg2+、H+、OH-、Cl-、HCO
、Ba2+、Mg2+、H+、OH-、Cl-、HCO 、SO
、SO 中的不同阳离子和阴离子各一种组成,已知:
中的不同阳离子和阴离子各一种组成,已知:①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;
②0.1 mol·L-1乙溶液中pH<1;
③向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。推断甲、乙、丙、丁的化学式:甲
(2)一定条件下,向FeSO4溶液中滴加碱性NaBH4溶液,溶液中BH
 (B元素的化合价为+3价)与Fe2+反应生成纳米铁粉、H2和B(OH)
(B元素的化合价为+3价)与Fe2+反应生成纳米铁粉、H2和B(OH) ,其离子方程式为
,其离子方程式为(3)无水条件下制备高铁酸钠的主要反应为2FeSO4+aNa2O2=2Na2FeO4+bX+2Na2SO4+cO2↑,该反应中物质X的化学式为
您最近一年使用:0次
2021-10-22更新
|
109次组卷
|
2卷引用:黑龙江省佳木斯市第一中学2021-2022学年高三上学期第四次调研考试化学试题



