名校
解题方法
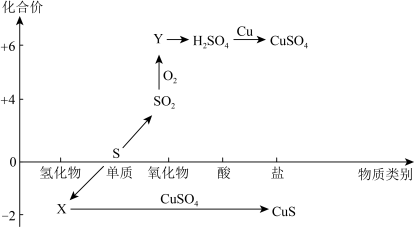
1 . 硫及其化合物的“价-类”二维图如下图所示,回答下列问题:___________ ,Y的化学式是___________ 。
(2)检验 时,取少量待测液于试管中,先加入
时,取少量待测液于试管中,先加入___________ ,无明显现象,再加入___________ 溶液,若产生白色沉淀,则溶液中含有 。
。
(3)CuS与足量浓硫酸反应也可制得SO2,该反应的化学方程式为:CuS+4H2SO4(浓) CuSO4+4SO2↑+4H2O。
CuSO4+4SO2↑+4H2O。
①请用“双线桥”法标明该反应电子转移的方向和数目___________ 。
②当有1.5NA电子发生转移时,理论上生成SO2的体积(标准状况)为___________ L。
(2)检验
 时,取少量待测液于试管中,先加入
时,取少量待测液于试管中,先加入 。
。(3)CuS与足量浓硫酸反应也可制得SO2,该反应的化学方程式为:CuS+4H2SO4(浓)
 CuSO4+4SO2↑+4H2O。
CuSO4+4SO2↑+4H2O。①请用“双线桥”法标明该反应电子转移的方向和数目
②当有1.5NA电子发生转移时,理论上生成SO2的体积(标准状况)为
您最近一年使用:0次
名校
解题方法
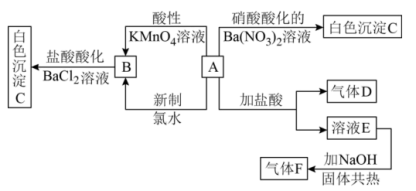
2 . 一种白色晶体A极易溶于水,将A配成溶液进行如下框图所示的实验,实验现象及转化关系如下列框图所示。其中A为正盐,气体D能使品红溶液褪色,气体F能使湿润的红色石蕊试纸变蓝。
(1)写出下列物质化学式:A___________ ;C___________ ;
(2)写出F的电子式:___________ ;
(3)写出溶液E与 共热反应的离子方程式:
共热反应的离子方程式:___________ ;
(4)写出A和新制氯水反应的离子方程式:___________ 。
(1)写出下列物质化学式:A
(2)写出F的电子式:
(3)写出溶液E与
 共热反应的离子方程式:
共热反应的离子方程式:(4)写出A和新制氯水反应的离子方程式:
您最近一年使用:0次
名校
3 . 我国铂族金属储量占世界储量的0.58%,而消费总量占世界消费总量的27%,因此从汽车废弃催化剂中回收铂族金属对可持续发展有重大意义。废弃催化剂中含有Pt,还含有少量的Fe2O3、MgO、Al2O3、 SiO2.一种从汽车废弃催化剂中回收铂的流程如下:
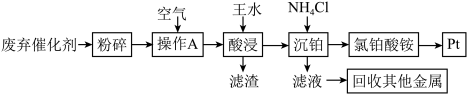
已知:①长期使用的催化剂,表面会覆盖积碳和有机物;
②Pt溶于王水生成NO和氯铂酸,该酸的阴离子具有正八面体结构,其中Pt为正四价;
③该工艺条件下(常温),有关金属离子开始沉淀和沉淀完全时的pH见下表。
回答下列问题:
(1)粉碎废弃催化剂后,需进行预处理操作A,请写出操作A的名称_______ 。
(2)为了提高酸浸效率,温度不宜过高的原因是_________ 。
(3)酸浸工序中,铂发生的反应的化学方程式为___________ ,有同学提议,将王水换成盐酸和过氧化氢的混合溶液,请分析优缺点:___________ 。
(4)通过调节滤液的pH以回收其他金属,依次析出的金属离子为_______ ,当Al3+开始沉淀时,溶液中的Fe3+浓度为___________ mol·L−1。
(5)铂的浸出率与不同加热方式、浸出时间及不同固液比的关系如下图所示:
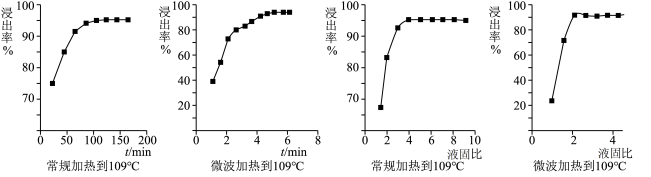
由图可知,Pt 浸出的最佳条件为___________ 。

已知:①长期使用的催化剂,表面会覆盖积碳和有机物;
②Pt溶于王水生成NO和氯铂酸,该酸的阴离子具有正八面体结构,其中Pt为正四价;
③该工艺条件下(常温),有关金属离子开始沉淀和沉淀完全时的pH见下表。
| 金属离子 | Al3+ | Mg2+ | Fe3+ |
| 开始沉淀的pH | 3.5 | 9.5 | 2.2 |
| 沉淀完全(c=1.0× 10−5 mol·L−1)的pH | 4.7 | 11.1 | 3.2 |
(1)粉碎废弃催化剂后,需进行预处理操作A,请写出操作A的名称
(2)为了提高酸浸效率,温度不宜过高的原因是
(3)酸浸工序中,铂发生的反应的化学方程式为
(4)通过调节滤液的pH以回收其他金属,依次析出的金属离子为
(5)铂的浸出率与不同加热方式、浸出时间及不同固液比的关系如下图所示:

由图可知,Pt 浸出的最佳条件为
您最近一年使用:0次
名校
解题方法
4 . 环己酮可作为涂料和油漆的溶剂。在实验室中以环己醇为原料制备环己酮的原理和装置如图所示(夹持及加热装置略)。

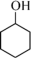

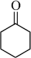 +H2O
+H2O
已知:环己醇、环己酮的部分物理性质如下表(括号中的沸点数据表示该有机物与水形成的具有固定组成的恒沸混合物的沸点)。
回答下列问题:
(1)仪器B的名称是_______ 。
(2)酸化 溶液时不能选用盐酸,原因是
溶液时不能选用盐酸,原因是_________ (用离子方程式表示)。
(3)该制备反应很剧烈,且放出大量的热。为控制反应体系温度在55~60 ℃范围内,可采取的措施一是加热方式选用______ ,二是在加入反应物时将______ (填化学式)缓慢滴加到其他试剂中。
(4)制备反应完成后,向混合物中加入适量水,蒸馏,收集95~100 ℃的馏分,得到主要含环己酮和水的混合物。采用先加入适量水然后蒸馏而非直接蒸馏,原因是___________ 。
(5)环己酮的提纯过程如下:
①在馏分中加NaCl固体至饱和,静置,分液,加NaCl的目的是_________ 。
②加入无水MgSO4块状固体,目的是________ 。
③________ (填操作名称)后进行蒸馏,收集150~156 ℃的馏分。
(6)数据处理。反应开始时加入8.4 mL(0.08 mol)环己醇和过量的酸化的 溶液。实验结束后收集到产品0.06 mol,则该合成反应的产率为
溶液。实验结束后收集到产品0.06 mol,则该合成反应的产率为________ 。



 +H2O
+H2O已知:环己醇、环己酮的部分物理性质如下表(括号中的沸点数据表示该有机物与水形成的具有固定组成的恒沸混合物的沸点)。
| 物质 | 沸点/(℃,1 atm) | 密度/(g·cm−3) | 溶解性 |
| 环己醇 | 161.1(97.8) | 0.96 | 能溶于水,易溶于常见有机溶剂 |
| 环己酮 | 155.6(95) | 0.94 | 微溶于水 |
(1)仪器B的名称是
(2)酸化
 溶液时不能选用盐酸,原因是
溶液时不能选用盐酸,原因是(3)该制备反应很剧烈,且放出大量的热。为控制反应体系温度在55~60 ℃范围内,可采取的措施一是加热方式选用
(4)制备反应完成后,向混合物中加入适量水,蒸馏,收集95~100 ℃的馏分,得到主要含环己酮和水的混合物。采用先加入适量水然后蒸馏而非直接蒸馏,原因是
(5)环己酮的提纯过程如下:
①在馏分中加NaCl固体至饱和,静置,分液,加NaCl的目的是
②加入无水MgSO4块状固体,目的是
③
(6)数据处理。反应开始时加入8.4 mL(0.08 mol)环己醇和过量的酸化的
 溶液。实验结束后收集到产品0.06 mol,则该合成反应的产率为
溶液。实验结束后收集到产品0.06 mol,则该合成反应的产率为
您最近一年使用:0次
名校
解题方法
5 . MgF2是一种重要的无机化工原料,可用于制备多晶材料、光学玻璃。现有如下两种途径可以制得。
途径Ⅰ:以工业级MgSO4溶液(含Fe3+和Mn2+等杂质)为原料制备MgF2,过程如下:

(1)除杂
①向硫酸镁溶液中加入Na2SO4,加热、保持溶液温度在80~95℃,将Fe3+转化为Na2Fe6(SO4)4(OH)12沉淀,反应后滤液的pH___________ (填“增大”、“不变”或“减小”);
②调节滤液的pH,使溶液呈弱碱性,向其中加入H2O2,将Mn2+转化为MnO2沉淀,写出该反应的离子方程式___________ 。
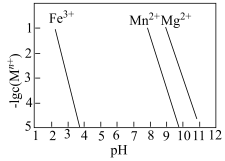
③Mn+(Fe3+、Mn2+、Mg2+)转变为氢氧化物沉淀的pH如图。除杂时未采取将Mn2+直接转化为Mn(OH)2的原因是___________ 。
(2)沉镁
向“除杂”后滤液中加入Na2CO3,同时产生气体,写出生成Mg2(OH)2CO3的化学方程式___________ 。
(3)酸溶
将所得Mg2(OH)2CO3置于___________ (填“玻璃”、“聚丙烯”或“石英”)烧杯中,加入适量的HF,搅拌溶解。
途径Ⅰ:以工业级MgSO4溶液(含Fe3+和Mn2+等杂质)为原料制备MgF2,过程如下:

(1)除杂
①向硫酸镁溶液中加入Na2SO4,加热、保持溶液温度在80~95℃,将Fe3+转化为Na2Fe6(SO4)4(OH)12沉淀,反应后滤液的pH
②调节滤液的pH,使溶液呈弱碱性,向其中加入H2O2,将Mn2+转化为MnO2沉淀,写出该反应的离子方程式
③Mn+(Fe3+、Mn2+、Mg2+)转变为氢氧化物沉淀的pH如图。除杂时未采取将Mn2+直接转化为Mn(OH)2的原因是

(2)沉镁
向“除杂”后滤液中加入Na2CO3,同时产生气体,写出生成Mg2(OH)2CO3的化学方程式
(3)酸溶
将所得Mg2(OH)2CO3置于
您最近一年使用:0次
2024-01-10更新
|
71次组卷
|
2卷引用:黑龙江省齐齐哈尔市讷河市第二中学2023-2024学年高二上学期期末考试化学试题
名校
解题方法
6 . 连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂,易溶于水,难溶于乙醇,在碱性介质中较稳定,在空气中易被氧化。
回答下列问题:
(1)Na2S2O4在潮湿空气中氧化,生成的两种常见酸式盐,写出这两种酸式盐在水中发生反应的离子方程式___________
(2)锌粉法制备Na2S2O4的工艺流程如图所示:
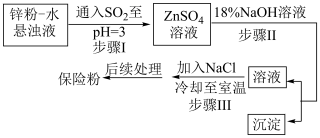
①工业上常将锌块进行预处理得到锌粉一水悬浊液,其目的是___________ 。
②在步骤Ⅲ中得到的Na2S2O4固体要用乙醇洗涤,其优点是___________ ,“后续处理”最终要加入少量的Na2CO3固体,其原因是___________ 。
③步骤Ⅱ中发生反应的化学方程式为___________ 。
④步骤Ⅲ中加入NaCl固体的作用是___________ 。
(3)目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加入乙醇水溶液中,然后通入SO2发生反应,有CO2气体放出,总反应的离子方程式是___________ 。
回答下列问题:
(1)Na2S2O4在潮湿空气中氧化,生成的两种常见酸式盐,写出这两种酸式盐在水中发生反应的离子方程式
(2)锌粉法制备Na2S2O4的工艺流程如图所示:

①工业上常将锌块进行预处理得到锌粉一水悬浊液,其目的是
②在步骤Ⅲ中得到的Na2S2O4固体要用乙醇洗涤,其优点是
③步骤Ⅱ中发生反应的化学方程式为
④步骤Ⅲ中加入NaCl固体的作用是
(3)目前,我国普遍采用甲酸钠法生产连二亚硫酸钠,其原理是先将HCOONa和烧碱加入乙醇水溶液中,然后通入SO2发生反应,有CO2气体放出,总反应的离子方程式是
您最近一年使用:0次
名校
解题方法
7 . 三氯化氮(NCl3)为黄色油状液体,在弱酸性溶液中稳定,易溶于有机溶剂,在热水中易水解,95°C以上易爆炸,常用作漂白剂和杀菌剂。实验室常用Cl2与铵盐溶液反应制备,反应装置如图所示(夹持装置略)。

(1)装置A中盛放浓盐酸的仪器名称___________ ,该仪器与普通分液漏斗相比优点是___________ 。
(2)若用装置A制取氯气,则A中反应的离子方程式可以是(任写一条即可)___________ 。
(3)B中冰水浴的目的是___________ ,B中Cl2与NH4Cl充分反应后,采用___________ (填操作名称)得到NCl3的四氯化碳溶液,经系列操作后,将制取得到的NCl3保存在 溶液中。装置C的作用为
溶液中。装置C的作用为___________ 。
(4)反应生成的NCl3遇热水易水解,反应液有漂白性,产生的气体能让湿润的红色石蕊试纸变蓝。写出NCl3水解的化学方程式:___________ 。

(1)装置A中盛放浓盐酸的仪器名称
(2)若用装置A制取氯气,则A中反应的离子方程式可以是(任写一条即可)
(3)B中冰水浴的目的是
 溶液中。装置C的作用为
溶液中。装置C的作用为(4)反应生成的NCl3遇热水易水解,反应液有漂白性,产生的气体能让湿润的红色石蕊试纸变蓝。写出NCl3水解的化学方程式:
您最近一年使用:0次
解题方法
8 . 钴是生产多种合金和钴盐的重要原料,水钴矿主要成分为CoOOH,同时含有少量Fe、Al、Mn、Mg、Ca的氧化物及其他杂质。用水钴矿制取Co的工艺流程如图所示:
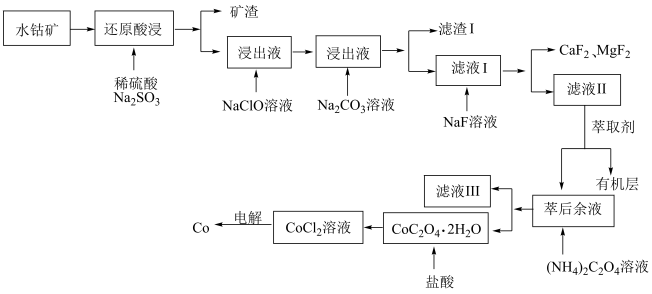
已知:①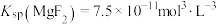 ;
;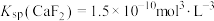
②部分阳离子以氢氧化物形成沉淀时,溶液的pH见下表。
请回答下列问题:
(1)CoOOH中Co的化合价为_____ , 溶液的作用是
溶液的作用是______ ,请写出“还原酸浸”中发生的主要氧化还原反应的化学方程式:______ 。
(2)浸出过程中加入 溶液调pH的范围是
溶液调pH的范围是______ ≤pH<______
(3)当加入过量NaF后,所得滤液Ⅱ中 与
与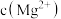 之比为
之比为______ 。
(4)萃取剂对金属离子的萃取率与pH的关系如图1所示,加萃取剂的目的是______ ,其使用的最佳pH范围是______ (填字母代号)。
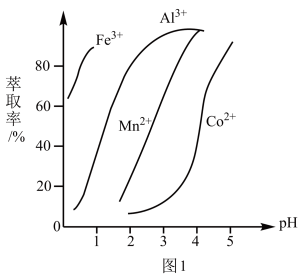
a.2.0~2.5 b.3.0~3.5 c.4.0~4.5
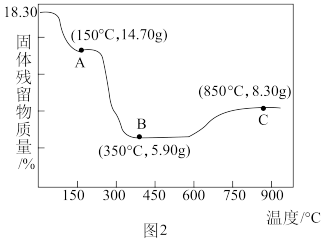
(5)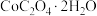 热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600℃以后是在空气中加热。A、B、C均为纯净物,C点所示产物的化学式是
热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600℃以后是在空气中加热。A、B、C均为纯净物,C点所示产物的化学式是______ 。

已知:①
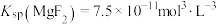 ;
;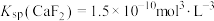
②部分阳离子以氢氧化物形成沉淀时,溶液的pH见下表。
沉淀物 |
|
|
|
|
|
开始沉淀时的pH | 7.0 | 2.7 | 7.6 | 7.7 | 4.0 |
沉淀完全时的pH | 9.6 | 3.7 | 9.2 | 9.8 | 5.2 |
(1)CoOOH中Co的化合价为
 溶液的作用是
溶液的作用是(2)浸出过程中加入
 溶液调pH的范围是
溶液调pH的范围是(3)当加入过量NaF后,所得滤液Ⅱ中
 与
与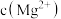 之比为
之比为(4)萃取剂对金属离子的萃取率与pH的关系如图1所示,加萃取剂的目的是

a.2.0~2.5 b.3.0~3.5 c.4.0~4.5
(5)
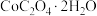 热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600℃以后是在空气中加热。A、B、C均为纯净物,C点所示产物的化学式是
热分解质量变化过程如图2所示。其中600℃以前是隔绝空气加热,600℃以后是在空气中加热。A、B、C均为纯净物,C点所示产物的化学式是
您最近一年使用:0次
2023-12-05更新
|
107次组卷
|
2卷引用:黑龙江省齐齐哈尔市龙西北高中名校联盟2023-2024学年高三上学期10月联考化学试题
9 . 氯化亚铜( )广泛应用于化工行业,以海绵铜(主要成分是
)广泛应用于化工行业,以海绵铜(主要成分是 和少量
和少量 、
、 )为原料,生产
)为原料,生产 的工艺流程如下:
的工艺流程如下:

已知: 难溶于醇和水,在氯离子浓度较大的体系中生成
难溶于醇和水,在氯离子浓度较大的体系中生成 ,在潮湿空气中易水解氧化。
,在潮湿空气中易水解氧化。
回答下列问题:
(1)海绵铜“酸溶”时,为了提高溶出率,可采取的措施是___________ (任写一种)。
(2)“酸溶”过程发生氧化还原反应的离子方程式是___________ ;滤渣1的主要成分为___________ 。
(3)已知“还原”步骤中 的沉淀率与加入的
的沉淀率与加入的 的量关系如图所示:
的量关系如图所示:

①写出“还原”步骤中主要反应的离子方程式:___________ 。
②“还原”步骤中亚硫酸铵适当过量的可能原因是___________ (答出2条)。
③随着 用量增加,
用量增加, 沉降率先增大后减小,减小的原因可能是
沉降率先增大后减小,减小的原因可能是___________ (用化学方程式表示)。
(4)“一系列操作”中包含用 的酸洗、水洗、醇洗、烘干,选用醇洗的原因是
的酸洗、水洗、醇洗、烘干,选用醇洗的原因是___________ 。烘干时需要隔绝空气,原因是___________ 。
(5)“浓缩分离”得到副产品a的主要成分是___________ (填化学式)。
 )广泛应用于化工行业,以海绵铜(主要成分是
)广泛应用于化工行业,以海绵铜(主要成分是 和少量
和少量 、
、 )为原料,生产
)为原料,生产 的工艺流程如下:
的工艺流程如下:
已知:
 难溶于醇和水,在氯离子浓度较大的体系中生成
难溶于醇和水,在氯离子浓度较大的体系中生成 ,在潮湿空气中易水解氧化。
,在潮湿空气中易水解氧化。回答下列问题:
(1)海绵铜“酸溶”时,为了提高溶出率,可采取的措施是
(2)“酸溶”过程发生氧化还原反应的离子方程式是
(3)已知“还原”步骤中
 的沉淀率与加入的
的沉淀率与加入的 的量关系如图所示:
的量关系如图所示:
①写出“还原”步骤中主要反应的离子方程式:
②“还原”步骤中亚硫酸铵适当过量的可能原因是
③随着
 用量增加,
用量增加, 沉降率先增大后减小,减小的原因可能是
沉降率先增大后减小,减小的原因可能是(4)“一系列操作”中包含用
 的酸洗、水洗、醇洗、烘干,选用醇洗的原因是
的酸洗、水洗、醇洗、烘干,选用醇洗的原因是(5)“浓缩分离”得到副产品a的主要成分是
您最近一年使用:0次
10 . 一种磁性材料的磨削废料(含镍质量分数约21%)主要成分是铁镍合金,还含有铜、钙、镁、硅的氧化物。由该废料制备纯度较高的氢氧化镍,工艺流程如下:

回答下列问题:
(1)合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸,反应有 生成。写出金属镍溶解的离子方程式:
生成。写出金属镍溶解的离子方程式:___________ 。“酸溶”时产生的废渣主要成分为___________ 。
(2)“除铁”时 的作用是
的作用是___________ ,为了证明添加的 已足量,应选择的试剂是
已足量,应选择的试剂是___________ 填“铁氰化钾”或“硫氰化钾”)溶液。黄钠铁矾[ ]有沉淀颗粒大、沉淀速率快、容易过滤等特点,已知
]有沉淀颗粒大、沉淀速率快、容易过滤等特点,已知 、
、 、
、 ,则
,则
___________ ,写出“除铁”中加入 时反应的离子方程式:
时反应的离子方程式:___________ 。
(3)“除铜”时,反应的离子方程式为___________ ,若用 代替
代替 除铜,优点是
除铜,优点是___________ 。
(4)100kg废料经上述工艺制得 固体的质量为31kg,则镍回收率的计算式为
固体的质量为31kg,则镍回收率的计算式为___________ (只列式可不计算出结果)。

回答下列问题:
(1)合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸,反应有
 生成。写出金属镍溶解的离子方程式:
生成。写出金属镍溶解的离子方程式:(2)“除铁”时
 的作用是
的作用是 已足量,应选择的试剂是
已足量,应选择的试剂是 ]有沉淀颗粒大、沉淀速率快、容易过滤等特点,已知
]有沉淀颗粒大、沉淀速率快、容易过滤等特点,已知 、
、 、
、 ,则
,则
 时反应的离子方程式:
时反应的离子方程式:(3)“除铜”时,反应的离子方程式为
 代替
代替 除铜,优点是
除铜,优点是(4)100kg废料经上述工艺制得
 固体的质量为31kg,则镍回收率的计算式为
固体的质量为31kg,则镍回收率的计算式为
您最近一年使用:0次








