名校
解题方法
1 . 高纯活性氧化锌可用于光催化、光电极、彩色显影等领域。以工业级氧化锌(含 等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:
等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下: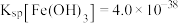 。
。
回答下列问题:
(1)浸出时,为了提高浸出效率可采取的措施有(写两种):___________ 。
(2)氧化时,加入 溶液是为了将浸出液中的
溶液是为了将浸出液中的 和
和 均转化为沉淀而除去,(溶液中
均转化为沉淀而除去,(溶液中 元素全部转化为
元素全部转化为 ),请分别写出
),请分别写出 除去
除去 和
和 的离子方程式
的离子方程式___________ ,___________ 。
(3)加入锌粉的目的是___________ 。
(4)已知 浸出液中,
浸出液中, 、
、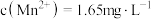 。
。
①若要除尽 上述浸出液中的
上述浸出液中的 和
和 ,需加入
,需加入___________ 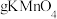 。
。
②加入 溶液反应一段时间后,溶液中
溶液反应一段时间后,溶液中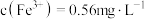 ,若溶液
,若溶液 ,则此时
,则此时
___________ (填“能”或“不能”)生成沉淀。
 等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下:
等)为原料,用硫酸浸出法生产高纯活性氧化锌的工艺流程如下: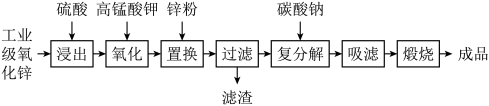
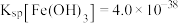 。
。回答下列问题:
(1)浸出时,为了提高浸出效率可采取的措施有(写两种):
(2)氧化时,加入
 溶液是为了将浸出液中的
溶液是为了将浸出液中的 和
和 均转化为沉淀而除去,(溶液中
均转化为沉淀而除去,(溶液中 元素全部转化为
元素全部转化为 ),请分别写出
),请分别写出 除去
除去 和
和 的离子方程式
的离子方程式(3)加入锌粉的目的是
(4)已知
 浸出液中,
浸出液中, 、
、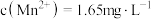 。
。①若要除尽
 上述浸出液中的
上述浸出液中的 和
和 ,需加入
,需加入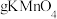 。
。②加入
 溶液反应一段时间后,溶液中
溶液反应一段时间后,溶液中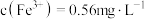 ,若溶液
,若溶液 ,则此时
,则此时
您最近一年使用:0次
2024-02-20更新
|
215次组卷
|
3卷引用:黑龙江省哈尔滨市第三中学校2020-2021学年高三上学期期末考试理科综合试卷-高中化学
黑龙江省哈尔滨市第三中学校2020-2021学年高三上学期期末考试理科综合试卷-高中化学(已下线)专题08 工艺流程综合题-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)江西省南昌十九中2023-2024学年高三下学期第一次模拟考试化学试卷
名校
2 . 按要求完成下列问题
(1)已知实验室制备NO的反应为: 。反应中氧化剂是
。反应中氧化剂是_______ ; 被氧化的元素是_______ ;氧化产物是_______ 。
(2)请配平下列方程式_______
_______Al +_______ + _______NaOH= _______
+ _______NaOH= _______ + _______
+ _______ ↑ + _______
↑ + _______
(3)用 溶液与Cu反应制作的印刷电路板,其制作原理可用
溶液与Cu反应制作的印刷电路板,其制作原理可用 表示。
表示。
①上式中X的化学式为_______ 。
②该反应的离子方程式为_______ 。
③请写出反应物氯化铁的电离方程式_______ 。
(1)已知实验室制备NO的反应为:
 。反应中氧化剂是
。反应中氧化剂是(2)请配平下列方程式
_______Al +_______
 + _______NaOH= _______
+ _______NaOH= _______ + _______
+ _______ ↑ + _______
↑ + _______
(3)用
 溶液与Cu反应制作的印刷电路板,其制作原理可用
溶液与Cu反应制作的印刷电路板,其制作原理可用 表示。
表示。①上式中X的化学式为
②该反应的离子方程式为
③请写出反应物氯化铁的电离方程式
您最近一年使用:0次
2022-12-20更新
|
125次组卷
|
2卷引用:黑龙江省鹤岗市绥滨县第一中学2021-2022年度高一上学期期中考试化学试题
解题方法
3 . 碳酸锂是制取各种精细锂化合物、金属锂等的基础锂盐。一种用锂辉矿烧渣(主要成分为β-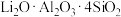 ,还含有少量MgO、Fe2O3及FeO等杂质)制备Li2CO3的工艺流程如下:
,还含有少量MgO、Fe2O3及FeO等杂质)制备Li2CO3的工艺流程如下:

回答下列问题:
(1)步骤II加CaCO3粉末的作用是_______ 。
(2)步骤IV加入H2O2发生反应的离子方程式_______ ;步骤V“过滤”前需调整溶液的pH范围为_______ 。(已知Fe3+开始沉淀的pH为2.2,沉淀完全的pH为3.5;Al3+开始沉淀的pH为4.1,沉淀完全的pH为5.4,pH大于7.8时沉淀开始溶解)。
(3)步骤VII“过滤”时得到的滤渣的主要成分是_______ (填化学式)。
(4)步骤X“洗涤”时,为检验是否洗涤完全,可选用的试剂是_______ 。
(5)LiBF4可用作锂离子电池的电解质,可用HBF4(氟硼酸)与Li2CO3在水溶液中制取,该反应的化学方程式为_______ 。
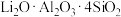 ,还含有少量MgO、Fe2O3及FeO等杂质)制备Li2CO3的工艺流程如下:
,还含有少量MgO、Fe2O3及FeO等杂质)制备Li2CO3的工艺流程如下:
回答下列问题:
(1)步骤II加CaCO3粉末的作用是
(2)步骤IV加入H2O2发生反应的离子方程式
(3)步骤VII“过滤”时得到的滤渣的主要成分是
(4)步骤X“洗涤”时,为检验是否洗涤完全,可选用的试剂是
(5)LiBF4可用作锂离子电池的电解质,可用HBF4(氟硼酸)与Li2CO3在水溶液中制取,该反应的化学方程式为
您最近一年使用:0次
名校
解题方法
4 . 化学工业为新冠疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。实验室中利用如图装置(部分装置省略)制备制备KClO3和NaClO,探究其氧化还原性质。
回答下列问题:
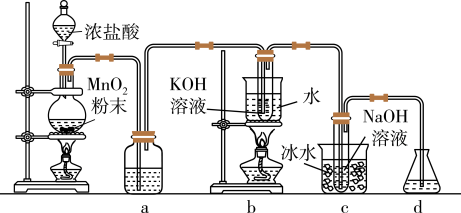
(1)加浓盐酸的仪器名称是___________ ,b中化学反应的离子方程式是 ___________ 。
(2)c中采用冰水浴冷却的目的是___________ 。
(3)反应结束后取出c中试管,取其中少量溶液加入稀H2SO4产生黄绿色气体,原因是___________ (用离子方程式表示)。
(4)氯的化合物ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1.6molClO2消耗NaClO2的物质的量为___________ mol;产生“气泡”的化学方程式为 ___________ 。
回答下列问题:

(1)加浓盐酸的仪器名称是
(2)c中采用冰水浴冷却的目的是
(3)反应结束后取出c中试管,取其中少量溶液加入稀H2SO4产生黄绿色气体,原因是
(4)氯的化合物ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1.6molClO2消耗NaClO2的物质的量为
您最近一年使用:0次
5 . 平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2等物质)。某课题小组以此粉末为原料进行资源回收的工艺流程如图:

(1)铈(Ce)是稀土元素之一,萃取是分离稀土元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP应满足的条件为____ 。
(2)写出第①步反应的离子方程式:____ ,第①步不能用浓盐酸的理由:____ 。
(3)第①步洗涤滤渣A,检验滤渣A是否洗净的方法是____ ,写出第②步反应的化学方程式:____ 。
(4)工业上利用上述回收的资源以及焦炭、氯气、氢气制取纯硅,写出制取纯硅的相关化学方程式:____ 。

(1)铈(Ce)是稀土元素之一,萃取是分离稀土元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP应满足的条件为
(2)写出第①步反应的离子方程式:
(3)第①步洗涤滤渣A,检验滤渣A是否洗净的方法是
(4)工业上利用上述回收的资源以及焦炭、氯气、氢气制取纯硅,写出制取纯硅的相关化学方程式:
您最近一年使用:0次
解题方法
6 . 利用如图装置进行木炭粉和浓硫酸的反应及其产物的检验。
已知:紫红色的酸性高锰酸钾溶液能与二氧化硫发生氧化还原反应,向酸性高锰酸钾溶液通入足量的二氧化硫气体,溶液的紫红色会完全褪去。

(1)组装好上述装置后,首先要进行的操作是____ 。
(2)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:____ 。
(3)用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入试剂的名称及其作用:A中加入的试剂和作用是____ 、____ ;B中加入的试剂和作用是____ 、____ 。
(4)实验时,C中应观察到什么现象,才可以说明生成了二氧化碳:____ 。
已知:紫红色的酸性高锰酸钾溶液能与二氧化硫发生氧化还原反应,向酸性高锰酸钾溶液通入足量的二氧化硫气体,溶液的紫红色会完全褪去。

(1)组装好上述装置后,首先要进行的操作是
(2)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:
(3)用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入试剂的名称及其作用:A中加入的试剂和作用是
(4)实验时,C中应观察到什么现象,才可以说明生成了二氧化碳:
您最近一年使用:0次
名校
7 . 氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用下图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。
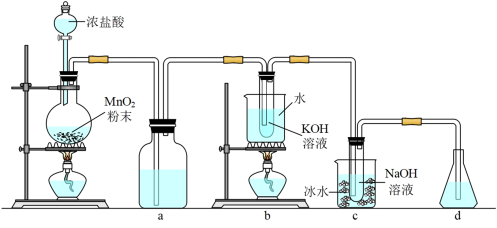
回答下列问题:
(1)盛放浓盐酸的仪器名称是_______ ,a中的试剂为_______ 。
(2)c中采用冰水冷却方式的目的是_______ ,c中化学反应的离子方程式是_______ 。
(3)d的作用是_______ ,可选用试剂_______ (填标号)。
A.Na2S B.NaCl C.NaOH D.H2SO4
(4)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的质量为_______ g;产生“气泡”的化学方程式为_______ 。
(5)“84消毒液”的有效成分为NaClO,不可与洁厕灵混用的原因是_______ (用离子方程式表示)。

回答下列问题:
(1)盛放浓盐酸的仪器名称是
(2)c中采用冰水冷却方式的目的是
(3)d的作用是
A.Na2S B.NaCl C.NaOH D.H2SO4
(4)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的质量为
(5)“84消毒液”的有效成分为NaClO,不可与洁厕灵混用的原因是
您最近一年使用:0次
名校
8 . 铜及其化合物在工业生产上有许多用途。某工厂以辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)为原料制备不溶于水的碱式碳酸铜的流程如下:

已知:①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
②Ksp[Fe(OH)3]=4.0×10-38
(1)加快“浸取”速率,除加热外,还可采取的措施有_______ (任写一种)。
(2)滤渣I中的主要成分是S、SiO2,请写出“浸取”反应中Cu2S生成S的化学方程式:_______
(3)常温下“除铁”时加入的试剂A可用_______ 起到调节pH的作用,调节pH调的范围为_______ ,若加A后溶液的pH调为5.0,则溶液中Fe3+的浓度为_______ mol/L。
(4).写出“沉锰”(除Mn2+)过程中反应的离子方程式:_______
(5)“赶氨”时,最适宜的操作方法是_______

已知:①常温下几种物质开始形成沉淀与完全沉淀时的pH如下表
| 金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
| 开始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
| 完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
②Ksp[Fe(OH)3]=4.0×10-38
(1)加快“浸取”速率,除加热外,还可采取的措施有
(2)滤渣I中的主要成分是S、SiO2,请写出“浸取”反应中Cu2S生成S的化学方程式:
(3)常温下“除铁”时加入的试剂A可用
(4).写出“沉锰”(除Mn2+)过程中反应的离子方程式:
(5)“赶氨”时,最适宜的操作方法是
您最近一年使用:0次
9 . 一种利用辉铋矿(主要成分是 ,以及少量
,以及少量 、
、 3、
3、 等杂质)为原料制备
等杂质)为原料制备 (难溶于水)的流程如图所示:
(难溶于水)的流程如图所示:

(1)“浸出”时常常需要加热或搅拌,其原因是___________ ;写出“浸出”时 反应的化学方程式:
反应的化学方程式:___________ ( 的化合价不发生变化)。
的化合价不发生变化)。
(2)“氧化”的目的是___________ (用离子方程式表示)。
(3)下列实验仪器与“操作a”相对应的是___________(填字母)。
(4)为提高 的产率,“调pH”时可加入
的产率,“调pH”时可加入___________ (填化学式)。
(5)写出“制备”反应的离子方程式:___________ 。
(6) 氧化性较强,在酸性条件下,可将
氧化性较强,在酸性条件下,可将 氧化为
氧化为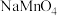 。若生成
。若生成
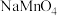 ,则理论上消耗
,则理论上消耗___________ 
 (还原产物为
(还原产物为 )。
)。
 ,以及少量
,以及少量 、
、 3、
3、 等杂质)为原料制备
等杂质)为原料制备 (难溶于水)的流程如图所示:
(难溶于水)的流程如图所示:
(1)“浸出”时常常需要加热或搅拌,其原因是
 反应的化学方程式:
反应的化学方程式: 的化合价不发生变化)。
的化合价不发生变化)。(2)“氧化”的目的是
(3)下列实验仪器与“操作a”相对应的是___________(填字母)。
A. | B. | C. | D. |
 的产率,“调pH”时可加入
的产率,“调pH”时可加入(5)写出“制备”反应的离子方程式:
(6)
 氧化性较强,在酸性条件下,可将
氧化性较强,在酸性条件下,可将 氧化为
氧化为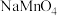 。若生成
。若生成
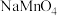 ,则理论上消耗
,则理论上消耗
 (还原产物为
(还原产物为 )。
)。
您最近一年使用:0次
名校
解题方法
10 . 工业利用含镍废料(以镍铁钙合金为主)制取NiC2O4(草酸镍),再经过高温煅烧NiC2O4制取Ni2O3的流程如图1所示。
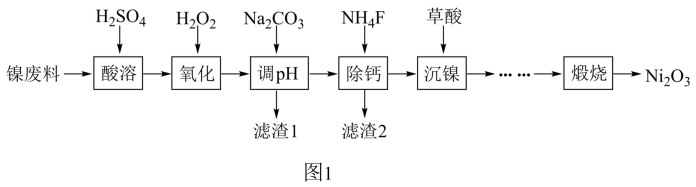
已知:NiC2O4、CaC2O4均难溶于水;Fe3+完全沉淀的pH约为3.2。
(1)“酸溶”时加快溶解速率的方法____ (写两种即可)。
(2)加入H2O2发生的主要反应的离子方程式为____ 。
(3)加入Na2CO3溶液调节pH至4.0~5.0,其目的为____ 。
(4)加入NH4F溶液可将Ca2+转化为CaF2沉淀除去,已知25℃时Ksp(CaF2)=1.6×10-10,要使溶液中Ca2+沉淀完全[c(Ca2+)≤1.0×10-5mol·L-1],则“除钙”时需控制NH4F的浓度至少为____ mol·L-1。
(5)隔绝空气高温煅烧NiC2O4可制得Ni2O3,NiC2O4受热分解的化学方程式为____ 。
(6)Ni2O3还可用于制备合成氨的催化剂ConNi1-nFe2O4。在其他条件相同时合成氨的相对初始速率随催化剂中n值变化的曲线如图2:
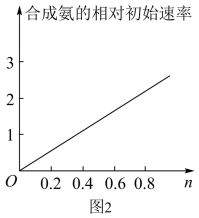
由图可知Co2+、Ni2+两种离子中催化效果更好的是____ 。

已知:NiC2O4、CaC2O4均难溶于水;Fe3+完全沉淀的pH约为3.2。
(1)“酸溶”时加快溶解速率的方法
(2)加入H2O2发生的主要反应的离子方程式为
(3)加入Na2CO3溶液调节pH至4.0~5.0,其目的为
(4)加入NH4F溶液可将Ca2+转化为CaF2沉淀除去,已知25℃时Ksp(CaF2)=1.6×10-10,要使溶液中Ca2+沉淀完全[c(Ca2+)≤1.0×10-5mol·L-1],则“除钙”时需控制NH4F的浓度至少为
(5)隔绝空气高温煅烧NiC2O4可制得Ni2O3,NiC2O4受热分解的化学方程式为
(6)Ni2O3还可用于制备合成氨的催化剂ConNi1-nFe2O4。在其他条件相同时合成氨的相对初始速率随催化剂中n值变化的曲线如图2:

由图可知Co2+、Ni2+两种离子中催化效果更好的是
您最近一年使用:0次
2022-03-16更新
|
66次组卷
|
4卷引用:黑龙江省八校2022届高三上学期期中联合考试化学试题



