名校
解题方法
1 . 从铝土矿(主要成分为Al2O3,还含有少量SiO2、Fe2O3等杂质)中提取Al2O3并生产AlN的工艺流程如下:

回答下列问题:
(1)“溶解”时,溶液中的硅酸钠与偏铝酸钠发生如下反应: 。赤泥的主要成分为
。赤泥的主要成分为_______ (填化学式,下同)。
(2)“酸化”时通入过量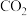 与
与 反应生成
反应生成 ,滤液的主要成分为
,滤液的主要成分为_______ 。
(3)“灼烧”时发生反应的化学方程式为_______ 。
(4)“还原”时,炭黑在高温下被氧化为CO,反应的化学方程式为_______ 。
(5)取三份不同质量的氮化铝样品(假设杂质只含有炭黑)分别加到20.00 mL相同浓度的NaOH溶液中,充分反应后,测得实验数据如下表所示。(已知: )
)
该样品中AlN的质量分数为_______ ,所用NaOH溶液的浓度为_______ 。

回答下列问题:
(1)“溶解”时,溶液中的硅酸钠与偏铝酸钠发生如下反应:
 。赤泥的主要成分为
。赤泥的主要成分为(2)“酸化”时通入过量
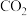 与
与 反应生成
反应生成 ,滤液的主要成分为
,滤液的主要成分为(3)“灼烧”时发生反应的化学方程式为
(4)“还原”时,炭黑在高温下被氧化为CO,反应的化学方程式为
(5)取三份不同质量的氮化铝样品(假设杂质只含有炭黑)分别加到20.00 mL相同浓度的NaOH溶液中,充分反应后,测得实验数据如下表所示。(已知:
 )
)| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| 加入氮化铝样品的质量/g | 4.1 | 8.2 | 12.3 |
| 生成氨气的体积(标准状况下)/L | 1.456 | 2.912 | 4.256 |
该样品中AlN的质量分数为
您最近一年使用:0次
2021-11-18更新
|
215次组卷
|
2卷引用:青海省西宁市大通回族土族自治县2021-2022学年高三上学期期中考试化学试题
解题方法
2 . 溴元素被称为海洋元素,它主要以溴离子形式存在于海水中。工业上制备粗溴( )的流程如图:
)的流程如图:

已知:①在酸性条件下,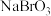 具有强氧化性;②
具有强氧化性;② 。回答下列问题:
。回答下列问题:
(1)“置换”时通入 发生反应的离子方程式为
发生反应的离子方程式为___________ 。
(2)单质溴可用热空气吹出,其原因是___________ 。
(3)写出“酸化”时发生反应的化学方程式:___________ 。
(4)用 溶液而不用盐酸“酸化”的原因可能是
溶液而不用盐酸“酸化”的原因可能是___________ 。
(5)为了除去粗溴中微量的氯气,可向粗溴中加入适量___________ (填字母),充分反应后,分液。
a.饱和NaCl溶液 b.NaOH溶液 c.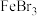 溶液 d.
溶液 d. 溶液
溶液
 )的流程如图:
)的流程如图:
已知:①在酸性条件下,
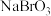 具有强氧化性;②
具有强氧化性;② 。回答下列问题:
。回答下列问题:(1)“置换”时通入
 发生反应的离子方程式为
发生反应的离子方程式为(2)单质溴可用热空气吹出,其原因是
(3)写出“酸化”时发生反应的化学方程式:
(4)用
 溶液而不用盐酸“酸化”的原因可能是
溶液而不用盐酸“酸化”的原因可能是(5)为了除去粗溴中微量的氯气,可向粗溴中加入适量
a.饱和NaCl溶液 b.NaOH溶液 c.
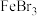 溶液 d.
溶液 d. 溶液
溶液
您最近一年使用:0次
解题方法
3 . MnCO3是制造电器材料软磁铁氧体的原料。实验室利用菱锰矿(主要成分MnCO3,还含有Fe2O3、FeO、MgO、SiO2等杂质)得到高纯碳酸锰产品。工艺流程如下:

(1)将菱锰矿粉与氯化铵混合研磨再焙烧的目的是___________ ,X为NH3和CO2的混合气体,写出焙烧的化学方程式:___________ 。
(2)为了降低生产成本,有些物质可以循环利用,能循环利用的物质为___________ (填名称)。
(3)氧化剂MnO2能将浸出液中的Fe2+转变成Fe3+,该反应的离子方程式是___________ 。
(4)物质Y可以是___________ (填字母)。
a.MnCl2 b.MnCO3 c.NH3·H2O d.NaOH
(5)氯化铵用量对锰浸出率的影响如图所示,请分析,选择氯化铵与锰矿粉的质量比为___________ 适宜。

(6)焙烧过程中产生的尾气NH3、CO2以及少量HCl会对设备有一定腐蚀作用,直接排放会造成一定污染,实验中用如图所示装置进行尾气处理:(已知冷凝管和洗气瓶中有相同产物)

①冷凝管的作用为___________ 。
②请写出洗气瓶中的化学方程式:___________ 。

(1)将菱锰矿粉与氯化铵混合研磨再焙烧的目的是
(2)为了降低生产成本,有些物质可以循环利用,能循环利用的物质为
(3)氧化剂MnO2能将浸出液中的Fe2+转变成Fe3+,该反应的离子方程式是
(4)物质Y可以是
a.MnCl2 b.MnCO3 c.NH3·H2O d.NaOH
(5)氯化铵用量对锰浸出率的影响如图所示,请分析,选择氯化铵与锰矿粉的质量比为

(6)焙烧过程中产生的尾气NH3、CO2以及少量HCl会对设备有一定腐蚀作用,直接排放会造成一定污染,实验中用如图所示装置进行尾气处理:(已知冷凝管和洗气瓶中有相同产物)

①冷凝管的作用为
②请写出洗气瓶中的化学方程式:
您最近一年使用:0次
名校
解题方法
4 . 肼(N2H4)的熔点2.0℃、沸点113.5℃,极易溶于水,在碱性介质中具有还原性。在强碱性介质中,用次氯酸钠氧化尿素[CO(NH2)2]可得粗肼,再经蒸馏得到肼溶液。回答下列问题:
I.制备NaClO强碱性溶液
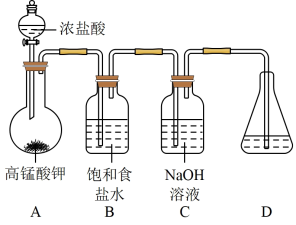
(1)在加入实验药品之前必须进行的操作是_______ 。
(2)A为氯气发生装置,A中反应的化学方程式是_______ 。
(3)次氯酸钠高于35℃容易分解。制备NaClO 强碱性溶液时需要注意的两个关键问题是_______ 。
II.制备N2H4

(4)仪器F的名称是_______ 。
(5)通入N2目的是_______ 。
(6)次氯酸钠氧化尿素的温度一般控制在105~108℃。E中制得肼的离子方程式为_______ .。
(7)向三颈烧瓶中加入NaClO强碱性溶液应当_______ . (填“一次大量”或“分批少量”)加入,充分反应后制得粗肼。蒸馏提纯时应调节控温槽的温度略高于_______ ℃,得到肼溶液。
I.制备NaClO强碱性溶液

(1)在加入实验药品之前必须进行的操作是
(2)A为氯气发生装置,A中反应的化学方程式是
(3)次氯酸钠高于35℃容易分解。制备NaClO 强碱性溶液时需要注意的两个关键问题是
II.制备N2H4

(4)仪器F的名称是
(5)通入N2目的是
(6)次氯酸钠氧化尿素的温度一般控制在105~108℃。E中制得肼的离子方程式为
(7)向三颈烧瓶中加入NaClO强碱性溶液应当
您最近一年使用:0次
2021-03-05更新
|
585次组卷
|
3卷引用:青海省西宁市2021届高三复习检测一(一模)理科综合化学试题
5 . 铁是应用最广泛的金属,铁的氯化物、氧化物均为重要化合物。
(1)工业上常用 作印刷电路板的蚀刻剂。某实验小组欲从印刷电路板的废液中回收铜,并获得
作印刷电路板的蚀刻剂。某实验小组欲从印刷电路板的废液中回收铜,并获得 溶液,设计了如下方案:
溶液,设计了如下方案:

①试剂D为___________ (填名称)。
②滤液B的溶质为___________ (填化学式)。
③通入气体F时发生反应的离子方程式为___________ 。
④实验中若要证明蚀刻废液中不含 而可能含有
而可能含有 ,正确的实验操作为
,正确的实验操作为___________ 。
(2)水热法制备 纳米颗粒的反应为
纳米颗粒的反应为 。请回答下列问题:
。请回答下列问题:
①水热法制备 纳米颗粒的反应中,被氧化的元素为
纳米颗粒的反应中,被氧化的元素为___________ (填元素符号)。
②该反应的化学方程式中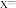
___________ 。
③每生成 ,反应转移的电子为
,反应转移的电子为___________  。
。
(1)工业上常用
 作印刷电路板的蚀刻剂。某实验小组欲从印刷电路板的废液中回收铜,并获得
作印刷电路板的蚀刻剂。某实验小组欲从印刷电路板的废液中回收铜,并获得 溶液,设计了如下方案:
溶液,设计了如下方案:
①试剂D为
②滤液B的溶质为
③通入气体F时发生反应的离子方程式为
④实验中若要证明蚀刻废液中不含
 而可能含有
而可能含有 ,正确的实验操作为
,正确的实验操作为(2)水热法制备
 纳米颗粒的反应为
纳米颗粒的反应为 。请回答下列问题:
。请回答下列问题:①水热法制备
 纳米颗粒的反应中,被氧化的元素为
纳米颗粒的反应中,被氧化的元素为②该反应的化学方程式中
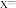
③每生成
 ,反应转移的电子为
,反应转移的电子为 。
。
您最近一年使用:0次
2021-01-30更新
|
460次组卷
|
5卷引用:青海省海东市2020-2021学年高一上学期期末考试化学试题
6 . 化学工业为疫情防控提供了强有力的物质支撑。氯的许多化合物既是重要化工原料,又是高效、广谱的灭菌消毒剂。回答下列问题:
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许______ 离子通过,氯气的逸出口是_______ (填标号)。

(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X)= ,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为
,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为______ 。
(3)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为______ 。
(4)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为_____ mol;产生“气泡”的化学方程式为____________ 。
(5)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是______ (用离子方程式表示)。工业上是将氯气通入到30%的NaOH溶液中来制备NaClO溶液,若NaClO溶液中NaOH的质量分数为1%,则生产1000 kg该溶液需消耗氯气的质量为____ kg(保留整数)。
(1)氯气是制备系列含氯化合物的主要原料,可采用如图(a)所示的装置来制取。装置中的离子膜只允许

(2)次氯酸为一元弱酸,具有漂白和杀菌作用,其电离平衡体系中各成分的组成分数δ[δ(X)=
 ,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为
,X为HClO或ClO−]与pH的关系如图(b)所示。HClO的电离常数Ka值为(3)Cl2O为淡棕黄色气体,是次氯酸的酸酐,可由新制的HgO和Cl2反应来制备,该反应为歧化反应(氧化剂和还原剂为同一种物质的反应)。上述制备Cl2O的化学方程式为
(4)ClO2常温下为黄色气体,易溶于水,其水溶液是一种广谱杀菌剂。一种有效成分为NaClO2、NaHSO4、NaHCO3的“二氧化氯泡腾片”,能快速溶于水,溢出大量气泡,得到ClO2溶液。上述过程中,生成ClO2的反应属于歧化反应,每生成1 mol ClO2消耗NaClO2的量为
(5)“84消毒液”的有效成分为NaClO,不可与酸性清洁剂混用的原因是
您最近一年使用:0次
2020-07-08更新
|
12763次组卷
|
13卷引用:青海省湟川中学2020-2021学年高二下学期第一次月考化学试题
青海省湟川中学2020-2021学年高二下学期第一次月考化学试题(已下线)专题08 常见无机物及其应用——备战2021年高考化学纠错笔记(已下线)押全国卷理综第27题 工业流程-备战2021年高考化学临考题号押题(课标全国卷)山东省枣庄市第三中学2022届高三第一次月考化学试题2020年全国统一考试化学试题(新课标Ⅱ)(已下线)专题13 元素及其化合物知识的综合应用-2020年高考真题和模拟题化学分项汇编四川省成都市双流棠湖中学2021届高三上学期开学考试理综化学试题2020年全国卷Ⅱ化学真题变式题(已下线)专题11 无机工艺流程题—2022年高考化学二轮复习讲练测(全国版)-练习(已下线)押全国卷理综第27题 工业流程-备战2022年高考化学临考题号押题(全国卷)(已下线)第05练 以简单工业流程突破金属及其化合物-2022年【暑假分层作业】高二化学(2023届一轮复习通用)(已下线)题型43 次氯酸、氯的含氧酸盐的性质和应用(已下线)专题17 原理综合题
名校
解题方法
7 . 常用于印染工业的连二亚硫酸钠(Na2S2O4)俗称保险粉,可溶于水,但不溶于甲醇,其固体受热、遇水都会发生反应放出大量的热,甚至引起燃烧,工业制备流程如下:
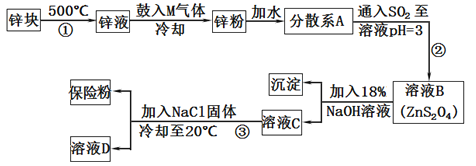
请回答下列问题:
(1)保险粉应如何保存?_______________________ (填一个注意事项)。
(2)由锌块制备锌粉的目的是___________ ;向液锌中鼓入M气体,使液态锌雾化,冷却得到粒度约为180μm(1m=106μm)的锌粉.鼓入气体M为常见的双原子单质分子,则M的化学式为___________ ;分散系A为____________ (填“溶液”“胶体”或“悬浊液”)。
(3)流程②的化学方程式为_____________________ 。
(4)流程③的分离方法步骤为___________ 、洗涤、干燥,其中洗涤所用试剂是__________ ;实验室加入NaCl固体的作用是_____________ 。
(5)保险粉可以用于除去废水中的重铬酸根离子(Cr2O72-被转化为Cr3+,S2O42-被转化为SO42-),这是目前除去酸性废水中重铬酸根离子的有效方法之一,写出该反应的离子方程式____________________ 。
(6)保险粉在空气中容易吸收氧气而发生氧化。其方程式为:
①2Na2S2O4+O2+H2O=4NaHSO3或②2Na2S2O4+O2+H2O==4NaHSO3+NaHSO4
若在此条件下NaHSO3不会被氧化,请设计实验证明氧化时发生的反应是②__________________ 。

请回答下列问题:
(1)保险粉应如何保存?
(2)由锌块制备锌粉的目的是
(3)流程②的化学方程式为
(4)流程③的分离方法步骤为
(5)保险粉可以用于除去废水中的重铬酸根离子(Cr2O72-被转化为Cr3+,S2O42-被转化为SO42-),这是目前除去酸性废水中重铬酸根离子的有效方法之一,写出该反应的离子方程式
(6)保险粉在空气中容易吸收氧气而发生氧化。其方程式为:
①2Na2S2O4+O2+H2O=4NaHSO3或②2Na2S2O4+O2+H2O==4NaHSO3+NaHSO4
若在此条件下NaHSO3不会被氧化,请设计实验证明氧化时发生的反应是②
您最近一年使用:0次
2017-02-17更新
|
1264次组卷
|
2卷引用:青海湟川中学2020-2021学年高一下学期3月考化学试题



