名校
解题方法
1 . 含氮物质、含硫物质的过量排放会污染大气或水体,研究氮、硫及其化合物的性质及转化,对降低含氮、含硫物质的污染有着重大的意义。
(1)在一定条件下,浓度为5%的尿素[CO(NH2)2]吸收液可以脱除烟气中的NOx。不同吸收反应温度下,测得NOx的脱除率变化如图所示。
已知信息:尿素的分解温度是160℃。尿素水解:CO(NH2)2+H2O=CO2↑+2NH3↑,在低温水解速度慢。
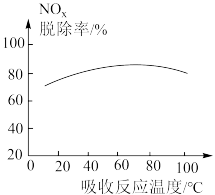
①当温度大于80℃时,NOx的脱除率随温度升高而降低的原因是______ 。
②写出在70~80℃条件下,尿素和烟气中NO2反应的化学方程式为______ 。
(2)ClO2可对烟气中NOx、SO2进行协同脱除,涉及的部分反应如下:
Ⅰ.ClO2+NO=NO2+ClO
Ⅱ.ClO+NO=Cl+NO2
Ⅲ.ClO2+SO2=ClO+SO3
Ⅳ.ClO+SO2=Cl+SO3
①反应Ⅳ的历程如图4所示。该历程中最大活化能E正=_____ kcal·mol-1。
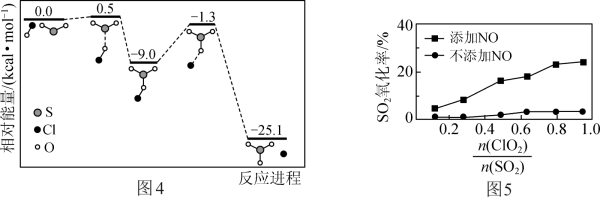
②保持其他条件不变,分别在不添加NO、添加NO两种情况下,控制模拟烟气中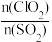 不同并反应相同时间,测得SO2氧化率随
不同并反应相同时间,测得SO2氧化率随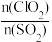 变化如图5所示。不添加NO时,SO2氧化率较低(不超过3%)的原因可能是
变化如图5所示。不添加NO时,SO2氧化率较低(不超过3%)的原因可能是______ 。添加NO时,SO2氧化率比不添加NO时高,其原因可能是______ 。
(1)在一定条件下,浓度为5%的尿素[CO(NH2)2]吸收液可以脱除烟气中的NOx。不同吸收反应温度下,测得NOx的脱除率变化如图所示。
已知信息:尿素的分解温度是160℃。尿素水解:CO(NH2)2+H2O=CO2↑+2NH3↑,在低温水解速度慢。

①当温度大于80℃时,NOx的脱除率随温度升高而降低的原因是
②写出在70~80℃条件下,尿素和烟气中NO2反应的化学方程式为
(2)ClO2可对烟气中NOx、SO2进行协同脱除,涉及的部分反应如下:
Ⅰ.ClO2+NO=NO2+ClO
Ⅱ.ClO+NO=Cl+NO2
Ⅲ.ClO2+SO2=ClO+SO3
Ⅳ.ClO+SO2=Cl+SO3
①反应Ⅳ的历程如图4所示。该历程中最大活化能E正=
②保持其他条件不变,分别在不添加NO、添加NO两种情况下,控制模拟烟气中
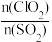 不同并反应相同时间,测得SO2氧化率随
不同并反应相同时间,测得SO2氧化率随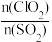 变化如图5所示。不添加NO时,SO2氧化率较低(不超过3%)的原因可能是
变化如图5所示。不添加NO时,SO2氧化率较低(不超过3%)的原因可能是
您最近一年使用:0次
名校
解题方法
2 . NaClO2·3H2O具有强氧化性,在消毒和果蔬保鲜等方面有广泛应用。
I.下列是制备NaClO2·3H2O的一种流程:
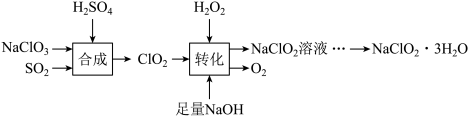
已知:NaClO2饱和溶液在低于38℃时析出NaClO2·3H2O,高于38℃时析出NaClO2。
(1)写出“合成”中发生反应的离子方程式:___________________________________________ 。
(2)“转化”过程中反应的化学方程式是______________________________________________ 。
(3)由NaClO2溶液得到NaClO2·3H2O的操作为:蒸发浓缩,___________ ,过滤洗涤,得到NaClO2·3H2O产品。
II.为确定产品的纯度,进行如下实验:
步骤1:取20.00gNaClO2·3H2O样品,溶于经煮沸冷却后的蒸馏水,配成200.00mL溶液。
步骤2:取出20.00mL配制的溶液于锥形瓶中,加入略过量的1.000mol/LKI溶液,塞上瓶塞。充分反应后,向锥形瓶中滴加两滴淀粉溶液,用2.000mol/LNa2S2O3溶液滴定至终点。
步骤3:重复以上操作2~3次,测得滴定Na2S2O3溶液的平均体积为22.00mL。
已知: +4I-+4H+=Cl-+2I2+2H2O,I2+2
+4I-+4H+=Cl-+2I2+2H2O,I2+2 =2I-+
=2I-+
(4)试计算该NaClO2·3H2O样品的纯度___________ 。
I.下列是制备NaClO2·3H2O的一种流程:

已知:NaClO2饱和溶液在低于38℃时析出NaClO2·3H2O,高于38℃时析出NaClO2。
(1)写出“合成”中发生反应的离子方程式:
(2)“转化”过程中反应的化学方程式是
(3)由NaClO2溶液得到NaClO2·3H2O的操作为:蒸发浓缩,
II.为确定产品的纯度,进行如下实验:
步骤1:取20.00gNaClO2·3H2O样品,溶于经煮沸冷却后的蒸馏水,配成200.00mL溶液。
步骤2:取出20.00mL配制的溶液于锥形瓶中,加入略过量的1.000mol/LKI溶液,塞上瓶塞。充分反应后,向锥形瓶中滴加两滴淀粉溶液,用2.000mol/LNa2S2O3溶液滴定至终点。
步骤3:重复以上操作2~3次,测得滴定Na2S2O3溶液的平均体积为22.00mL。
已知:
 +4I-+4H+=Cl-+2I2+2H2O,I2+2
+4I-+4H+=Cl-+2I2+2H2O,I2+2 =2I-+
=2I-+
(4)试计算该NaClO2·3H2O样品的纯度
您最近一年使用:0次
2022-12-09更新
|
808次组卷
|
3卷引用:江苏省徐州市沛县歌风中学2021-2022学年高一12月学情检测化学试题
解题方法
3 . 控制和治理二氧化硫,是解决酸雨问题的有效途径。
(1)SO2是酸性氧化物,可用NaOH溶液吸收含 SO2的尾气,该反应的离子方程式为__________ 。
(2)用NaClO碱性溶液吸收二氧化硫。工业上控制在40℃~50℃时,将含有SO2的烟气和NaClO 碱性溶液按图示方式通入反应釜。

①该反应中的离子方程式为_______________________________________________ 。
②反应釜中采用“气—液逆流”接触吸收法的优点是___________ 。
③为了提高SO2的吸收效率,工业上常加Ni2O3作催化剂,催化过程如图1所示。在催化过程中,反应产生的四价镍和氧原子具有强氧化能力,能加快吸收速度。试写出过程1的离子方程式∶___________ 。
(3)碘、水吸收二氧化硫,具体流程如图2 所示。

图2
已知∶ I2易升华;硫酸是高沸点含氧酸,HI易挥发。
① 在反应器中,控制温度不超过100℃的目的是___________ 。
② 碘、水吸收二氧化硫的总反应方程式为___________ 。
③ 该工艺中可以循环使用的物质是___________ 。
(1)SO2是酸性氧化物,可用NaOH溶液吸收含 SO2的尾气,该反应的离子方程式为
(2)用NaClO碱性溶液吸收二氧化硫。工业上控制在40℃~50℃时,将含有SO2的烟气和NaClO 碱性溶液按图示方式通入反应釜。

①该反应中的离子方程式为
②反应釜中采用“气—液逆流”接触吸收法的优点是
③为了提高SO2的吸收效率,工业上常加Ni2O3作催化剂,催化过程如图1所示。在催化过程中,反应产生的四价镍和氧原子具有强氧化能力,能加快吸收速度。试写出过程1的离子方程式∶
(3)碘、水吸收二氧化硫,具体流程如图2 所示。

图2
已知∶ I2易升华;硫酸是高沸点含氧酸,HI易挥发。
① 在反应器中,控制温度不超过100℃的目的是
② 碘、水吸收二氧化硫的总反应方程式为
③ 该工艺中可以循环使用的物质是
您最近一年使用:0次
名校
解题方法
4 . 氮是一种地球上含量丰富的元素。如图表示氮及其化合物在一定条件下的转化关系:
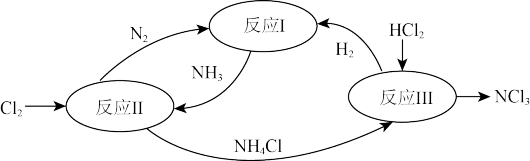
(1)氮元素在不同的物质中存在循环,体现了化学反应前后_______ (填“分子种类”、“原子种类”或“离子种类”)不变
(2)反应Ⅰ所属的基本反应类型是_______
(3)反应Ⅱ的化学方程式为_______
(4)氨是氮肥工业的重要原料;某化肥厂生产铵态氮肥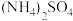 的工艺流程如图:
的工艺流程如图:
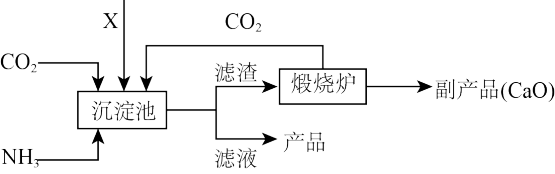
①加入的X应为_______ (填字母序号)
A. B.
B. C.
C.
②生产流程中能被循环利用的物质是_______

(1)氮元素在不同的物质中存在循环,体现了化学反应前后
(2)反应Ⅰ所属的基本反应类型是
(3)反应Ⅱ的化学方程式为
(4)氨是氮肥工业的重要原料;某化肥厂生产铵态氮肥
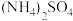 的工艺流程如图:
的工艺流程如图:
①加入的X应为
A.
 B.
B. C.
C.
②生产流程中能被循环利用的物质是
您最近一年使用:0次
5 . 下表为元素周期表的一部分,表中所列的字母分别代表一种化学元素,回答(1)(2)两小问
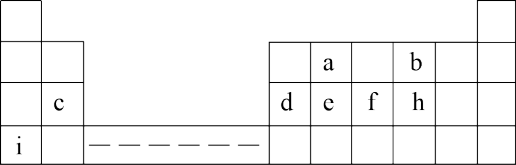
(1)a、b、c三种元素的原子半径由大到小的顺序是___________ (填元素符号);
(2)c、d、e三种元素最高价氧化物对应水化物中碱性最强的是_____ (填水化物的化学式)。
(3)配平下列离子方程式___ __MnO + ____Cl- + ____H+= ______Mn2+ + _____Cl2 + ___H2O
+ ____Cl- + ____H+= ______Mn2+ + _____Cl2 + ___H2O
(4)保持洁净安全的生存环境已成为全人类的共识。二氧化硫是引起酸雨的一种主要物质,必须严格控制排放。酸雨降落到地面后,其中的亚硫酸在空气中被氧气逐渐氧化生成硫酸,使酸性进一步增强,写出这一过程的化学方程式:___________ 。

(1)a、b、c三种元素的原子半径由大到小的顺序是
(2)c、d、e三种元素最高价氧化物对应水化物中碱性最强的是
(3)配平下列离子方程式
 + ____Cl- + ____H+= ______Mn2+ + _____Cl2 + ___H2O
+ ____Cl- + ____H+= ______Mn2+ + _____Cl2 + ___H2O(4)保持洁净安全的生存环境已成为全人类的共识。二氧化硫是引起酸雨的一种主要物质,必须严格控制排放。酸雨降落到地面后,其中的亚硫酸在空气中被氧气逐渐氧化生成硫酸,使酸性进一步增强,写出这一过程的化学方程式:
您最近一年使用:0次
解题方法
6 . 绿矾(FeSO4﹒7H2O)是存在于自然界中的一种矿石。古籍有记载焙烧绿矾可以制备铁红(主要成分是Fe2O3,传统红色颜料的重要着色剂);同时焙烧绿矾也是一种生产硫酸的古老方法。
现利用下图所示装置对焙烧绿矾的反应进行探究。

(1)装置C的作用是__ 。
(2)向U形管中滴入石蕊试液,溶液呈红色,说明该溶液呈____ (填“酸性”或“碱性”);再向该溶液中滴加BaCl2溶液出现白色沉淀,说明其中含有___ (填离子化学式)。
(3)实验过程中,装置A玻管中发生的化学反应方程式为__ 。
现利用下图所示装置对焙烧绿矾的反应进行探究。

(1)装置C的作用是
(2)向U形管中滴入石蕊试液,溶液呈红色,说明该溶液呈
(3)实验过程中,装置A玻管中发生的化学反应方程式为
您最近一年使用:0次
名校
解题方法
7 . 某兴趣小组用铬铁矿[Fe(CrO2)2]制备K2Cr2O7晶体,流程如下:
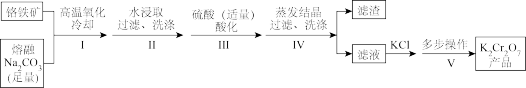
已知:NaFeO2遇水强烈水解;
回答以下问题:
(1)步骤I中铬铁矿转化为Na2CrO4和NaFeO2,化学反应方程式为_______ 。
(2)步骤III中加入硫酸不宜过多的原因是_______ 。
(3)步骤IV,所得滤渣的主要成分是_______ 。
(4)为了测定K2Cr2O7(摩尔质量为294g/mol)产品的纯度,可采用氧化还原滴定法:称取重铬酸钾试样2.500g配成500mL溶液,取出25.00mL于锥形瓶中,加10mL2mo/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入淀粉溶液做指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O =2I-+S4O
=2I-+S4O ),用去20.00mLNa2S2O3标准溶液,则该样品的纯度为
),用去20.00mLNa2S2O3标准溶液,则该样品的纯度为________ 。(写出计算过程)
(5)PbCrO4是一种黄色颜料,难溶于水。请设计由K2Cr2O7溶液制备PbCrO4的实验方案:_______ ,静置,过滤,洗涤,干燥,得PbCrO4。[实验中须使用的试剂有:6mol·L-1的KOH溶液,0.5mol·L-1Pb(NO3)2溶液]。
已知:①Pb(OH)2开始沉淀时pH为7.2,完全沉淀时pH为8.7。
②PbCrO4可由沸腾的铬酸盐溶液与铅盐溶液反应制得,含PbCrO4晶种时更易生成。
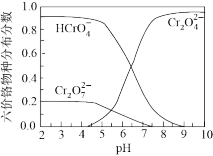
③六价铬在溶液中物种分布分数与pH关系如图所示。
已知:NaFeO2遇水强烈水解;
回答以下问题:
(1)步骤I中铬铁矿转化为Na2CrO4和NaFeO2,化学反应方程式为
(2)步骤III中加入硫酸不宜过多的原因是
(3)步骤IV,所得滤渣的主要成分是
(4)为了测定K2Cr2O7(摩尔质量为294g/mol)产品的纯度,可采用氧化还原滴定法:称取重铬酸钾试样2.500g配成500mL溶液,取出25.00mL于锥形瓶中,加10mL2mo/LH2SO4和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min,然后加入100mL水,加入淀粉溶液做指示剂,用0.1200mol/LNa2S2O3标准溶液滴定(I2+2S2O
 =2I-+S4O
=2I-+S4O ),用去20.00mLNa2S2O3标准溶液,则该样品的纯度为
),用去20.00mLNa2S2O3标准溶液,则该样品的纯度为(5)PbCrO4是一种黄色颜料,难溶于水。请设计由K2Cr2O7溶液制备PbCrO4的实验方案:
已知:①Pb(OH)2开始沉淀时pH为7.2,完全沉淀时pH为8.7。
②PbCrO4可由沸腾的铬酸盐溶液与铅盐溶液反应制得,含PbCrO4晶种时更易生成。
③六价铬在溶液中物种分布分数与pH关系如图所示。

您最近一年使用:0次
2022-09-02更新
|
313次组卷
|
3卷引用:江苏省南师附中、天一中学、海安中学、海门中学四校2021-2022学年高三12月联考化学试题
名校
解题方法
8 . 工业上,以钛白副产品硫酸亚铁制备的铁黄(FeOOH)代替硝酸铁等可溶性铁盐制备高铁酸钾,可降低生产工艺成本且产品质量好。工艺流程如图所示:

已知:①K2FeO4为暗紫色固体,可溶于水,微溶于KOH溶液。
②FeO 具有强氧化性,在酸性或者中性溶液中能产生O2,在碱性溶液中较稳定。
具有强氧化性,在酸性或者中性溶液中能产生O2,在碱性溶液中较稳定。
③铁黄在177℃开始分解。
(1)从电子排布的角度分析,Fe2+稳定性小于Fe3+的原因_______ 。
(2)制备铁黄的离子方程式为_______ 。
(3)实验测得反应液的温度、pH对铁黄产量的影响如图所示。
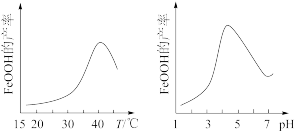
①反应液温度高于40 °C时,铁黄的产量下降的原因可能是_______ 。
②pH大于4.5时铁黄产量降低的主要原因可能是_______ 。
(4)粗产品K2FeO4提纯时采用重结晶、洗涤、低温烘干的方法,洗涤剂最好选用 _______(填序号)。
(5)用K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的S2-、CN-、NH3等,生成的Fe(OH)3胶体还能吸附水中的悬浮杂质。试写出K2FeO4处理含有CN- 的碱性污水时与CN-反应的离子方程式_______ 。

已知:①K2FeO4为暗紫色固体,可溶于水,微溶于KOH溶液。
②FeO
 具有强氧化性,在酸性或者中性溶液中能产生O2,在碱性溶液中较稳定。
具有强氧化性,在酸性或者中性溶液中能产生O2,在碱性溶液中较稳定。③铁黄在177℃开始分解。
(1)从电子排布的角度分析,Fe2+稳定性小于Fe3+的原因
(2)制备铁黄的离子方程式为
(3)实验测得反应液的温度、pH对铁黄产量的影响如图所示。
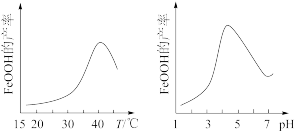
①反应液温度高于40 °C时,铁黄的产量下降的原因可能是
②pH大于4.5时铁黄产量降低的主要原因可能是
(4)粗产品K2FeO4提纯时采用重结晶、洗涤、低温烘干的方法,洗涤剂最好选用 _______(填序号)。
| A.冰水 | B.NaOH溶液 | C.稀硫酸 | D.Fe(NO3)3溶液 |
您最近一年使用:0次
2022-09-02更新
|
330次组卷
|
4卷引用:江苏省南师附中、天一中学、海安中学、海门中学四校2021-2022学年高三12月联考化学试题
名校
9 . ClO2是一种易溶于水的黄绿色气体,可用作安全高效的水处理剂,制备ClO2并被吸收的原理及装置如图:
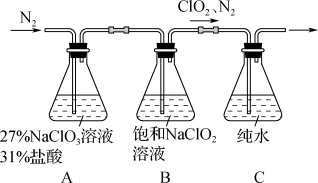
已知装置A中发生的反应:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl(主反应)
NaClO3+6HCl=NaCl+3Cl2↑+3H2O(副反应)
(1)实验过程中不断缓慢通入N2的目的是____ 。
(2)装置B中发生的主要反应的化学方程式为____ 。
(3)单位体积ClO2吸收液中含有ClO2的质量的实验测定步骤如下:
步骤1.配制Na2S2O3标准溶液:准确称取1.9840gNa2S2O3•5H2O,用新煮沸并冷却的蒸馏水配成100.0mL溶液。
步骤2.准确移取1.00mL装置C中的吸收液加入锥形瓶中,加入丙二酸静置后,再加入适量硫酸及稍过量的KI溶液(2ClO2+10I-+8H+=5I2+2Cl-+4H2O),在暗处放置5min。
步骤3.向步骤2的锥形瓶的反应液中加入1mL淀粉溶液作指示剂,再向其中滴加步骤1配制的Na2S2O3溶液(发生反应I2+2Na2S2O3=2NaI+Na2S4O6),至恰好完全反应时消耗Na2S2O3溶液20.00mL。
①在步骤1中,所配Na2S2O3标准溶液的物质的量浓度是____ 。
②在步骤3中,判断滴定至完全反应的依据是____ 。
③计算:装置C中,每1.00mLClO2吸收液中含有ClO2的质量____ (单位mg)(写出计算过程)。

已知装置A中发生的反应:2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl(主反应)
NaClO3+6HCl=NaCl+3Cl2↑+3H2O(副反应)
(1)实验过程中不断缓慢通入N2的目的是
(2)装置B中发生的主要反应的化学方程式为
(3)单位体积ClO2吸收液中含有ClO2的质量的实验测定步骤如下:
步骤1.配制Na2S2O3标准溶液:准确称取1.9840gNa2S2O3•5H2O,用新煮沸并冷却的蒸馏水配成100.0mL溶液。
步骤2.准确移取1.00mL装置C中的吸收液加入锥形瓶中,加入丙二酸静置后,再加入适量硫酸及稍过量的KI溶液(2ClO2+10I-+8H+=5I2+2Cl-+4H2O),在暗处放置5min。
步骤3.向步骤2的锥形瓶的反应液中加入1mL淀粉溶液作指示剂,再向其中滴加步骤1配制的Na2S2O3溶液(发生反应I2+2Na2S2O3=2NaI+Na2S4O6),至恰好完全反应时消耗Na2S2O3溶液20.00mL。
①在步骤1中,所配Na2S2O3标准溶液的物质的量浓度是
②在步骤3中,判断滴定至完全反应的依据是
③计算:装置C中,每1.00mLClO2吸收液中含有ClO2的质量
您最近一年使用:0次
名校
10 .  随意排放会造成严重的大气污染。下列是某小组同学设计处理烟气(主要含
随意排放会造成严重的大气污染。下列是某小组同学设计处理烟气(主要含 、
、 、
、 、粉尘)中
、粉尘)中 的方法。
的方法。
(1)方法一:利用氯碱工业产品处理含 的烟气,流程如图。
的烟气,流程如图。

①“吸收装置”中发生反应的离子方程式是_______ 。
②上述流程中循环利用的物质是_______
(2)方法二:利用 溶液的氧化性吸收烟气中的
溶液的氧化性吸收烟气中的
①该反应的离子方程式是_______ 。
②吸收 的过程可观察到溶液变为红褐色,则可能的原因:
的过程可观察到溶液变为红褐色,则可能的原因:
a.生成了_______ 胶体。
b.生成了红褐色的 溶液。
溶液。
 随意排放会造成严重的大气污染。下列是某小组同学设计处理烟气(主要含
随意排放会造成严重的大气污染。下列是某小组同学设计处理烟气(主要含 、
、 、
、 、粉尘)中
、粉尘)中 的方法。
的方法。(1)方法一:利用氯碱工业产品处理含
 的烟气,流程如图。
的烟气,流程如图。
①“吸收装置”中发生反应的离子方程式是
②上述流程中循环利用的物质是
(2)方法二:利用
 溶液的氧化性吸收烟气中的
溶液的氧化性吸收烟气中的
①该反应的离子方程式是
②吸收
 的过程可观察到溶液变为红褐色,则可能的原因:
的过程可观察到溶液变为红褐色,则可能的原因:a.生成了
b.生成了红褐色的
 溶液。
溶液。
您最近一年使用:0次



